 Кислоты.
Кислоты.
 Кислоты сложные химические соединения, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Кислоты сложные химические соединения, состоящие из одного или нескольких атомов водорода и кислотного остатка.
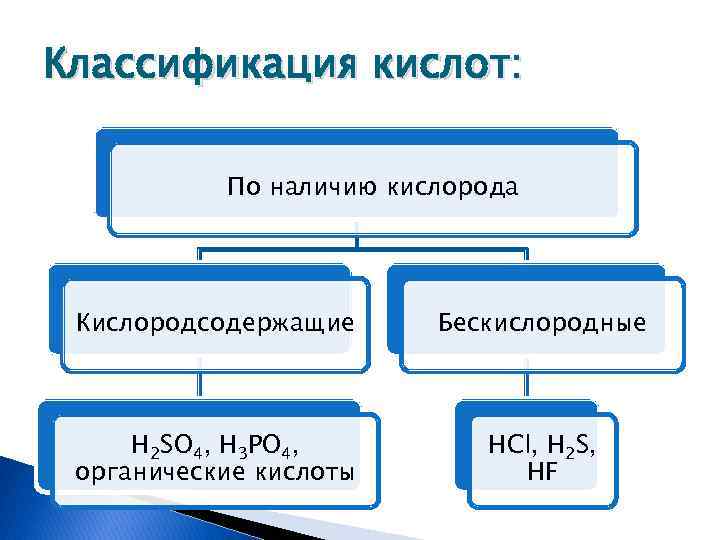 Классификация кислот: По наличию кислорода Кислородсодержащие Бескислородные H 2 SO 4, H 3 PO 4, органические кислоты HCl, H 2 S, HF
Классификация кислот: По наличию кислорода Кислородсодержащие Бескислородные H 2 SO 4, H 3 PO 4, органические кислоты HCl, H 2 S, HF
 По основности: А) Одноосновные (HCl, CH 3 COOH, HNO 3) Б) Двухосновные (H 2 SO 4, HOOC-COOH) В) Трехосновные (Н 3 РО 4) По растворимости: А) Растворимые (см. таблицу растворимостей) Б) Нерастворимые (H 2 Si. O 3, жирные кислоты) По летучести: А) Летучие Б) Нелетучие По степени электролитической диссоциации: А) Сильные Б) Слабые
По основности: А) Одноосновные (HCl, CH 3 COOH, HNO 3) Б) Двухосновные (H 2 SO 4, HOOC-COOH) В) Трехосновные (Н 3 РО 4) По растворимости: А) Растворимые (см. таблицу растворимостей) Б) Нерастворимые (H 2 Si. O 3, жирные кислоты) По летучести: А) Летучие Б) Нелетучие По степени электролитической диссоциации: А) Сильные Б) Слабые
 По стабильности: А) Стабильные Б) Нестабильные
По стабильности: А) Стабильные Б) Нестабильные
 Химические свойства кислот: 1) Свойства концентрированной и разбавленной азотной кислоты: Me + HNO 3 → Men+(NO 3)n + H 2 O + А, где А – соединения азота с определённой степенью окисления в зависимости от концентрации кислоты и металла:
Химические свойства кислот: 1) Свойства концентрированной и разбавленной азотной кислоты: Me + HNO 3 → Men+(NO 3)n + H 2 O + А, где А – соединения азота с определённой степенью окисления в зависимости от концентрации кислоты и металла:
 2) Свойства концентрированной и разбавленной серной кислоты:
2) Свойства концентрированной и разбавленной серной кислоты:
 3) Взаимодействие кислот с оксидами металлов: Кислота + основный оксид = соль + H 2 O 3 Н 2 SО 4 + Fe 2 O 3 = Fe 2(SO 4)3 + 3 Н 2 О 6 H+ + Fe 2 O 3 = 2 Fe 3+ + 3 H 2 O H 2 SO 4 + Cu. O → Cu. SO 4 + H 2 O 4) Взаимодействие кислот с гидроксидами металлов: Реакция нейтрализации Н+ + ОН- = Н 2 О 2 Fe(OH)3 + 3 Н 2 SО 4 = 2 Fe 2(SО 4)3 + 3 H 2 O 2 Fe(OH)3+ 6 H+ = 2 Fe 3+ + 3 H 2 O
3) Взаимодействие кислот с оксидами металлов: Кислота + основный оксид = соль + H 2 O 3 Н 2 SО 4 + Fe 2 O 3 = Fe 2(SO 4)3 + 3 Н 2 О 6 H+ + Fe 2 O 3 = 2 Fe 3+ + 3 H 2 O H 2 SO 4 + Cu. O → Cu. SO 4 + H 2 O 4) Взаимодействие кислот с гидроксидами металлов: Реакция нейтрализации Н+ + ОН- = Н 2 О 2 Fe(OH)3 + 3 Н 2 SО 4 = 2 Fe 2(SО 4)3 + 3 H 2 O 2 Fe(OH)3+ 6 H+ = 2 Fe 3+ + 3 H 2 O
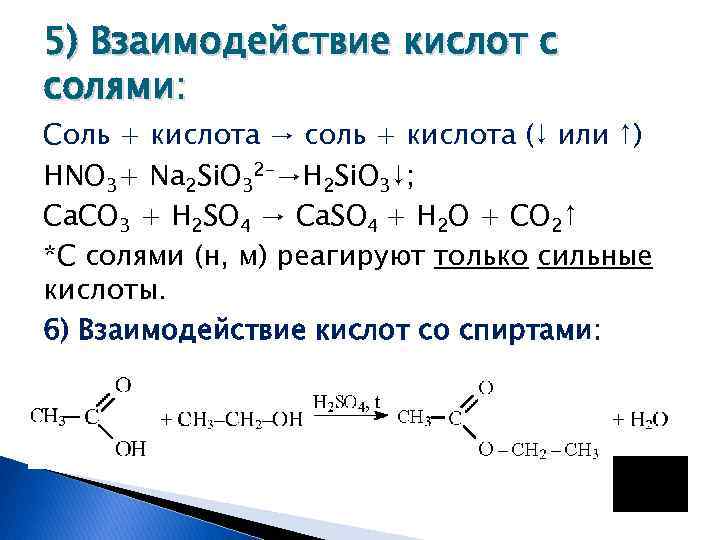 5) Взаимодействие кислот с солями: Соль + кислота → соль + кислота (↓ или ↑) HNO 3+ Na 2 Si. O 32 -→H 2 Si. O 3↓; Са. СО 3 + H 2 SO 4 → Са. SO 4 + Н 2 О + СО 2↑ *С солями (н, м) реагируют только сильные кислоты. 6) Взаимодействие кислот со спиртами:
5) Взаимодействие кислот с солями: Соль + кислота → соль + кислота (↓ или ↑) HNO 3+ Na 2 Si. O 32 -→H 2 Si. O 3↓; Са. СО 3 + H 2 SO 4 → Са. SO 4 + Н 2 О + СО 2↑ *С солями (н, м) реагируют только сильные кислоты. 6) Взаимодействие кислот со спиртами:
 Получение тринитроглицерина:
Получение тринитроглицерина:
 Домашнее задание: § 22, № 5, 7, с. 188
Домашнее задание: § 22, № 5, 7, с. 188