 КИСЛОТЫ
КИСЛОТЫ
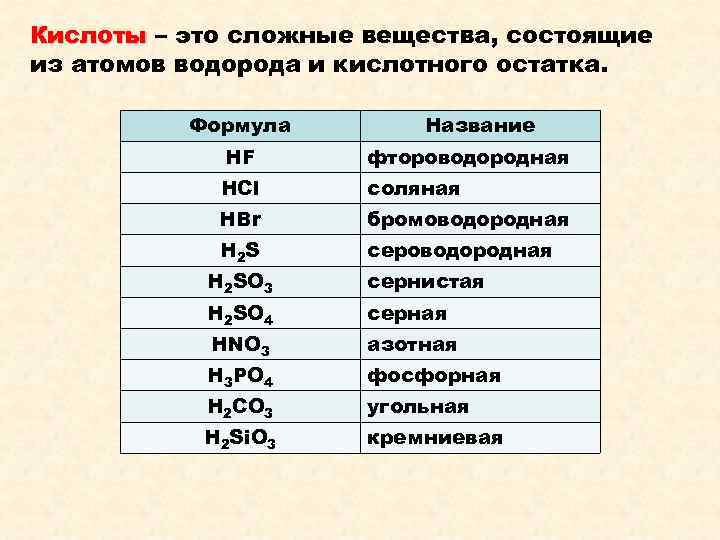 Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Формула Название HF фтороводородная HCl соляная HBr бромоводородная H 2 S сероводородная H 2 SO 3 сернистая H 2 SO 4 серная HNO 3 азотная H 3 PO 4 фосфорная H 2 CO 3 угольная H 2 Si. O 3 кремниевая
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Формула Название HF фтороводородная HCl соляная HBr бромоводородная H 2 S сероводородная H 2 SO 3 сернистая H 2 SO 4 серная HNO 3 азотная H 3 PO 4 фосфорная H 2 CO 3 угольная H 2 Si. O 3 кремниевая
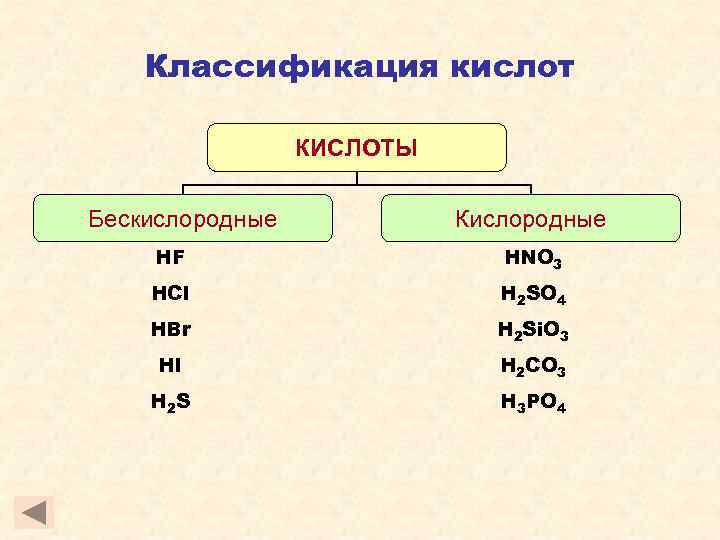 Классификация кислот КИСЛОТЫ Бескислородные Кислородные HF HNO 3 HCl H 2 SO 4 HBr H 2 Si. O 3 HI H 2 CO 3 H 2 S H 3 PO 4
Классификация кислот КИСЛОТЫ Бескислородные Кислородные HF HNO 3 HCl H 2 SO 4 HBr H 2 Si. O 3 HI H 2 CO 3 H 2 S H 3 PO 4
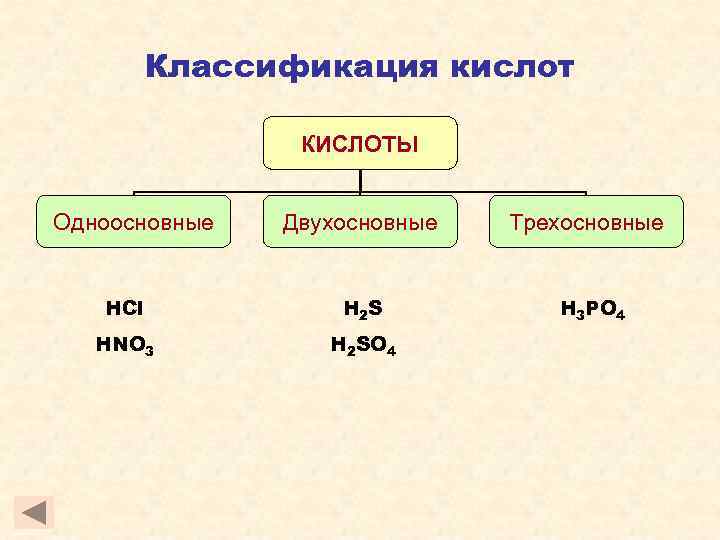 Классификация кислот КИСЛОТЫ Одноосновные Двухосновные HCl H 2 S HNO 3 H 2 SO 4 Трехосновные H 3 PO 4
Классификация кислот КИСЛОТЫ Одноосновные Двухосновные HCl H 2 S HNO 3 H 2 SO 4 Трехосновные H 3 PO 4
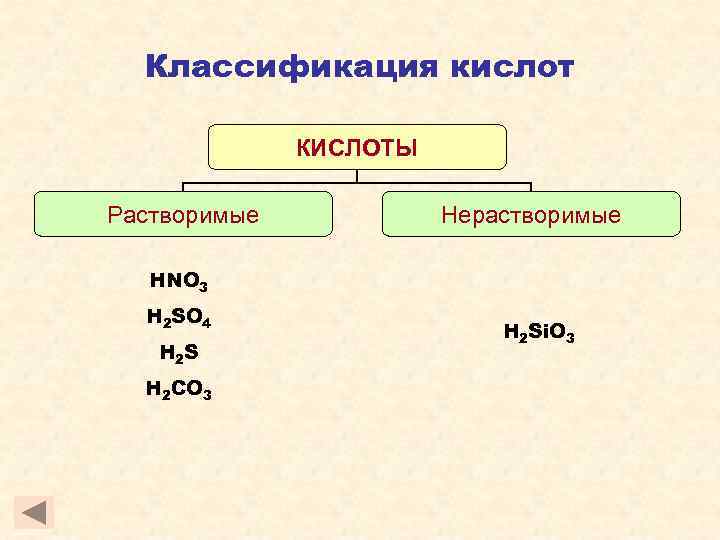 Классификация кислот КИСЛОТЫ Растворимые Нерастворимые HNO 3 H 2 SO 4 H 2 S H 2 CO 3 H 2 Si. O 3
Классификация кислот КИСЛОТЫ Растворимые Нерастворимые HNO 3 H 2 SO 4 H 2 S H 2 CO 3 H 2 Si. O 3
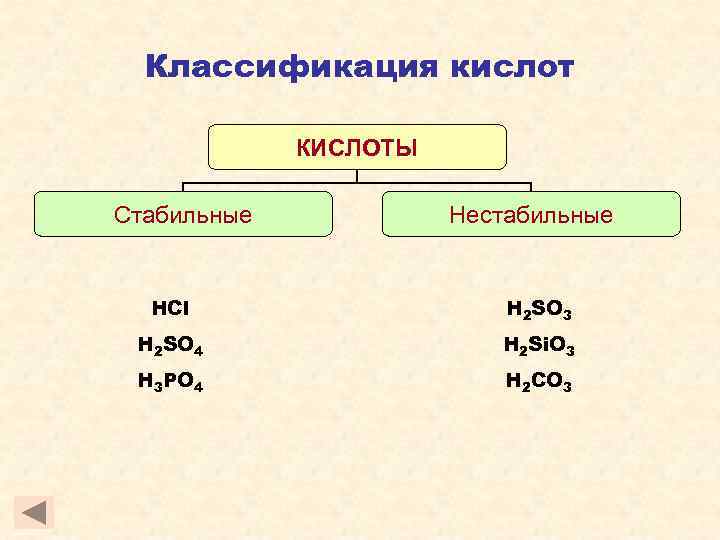 Классификация кислот КИСЛОТЫ Стабильные Нестабильные HCl H 2 SO 3 H 2 SO 4 H 2 Si. O 3 H 3 PO 4 H 2 CO 3
Классификация кислот КИСЛОТЫ Стабильные Нестабильные HCl H 2 SO 3 H 2 SO 4 H 2 Si. O 3 H 3 PO 4 H 2 CO 3
 Физические свойства кислот Окраска растворов кислот • Не имеют окраски: растворы HCl, HNO 3, H 2 SO 4, H 3 PO 4 и ряд других. • Окрашенные растворы: H 2 Cr. O 4 Правила безопасности при работе с кислотами HMn. O 4
Физические свойства кислот Окраска растворов кислот • Не имеют окраски: растворы HCl, HNO 3, H 2 SO 4, H 3 PO 4 и ряд других. • Окрашенные растворы: H 2 Cr. O 4 Правила безопасности при работе с кислотами HMn. O 4
 Химические свойства кислот • Действие кислот на индикаторы лакмус метилоранж Опыт фенолфталеин
Химические свойства кислот • Действие кислот на индикаторы лакмус метилоранж Опыт фенолфталеин
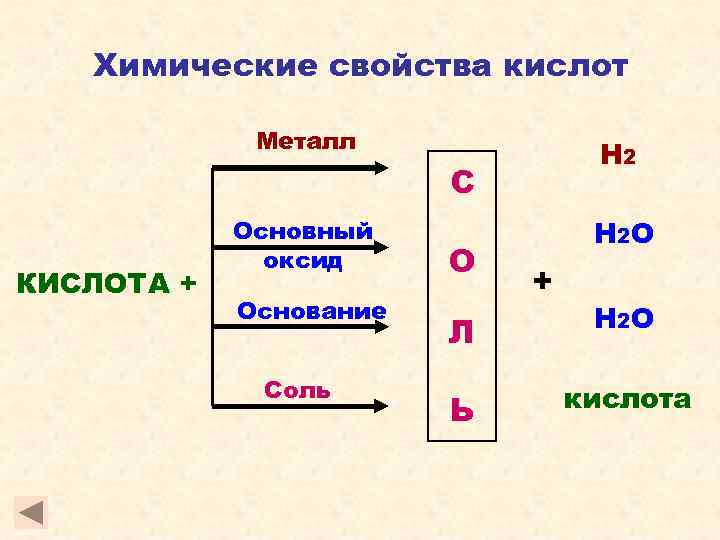 Химические свойства кислот Металл Н 2 С КИСЛОТА + Основный оксид Основание Соль О Н 2 О + Л Н 2 О Ь кислота
Химические свойства кислот Металл Н 2 С КИСЛОТА + Основный оксид Основание Соль О Н 2 О + Л Н 2 О Ь кислота
 Химические свойства кислот Кислота + металл = соль + водород Ряд активности металлов: Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au Активность металлов уменьшается Опыт 1. Взаимодействие цинка с соляной кислотой Опыт 2. Взаимодействие металлов с кислотами
Химические свойства кислот Кислота + металл = соль + водород Ряд активности металлов: Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au Активность металлов уменьшается Опыт 1. Взаимодействие цинка с соляной кислотой Опыт 2. Взаимодействие металлов с кислотами
 Химические свойства кислот Кислота + основный оксид = соль + вода Опыт. Взаимодействие оксида меди (II) с серной кислотой Сu. O + H 2 SO 4 = Cu. SO 4 + H 2 O
Химические свойства кислот Кислота + основный оксид = соль + вода Опыт. Взаимодействие оксида меди (II) с серной кислотой Сu. O + H 2 SO 4 = Cu. SO 4 + H 2 O
 Химические свойства кислот Кислота + основание = соль + вода HCl + Na. OH = Na. Cl + H 2 O H 2 SO 4 + Cu(OH)2 = Cu. SO 4 + 2 H 2 O Опыт.
Химические свойства кислот Кислота + основание = соль + вода HCl + Na. OH = Na. Cl + H 2 O H 2 SO 4 + Cu(OH)2 = Cu. SO 4 + 2 H 2 O Опыт.
 Химические свойства кислот Кислота 1 + соль 1 = соль 2 + Кислота 2 Условия реакции: 1. Если образуется осадок ↓: H 2 SO 4 + Ba. Cl 2 = Ba. SO 4↓ + 2 HCl 2. Если выделяется газ: 2 HNO 3 + Ca. CO 3 = Ca(NO 3)2 + H 2 O + CO 2
Химические свойства кислот Кислота 1 + соль 1 = соль 2 + Кислота 2 Условия реакции: 1. Если образуется осадок ↓: H 2 SO 4 + Ba. Cl 2 = Ba. SO 4↓ + 2 HCl 2. Если выделяется газ: 2 HNO 3 + Ca. CO 3 = Ca(NO 3)2 + H 2 O + CO 2
 Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. 1) Si. О 2 А 2) Li. ОН К 3) Ва(NО 3)2 А 4) НСI С 5) К 2 О Л 6) К 2 Si. О 3 И 7) НNО 3 О 8) Fе(ОН)3 Й
Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. 1) Si. О 2 А 2) Li. ОН К 3) Ва(NО 3)2 А 4) НСI С 5) К 2 О Л 6) К 2 Si. О 3 И 7) НNО 3 О 8) Fе(ОН)3 Й