 Кислоты
Кислоты
 Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка
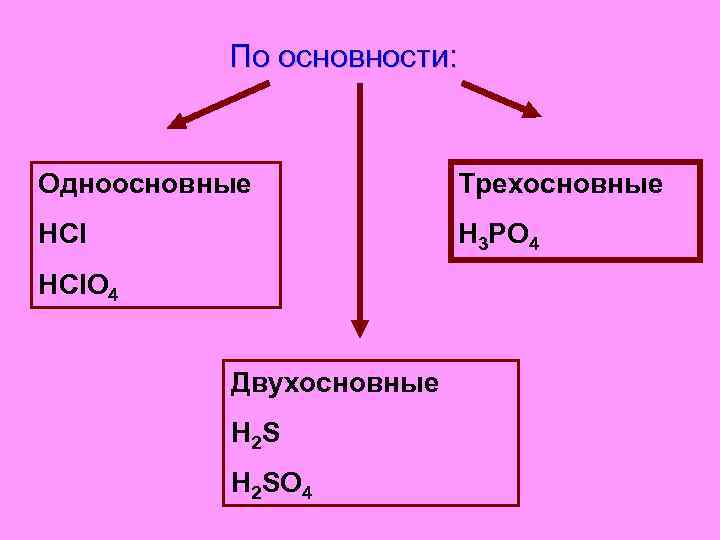 По основности: Одноосновные Трехосновные HCl H 3 PO 4 HCl. O 4 Двухосновные H 2 SO 4
По основности: Одноосновные Трехосновные HCl H 3 PO 4 HCl. O 4 Двухосновные H 2 SO 4
 По содержанию кислорода: Кислородсодержащие Бескислородные HCl. O 4 HCl H 2 SO 4 H 2 S
По содержанию кислорода: Кислородсодержащие Бескислородные HCl. O 4 HCl H 2 SO 4 H 2 S
 По стабильности: Стабильные Нестабильные H 2 SO 4 H 2 CO 3 H 3 PO 4 H 2 Si. O 3 HCl H 2 SO 3
По стабильности: Стабильные Нестабильные H 2 SO 4 H 2 CO 3 H 3 PO 4 H 2 Si. O 3 HCl H 2 SO 3
 По растворимости: Растворимые Нерастворимые H 2 SO 4 H 2 Si. O 3 HCl HNO 3
По растворимости: Растворимые Нерастворимые H 2 SO 4 H 2 Si. O 3 HCl HNO 3
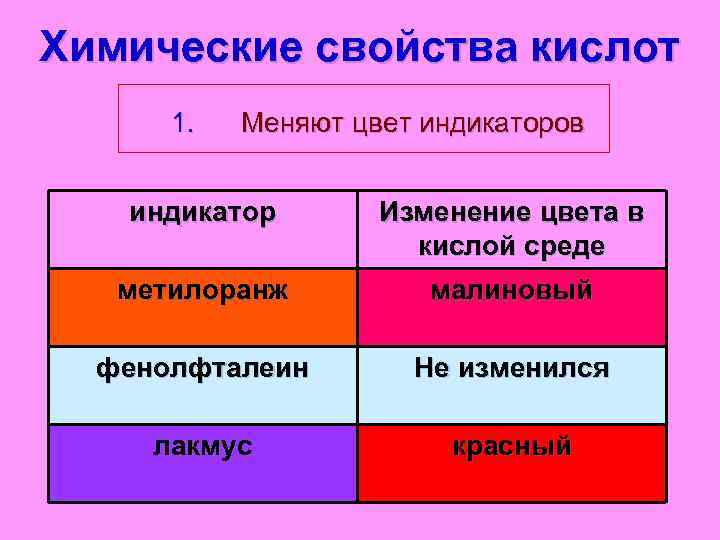 Химические свойства кислот 1. Меняют цвет индикаторов индикатор Изменение цвета в кислой среде метилоранж малиновый фенолфталеин Не изменился лакмус красный
Химические свойства кислот 1. Меняют цвет индикаторов индикатор Изменение цвета в кислой среде метилоранж малиновый фенолфталеин Не изменился лакмус красный
 2. Кислота + Металл→ соль + Н 2 Три условия: § кислота растворимая (кроме HNO 3) § Ме стоит в ряду активности до водорода § Получается растворимая соль 1) Cu + НСl —> не идет 2) Zn + 2 HCl —> Zn. CI 2 + H 2 ↑ 3) Na + H 3 PO 4 —> 4) Ca + H 2 SO 4 —>
2. Кислота + Металл→ соль + Н 2 Три условия: § кислота растворимая (кроме HNO 3) § Ме стоит в ряду активности до водорода § Получается растворимая соль 1) Cu + НСl —> не идет 2) Zn + 2 HCl —> Zn. CI 2 + H 2 ↑ 3) Na + H 3 PO 4 —> 4) Ca + H 2 SO 4 —>
 3. Кислота + основной оксид → соль + Н 2 О Условия: § Все кислоты кроме нестабильных (H 2 CO 3, H 2 Si. O 3) § Образуется растворимая соль 1) 2 HCl + Ca. O —> Ca. Cl 2 + H 2 O 2) HNO 3 + K 2 O —> t 3) HCl + Cu. O —>
3. Кислота + основной оксид → соль + Н 2 О Условия: § Все кислоты кроме нестабильных (H 2 CO 3, H 2 Si. O 3) § Образуется растворимая соль 1) 2 HCl + Ca. O —> Ca. Cl 2 + H 2 O 2) HNO 3 + K 2 O —> t 3) HCl + Cu. O —>
 4. Кислота + основание → соль + Н 2 О (реакция нейтрализации) 1) H 2 SO 4 + 2 KOH —> K 2 SO 4 + 2 H 2 O 2) HCl + Al(OH)3 —> 3) HNO 3 + Zn(OH)2 —>
4. Кислота + основание → соль + Н 2 О (реакция нейтрализации) 1) H 2 SO 4 + 2 KOH —> K 2 SO 4 + 2 H 2 O 2) HCl + Al(OH)3 —> 3) HNO 3 + Zn(OH)2 —>
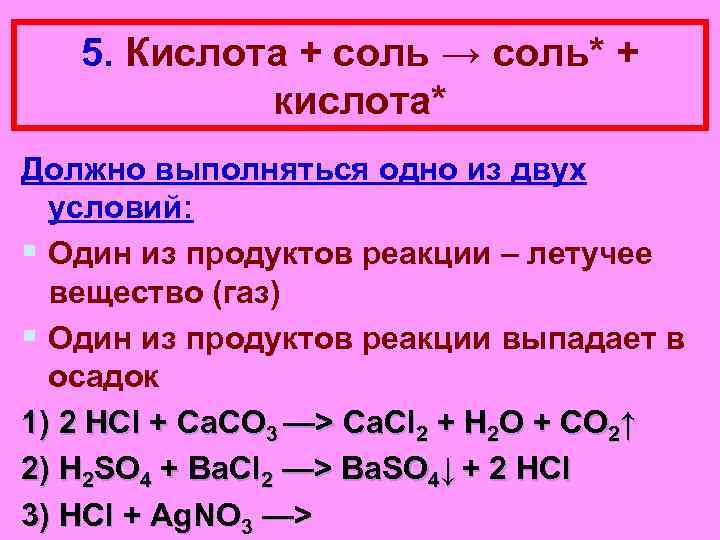 5. Кислота + соль → соль* + кислота* Должно выполняться одно из двух условий: § Один из продуктов реакции – летучее вещество (газ) § Один из продуктов реакции выпадает в осадок 1) 2 HCl + Ca. CO 3 —> Ca. Cl 2 + H 2 O + CO 2↑ 2) H 2 SO 4 + Ba. Cl 2 —> Ba. SO 4↓ + 2 HCl 3) HCl + Ag. NO 3 —>
5. Кислота + соль → соль* + кислота* Должно выполняться одно из двух условий: § Один из продуктов реакции – летучее вещество (газ) § Один из продуктов реакции выпадает в осадок 1) 2 HCl + Ca. CO 3 —> Ca. Cl 2 + H 2 O + CO 2↑ 2) H 2 SO 4 + Ba. Cl 2 —> Ba. SO 4↓ + 2 HCl 3) HCl + Ag. NO 3 —>
 6. При нагревании некоторые кислоты разлагаются. Как правило, образуются кислотный оксид и вода Т 1) H 2 Si. O 3 —> H 2 O + Si. O 2 T, свет 2) 4 HNO 3 —> 2 H 2 O + 4 NO 2↑ + O 2 ↑
6. При нагревании некоторые кислоты разлагаются. Как правило, образуются кислотный оксид и вода Т 1) H 2 Si. O 3 —> H 2 O + Si. O 2 T, свет 2) 4 HNO 3 —> 2 H 2 O + 4 NO 2↑ + O 2 ↑
 Способы получения кислот 1. Кислотный оксид + Н 2 О → кислота SO 3 + H 2 O → H 2 SO 4 2. Водород + Не. Ме → кислота Н 2 + Cl 2 → 2 HCl 3. Кислота + соль → соль* + кислота* t 2 Na. Cl + H 2 SO 4 → Na 2 SO 4 + 2 HCl↑
Способы получения кислот 1. Кислотный оксид + Н 2 О → кислота SO 3 + H 2 O → H 2 SO 4 2. Водород + Не. Ме → кислота Н 2 + Cl 2 → 2 HCl 3. Кислота + соль → соль* + кислота* t 2 Na. Cl + H 2 SO 4 → Na 2 SO 4 + 2 HCl↑