Кислотные дожди

















 Кислотные дожди -Х I Х в англ. Р. Смит «Воздух и дождь: начало химической климатологии» -Какова причина гибели растений, рыб и, отчасти, животных в районах, далеких от промышленных зон. (1) Основные пути образования - Кислотные осадки – осадки с p. H < 5, 6 уксус дождь чистый сода питьевая аммиак p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 кислотные дожди 5, 6 - Образование кислотных осадков, в основном, связано с антропогенным загрязнением атмосферы SO 2 и Nox (образ. при сжигании топлив, при производстве Ме): 2 Zn. S + 3 O 2 = 2 Zn. O + 2 SO 2 2 Cu. S + 3 O 2 = 2 Cu. O + 2 SO 2
Кислотные дожди -Х I Х в англ. Р. Смит «Воздух и дождь: начало химической климатологии» -Какова причина гибели растений, рыб и, отчасти, животных в районах, далеких от промышленных зон. (1) Основные пути образования - Кислотные осадки – осадки с p. H < 5, 6 уксус дождь чистый сода питьевая аммиак p. H 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 кислотные дожди 5, 6 - Образование кислотных осадков, в основном, связано с антропогенным загрязнением атмосферы SO 2 и Nox (образ. при сжигании топлив, при производстве Ме): 2 Zn. S + 3 O 2 = 2 Zn. O + 2 SO 2 2 Cu. S + 3 O 2 = 2 Cu. O + 2 SO 2
 - Основные реакции при сгорании орг. топлив: S + O 2 SO 2 + ½ O 2 SO 3 + 85 к. Дж - Природные процессы – «поставщики» SO 2 и NOx - вулканические газы; - лесные пожары; - грозовые разряды и молнии; - деятельность бактерий (SO 2 может образоваться в результате окисления H 2 S при разложении орг. вещества). SO 2 Кислотные дожди NOx Природные источники • вулканические газы Антропогенные источники • лесные пожары • грозовые разряды и • сжигание топлива (дрова, молнии уголь, мазут) • деятельность бактерий • выплавка Ме из руд
- Основные реакции при сгорании орг. топлив: S + O 2 SO 2 + ½ O 2 SO 3 + 85 к. Дж - Природные процессы – «поставщики» SO 2 и NOx - вулканические газы; - лесные пожары; - грозовые разряды и молнии; - деятельность бактерий (SO 2 может образоваться в результате окисления H 2 S при разложении орг. вещества). SO 2 Кислотные дожди NOx Природные источники • вулканические газы Антропогенные источники • лесные пожары • грозовые разряды и • сжигание топлива (дрова, молнии уголь, мазут) • деятельность бактерий • выплавка Ме из руд
 (2) SO 2 а атмосфере - Наибольшая опасность - Суммарные годовые выбросы 160 млн. т. - Концентрации SO 2: • воздух над океаном 0 -4 мкг/м 3 • село 10 -40 мкг/м 3 • пром. города в 100 – 500 р. > - Растворимость SO 2 в воде высока – до 40 V на один V H 2 O: SO 2 + H 2 O H 2 SO 3 H+ + HSO 3 - 2 H+ + SO 32 - - Сернистая кислота может окисляться до сульфат-иона: H 2 SO 3 + H 2 O - 2ē = SO 42 - + 4 H+ (Kt: примеси разл. Ме в загряз. атмосф. ) - Серная кислота, являясь сильным электролитом, в разбавл. растворе диссоциирует практич. полностью: H 2 SO 4 2 H+ + SO 42 - что приводит к > кислотности атмосфер. влаги
(2) SO 2 а атмосфере - Наибольшая опасность - Суммарные годовые выбросы 160 млн. т. - Концентрации SO 2: • воздух над океаном 0 -4 мкг/м 3 • село 10 -40 мкг/м 3 • пром. города в 100 – 500 р. > - Растворимость SO 2 в воде высока – до 40 V на один V H 2 O: SO 2 + H 2 O H 2 SO 3 H+ + HSO 3 - 2 H+ + SO 32 - - Сернистая кислота может окисляться до сульфат-иона: H 2 SO 3 + H 2 O - 2ē = SO 42 - + 4 H+ (Kt: примеси разл. Ме в загряз. атмосф. ) - Серная кислота, являясь сильным электролитом, в разбавл. растворе диссоциирует практич. полностью: H 2 SO 4 2 H+ + SO 42 - что приводит к > кислотности атмосфер. влаги
 - В атмосфере SO 2 + O 2 SO 3 ( Kt : Ме ) в качестве окислителя также O 3 и H 2 O 2 - Время жизни SO 2 в атмосфере от нескольких часов до нескольких суток - На небольших высотах SO 2 превалирует над SO 4 2 -. Отношение SO 2/ SO 42 - уменьшается с высотой - При взаимодействии SO 2 с катионами образуются сульфаты , биологическое действие которых более выражено, чем SO 2 - Сульфаты явл. одной из осн. причин образования смога: NH 3(г) + H 2 SO 4(aq) = NH 4(HSO 4) тв. , aq NH 4(HSO 4)aq + NH 3 r = (NH 4)2 SO 4 тв. , aq - Содержание сульфатов над сельской местностью и океаном 1 -5 мкг/м 3 , над городами со средним загрязнением – 7÷ 20 мкг/м 3
- В атмосфере SO 2 + O 2 SO 3 ( Kt : Ме ) в качестве окислителя также O 3 и H 2 O 2 - Время жизни SO 2 в атмосфере от нескольких часов до нескольких суток - На небольших высотах SO 2 превалирует над SO 4 2 -. Отношение SO 2/ SO 42 - уменьшается с высотой - При взаимодействии SO 2 с катионами образуются сульфаты , биологическое действие которых более выражено, чем SO 2 - Сульфаты явл. одной из осн. причин образования смога: NH 3(г) + H 2 SO 4(aq) = NH 4(HSO 4) тв. , aq NH 4(HSO 4)aq + NH 3 r = (NH 4)2 SO 4 тв. , aq - Содержание сульфатов над сельской местностью и океаном 1 -5 мкг/м 3 , над городами со средним загрязнением – 7÷ 20 мкг/м 3
 (3) Фотохимическое окисление SO 2 2 SO 2 + hν 2 SO 3 Реакция протекает через несколько стадий: SO 2 + hν SO 2* + O 2 SO 4* ; SO 4* + O 2 SO 3 + O 3 Возможно протекание и др. реакций: SO 2 + H 2 O + NO 2 (NO ∙ H 2 SO 4) O + H 2 O 2 OH° H 2 O + SO 2 SO 3 + OH° - Диоксид S растворяется в H 2 O и потом доокисляется до H 2 SO 4 : 2 H 2 SO 3 + O 2 2 H 2 SO 4 - Процесс взаимодействия H 2 SO 4 и NH 3 протекает через фазу образования гидратов:
(3) Фотохимическое окисление SO 2 2 SO 2 + hν 2 SO 3 Реакция протекает через несколько стадий: SO 2 + hν SO 2* + O 2 SO 4* ; SO 4* + O 2 SO 3 + O 3 Возможно протекание и др. реакций: SO 2 + H 2 O + NO 2 (NO ∙ H 2 SO 4) O + H 2 O 2 OH° H 2 O + SO 2 SO 3 + OH° - Диоксид S растворяется в H 2 O и потом доокисляется до H 2 SO 4 : 2 H 2 SO 3 + O 2 2 H 2 SO 4 - Процесс взаимодействия H 2 SO 4 и NH 3 протекает через фазу образования гидратов:
 NH 3 + H 2 SO 4 ∙ n. H 2 O NH 4 HSO 4 ∙ n. H 2 O NH 3 + NH 4 HSO 4 ∙ n. H 2 O (NH 4)2 SO 4 ∙ n. H 2 O - Сами гидраты катализируют процесс окисления SO 2 до H 2 SO 4 в атмосферных условиях: гидраты 2 SO 2 + 2 H 2 O + O 2 H 2 SO 4 - Перенос SO 2 из тропосферы в океан: SO 2(r) + H 2 O SO 2 aq + H 2 O H 2 SO 3 K 1 H 2 SO 3 + H 2 O H 3 O+ + HSO 3 - K 1 = 1, 6 ∙ 10 -2 K 2 HSO 3 + H 2 O - H 3 O+ + SO 32 - K 2 = 1, 0 ∙ 10 -7 K 3 2 HSO 3 - S 2 O 52 - + H 2 O K 3 = 7 ∙ 10 -2
NH 3 + H 2 SO 4 ∙ n. H 2 O NH 4 HSO 4 ∙ n. H 2 O NH 3 + NH 4 HSO 4 ∙ n. H 2 O (NH 4)2 SO 4 ∙ n. H 2 O - Сами гидраты катализируют процесс окисления SO 2 до H 2 SO 4 в атмосферных условиях: гидраты 2 SO 2 + 2 H 2 O + O 2 H 2 SO 4 - Перенос SO 2 из тропосферы в океан: SO 2(r) + H 2 O SO 2 aq + H 2 O H 2 SO 3 K 1 H 2 SO 3 + H 2 O H 3 O+ + HSO 3 - K 1 = 1, 6 ∙ 10 -2 K 2 HSO 3 + H 2 O - H 3 O+ + SO 32 - K 2 = 1, 0 ∙ 10 -7 K 3 2 HSO 3 - S 2 O 52 - + H 2 O K 3 = 7 ∙ 10 -2
 (4) NOx в атмосфере - В атмосфере – пять N-содержащих газов: N 2, NH 3, NO 2, N 2 O - В конденсированной фазе – в форме NH 4+, NO 3 - - Оксиды азота антропогенного происхождения в основном попадают в атмосферу в виде NO. Затем происходят следующие реакции: 2 NO + O 2 2 NO 2 NO 2 + hν NO + O O + O 2 + M O 3 + M O 3 + NO 2 + O 2 - Другие реакции соединений, содержат N и O O + NO 2 NO + O 2 NO 3 + NO 2 O + NO 2 + M NO 3 + M NO 2 + O 3 NO 3 + O 2 O + NO + M NO 2 + M NO 3 + NO 2 + M N 2 O 5 + M
(4) NOx в атмосфере - В атмосфере – пять N-содержащих газов: N 2, NH 3, NO 2, N 2 O - В конденсированной фазе – в форме NH 4+, NO 3 - - Оксиды азота антропогенного происхождения в основном попадают в атмосферу в виде NO. Затем происходят следующие реакции: 2 NO + O 2 2 NO 2 NO 2 + hν NO + O O + O 2 + M O 3 + M O 3 + NO 2 + O 2 - Другие реакции соединений, содержат N и O O + NO 2 NO + O 2 NO 3 + NO 2 O + NO 2 + M NO 3 + M NO 2 + O 3 NO 3 + O 2 O + NO + M NO 2 + M NO 3 + NO 2 + M N 2 O 5 + M
 - Цикл соединений азота в тропосфере включ. образование HNO 3 4 NO 2 + 2 H 2 O + O 2 4 HNO 3 - В газовой фазе NO 2 гидролизуется: 3 NO 2 + H 2 O 2 HNO 3 + NO - Далее HNO 3, взаимодействуя с Ме, образует нитраты (5) Действие кислотных дождей на окружающую среду • Кислотные дожди не знают границ и перемещаются на большие расстояния (трансграничный перенос) • Леса : при действии кисл. дождей леса « высыхают» , развивается «суховершинность» - В Германии повреждено 35% лесных массивов (в некоторых районах Европы поражение лесов достигло 50%) - Отмечена гибель красной ели в Северных Аппалачах
- Цикл соединений азота в тропосфере включ. образование HNO 3 4 NO 2 + 2 H 2 O + O 2 4 HNO 3 - В газовой фазе NO 2 гидролизуется: 3 NO 2 + H 2 O 2 HNO 3 + NO - Далее HNO 3, взаимодействуя с Ме, образует нитраты (5) Действие кислотных дождей на окружающую среду • Кислотные дожди не знают границ и перемещаются на большие расстояния (трансграничный перенос) • Леса : при действии кисл. дождей леса « высыхают» , развивается «суховершинность» - В Германии повреждено 35% лесных массивов (в некоторых районах Европы поражение лесов достигло 50%) - Отмечена гибель красной ели в Северных Аппалачах
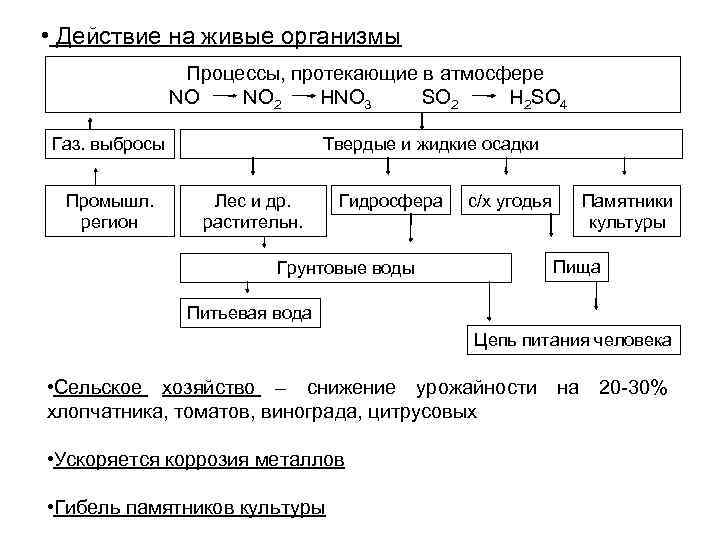
 • Действие на живые организмы Процессы, протекающие в атмосфере NO 2 HNO 3 SO 2 H 2 SO 4 Газ. выбросы Твердые и жидкие осадки Промышл. Лес и др. Гидросфера с/х угодья Памятники регион растительн. культуры Грунтовые воды Пища Питьевая вода Цепь питания человека • Сельское хозяйство – снижение урожайности на 20 -30% хлопчатника, томатов, винограда, цитрусовых • Ускоряется коррозия металлов • Гибель памятников культуры
• Действие на живые организмы Процессы, протекающие в атмосфере NO 2 HNO 3 SO 2 H 2 SO 4 Газ. выбросы Твердые и жидкие осадки Промышл. Лес и др. Гидросфера с/х угодья Памятники регион растительн. культуры Грунтовые воды Пища Питьевая вода Цепь питания человека • Сельское хозяйство – снижение урожайности на 20 -30% хлопчатника, томатов, винограда, цитрусовых • Ускоряется коррозия металлов • Гибель памятников культуры
 Действие на гидробионты 8 7. 5 7 6. 5 6 5. 5 5 4. 5 4 Гибель ракообразных, моллюсков, улиток и т. д. Гибель лосося, гольца, плотвы. Гибель наиболее чувствительных насекомых. Гибель сиговых рыб, форели, хариуса. Гибель окуня, щуки. Гибель угря. Озера - Швеция – 15000 озер повреждены, в 4000 озерах не водится рыба. - Канада – более 14000 озер закислены. - Норвегия – из 5000 обследованных озер, в 1750 исчезла рыба (повреждено 80% озер). - Карелия – Во многих озерах p. H < 4. 7 - Швейцария – Ежегодно расходует 10 -15 млн. крон, чтобы известкованием снизить кислотность вод.
Действие на гидробионты 8 7. 5 7 6. 5 6 5. 5 5 4. 5 4 Гибель ракообразных, моллюсков, улиток и т. д. Гибель лосося, гольца, плотвы. Гибель наиболее чувствительных насекомых. Гибель сиговых рыб, форели, хариуса. Гибель окуня, щуки. Гибель угря. Озера - Швеция – 15000 озер повреждены, в 4000 озерах не водится рыба. - Канада – более 14000 озер закислены. - Норвегия – из 5000 обследованных озер, в 1750 исчезла рыба (повреждено 80% озер). - Карелия – Во многих озерах p. H < 4. 7 - Швейцария – Ежегодно расходует 10 -15 млн. крон, чтобы известкованием снизить кислотность вод.
 Почва При p. H < 5 начинается снижение плодородия, при p. H ≤ 3 почва бесплодна. - Кислотность увеличивает подвижность Al в почвах: 2 Al + 6 H+ = 2 Al 3+ + 3 H 2 Al 3+ токсичен для мелких корней, приводит к угнетанию листвы, хвои. - На исследованной площади ЕТР 3, 2 млн. км 2 уровни критических нагрузок по азоту превышают на площади 2. 3 млн. км 2, а по сере – на площади 1. 7 млн. км 2 Человек - Н+ способствует переводу многих токсичных металлов (Hg, Cd, Pb и др) в растворенное состояние и попадание в воду. - Кислотные осадки в виде твердых частиц могут непосредственно поступать в организм человека и животных в процессе дыхания:
Почва При p. H < 5 начинается снижение плодородия, при p. H ≤ 3 почва бесплодна. - Кислотность увеличивает подвижность Al в почвах: 2 Al + 6 H+ = 2 Al 3+ + 3 H 2 Al 3+ токсичен для мелких корней, приводит к угнетанию листвы, хвои. - На исследованной площади ЕТР 3, 2 млн. км 2 уровни критических нагрузок по азоту превышают на площади 2. 3 млн. км 2, а по сере – на площади 1. 7 млн. км 2 Человек - Н+ способствует переводу многих токсичных металлов (Hg, Cd, Pb и др) в растворенное состояние и попадание в воду. - Кислотные осадки в виде твердых частиц могут непосредственно поступать в организм человека и животных в процессе дыхания:
 Мокрые и сухие выпадения S и N в 1997 г (г/кв. м. год) в расчете на массу элемента. С Т А Н Ц И Я* Выпадения 1 2 3 СЕРА Мокрые 0. 14 (35%) 0. 23 (80%) 0. 56 (75%) Сухие 0. 25 (65%) 0. 06 (20%) 0. 19 (25%) ∑ 0. 39 0. 29 0. 75 АЗОТ Мокрые 0. 05 (70%) 0. 29 (90%) 0. 46 (80%) Сухие 0. 02 (30%) 0. 03 (10%) 0. 12 (20%) ∑ 0. 07 0. 32 0. 58 *) 1 – Карелия; 2 – Калининградская область; 3 – Центр ЕТР
Мокрые и сухие выпадения S и N в 1997 г (г/кв. м. год) в расчете на массу элемента. С Т А Н Ц И Я* Выпадения 1 2 3 СЕРА Мокрые 0. 14 (35%) 0. 23 (80%) 0. 56 (75%) Сухие 0. 25 (65%) 0. 06 (20%) 0. 19 (25%) ∑ 0. 39 0. 29 0. 75 АЗОТ Мокрые 0. 05 (70%) 0. 29 (90%) 0. 46 (80%) Сухие 0. 02 (30%) 0. 03 (10%) 0. 12 (20%) ∑ 0. 07 0. 32 0. 58 *) 1 – Карелия; 2 – Калининградская область; 3 – Центр ЕТР
 (6) Мониторинг атмосферного воздуха по «кислым» компонентам. Регион Концентрация мг/л p. H России SO 43 - NO 3 - NH 4+ Cl- HCO 3 - Ca 2+ ∑ ионов min max ? Арктика 4. 6 1. 2 0. 6 6. 7 3. 3 2. 4 20. 2 5. 2 6. 7 6. Сев-Зап. ЕТР 6. 3 3. 2 1. 1 2. 5 10. 3 2. 9 32. 3 5. 2 7. 0 6. Центр ЕТР 14. 1 3. 8 1. 3 4. 5 17. 5 6. 1 54. 9 5. 8 7. 2 6. Юг ЕТР 2. 1 2. 9 1. 3 3. 7 5. 7 1. 7 20. 8 5. 2 6. 8 6. Поволжье 11. 1 4. 9 1. 0 4. 5 14. 2 5. 9 47. 9 5. 6 7. 3 6. Урал 7. 5 3. 4 1. 0 3. 2 10. 7 4. 2 34. 0 5. 7 7. 4 6. Сев. Сибирь 3. 0 0. 8 1. 6 4. 0 0. 8 11. 9 6. 1 7. 0 6. Южн. Сибирь 9. 3 1. 9 0. 6 2. 5 9. 0 1. 6 21. 6 6. 0 7. 2 6. Д. Восток 6. 6 0. 9 3. 5 1. 3 1. 1 18. 1 4. 7 6. 5 5. Средн. ЕТР 8. 2 3. 6 1. 1 3. 7 11. 7 4. 2 38. 0 5. 5 7. 1 6. Средн. Сиб 6. 3 1. 1 0. 8 2. 5 4. 8 1. 2 17. 2 5. 6 6. 9 6. - Анализ таблицы: практически по всем показателям ЕТР хуже, чем Сибирь и Д. Восток - Показатели зависят от времени года
(6) Мониторинг атмосферного воздуха по «кислым» компонентам. Регион Концентрация мг/л p. H России SO 43 - NO 3 - NH 4+ Cl- HCO 3 - Ca 2+ ∑ ионов min max ? Арктика 4. 6 1. 2 0. 6 6. 7 3. 3 2. 4 20. 2 5. 2 6. 7 6. Сев-Зап. ЕТР 6. 3 3. 2 1. 1 2. 5 10. 3 2. 9 32. 3 5. 2 7. 0 6. Центр ЕТР 14. 1 3. 8 1. 3 4. 5 17. 5 6. 1 54. 9 5. 8 7. 2 6. Юг ЕТР 2. 1 2. 9 1. 3 3. 7 5. 7 1. 7 20. 8 5. 2 6. 8 6. Поволжье 11. 1 4. 9 1. 0 4. 5 14. 2 5. 9 47. 9 5. 6 7. 3 6. Урал 7. 5 3. 4 1. 0 3. 2 10. 7 4. 2 34. 0 5. 7 7. 4 6. Сев. Сибирь 3. 0 0. 8 1. 6 4. 0 0. 8 11. 9 6. 1 7. 0 6. Южн. Сибирь 9. 3 1. 9 0. 6 2. 5 9. 0 1. 6 21. 6 6. 0 7. 2 6. Д. Восток 6. 6 0. 9 3. 5 1. 3 1. 1 18. 1 4. 7 6. 5 5. Средн. ЕТР 8. 2 3. 6 1. 1 3. 7 11. 7 4. 2 38. 0 5. 5 7. 1 6. Средн. Сиб 6. 3 1. 1 0. 8 2. 5 4. 8 1. 2 17. 2 5. 6 6. 9 6. - Анализ таблицы: практически по всем показателям ЕТР хуже, чем Сибирь и Д. Восток - Показатели зависят от времени года
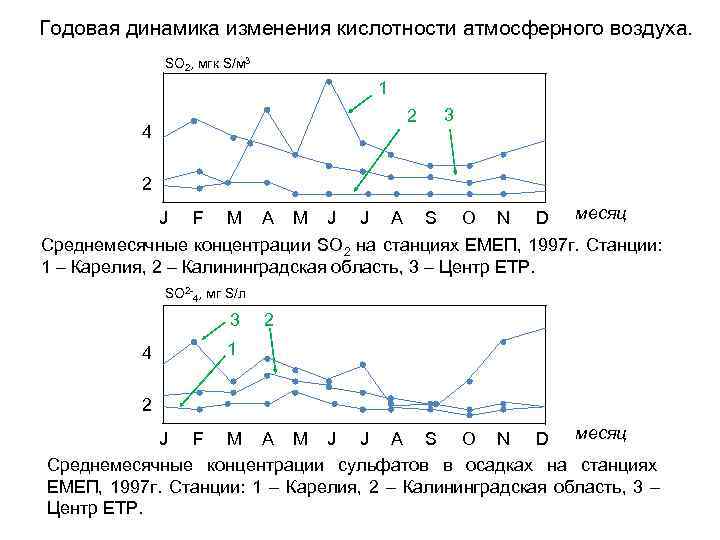
 Годовая динамика изменения кислотности атмосферного воздуха. SO 2, мгк S/м 3 1 2 3 4 2 J F M A M J J A S O N D месяц Среднемесячные концентрации SO 2 на станциях ЕМЕП, 1997 г. Станции: 1 – Карелия, 2 – Калининградская область, 3 – Центр ЕТР. SO 2 -4, мг S/л 3 2 4 1 2 J F M A M J J A S O N D месяц Среднемесячные концентрации сульфатов в осадках на станциях ЕМЕП, 1997 г. Станции: 1 – Карелия, 2 – Калининградская область, 3 – Центр ЕТР.
Годовая динамика изменения кислотности атмосферного воздуха. SO 2, мгк S/м 3 1 2 3 4 2 J F M A M J J A S O N D месяц Среднемесячные концентрации SO 2 на станциях ЕМЕП, 1997 г. Станции: 1 – Карелия, 2 – Калининградская область, 3 – Центр ЕТР. SO 2 -4, мг S/л 3 2 4 1 2 J F M A M J J A S O N D месяц Среднемесячные концентрации сульфатов в осадках на станциях ЕМЕП, 1997 г. Станции: 1 – Карелия, 2 – Калининградская область, 3 – Центр ЕТР.
 (7) Основные пути решения проблем кислотных дождей. 1) Резкое снижение выбросов SO 2 и NO 2 , в первую очередь SO 2 , т. к. именно H 2 SO 4 и ее соли на 70 -80% обуславливают кислотность дождей. 2) Внедрение новых технологий: -Экология топлива (объем загрязнений пропорционален экономии энергии) - Извлечение и удаление серы из топлива ( Нефтепер. - гидроочистка) - Улавливание SO 2 из дымовых газов. Основное распространение получили методы адсорбции основными реагентами: Ca(OH) 2 , Ca. O, NH 3, Ca. CO 3, Na 2 CO 3 x 10 H 2 O, Ca. CO 3 x Mg. CO 3 (Доломит). - Утилизация диоксида серы основано на его кислотных свойствах и способности S(IV) окисляться до S(VI): Ca. CO 3 + SO 2 + ½O 2 = Ca. SO 4 + CO 2 4 NH 3 + 2 SO 2 + 2 H 2 O = 2(NH 4)2 SO 4
(7) Основные пути решения проблем кислотных дождей. 1) Резкое снижение выбросов SO 2 и NO 2 , в первую очередь SO 2 , т. к. именно H 2 SO 4 и ее соли на 70 -80% обуславливают кислотность дождей. 2) Внедрение новых технологий: -Экология топлива (объем загрязнений пропорционален экономии энергии) - Извлечение и удаление серы из топлива ( Нефтепер. - гидроочистка) - Улавливание SO 2 из дымовых газов. Основное распространение получили методы адсорбции основными реагентами: Ca(OH) 2 , Ca. O, NH 3, Ca. CO 3, Na 2 CO 3 x 10 H 2 O, Ca. CO 3 x Mg. CO 3 (Доломит). - Утилизация диоксида серы основано на его кислотных свойствах и способности S(IV) окисляться до S(VI): Ca. CO 3 + SO 2 + ½O 2 = Ca. SO 4 + CO 2 4 NH 3 + 2 SO 2 + 2 H 2 O = 2(NH 4)2 SO 4
 - Известно более 200 технологий по очистке дымовых газов от SO 2 - Чаще применяется промывка газов с добавлением извести (90 - 95% очистка) Ca. CO 3 (тв) → Ca. O (тв) + CO 2(г) Ca. O(тв) + SO 2 → Ca. SO 3 (тв) - Строго контролировать соотношение воздуха: топливо (в зоне горения) – выбросы Nox уменьшаются на 40 -60% 3) Международное сотрудничество, т. к. проблема кислотных дождей глобальна. (8) Улавливание SO 2 и No x низко-концентрированными щелочными отработанными растворами текстильных предприятий. Nox + Na. OH → Na. NO 2 + Na. NO 3 + H 2 O SO 2 + Na. OH → Na 2 SO 3 + H 2 O Nox + Na. OH +H 2 O 2 → Na. NO 3 + H 2 O SO 2 + Na. OH + H 2 O 2 → Na 2 SO 4 + H 2 O
- Известно более 200 технологий по очистке дымовых газов от SO 2 - Чаще применяется промывка газов с добавлением извести (90 - 95% очистка) Ca. CO 3 (тв) → Ca. O (тв) + CO 2(г) Ca. O(тв) + SO 2 → Ca. SO 3 (тв) - Строго контролировать соотношение воздуха: топливо (в зоне горения) – выбросы Nox уменьшаются на 40 -60% 3) Международное сотрудничество, т. к. проблема кислотных дождей глобальна. (8) Улавливание SO 2 и No x низко-концентрированными щелочными отработанными растворами текстильных предприятий. Nox + Na. OH → Na. NO 2 + Na. NO 3 + H 2 O SO 2 + Na. OH → Na 2 SO 3 + H 2 O Nox + Na. OH +H 2 O 2 → Na. NO 3 + H 2 O SO 2 + Na. OH + H 2 O 2 → Na 2 SO 4 + H 2 O
 - Образующиеся при этом растворы электролитов м. б. частично или полностью быть использованы в технологических процессах текстильного производства (замкнутый цикл). Газообразные Отработанные Очищенный газ продукты технологич. растворы сгорания твердого Абсорбция Использование топлива в технологич. электролитов: ТЭУ, в т. ч. и растворами отварка, газы текстильного отбелка, производства крашение SO 2 и NOx Отработанный электролит - Данный метод прошел экспериментальную проверку: 15% садовый раствор SO 2 + Na. OH → Na 2 SO 3 + H 2 O На стадию отварки-беления
- Образующиеся при этом растворы электролитов м. б. частично или полностью быть использованы в технологических процессах текстильного производства (замкнутый цикл). Газообразные Отработанные Очищенный газ продукты технологич. растворы сгорания твердого Абсорбция Использование топлива в технологич. электролитов: ТЭУ, в т. ч. и растворами отварка, газы текстильного отбелка, производства крашение SO 2 и NOx Отработанный электролит - Данный метод прошел экспериментальную проверку: 15% садовый раствор SO 2 + Na. OH → Na 2 SO 3 + H 2 O На стадию отварки-беления
 - Исходный p. H=10. 5, конечный p. H~ 8, ρ=1. 121 г/см 3 при 19°C Состав варочных растворов и капиллярность образцов х/б ткани. Время Варочный К А П И Л Л Я Р Н О С Т Ь, см отварки раствор: Na. OH+Na 2 SO 3 Продолжительность процесса, мин час г/л 10 20 30 40 50 60 ½ 5 + 10 11/9 13/14 15/11 18/11 18/- 18/15 ½ 10 + 5 -/9 14/14 15/14 16/14 16/16 16/14 ½ 15 + 3 14/14 14/15 14/11 15/16 15/14 16/14 - Состав отбеливающего раствора (г/л): H 2 O 2 – 2, 5; Na. OH – 2, 5; ПЭГ – 5, 0; ОП-10 -0, 1. Состав варочных растворов и степень белизны отбеленной х/б ткани. Содержание Na 2 SO 3, г/л 3 5 10 0 Степень белизны, % 85. 6 85. 8 85. 9 84. 8
- Исходный p. H=10. 5, конечный p. H~ 8, ρ=1. 121 г/см 3 при 19°C Состав варочных растворов и капиллярность образцов х/б ткани. Время Варочный К А П И Л Л Я Р Н О С Т Ь, см отварки раствор: Na. OH+Na 2 SO 3 Продолжительность процесса, мин час г/л 10 20 30 40 50 60 ½ 5 + 10 11/9 13/14 15/11 18/11 18/- 18/15 ½ 10 + 5 -/9 14/14 15/14 16/14 16/16 16/14 ½ 15 + 3 14/14 14/15 14/11 15/16 15/14 16/14 - Состав отбеливающего раствора (г/л): H 2 O 2 – 2, 5; Na. OH – 2, 5; ПЭГ – 5, 0; ОП-10 -0, 1. Состав варочных растворов и степень белизны отбеленной х/б ткани. Содержание Na 2 SO 3, г/л 3 5 10 0 Степень белизны, % 85. 6 85. 8 85. 9 84. 8

