Кислотно-основные сис




























 Кислотно-основные сис ы.
Кислотно-основные сис ы.
 Кислотно основные превращения – превращения с участием неподеленой электронной пары по донорно акцептному механизму без изменения степеней окисления реагентов. Наибольшее распространение они в химии получили в теориях: 1) Теория Аррениуса 2) Теория Бренстеда Лоури 3) Теория Льюиса
Кислотно основные превращения – превращения с участием неподеленой электронной пары по донорно акцептному механизму без изменения степеней окисления реагентов. Наибольшее распространение они в химии получили в теориях: 1) Теория Аррениуса 2) Теория Бренстеда Лоури 3) Теория Льюиса
 Теория Аррениуса. l Создана в 1887 году шведским ученым Сванте Аррениусом(1859 1927). l Теория электролитической диссоциации (ТЭД) электролитов Аррениуса - это теория растворов слабых электролитов.
Теория Аррениуса. l Создана в 1887 году шведским ученым Сванте Аррениусом(1859 1927). l Теория электролитической диссоциации (ТЭД) электролитов Аррениуса - это теория растворов слабых электролитов.
 Кислоты и основания. Кислота вещество, образующие в водных растворах ионы H+. Например: HNO 3 → H+ + NO 3− Основание – вещества, образующие в водных растворах ионы ОН¯. Например: Na. OH →Na+ + ОН¯
Кислоты и основания. Кислота вещество, образующие в водных растворах ионы H+. Например: HNO 3 → H+ + NO 3− Основание – вещества, образующие в водных растворах ионы ОН¯. Например: Na. OH →Na+ + ОН¯
 Сильные и слабые кислоты. l Кислоты и основания, для которых степень распада на ионы (степень электролитической диссоциации) имеет значение, близкое к единице, были названы Аррениусом сильными (HNO 3, Na. OH), а все остальные слабыми (HNO 2, NH 3 , H 2 O).
Сильные и слабые кислоты. l Кислоты и основания, для которых степень распада на ионы (степень электролитической диссоциации) имеет значение, близкое к единице, были названы Аррениусом сильными (HNO 3, Na. OH), а все остальные слабыми (HNO 2, NH 3 , H 2 O).
 Кислотно-основные свойства. l Кислотно основные свойства по Аррениусу для веществ Нn ЭОm достаточно хорошо трактуются через электроотрицательность(χ) основного элемента Э. Существуют три случая: а) Нn ЭОm кислота если χ (э ) ≥ 2 б) Hn ЭОm – основание, если χ (э) < 1, 5 в) Нn ЭОm – амфотерное соединение, (χ (э) от 1, 5 до 2, 0)
Кислотно-основные свойства. l Кислотно основные свойства по Аррениусу для веществ Нn ЭОm достаточно хорошо трактуются через электроотрицательность(χ) основного элемента Э. Существуют три случая: а) Нn ЭОm кислота если χ (э ) ≥ 2 б) Hn ЭОm – основание, если χ (э) < 1, 5 в) Нn ЭОm – амфотерное соединение, (χ (э) от 1, 5 до 2, 0)
 Ограниченность теории. l 1)Во-первых, в разбавленном растворе степень диссоциации слабой кислоты или основания становилась больше, чем в концентрированном, а по теории Аррениуса следует обратное. 2)Во-вторых, по идее Аррениуса, вода является лишь растворителем (средой) и химически не участвует в реакциях диссоциации кислот и оснований. Однако это не всегда так. 3)В-третьих, в рамки определений Аррениуса не укладывались реакции гидролиза солей, образованных слабыми кислотами или слабыми основаниями. 4)В-четвертых, по идее Аррениуса, реакции нейтрализации типа кислота плюс основание происходит только в водном растворе. 5) В-пятых, известно множество реакций не кислотно основного взаимодействия по Аррениусу, весьма схожих с реакциями нейтрализации. С точки зрения теории электролитической диссоциации эти реакции не могут получить объяснения, отражающего их сходство с реакциями нейтрализации в водном растворе.
Ограниченность теории. l 1)Во-первых, в разбавленном растворе степень диссоциации слабой кислоты или основания становилась больше, чем в концентрированном, а по теории Аррениуса следует обратное. 2)Во-вторых, по идее Аррениуса, вода является лишь растворителем (средой) и химически не участвует в реакциях диссоциации кислот и оснований. Однако это не всегда так. 3)В-третьих, в рамки определений Аррениуса не укладывались реакции гидролиза солей, образованных слабыми кислотами или слабыми основаниями. 4)В-четвертых, по идее Аррениуса, реакции нейтрализации типа кислота плюс основание происходит только в водном растворе. 5) В-пятых, известно множество реакций не кислотно основного взаимодействия по Аррениусу, весьма схожих с реакциями нейтрализации. С точки зрения теории электролитической диссоциации эти реакции не могут получить объяснения, отражающего их сходство с реакциями нейтрализации в водном растворе.
 Протонная теория кислот и оснований Бренстенда-Лаури. Сущность реакции между любой кислотой и водой была впервые осознана датским химиком Йоханнесом Бренстендом (1879 1947) и английским химиком Томасом М. Лаури (1874 1936).
Протонная теория кислот и оснований Бренстенда-Лаури. Сущность реакции между любой кислотой и водой была впервые осознана датским химиком Йоханнесом Бренстендом (1879 1947) и английским химиком Томасом М. Лаури (1874 1936).
 Кислота и основание(по Бренстеду). l кислота это водородсодержащая частица вещества (молекула или ион), способная быть донором протона, а основание это частица вещества, способная быть акцептором протона. l передача протона от кислоты к основанию именуется протолизом, а химическая реакция между ними протолитической реакцией: HA + B ⇄ A¯ + HB+; кислота +основание ⇄ основание + кислота l в протолитической реакции всегда две сопряженные пары "кислота" / "основание" HA / A¯ и HB+/ B. Например, в реакции HNO 3 + NH 3 ⇄ NO 3¯ + NH 4+ сопряженными парами будут HNO 3 / NO 3¯ и NH 4+ / NH 3. HCl↑ + NH 3↑ ⇄ NH 4 + Cl взаимодействие кислоты и основания по Бренстеду донор H+ акцептор Н+ кислота основание
Кислота и основание(по Бренстеду). l кислота это водородсодержащая частица вещества (молекула или ион), способная быть донором протона, а основание это частица вещества, способная быть акцептором протона. l передача протона от кислоты к основанию именуется протолизом, а химическая реакция между ними протолитической реакцией: HA + B ⇄ A¯ + HB+; кислота +основание ⇄ основание + кислота l в протолитической реакции всегда две сопряженные пары "кислота" / "основание" HA / A¯ и HB+/ B. Например, в реакции HNO 3 + NH 3 ⇄ NO 3¯ + NH 4+ сопряженными парами будут HNO 3 / NO 3¯ и NH 4+ / NH 3. HCl↑ + NH 3↑ ⇄ NH 4 + Cl взаимодействие кислоты и основания по Бренстеду донор H+ акцептор Н+ кислота основание
 Протонная теория кислот и оснований. Теория Бренстеда – Лоури (1923 г. ) Основные положения : 1. Кислота - всякая частица (молекула, ион) отдающая протон, т. е. донор протонов. Основание – частица, присоединяющая протон, т. е. акцептор протонов.
Протонная теория кислот и оснований. Теория Бренстеда – Лоури (1923 г. ) Основные положения : 1. Кислота - всякая частица (молекула, ион) отдающая протон, т. е. донор протонов. Основание – частица, присоединяющая протон, т. е. акцептор протонов.
 Вещества по Бренстеду. l вещества бывают взависимости от сродства к протону: а) Протофильные б) Протогенные в)Амфипротонные большое сродство низкое сродство среднее сродство к протону к протону склонные присоединять склонные отдавать могут присоединять и протон отдавать протон в взависимости от состава системы основания кислоты H 2 O ; CH 3 COOH NH 3; OH HF; H 2 SO 4 ,
Вещества по Бренстеду. l вещества бывают взависимости от сродства к протону: а) Протофильные б) Протогенные в)Амфипротонные большое сродство низкое сродство среднее сродство к протону к протону склонные присоединять склонные отдавать могут присоединять и протон отдавать протон в взависимости от состава системы основания кислоты H 2 O ; CH 3 COOH NH 3; OH HF; H 2 SO 4 ,
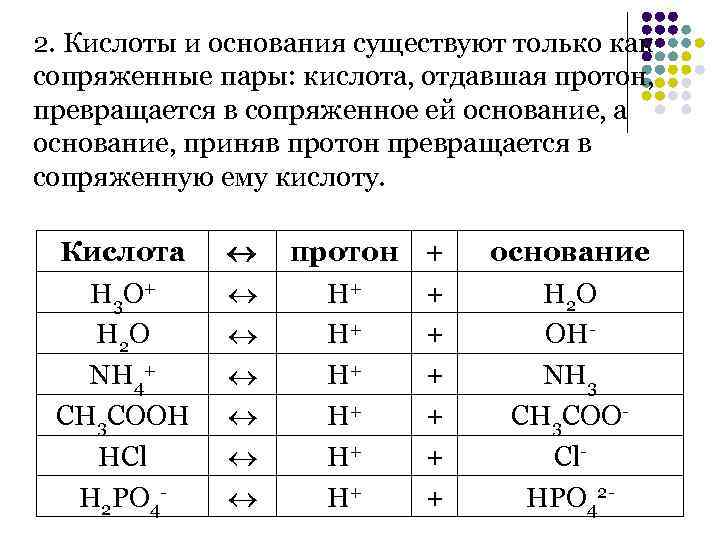
 2. Кислоты и основания существуют только как сопряженные пары: кислота, отдавшая протон, превращается в сопряженное ей основание, а основание, приняв протон превращается в сопряженную ему кислоту. Кислота протон + основание Н 3 О+ Н+ + Н 2 О Н+ + ОН- NH 4+ Н+ + NH 3 CH 3 COOH Н+ + CH 3 COO- HCl Н+ + Cl- H 2 PO 4 - Н+ + HPO 42 -
2. Кислоты и основания существуют только как сопряженные пары: кислота, отдавшая протон, превращается в сопряженное ей основание, а основание, приняв протон превращается в сопряженную ему кислоту. Кислота протон + основание Н 3 О+ Н+ + Н 2 О Н+ + ОН- NH 4+ Н+ + NH 3 CH 3 COOH Н+ + CH 3 COO- HCl Н+ + Cl- H 2 PO 4 - Н+ + HPO 42 -
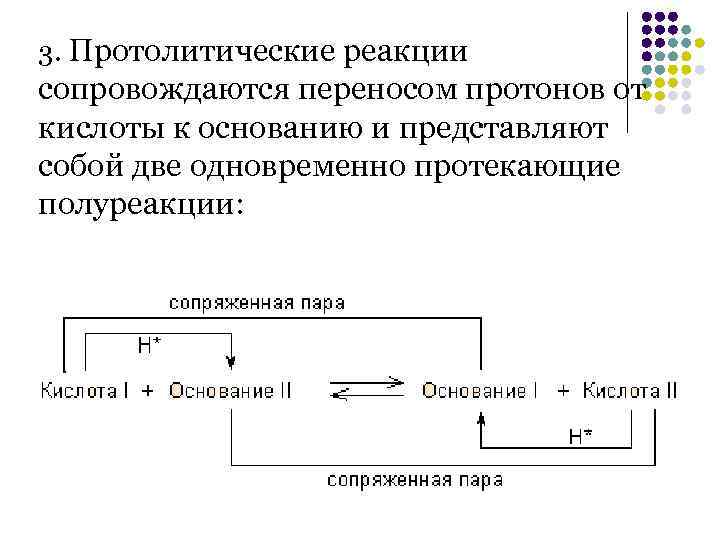
 3. Протолитические реакции сопровождаются переносом протонов от кислоты к основанию и представляют собой две одновременно протекающие полуреакции:
3. Протолитические реакции сопровождаются переносом протонов от кислоты к основанию и представляют собой две одновременно протекающие полуреакции:
 Вывод. Теория Бренстеда более широкая теория кислот и оснований, включает в себя теорию Аррениуса. По Бренстеду, любые взаимодействия , сопровождающиеся переносом Н+, независимо от среды (ТВ. , ГАЗ. , ЖИДК. ) и наличие электролитической диссоциации относится к кислотно основным.
Вывод. Теория Бренстеда более широкая теория кислот и оснований, включает в себя теорию Аррениуса. По Бренстеду, любые взаимодействия , сопровождающиеся переносом Н+, независимо от среды (ТВ. , ГАЗ. , ЖИДК. ) и наличие электролитической диссоциации относится к кислотно основным.
 Типы протолитических реакций 1. нейтрализация 2. гидролиз 3. электролитическая диссоциация
Типы протолитических реакций 1. нейтрализация 2. гидролиз 3. электролитическая диссоциация
 4. Кислотно-основные свойства вещество проявляет в конкретной химической реакции. В зависимости от партнера могут быть вещества амфолиты. Характеристика воды как амфолита 5. Протон в водных растворах гидратирован, существует в виде иона –гидроксония Н 3 О+
4. Кислотно-основные свойства вещество проявляет в конкретной химической реакции. В зависимости от партнера могут быть вещества амфолиты. Характеристика воды как амфолита 5. Протон в водных растворах гидратирован, существует в виде иона –гидроксония Н 3 О+
 Теория Льюиса. l Для того чтобы вещество могло быть акцептором протонов оно должно обладать неподеленной парой электронов, которая связывала бы протон. На эту особенность кислотно основных реакций впервые обратил внимание Г. Н. Льюис в 1923 году.
Теория Льюиса. l Для того чтобы вещество могло быть акцептором протонов оно должно обладать неподеленной парой электронов, которая связывала бы протон. На эту особенность кислотно основных реакций впервые обратил внимание Г. Н. Льюис в 1923 году.
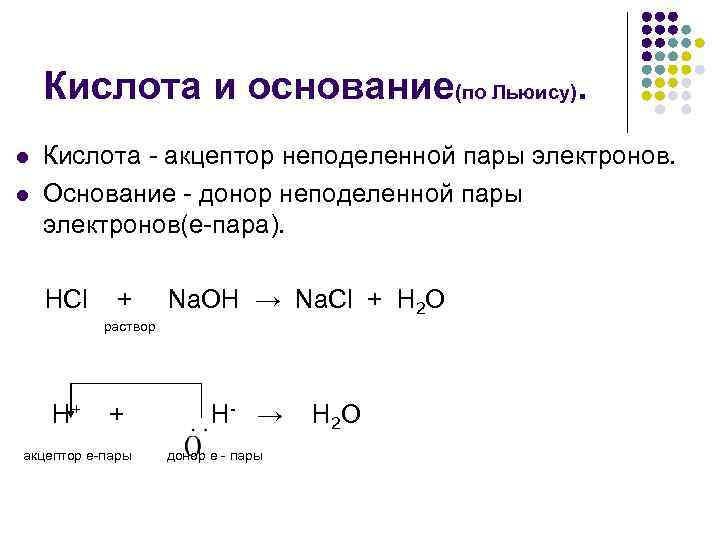
 Кислота и основание(по Льюису). l Кислота акцептор неподеленной пары электронов. l Основание донор неподеленной пары электронов(е пара). HCl + Na. OH → Na. Cl + H 2 O раствор H+ + H → H 2 O акцептор е пары донор е пары
Кислота и основание(по Льюису). l Кислота акцептор неподеленной пары электронов. l Основание донор неподеленной пары электронов(е пара). HCl + Na. OH → Na. Cl + H 2 O раствор H+ + H → H 2 O акцептор е пары донор е пары
 Комплексообразование (кислотно- основное взаимодействие по Льюису). l Комплексообразователь(ко) – акцептор е пар – кислота Льюиса. l Лиганды – доноры е пар – основания Льюиса. е пара Сu 2+ + 4 H 3 ⇄ [Cu(NH 3)4]2+ кислота основание Льюиса
Комплексообразование (кислотно- основное взаимодействие по Льюису). l Комплексообразователь(ко) – акцептор е пар – кислота Льюиса. l Лиганды – доноры е пар – основания Льюиса. е пара Сu 2+ + 4 H 3 ⇄ [Cu(NH 3)4]2+ кислота основание Льюиса
 Вывод. l Наиболее общая теория, охватывает теории Бренстеда и Аррениуса, по Льюису любые взаимодействия сопровождающиеся переносом неподделенной е пары относятся к кислотно основным.
Вывод. l Наиболее общая теория, охватывает теории Бренстеда и Аррениуса, по Льюису любые взаимодействия сопровождающиеся переносом неподделенной е пары относятся к кислотно основным.
 Частные случаи кислотно- основного взаимодействия. 1) Гидролиз по катиону – теория Льюиса по аниону – теория Бренстада. 2)Буферные системы. 3)Природные буферные системы.
Частные случаи кислотно- основного взаимодействия. 1) Гидролиз по катиону – теория Льюиса по аниону – теория Бренстада. 2)Буферные системы. 3)Природные буферные системы.
 Гидролиз по катиону. l Соли, образованные слабым основанием и сильной кислотой(примеры солей Cr. Cl 3, Zn. SO 4). Cr 3+ + H 2 ⇄ Cr. OH 2+ + H+ (р. H < 7) акцептор е пары донор е пары кислота Льюиса основание Льюиса Катионы малоактивных металлов, являясь акцепторами неподеленных пар ведут себя в водных растворах как кислоты Льюиса.
Гидролиз по катиону. l Соли, образованные слабым основанием и сильной кислотой(примеры солей Cr. Cl 3, Zn. SO 4). Cr 3+ + H 2 ⇄ Cr. OH 2+ + H+ (р. H < 7) акцептор е пары донор е пары кислота Льюиса основание Льюиса Катионы малоактивных металлов, являясь акцепторами неподеленных пар ведут себя в водных растворах как кислоты Льюиса.
 Гидролиз по аниону. l Соли образованные слабой кислотой и сильным основанием(примеры солей K 2 S, Na 2 CO 3). S 2 + H 2 O ⇄ HS + OH (р. H > 7 ) Высокое сродство к протону основание Бренстеда Анионы слабых кислот, обладая высоким сродством к протону, ведут себя в водных растворах как основания Бренстеда (р. H>7).
Гидролиз по аниону. l Соли образованные слабой кислотой и сильным основанием(примеры солей K 2 S, Na 2 CO 3). S 2 + H 2 O ⇄ HS + OH (р. H > 7 ) Высокое сродство к протону основание Бренстеда Анионы слабых кислот, обладая высоким сродством к протону, ведут себя в водных растворах как основания Бренстеда (р. H>7).
 Буферные системы. l Буферными называют растворы, р. Н которых практически не изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. С точки зрения протонной теории буферное действие растворов обусловлено наличием кислотно основного равновесия общего типа: Воснование + Н+ ⇄ ВН+сопряженная кислота НАкислота ⇄ Н+ + А сопряженное основание Сопряженные кислотно основные пары В /ВН+ и А /НА называют буферными системами.
Буферные системы. l Буферными называют растворы, р. Н которых практически не изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. С точки зрения протонной теории буферное действие растворов обусловлено наличием кислотно основного равновесия общего типа: Воснование + Н+ ⇄ ВН+сопряженная кислота НАкислота ⇄ Н+ + А сопряженное основание Сопряженные кислотно основные пары В /ВН+ и А /НА называют буферными системами.
 Классификация. l Буферные системы могут быть четырех типов: 1)Слабая кислота и ее анион А /НА 2)Слабое основание и его катион В/ВН+ 3)Анионы кислой и средней соли или двух кислых солей. 4) Ионы и молекулы амфипротонов.
Классификация. l Буферные системы могут быть четырех типов: 1)Слабая кислота и ее анион А /НА 2)Слабое основание и его катион В/ВН+ 3)Анионы кислой и средней соли или двух кислых солей. 4) Ионы и молекулы амфипротонов.
 Механизм буферного действия. На примере ацетатной буферной системы СН 3 СОО /СН 3 СОOH: СН 3 СООН ⇄ СН 3 СОО + Н+; кислота Бренстеда СН 3 СООNa ⇄ СН 3 СОО + Na+ основание Бренстеда При добавлении сильной кислоты: СН 3 СОО + Н+ ⇄ СН 3 СООН малодиссоциирующее вещество При добавлении основания: СН 3 СООН + ОН ⇄ СН 3 СОО + Н 2 О малодиссоциирующее вещество Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН в малодиссоциирующий продукт.
Механизм буферного действия. На примере ацетатной буферной системы СН 3 СОО /СН 3 СОOH: СН 3 СООН ⇄ СН 3 СОО + Н+; кислота Бренстеда СН 3 СООNa ⇄ СН 3 СОО + Na+ основание Бренстеда При добавлении сильной кислоты: СН 3 СОО + Н+ ⇄ СН 3 СООН малодиссоциирующее вещество При добавлении основания: СН 3 СООН + ОН ⇄ СН 3 СОО + Н 2 О малодиссоциирующее вещество Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН в малодиссоциирующий продукт.
 Природные буферные системы. l Буферные системы крови. Установлено, что состоянию нормы соответствует определенный диапазон колебаний р. Н крови – от 7, 37 до 7, 44 со средней величиной 7, 40. Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
Природные буферные системы. l Буферные системы крови. Установлено, что состоянию нормы соответствует определенный диапазон колебаний р. Н крови – от 7, 37 до 7, 44 со средней величиной 7, 40. Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
 Бикарбонатная буферная система. l Эта мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. Бикарбонатная система представляет собой сопряженную кислотно основную пару, состоящую из молекулы угольной кислоты Н 2 СО 3, выполняющую роль донора протона, и бикарбонат иона НСО 3–, выполняющего роль акцептора протона: H 2 CO 3 ⇄ H+ + HCO 3 донор акцептор протона
Бикарбонатная буферная система. l Эта мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. Бикарбонатная система представляет собой сопряженную кислотно основную пару, состоящую из молекулы угольной кислоты Н 2 СО 3, выполняющую роль донора протона, и бикарбонат иона НСО 3–, выполняющего роль акцептора протона: H 2 CO 3 ⇄ H+ + HCO 3 донор акцептор протона
 Фосфатная буферная система. l представляет собой сопряженную кислотно основную пару, состоящую из иона Н 2 Р (донор протонов) и иона НРО 42– (акцептор протонов): Н 2 РО 4– ⇄ H+ + НРО 42– донор акцептор протона l Роль кислоты в этой системе выполняет однозамещенный фосфат Na. H 2 PO 4, а роль соли двузамещенный фосфат – Na 2 HPO 4.
Фосфатная буферная система. l представляет собой сопряженную кислотно основную пару, состоящую из иона Н 2 Р (донор протонов) и иона НРО 42– (акцептор протонов): Н 2 РО 4– ⇄ H+ + НРО 42– донор акцептор протона l Роль кислоты в этой системе выполняет однозамещенный фосфат Na. H 2 PO 4, а роль соли двузамещенный фосфат – Na 2 HPO 4.
 Белковая буферная система Она имеет меньшее значение для поддержания кислотноосновного равновесия в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений р. Н 7, 2– 7, 4.
Белковая буферная система Она имеет меньшее значение для поддержания кислотноосновного равновесия в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений р. Н 7, 2– 7, 4.
 Гемоглобиновая буферная система l Это самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. l Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). l КНb + Н 2 СO 3 ⇄ КНСO 3 + ННb.
Гемоглобиновая буферная система l Это самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. l Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). l КНb + Н 2 СO 3 ⇄ КНСO 3 + ННb.

