Lektsia_7V_OP_OKh_Ob_ch_2.pptx
- Количество слайдов: 14
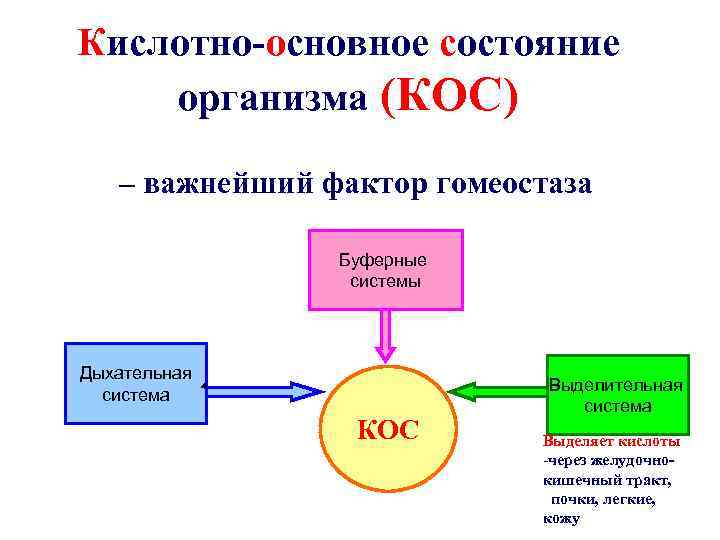 Кислотно-основное состояние организма (КОС) – важнейший фактор гомеостаза Буферные системы Дыхательная система КОС Выделительная система Выделяет кислоты -через желудочнокишечный тракт, почки, легкие, кожу
Кислотно-основное состояние организма (КОС) – важнейший фактор гомеостаза Буферные системы Дыхательная система КОС Выделительная система Выделяет кислоты -через желудочнокишечный тракт, почки, легкие, кожу
 Буферные системы организма 1. 2. 3. 4. 5. 6. Белковая: Pt-COOH - Pt-COONa Гемоглобиновая: HHb - KHb Оксигемоглобиновая: HHb. O 2 - KHb. O 2 Гидрофосфатная: Na. H 2 PO 4 - Na 2 HPO 4 Аммиачная: NH 4 Cl - NH 4 OH Гидрокарбонатная: H 2 CO 3 - Na. HCO 3
Буферные системы организма 1. 2. 3. 4. 5. 6. Белковая: Pt-COOH - Pt-COONa Гемоглобиновая: HHb - KHb Оксигемоглобиновая: HHb. O 2 - KHb. O 2 Гидрофосфатная: Na. H 2 PO 4 - Na 2 HPO 4 Аммиачная: NH 4 Cl - NH 4 OH Гидрокарбонатная: H 2 CO 3 - Na. HCO 3
 ОБМЕННЫЕ РЕАКЦИИ ПРОТОЛИТИЧЕСКИЕ ЛИГАНДООБМЕННЫЕ ДИССОЦИАЦИИ-АССОЦИАЦИИ Характерная особенность – элементы, входящие в состав реагирующих веществ, не меняют степени окисления
ОБМЕННЫЕ РЕАКЦИИ ПРОТОЛИТИЧЕСКИЕ ЛИГАНДООБМЕННЫЕ ДИССОЦИАЦИИ-АССОЦИАЦИИ Характерная особенность – элементы, входящие в состав реагирующих веществ, не меняют степени окисления
 Слабый электролит: Ка; р. Ка Комплексное соединение: Кн (Ку) (М. р. соединение + Н 2 О): ПР
Слабый электролит: Ка; р. Ка Комплексное соединение: Кн (Ку) (М. р. соединение + Н 2 О): ПР
![Константа равновесия процесса: M + n. L ↔ [MLn] называется константой устойчивости комплекса: Ку Константа равновесия процесса: M + n. L ↔ [MLn] называется константой устойчивости комплекса: Ку](https://present5.com/presentation/10409068_143272454/image-5.jpg) Константа равновесия процесса: M + n. L ↔ [MLn] называется константой устойчивости комплекса: Ку зависит от природы М и L, от особенностей химической связи
Константа равновесия процесса: M + n. L ↔ [MLn] называется константой устойчивости комплекса: Ку зависит от природы М и L, от особенностей химической связи
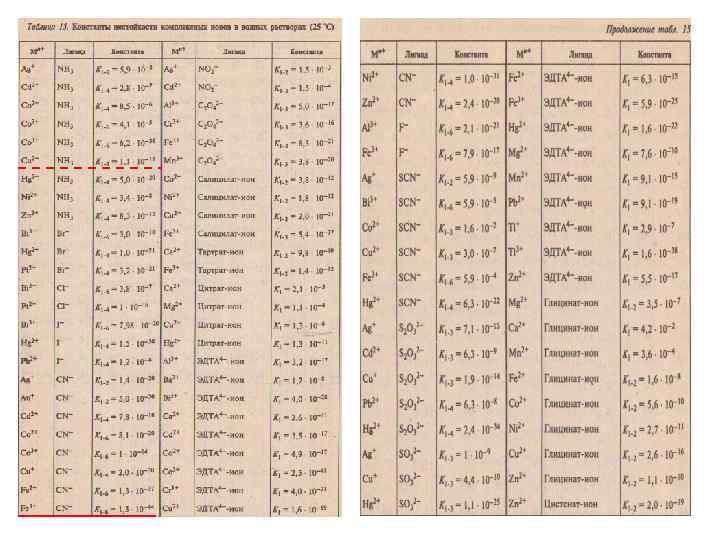
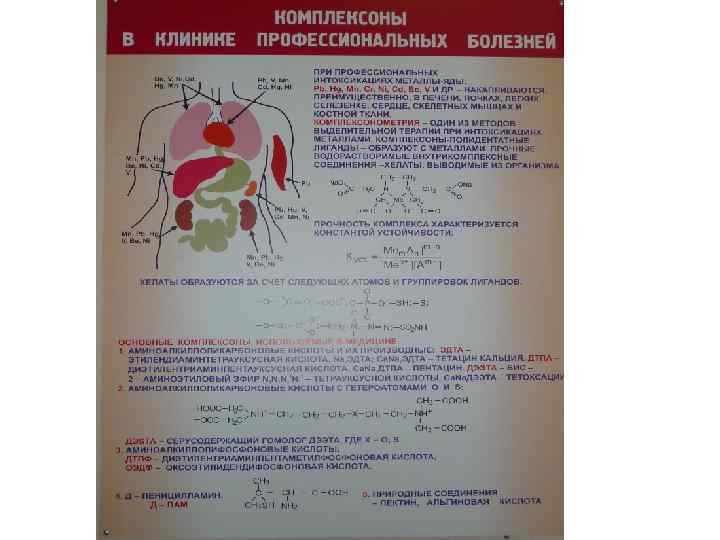
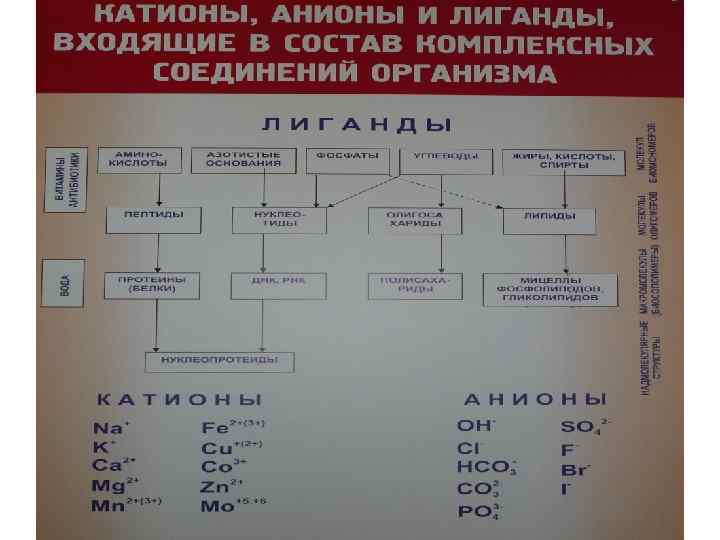
 Количественно оценить гетерогенный процесс в конкретной системе можно по следующему алгоритму: 1. определить ПК(произведение концентрации) 2. Сравнить ПК и ПР: • ПК> ПР - пересыщенный раствор – • образуется осадок • ПК = ПР - насыщенный раствор – • начало образования осадка • ПК< ПР - ненасыщенный раствор – • осадок растворяется
Количественно оценить гетерогенный процесс в конкретной системе можно по следующему алгоритму: 1. определить ПК(произведение концентрации) 2. Сравнить ПК и ПР: • ПК> ПР - пересыщенный раствор – • образуется осадок • ПК = ПР - насыщенный раствор – • начало образования осадка • ПК< ПР - ненасыщенный раствор – • осадок растворяется
 ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ МАЛОРАСТВОРИМЫХ ВЕЩЕСТВ (25 о. С) Соединение ПР Al(OH)3 5, 1·10 -33 Ca 3(PO 4)2 2, 0·10 -29 Ag. Cl 1, 6·10 -10 Fe(OH)3 3, 8·10 -38 Ag. Br 7, 7·10 -13 Fe(OH)2 1, 65·10 -15 Ag. CN 1, 4·10 -16 Fe. S 3, 7·10 -19 Ag. I 1, 5·10 -16 Mg. CO 3 1, 0·10 -5 Ag 2 S 3, 9·10 -50 Mn. S 1, 4·10 -15 Ag 2 SO 4 1, 5· 10 -9 Са 5(РО 4)3 ОН 1, 6· 10 -58 Ag 2 Cr. O 4 1, 1·10 -12 Mn(OH)2 4, 0·10 -14 Ba. Cr. O 4 2, 3·10 -10 Ni(OH)2 1, 6·10 -14 Ba. SO 4 1, 1·10 -10 Ni. CO 3 1, 4·10 -7 Ва. СО 3 8, 1·10 -9 Ni. S 3, 0·10 -21 Bi(OH)3 4, 3·10 -31 Pb(OH)2 2, 0·10 -16 Bi 2 S 3 1, 6·10 -72 Pb. Cl 2 2, 4·10 -4 Cr(OH)3 6, 7·10 -31 Pb. I 2 8, 7·10 -9
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ МАЛОРАСТВОРИМЫХ ВЕЩЕСТВ (25 о. С) Соединение ПР Al(OH)3 5, 1·10 -33 Ca 3(PO 4)2 2, 0·10 -29 Ag. Cl 1, 6·10 -10 Fe(OH)3 3, 8·10 -38 Ag. Br 7, 7·10 -13 Fe(OH)2 1, 65·10 -15 Ag. CN 1, 4·10 -16 Fe. S 3, 7·10 -19 Ag. I 1, 5·10 -16 Mg. CO 3 1, 0·10 -5 Ag 2 S 3, 9·10 -50 Mn. S 1, 4·10 -15 Ag 2 SO 4 1, 5· 10 -9 Са 5(РО 4)3 ОН 1, 6· 10 -58 Ag 2 Cr. O 4 1, 1·10 -12 Mn(OH)2 4, 0·10 -14 Ba. Cr. O 4 2, 3·10 -10 Ni(OH)2 1, 6·10 -14 Ba. SO 4 1, 1·10 -10 Ni. CO 3 1, 4·10 -7 Ва. СО 3 8, 1·10 -9 Ni. S 3, 0·10 -21 Bi(OH)3 4, 3·10 -31 Pb(OH)2 2, 0·10 -16 Bi 2 S 3 1, 6·10 -72 Pb. Cl 2 2, 4·10 -4 Cr(OH)3 6, 7·10 -31 Pb. I 2 8, 7·10 -9
 Окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними. В окислительно-восстановительных реакциях всегда происходят отдача и присоединение электронов. Окислитель – принимает электроны Восстановитель – отдает электроны
Окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними. В окислительно-восстановительных реакциях всегда происходят отдача и присоединение электронов. Окислитель – принимает электроны Восстановитель – отдает электроны
![СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Ag [Ag(NH 3)2]+ + СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Ag [Ag(NH 3)2]+ +](https://present5.com/presentation/10409068_143272454/image-12.jpg) СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Ag [Ag(NH 3)2]+ + ē ↔ Ag + 2 NH 3 +0, 80 Al Al. O 2 - + 4 H+ + 3 e ↔ Alтв. + 2 Н 2 О Аl(ОН)3 тв. + 3 е ↔ Аlтв. + 3 ОНАl 3+ + 2 е ↔ Аl+ -1, 262 -2, 31 -2, 76 Br Br 2 ж + 2 e ↔ 2 Br. O 3 - + 3 H 2 O + 6 e ↔ Br- + 6 OHHBr. O 3 + 4 H+ + 4 e ↔ HВr. O + 2 H 2 O 2 Br. O 3 - + 2 H 2 O + 2 e ↔ Br 2 ж + 4 OHBr. O- + H 2 O + 2 e ↔ Br- + 2 OH- +1, 05 +0, 61 +1, 46 +0, 45 +0, 76 Cl Сl 2 г + 2 е ↔ 2 Сl. О 4 - + 16 Н+ + 14 е ↔ Сl 2 г + 8 Н 2 О Сl. О 4 - + 2 Н+ + 2 е ↔ Сl. О 3 - + Н 2 О 2 Сl. О 3 - + 12 Н+ + 10 е ↔ Сl 2 г + 3 Н 2 О 2 НСl. О + 2 Н+ + 2 е ↔ Сl 2 г + Н 2 О Co Со 3+ + е ↔ Со 2+ Со 3 О 4 тв. + 8 Н+ + 2 е ↔ 3 Со 2+ + 4 Н 2 О Со 2 О 3 тв. + 6 Н+ + 2 е ↔ 2 Со 2+ + 3 Н 2 О +1, 35 +1, 39 +1, 19 +1, 47 +1, 63 +1, 81 +2, 11 +1, 75
СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Ag [Ag(NH 3)2]+ + ē ↔ Ag + 2 NH 3 +0, 80 Al Al. O 2 - + 4 H+ + 3 e ↔ Alтв. + 2 Н 2 О Аl(ОН)3 тв. + 3 е ↔ Аlтв. + 3 ОНАl 3+ + 2 е ↔ Аl+ -1, 262 -2, 31 -2, 76 Br Br 2 ж + 2 e ↔ 2 Br. O 3 - + 3 H 2 O + 6 e ↔ Br- + 6 OHHBr. O 3 + 4 H+ + 4 e ↔ HВr. O + 2 H 2 O 2 Br. O 3 - + 2 H 2 O + 2 e ↔ Br 2 ж + 4 OHBr. O- + H 2 O + 2 e ↔ Br- + 2 OH- +1, 05 +0, 61 +1, 46 +0, 45 +0, 76 Cl Сl 2 г + 2 е ↔ 2 Сl. О 4 - + 16 Н+ + 14 е ↔ Сl 2 г + 8 Н 2 О Сl. О 4 - + 2 Н+ + 2 е ↔ Сl. О 3 - + Н 2 О 2 Сl. О 3 - + 12 Н+ + 10 е ↔ Сl 2 г + 3 Н 2 О 2 НСl. О + 2 Н+ + 2 е ↔ Сl 2 г + Н 2 О Co Со 3+ + е ↔ Со 2+ Со 3 О 4 тв. + 8 Н+ + 2 е ↔ 3 Со 2+ + 4 Н 2 О Со 2 О 3 тв. + 6 Н+ + 2 е ↔ 2 Со 2+ + 3 Н 2 О +1, 35 +1, 39 +1, 19 +1, 47 +1, 63 +1, 81 +2, 11 +1, 75
 СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Cr Cr 3+ + e ↔ Cr 2+ Cr 2 O 72 - + 14 H+ + 6 e ↔ 2 Cr 3+ + 7 H 2 O Cr. O 42 - + 4 H 2 O + 3 e ↔ Cr(OH)3 тв. + 5 OHCr. O 42 - + 8 H+ + 3 e ↔ Cr 3+ + 4 H 2 O -0, 41 +1, 33 -0, 13 +1, 477 Cu Cu 2+ + ē ↔ Cu+ +0, 16 F F 2 + 2 e ↔ 2 F- +2, 87 Fe Fe 3+ + e ↔ Fe 2+ Fe. O 42 - + 8 H+ + 3 e ↔ Fe 3+ + 4 H 2 O +0, 77 +1, 70 H 2 Н+ + 2 е ↔ Н 2 г Н 2 - 2 е ↔ 2 Н 2 Н 2 О + 2 е ↔ Н 2 г + 2 ОНН 2 О 2 + 2 Н+ + 2 е ↔ 2 Н 2 О НО 2 - + Н 2 О + 2 е ↔ 3 ОН- 0, 000 -2, 25 -0, 83 +1, 776 +0, 88 O O 2 + 4 H+ + 4 e ↔ 2 H 2 O O 2 + 2 H 2 O + 4 e ↔ 4 OHO 2 + 2 H+ + 2 e ↔ H 2 O 2 O 3 г + 2 H+ + 2 e ↔ O 2 г + H 2 O +1, 229 +0, 401 +0, 69 +2, 076
СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (298 К) Элемент Уравнение полуреакции Ео, В Cr Cr 3+ + e ↔ Cr 2+ Cr 2 O 72 - + 14 H+ + 6 e ↔ 2 Cr 3+ + 7 H 2 O Cr. O 42 - + 4 H 2 O + 3 e ↔ Cr(OH)3 тв. + 5 OHCr. O 42 - + 8 H+ + 3 e ↔ Cr 3+ + 4 H 2 O -0, 41 +1, 33 -0, 13 +1, 477 Cu Cu 2+ + ē ↔ Cu+ +0, 16 F F 2 + 2 e ↔ 2 F- +2, 87 Fe Fe 3+ + e ↔ Fe 2+ Fe. O 42 - + 8 H+ + 3 e ↔ Fe 3+ + 4 H 2 O +0, 77 +1, 70 H 2 Н+ + 2 е ↔ Н 2 г Н 2 - 2 е ↔ 2 Н 2 Н 2 О + 2 е ↔ Н 2 г + 2 ОНН 2 О 2 + 2 Н+ + 2 е ↔ 2 Н 2 О НО 2 - + Н 2 О + 2 е ↔ 3 ОН- 0, 000 -2, 25 -0, 83 +1, 776 +0, 88 O O 2 + 4 H+ + 4 e ↔ 2 H 2 O O 2 + 2 H 2 O + 4 e ↔ 4 OHO 2 + 2 H+ + 2 e ↔ H 2 O 2 O 3 г + 2 H+ + 2 e ↔ O 2 г + H 2 O +1, 229 +0, 401 +0, 69 +2, 076
 Какая из систем проявляет самые сильные окислительные свойства? Mn. O 4 - + 5 e + 8 H+ ↔ Mn 2+ + 4 H 2 O; Cо 3+ + e ↔ Cо 2+; Cr 2 O 72 - + 14 H+ + 6 e ↔ 2 Cr 3+ + 7 H 2 O; Br. O 3 - + 3 H 2 O + 6 e ↔ Br- + 6 OH- Ео = 1, 51 В Е о = 1, 81 В Ео = 1, 33 В Ео = 0, 45 В Какая из систем обладает самым сильным восстановительным свойством? Al 3+ + 3 e ↔ Alo; Fe 3+ + e ↔ Fe 2+; SO 42 - + H 2 O + 2 e ↔ SO 32 - + 2 OH-; NO 3 - + 2 H+ + 2 e ↔ NO 2 - + H 2 O; Е о = -2, 76 В Е о = 0, 77 В Ео = -0, 93 В Ео = 0, 96 В
Какая из систем проявляет самые сильные окислительные свойства? Mn. O 4 - + 5 e + 8 H+ ↔ Mn 2+ + 4 H 2 O; Cо 3+ + e ↔ Cо 2+; Cr 2 O 72 - + 14 H+ + 6 e ↔ 2 Cr 3+ + 7 H 2 O; Br. O 3 - + 3 H 2 O + 6 e ↔ Br- + 6 OH- Ео = 1, 51 В Е о = 1, 81 В Ео = 1, 33 В Ео = 0, 45 В Какая из систем обладает самым сильным восстановительным свойством? Al 3+ + 3 e ↔ Alo; Fe 3+ + e ↔ Fe 2+; SO 42 - + H 2 O + 2 e ↔ SO 32 - + 2 OH-; NO 3 - + 2 H+ + 2 e ↔ NO 2 - + H 2 O; Е о = -2, 76 В Е о = 0, 77 В Ео = -0, 93 В Ео = 0, 96 В


