Кислотно-основное состояние.ppt
- Количество слайдов: 77
 "КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ" Лекция Ассистент кафедры Широков Д. М.
"КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ" Лекция Ассистент кафедры Широков Д. М.
 План лекции • История проблемы КОС. • Физико-химические основы КОС. Основные механизмы поддержания КОС. • Оценка кислотно-основного состояния. Основные показатели КОС, их нормативы и пределы переносимости. • Роль нарушений КОС и их коррекции при критических состояниях. • Методы и техника проведения анализа КОС. Контроль за состоянием КОС. • Нарушения КОС, их диагностика. • Коррекция нарушений КОС.
План лекции • История проблемы КОС. • Физико-химические основы КОС. Основные механизмы поддержания КОС. • Оценка кислотно-основного состояния. Основные показатели КОС, их нормативы и пределы переносимости. • Роль нарушений КОС и их коррекции при критических состояниях. • Методы и техника проведения анализа КОС. Контроль за состоянием КОС. • Нарушения КОС, их диагностика. • Коррекция нарушений КОС.
 История проблемы КОС Роберт Бойл (Robert Boуle) (1627— 1691) предложил колометрический способ измерения кислотности. Этот принцип был единственным в клинике до 50 -х годов XX столетия.
История проблемы КОС Роберт Бойл (Robert Boуle) (1627— 1691) предложил колометрический способ измерения кислотности. Этот принцип был единственным в клинике до 50 -х годов XX столетия.
 Буферная теория КОС 1909 Л. Гендерсон (L. Henderson) Уравнение бикарбонатной буферной системы Н 2 СО 3↔ НСО 3– + H+ [Н 2 СО 3] x Ka = [НСО 3–] x [H+] [H 2 CO 3] [H+]=Ka x –––– [HCO 3–]
Буферная теория КОС 1909 Л. Гендерсон (L. Henderson) Уравнение бикарбонатной буферной системы Н 2 СО 3↔ НСО 3– + H+ [Н 2 СО 3] x Ka = [НСО 3–] x [H+] [H 2 CO 3] [H+]=Ka x –––– [HCO 3–]
![1912 г. – Jogenson p. H= – lg [H+] 1912 г. – Jogenson p. H= – lg [H+]](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-5.jpg) 1912 г. – Jogenson p. H= – lg [H+]
1912 г. – Jogenson p. H= – lg [H+]
![1916 – Гессельбах (К. Hesselbach) уравнение Гендерсона-Гессельбаха выглядит как [HCO 3–] p. H = 1916 – Гессельбах (К. Hesselbach) уравнение Гендерсона-Гессельбаха выглядит как [HCO 3–] p. H =](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-6.jpg) 1916 – Гессельбах (К. Hesselbach) уравнение Гендерсона-Гессельбаха выглядит как [HCO 3–] p. H = lg. Ka + lg –––– [H 2 CO 3]
1916 – Гессельбах (К. Hesselbach) уравнение Гендерсона-Гессельбаха выглядит как [HCO 3–] p. H = lg. Ka + lg –––– [H 2 CO 3]
 ВАН-СЛАЙК (Van Slyke) Дональд Декстер (1883 -1971), американский биохимик и химик-аналитик • Создал прибор для количественного анализа газов, содержащихся в крови и других жидкостях. • 1921 г. установил, что совместимый с жизнью р. Н крови находится в пределах 6, 8 -8, 0
ВАН-СЛАЙК (Van Slyke) Дональд Декстер (1883 -1971), американский биохимик и химик-аналитик • Создал прибор для количественного анализа газов, содержащихся в крови и других жидкостях. • 1921 г. установил, что совместимый с жизнью р. Н крови находится в пределах 6, 8 -8, 0
 Бронстед (Bronsted, Дания) и Лоури (Lowry, Англия) 1923 – предложили называть кислотой или основанием молекулы и ионы в зависимости от склонности их к потере /донатор/ или поглощению /акцептор/ протона.
Бронстед (Bronsted, Дания) и Лоури (Lowry, Англия) 1923 – предложили называть кислотой или основанием молекулы и ионы в зависимости от склонности их к потере /донатор/ или поглощению /акцептор/ протона.
 О. Зиггард-Андерсен
О. Зиггард-Андерсен
 Пол Аструп (Paul Astrup) глава центральной больничной лаборатории в Копенгагене, а с 1964 г. – профессор клинической химии Копенгагенского университета.
Пол Аструп (Paul Astrup) глава центральной больничной лаборатории в Копенгагене, а с 1964 г. – профессор клинической химии Копенгагенского университета.
 1954 г. Американский физиолог Ричард Сноу (R. Snow) сообщил о создании полярографического электрода для прямого измерения р. СО 2.
1954 г. Американский физиолог Ричард Сноу (R. Snow) сообщил о создании полярографического электрода для прямого измерения р. СО 2.
 1956 г. Американский биохимик и физиолог Л. С. Кларк (L. Clark) разработал полярографический электрод для определения p. O 2 в биологических жидкостях, в том числе и крови The Clark-type electrode consists of a Pt- (A) and a reference Ag/Ag. Cl-electrode (B) covered by a film of halfsaturated KCl electrolyte (C) enclosed within a Teflon membrane (D) which is held in place by a rubber ring (E). The voltage supply (F) and the electronic instrument for the measurements of the current output is shown (G).
1956 г. Американский биохимик и физиолог Л. С. Кларк (L. Clark) разработал полярографический электрод для определения p. O 2 в биологических жидкостях, в том числе и крови The Clark-type electrode consists of a Pt- (A) and a reference Ag/Ag. Cl-electrode (B) covered by a film of halfsaturated KCl electrolyte (C) enclosed within a Teflon membrane (D) which is held in place by a rubber ring (E). The voltage supply (F) and the electronic instrument for the measurements of the current output is shown (G).
 RADIOMETER (РАДИОМЕТР), Дания
RADIOMETER (РАДИОМЕТР), Дания
 1970 -е годы – начинается новый этап в мониторировании этих показателей, который был связан с внедрением оптодных технологий измерения и регистрации р. Н, р. СО 2 и р. О 2.
1970 -е годы – начинается новый этап в мониторировании этих показателей, который был связан с внедрением оптодных технологий измерения и регистрации р. Н, р. СО 2 и р. О 2.
 Peter Stewart, Ph. D. 1921 -1993 в 1981 г опубликовал свой совершенно новый физикохимический подход к построению физиологии КОС – гипотезу «разницы сильных ионов» (РСИ)
Peter Stewart, Ph. D. 1921 -1993 в 1981 г опубликовал свой совершенно новый физикохимический подход к построению физиологии КОС – гипотезу «разницы сильных ионов» (РСИ)
![Изменения в [Н+] возникают как следствие постоянно идущей диссоциации воды Два закона физической химии: Изменения в [Н+] возникают как следствие постоянно идущей диссоциации воды Два закона физической химии:](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-16.jpg) Изменения в [Н+] возникают как следствие постоянно идущей диссоциации воды Два закона физической химии: • закон электронейтральности, который определяется тем, что в водных растворах сумма всех положительно заряженных ионов равна сумме отрицательно заряженных ионов; • закон сохранения масс, который означает, что количество вещества в данном растворе остается постоянным, если оно не добавляется или производится, или не удаляется или разрушается.
Изменения в [Н+] возникают как следствие постоянно идущей диссоциации воды Два закона физической химии: • закон электронейтральности, который определяется тем, что в водных растворах сумма всех положительно заряженных ионов равна сумме отрицательно заряженных ионов; • закон сохранения масс, который означает, что количество вещества в данном растворе остается постоянным, если оно не добавляется или производится, или не удаляется или разрушается.
 РСИ является отражением равновесия всех сильных ионов. Для практических целей результат может быть получен определением разницы плазменных концентраций Na+ и Сl—. У здоровых людей эта разница составляет 40 -42 мэкв/л
РСИ является отражением равновесия всех сильных ионов. Для практических целей результат может быть получен определением разницы плазменных концентраций Na+ и Сl—. У здоровых людей эта разница составляет 40 -42 мэкв/л
 Клиническое приложение гипотезы Стюарта (256 параллельных исследований РСИ и BE в крови пациентов ОРИТ) • Норма РСИ 40 -42 ммоль/л. • снижение РСИ до 30 ммоль/л - недыхательный ацидоз. • возрастание РСИ за пределы 50 ммоль/л свидетельствует о недыхательном сдвиге в сторону алкалоза.
Клиническое приложение гипотезы Стюарта (256 параллельных исследований РСИ и BE в крови пациентов ОРИТ) • Норма РСИ 40 -42 ммоль/л. • снижение РСИ до 30 ммоль/л - недыхательный ацидоз. • возрастание РСИ за пределы 50 ммоль/л свидетельствует о недыхательном сдвиге в сторону алкалоза.
 Физико-химические основы КОС. Кислотно-основное состояние (КОС) является одним из основных компонентов гомеостаза организма.
Физико-химические основы КОС. Кислотно-основное состояние (КОС) является одним из основных компонентов гомеостаза организма.
 Буферная теория КОС
Буферная теория КОС
![Диссоциация воды H 2 O ↔H+ + OH— Нейтральная реакция [H+] = [OH—] Кислая Диссоциация воды H 2 O ↔H+ + OH— Нейтральная реакция [H+] = [OH—] Кислая](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-21.jpg) Диссоциация воды H 2 O ↔H+ + OH— Нейтральная реакция [H+] = [OH—] Кислая реакция +] [H > [OH—] Щелочная реакция [H+] —] < [OH
Диссоциация воды H 2 O ↔H+ + OH— Нейтральная реакция [H+] = [OH—] Кислая реакция +] [H > [OH—] Щелочная реакция [H+] —] < [OH
![Диссоциация воды [Н+] =0, 000 1… 0, 000 01 ммоль/л, Или 100 -10 нмоль/л Диссоциация воды [Н+] =0, 000 1… 0, 000 01 ммоль/л, Или 100 -10 нмоль/л](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-22.jpg) Диссоциация воды [Н+] =0, 000 1… 0, 000 01 ммоль/л, Или 100 -10 нмоль/л 1 p. H = lg ––––– [Н+] Чистая вода при Т=25 ºС p. H = 7, 0
Диссоциация воды [Н+] =0, 000 1… 0, 000 01 ммоль/л, Или 100 -10 нмоль/л 1 p. H = lg ––––– [Н+] Чистая вода при Т=25 ºС p. H = 7, 0
 Диссоциация воды Какие факторы влияют на концентрацию водородных ионов в воде? • наличие в воде примесей (прежде всего веществ, обладающих кислотными или основными свойствами, т. е. способными выделять или поглощать ионы Н+); • температура – ускоряет реакцию диссоциации воды и [H+] повышается.
Диссоциация воды Какие факторы влияют на концентрацию водородных ионов в воде? • наличие в воде примесей (прежде всего веществ, обладающих кислотными или основными свойствами, т. е. способными выделять или поглощать ионы Н+); • температура – ускоряет реакцию диссоциации воды и [H+] повышается.
![Диссоциация кислот Кислота ↔ H+ + Основание— [Кислота] = [H+] x [Основание—] [Кислота] [Н+] Диссоциация кислот Кислота ↔ H+ + Основание— [Кислота] = [H+] x [Основание—] [Кислота] [Н+]](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-24.jpg) Диссоциация кислот Кислота ↔ H+ + Основание— [Кислота] = [H+] x [Основание—] [Кислота] [Н+] = –––––– [Основание]
Диссоциация кислот Кислота ↔ H+ + Основание— [Кислота] = [H+] x [Основание—] [Кислота] [Н+] = –––––– [Основание]
 Сильная кислота → H+ + Слабое основание Порядок р. К Кислота Очень сильная -7 НСl ↔ H+ + Cl— Очень слабое Очень сильная -2 H 3 O+ ↔ H+ + H 2 O Очень слабое Довольно слабая 6 H 2 CO 3 ↔ H+ + HCO 3— Весьма сильное Довольно слабая 7 H 2 PO 4 — ↔ H+ + HPO 42— Весьма сильное Более слабая 3, 5 NH 4 + ↔ H+ + NH 3 Более сильное Очень слабая 16 H 2 O ↔ H+ + OH— Очень сильное Протон Сопряженное основание Слабая кислота ← H+ + Cильное основание
Сильная кислота → H+ + Слабое основание Порядок р. К Кислота Очень сильная -7 НСl ↔ H+ + Cl— Очень слабое Очень сильная -2 H 3 O+ ↔ H+ + H 2 O Очень слабое Довольно слабая 6 H 2 CO 3 ↔ H+ + HCO 3— Весьма сильное Довольно слабая 7 H 2 PO 4 — ↔ H+ + HPO 42— Весьма сильное Более слабая 3, 5 NH 4 + ↔ H+ + NH 3 Более сильное Очень слабая 16 H 2 O ↔ H+ + OH— Очень сильное Протон Сопряженное основание Слабая кислота ← H+ + Cильное основание
![Диапазон [H+] и p. H при Т= 37°С Состояние АЛКАЛО З 6. 8 100 Диапазон [H+] и p. H при Т= 37°С Состояние АЛКАЛО З 6. 8 100](https://present5.com/presentation/3/-56555132_208039729.pdf-img/-56555132_208039729.pdf-26.jpg) Диапазон [H+] и p. H при Т= 37°С Состояние АЛКАЛО З 6. 8 100 7. 0 80 7. 1 63 7. 2 50 НОРМА p. Н 158 АЦИДОЗ H+ (nmol/l) 7. 3 44 7. 36 40 7. 4 36 7. 44 32 7. 5 25 7. 6 20 7. 7 16 7. 8 «Химический 0» «Биологический 0»
Диапазон [H+] и p. H при Т= 37°С Состояние АЛКАЛО З 6. 8 100 7. 0 80 7. 1 63 7. 2 50 НОРМА p. Н 158 АЦИДОЗ H+ (nmol/l) 7. 3 44 7. 36 40 7. 4 36 7. 44 32 7. 5 25 7. 6 20 7. 7 16 7. 8 «Химический 0» «Биологический 0»
 Для чего нужна стабилизация р. Н? • Активность ферментов зависит от p. H • При отклонении р. Н от нормальных величин функция мембран и ферментных систем организма нарушается. • Необходимы механизмы поддержания р. Н биологических сред в оптимальных (допустимых) пределах.
Для чего нужна стабилизация р. Н? • Активность ферментов зависит от p. H • При отклонении р. Н от нормальных величин функция мембран и ферментных систем организма нарушается. • Необходимы механизмы поддержания р. Н биологических сред в оптимальных (допустимых) пределах.
 Для чего нужна стабилизация р. Н? • Пример 1. Так ацидоз понижает сродство кислорода к гемоглобину, что затрудняет захват кислорода в легких, но улучшает отдачу в тканях. И, наоборот, алкалоз повышает сродство, что улучшает захват кислорода в легких, но затрудняет его отдачу в тканях. • Пример 2. Алкалоз понижает степень ионизации кальция, что может приводить к развитию судорог, тетании.
Для чего нужна стабилизация р. Н? • Пример 1. Так ацидоз понижает сродство кислорода к гемоглобину, что затрудняет захват кислорода в легких, но улучшает отдачу в тканях. И, наоборот, алкалоз повышает сродство, что улучшает захват кислорода в легких, но затрудняет его отдачу в тканях. • Пример 2. Алкалоз понижает степень ионизации кальция, что может приводить к развитию судорог, тетании.
 В организме постоянно образуются кислоты летучие кислоты (СО 2) нелетучие кислоты (фосфорная, серная, карбоновые и т. д. ), 15000 ммоль/сут 30— 80 мэкв • Поступают извне (с пищей и водой) кислоты и основания. ?
В организме постоянно образуются кислоты летучие кислоты (СО 2) нелетучие кислоты (фосфорная, серная, карбоновые и т. д. ), 15000 ммоль/сут 30— 80 мэкв • Поступают извне (с пищей и водой) кислоты и основания. ?
 Основные механизмы поддержания КОС • Буферизация • Компенсация • Коррекция
Основные механизмы поддержания КОС • Буферизация • Компенсация • Коррекция
 Регуляция p. H Система Скорость Полнота реакции компенсации Буферные системы Секунды Неполный Дыхание Минуты Неполный Часы и дни Полный Почки
Регуляция p. H Система Скорость Полнота реакции компенсации Буферные системы Секунды Неполный Дыхание Минуты Неполный Часы и дни Полный Почки
 Буферные системы (БС) • Бикарбонатная БС (53% - буферной емкости крови) Комплексная (небикарбонатная): • гемоглобин /оксигемоглобин, • фосфаты • белки
Буферные системы (БС) • Бикарбонатная БС (53% - буферной емкости крови) Комплексная (небикарбонатная): • гемоглобин /оксигемоглобин, • фосфаты • белки
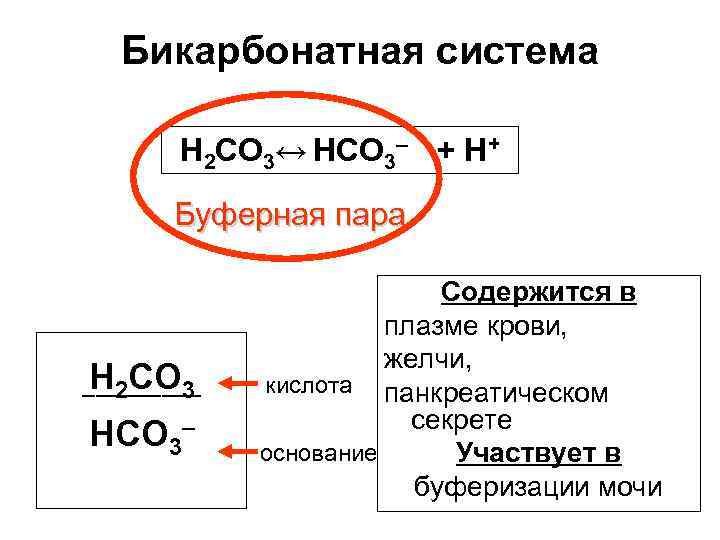 Бикарбонатная система Н 2 СО 3↔ НСО 3– + H+ Буферная пара Н 2 СО 3 ––––– НСО 3– Содержится в плазме крови, желчи, кислота панкреатическом секрете основание Участвует в буферизации мочи
Бикарбонатная система Н 2 СО 3↔ НСО 3– + H+ Буферная пара Н 2 СО 3 ––––– НСО 3– Содержится в плазме крови, желчи, кислота панкреатическом секрете основание Участвует в буферизации мочи
 Буферизация кислот Н 2 СО 3↔ НСО 3– + H+ Нейтральный ион Основание НСО 3– + HCl Н 2 СО 3 + Cl– Сильная кислота Слабая кислота
Буферизация кислот Н 2 СО 3↔ НСО 3– + H+ Нейтральный ион Основание НСО 3– + HCl Н 2 СО 3 + Cl– Сильная кислота Слабая кислота
 Буферизация оснований Н 2 СО 3↔ НСО 3– + H+ OH– + Н 2 СО 3 Н 2 О + НСО 3– Сильное основание Более слабое основание
Буферизация оснований Н 2 СО 3↔ НСО 3– + H+ OH– + Н 2 СО 3 Н 2 О + НСО 3– Сильное основание Более слабое основание
 Буферное действие угольной кислоты (транспорт СО 2 в крови) 6% 70% 24% Wahlin et al.
Буферное действие угольной кислоты (транспорт СО 2 в крови) 6% 70% 24% Wahlin et al.
 Гемоглобиновая буферная система НHb. O 2 ––––– Hb кислота основание Содержится в эритроцитах NB При анемиях буферная емкость крови значительно снижается
Гемоглобиновая буферная система НHb. O 2 ––––– Hb кислота основание Содержится в эритроцитах NB При анемиях буферная емкость крови значительно снижается
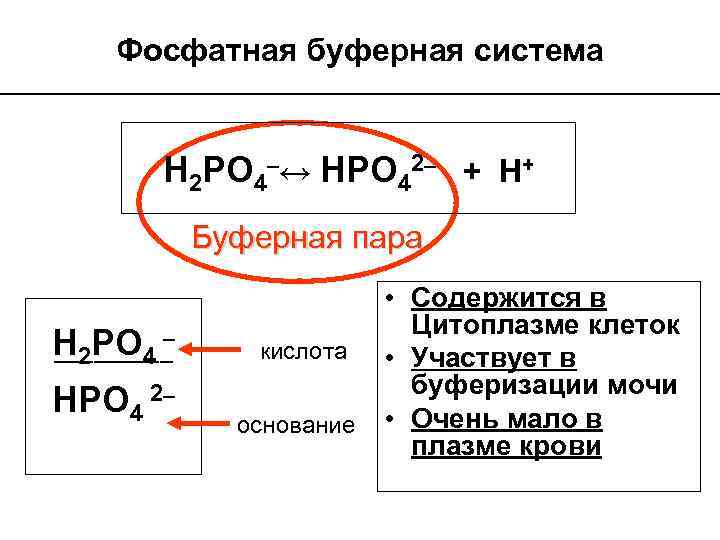 Фосфатная буферная система Н 2 PO 4–↔ НPO 42– + H+ Буферная пара Н 2 PO 4 – ––––– HPO 4 2– кислота основание • Содержится в Цитоплазме клеток • Участвует в буферизации мочи • Очень мало в плазме крови
Фосфатная буферная система Н 2 PO 4–↔ НPO 42– + H+ Буферная пара Н 2 PO 4 – ––––– HPO 4 2– кислота основание • Содержится в Цитоплазме клеток • Участвует в буферизации мочи • Очень мало в плазме крови
 Белковая буферная система НProt↔ Prot– + H+ Буферная пара НProt ––––– Prot– В пределах значений p. H организма буферной кислота способностью обладают только основание имидазольные группы гистидинов.
Белковая буферная система НProt↔ Prot– + H+ Буферная пара НProt ––––– Prot– В пределах значений p. H организма буферной кислота способностью обладают только основание имидазольные группы гистидинов.
 Относительная буферная емкость отдельных буферов в цельной крови Гемоглобин и 35% оксигемоглобин Органические фосфаты 3% Неорганические фосфаты Белки плазмы 2% 7% Гидрокарбонат плазмы 35% + Гидрокарбонат 18% эритроцитов
Относительная буферная емкость отдельных буферов в цельной крови Гемоглобин и 35% оксигемоглобин Органические фосфаты 3% Неорганические фосфаты Белки плазмы 2% 7% Гидрокарбонат плазмы 35% + Гидрокарбонат 18% эритроцитов
 Компенсация (от лат. compensatio — уравновешивание) — это вторичная реакция организма на сдвиг физиологического параметра. Компенсаторной реакцией при недыхательном ацидозе — легочная гипервентиляция, при недыхательном алкалозе — гиповентиляция.
Компенсация (от лат. compensatio — уравновешивание) — это вторичная реакция организма на сдвиг физиологического параметра. Компенсаторной реакцией при недыхательном ацидозе — легочная гипервентиляция, при недыхательном алкалозе — гиповентиляция.
 Коррекция (от лат. correctio — исправление, улучшение) — вторичная реакция организма, которая восстанавливает систему путем непосредственных влияний на начально сдвинутые физиологические параметры. Коррекция КЩБ означает нормализацию р. Н крови путем восстановления к норме сдвига метаболического или респираторного компонента. Так, при недыхательном ацидозе увеличение реабсорбции ионов НСO 3— почками или лечебное введение щелочных растворов являются способами его коррекции. Последняя, таким образом, осуществляется органами, физиологическими системами, а также лечебными воздействиями.
Коррекция (от лат. correctio — исправление, улучшение) — вторичная реакция организма, которая восстанавливает систему путем непосредственных влияний на начально сдвинутые физиологические параметры. Коррекция КЩБ означает нормализацию р. Н крови путем восстановления к норме сдвига метаболического или респираторного компонента. Так, при недыхательном ацидозе увеличение реабсорбции ионов НСO 3— почками или лечебное введение щелочных растворов являются способами его коррекции. Последняя, таким образом, осуществляется органами, физиологическими системами, а также лечебными воздействиями.
 Процессы компенсации и коррекции Легкие Почки
Процессы компенсации и коррекции Легкие Почки
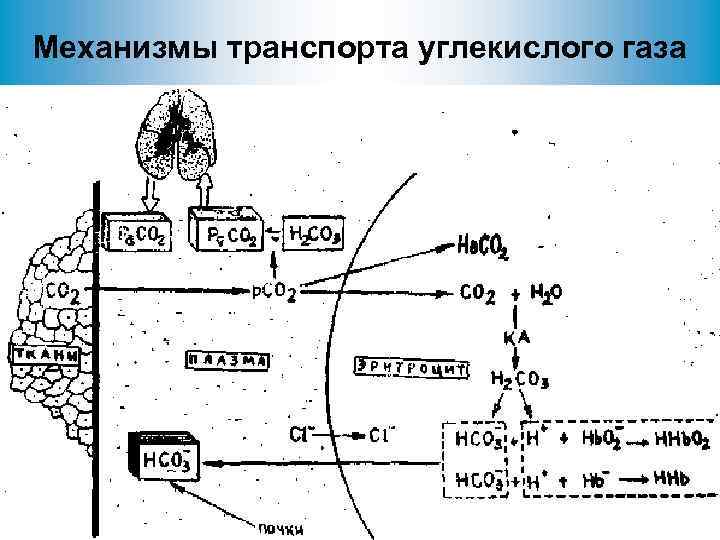 Механизмы транспорта углекислого газа
Механизмы транспорта углекислого газа
 Почечные механизмы регуляции КОС.
Почечные механизмы регуляции КОС.
 Участие печени в регуляции КОС • Метаболизм кислых продуктов (органических кислот) путем: • включение органических кислот в цикл Кребса • полное окисление до СО 2 и Н 2 О • ресинтез глюкозы. • Синтез мочевины из аммония. • Секреция желчи (бикарбонаты, желчные кислоты).
Участие печени в регуляции КОС • Метаболизм кислых продуктов (органических кислот) путем: • включение органических кислот в цикл Кребса • полное окисление до СО 2 и Н 2 О • ресинтез глюкозы. • Синтез мочевины из аммония. • Секреция желчи (бикарбонаты, желчные кислоты).
 Участие ЖКТ в КОС Отдел ЖКТ Желудок Процесс Секреция HCl Реакция Кислая Тонкий кишечник Секреция желчи и Щелочная панкреатического сока (НСО 3 -) Толстый кишечник Деятельность бактерий Кислая
Участие ЖКТ в КОС Отдел ЖКТ Желудок Процесс Секреция HCl Реакция Кислая Тонкий кишечник Секреция желчи и Щелочная панкреатического сока (НСО 3 -) Толстый кишечник Деятельность бактерий Кислая
 Причины нарушения КОС при патологических состояниях: • избыточное образование кислых продуктов (различные варианты гипоксии и гипоксемии); • Нарушения физиологических процессов удаления кислых продуктов (ОДН – дыхательный ацидоз, ОПН – дыхательный алкалоз); • нефизиологические потери различных субстанций, определяющих р. Н жидких сред организма (массивная рвота – недыхательный алкалоз, острая тонкокишечная непроходимость – недыхательный ацидоз); • Отравления кислотами/щелочами; • ятрогенные факторы (избыточная инфузия «несбалансированных» инфузионных растворов» , цитратный алкалоз), неадекватные режимы респираторной поддержки.
Причины нарушения КОС при патологических состояниях: • избыточное образование кислых продуктов (различные варианты гипоксии и гипоксемии); • Нарушения физиологических процессов удаления кислых продуктов (ОДН – дыхательный ацидоз, ОПН – дыхательный алкалоз); • нефизиологические потери различных субстанций, определяющих р. Н жидких сред организма (массивная рвота – недыхательный алкалоз, острая тонкокишечная непроходимость – недыхательный ацидоз); • Отравления кислотами/щелочами; • ятрогенные факторы (избыточная инфузия «несбалансированных» инфузионных растворов» , цитратный алкалоз), неадекватные режимы респираторной поддержки.
 Оценка кислотноосновного состояния. Основные показатели КОС, их нормативы и пределы переносимости.
Оценка кислотноосновного состояния. Основные показатели КОС, их нормативы и пределы переносимости.
 "Взятие образцов крови, равно как обращение с ними и транспортировка, являются ключевыми факторами точности клинического лабораторного анализа и в конечном счете качества предоставляемой медицинской помощи пациенту". Национальный Комитет по клиническим лабораторным стандартам, Дания (NCCLS, Document С 27 -А, Approved Guideline, April 1993)
"Взятие образцов крови, равно как обращение с ними и транспортировка, являются ключевыми факторами точности клинического лабораторного анализа и в конечном счете качества предоставляемой медицинской помощи пациенту". Национальный Комитет по клиническим лабораторным стандартам, Дания (NCCLS, Document С 27 -А, Approved Guideline, April 1993)
 Методы и техника проведения анализа КОС ПРАВИЛА ЗАБОРА КРОВИ ДЛЯ ИССЛЕДОВАНИЯ КОС АНАЭРОБНЫЕ УСЛОВИЯ Для забора проб крови используют шприцы емкостью 2 мл с поршнем, имеющим уплотнительное кольцо. Пробу хранить в анаэробных условиях. Необходимо сразу после заполнения шприца кровью удалить из него пузырьки воздуха и герметически закрыть при помощи иглы, насаженной на канюлю шприца и заполненной кровью, которая втыкается в резиновую пробку.
Методы и техника проведения анализа КОС ПРАВИЛА ЗАБОРА КРОВИ ДЛЯ ИССЛЕДОВАНИЯ КОС АНАЭРОБНЫЕ УСЛОВИЯ Для забора проб крови используют шприцы емкостью 2 мл с поршнем, имеющим уплотнительное кольцо. Пробу хранить в анаэробных условиях. Необходимо сразу после заполнения шприца кровью удалить из него пузырьки воздуха и герметически закрыть при помощи иглы, насаженной на канюлю шприца и заполненной кровью, которая втыкается в резиновую пробку.
 Методы и техника проведения анализа КОС ПРАВИЛА ЗАБОРА КРОВИ ДЛЯ ИССЛЕДОВАНИЯ КОС АНТИКОАГУЛЯНТ Шприц перед забором крови прополаскивают антикоагулянтом (только натриевая соль гепарина, т. к. ), удаляя последний полностью: остающееся его количество в канюле шприца (0, 15— 0, 2 мл).
Методы и техника проведения анализа КОС ПРАВИЛА ЗАБОРА КРОВИ ДЛЯ ИССЛЕДОВАНИЯ КОС АНТИКОАГУЛЯНТ Шприц перед забором крови прополаскивают антикоагулянтом (только натриевая соль гепарина, т. к. ), удаляя последний полностью: остающееся его количество в канюле шприца (0, 15— 0, 2 мл).
 МИНИМАЛЬНОЕ ВРЕМЯ ХРАНЕНИЯ ПРОБЫ Кровь — живущая ткань, которая продолжает потреблять кислород и выделять углекислоту, находясь в шприце. Cкорость изменений р. Н, р. О 2 и р. СО 2 в зависимости от температуры окружающей среды: 37°С р. Н — 0, 01/10 мин. 20°С 0, 001/10 мин р. О 2 — 0, 5 об%/10 мин 0, 05 об%/10 мин р. СО 2 1 мм рт. ст. /10 мин. 0, 1 мм рт. ст. /10 мин
МИНИМАЛЬНОЕ ВРЕМЯ ХРАНЕНИЯ ПРОБЫ Кровь — живущая ткань, которая продолжает потреблять кислород и выделять углекислоту, находясь в шприце. Cкорость изменений р. Н, р. О 2 и р. СО 2 в зависимости от температуры окружающей среды: 37°С р. Н — 0, 01/10 мин. 20°С 0, 001/10 мин р. О 2 — 0, 5 об%/10 мин 0, 05 об%/10 мин р. СО 2 1 мм рт. ст. /10 мин. 0, 1 мм рт. ст. /10 мин
 Контроль за состоянием КОС
Контроль за состоянием КОС
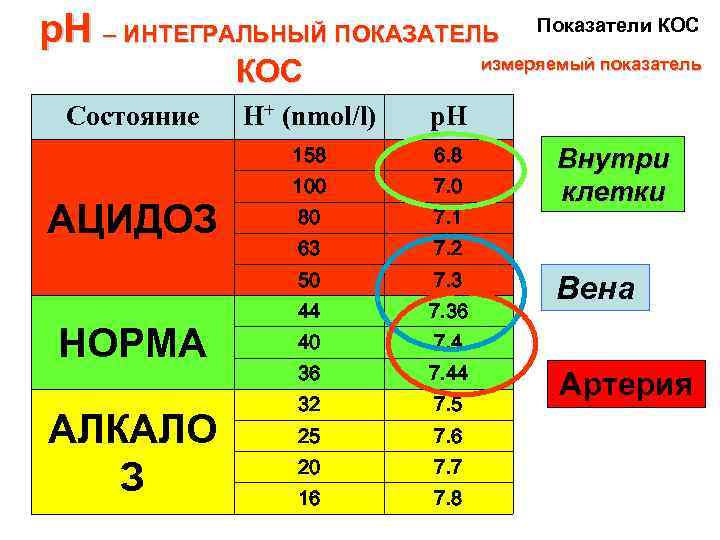 р. Н – ИНТЕГРАЛЬНЫЙ ПОКАЗАТЕЛЬ КОС Состояние измеряемый показатель АЛКАЛО З p. Н 6. 8 100 7. 0 80 7. 1 63 7. 2 50 НОРМА H+ (nmol/l) 158 АЦИДОЗ Показатели КОС 7. 3 44 7. 36 40 7. 4 36 7. 44 32 7. 5 25 7. 6 20 7. 7 16 7. 8 Внутри клетки Вена Артерия
р. Н – ИНТЕГРАЛЬНЫЙ ПОКАЗАТЕЛЬ КОС Состояние измеряемый показатель АЛКАЛО З p. Н 6. 8 100 7. 0 80 7. 1 63 7. 2 50 НОРМА H+ (nmol/l) 158 АЦИДОЗ Показатели КОС 7. 3 44 7. 36 40 7. 4 36 7. 44 32 7. 5 25 7. 6 20 7. 7 16 7. 8 Внутри клетки Вена Артерия
 Показатели КОС р. СО 2 - парциальное давление углекислого газа (измеряемый показатель) Показатель дыхательных нарушений КОС Значение р. СO 2 – парциальное давление – углекислого газа является мерой недиссоциированной угольной кислоты. Значения в норме • 40 (от 34 до 46) мм рт. ст. — артериальная кровь • 46 (от 42 до 55) мм рт. ст. — венозная кровь (Weisberg)
Показатели КОС р. СО 2 - парциальное давление углекислого газа (измеряемый показатель) Показатель дыхательных нарушений КОС Значение р. СO 2 – парциальное давление – углекислого газа является мерой недиссоциированной угольной кислоты. Значения в норме • 40 (от 34 до 46) мм рт. ст. — артериальная кровь • 46 (от 42 до 55) мм рт. ст. — венозная кровь (Weisberg)
 Показатели КОС AB – истинный бикарбонат (расчетный показатель) Действительной концентрации гидрокарбоната соответствует концентрация гидрокарбоната в плазме изучаемой пробы крови при действительных значениях р. Н и р. СO 2 и действительном насыщении кислорода в мэкв/л. • На действительную концентрацию гидрокарбоната действуют как дыхательные, так и метаболические влияния.
Показатели КОС AB – истинный бикарбонат (расчетный показатель) Действительной концентрации гидрокарбоната соответствует концентрация гидрокарбоната в плазме изучаемой пробы крови при действительных значениях р. Н и р. СO 2 и действительном насыщении кислорода в мэкв/л. • На действительную концентрацию гидрокарбоната действуют как дыхательные, так и метаболические влияния.
 Показатели КОС SB – Стандартный гидрокарбонат Показатель недыхательных нарушений КОС Стандартному гидрокарбонату соответствует концентрация гидрокарбоната в плазме изучаемой пробы крови в мэкв/л при стандартных условиях: • р. СО 2 = 40 мм рт. ст. , • полное насыщение гемоглобина кислородом, • T ° =37 °С). Значения в норме • 24 мэкв/л (22— 26) артериальная кровь • 26 мэкв/л (24— 28) венозная кровь (Geigy)
Показатели КОС SB – Стандартный гидрокарбонат Показатель недыхательных нарушений КОС Стандартному гидрокарбонату соответствует концентрация гидрокарбоната в плазме изучаемой пробы крови в мэкв/л при стандартных условиях: • р. СО 2 = 40 мм рт. ст. , • полное насыщение гемоглобина кислородом, • T ° =37 °С). Значения в норме • 24 мэкв/л (22— 26) артериальная кровь • 26 мэкв/л (24— 28) венозная кровь (Geigy)
 Показатели КОС ВВ – общие буферные основания всех буферных анионов изучаемой пробы крови, как ионы гидрокарбоната, фосфата, так и буферная емкость белков и гемоглобина при 37 °С и парциальном давлении углекислого газа 40 мм рт. ст. в мэкв/л крови.
Показатели КОС ВВ – общие буферные основания всех буферных анионов изучаемой пробы крови, как ионы гидрокарбоната, фосфата, так и буферная емкость белков и гемоглобина при 37 °С и парциальном давлении углекислого газа 40 мм рт. ст. в мэкв/л крови.
 Показатели КОС ВЕ – (Base Exces) избыток/дефицит оснований ВЕ = ВВфактич. — ВВнорм. Параметр BE указывает на количество кислоты или основания, необходимое для титрования литра крови до р. Н=7, 40 Условия • р. СО 2 = 40 мм рт. ст. , • Т° = 37°С и • So 2= 100%. (Severinghaus J. , 1966).
Показатели КОС ВЕ – (Base Exces) избыток/дефицит оснований ВЕ = ВВфактич. — ВВнорм. Параметр BE указывает на количество кислоты или основания, необходимое для титрования литра крови до р. Н=7, 40 Условия • р. СО 2 = 40 мм рт. ст. , • Т° = 37°С и • So 2= 100%. (Severinghaus J. , 1966).
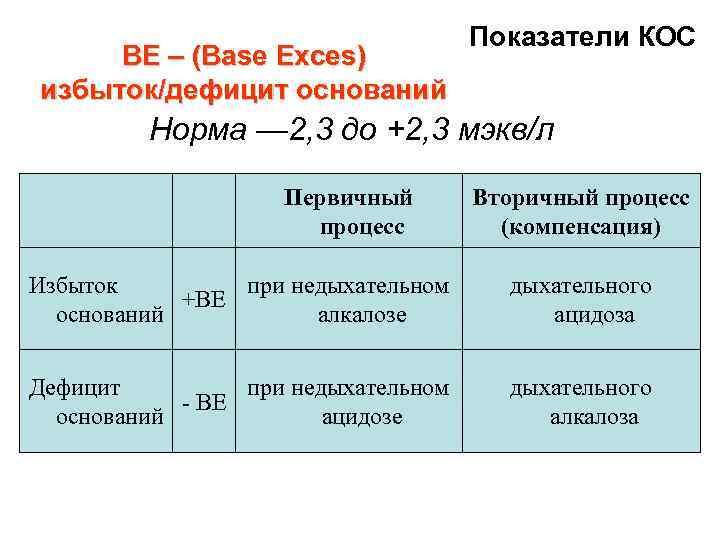 ВЕ – (Base Exces) избыток/дефицит оснований Показатели КОС Норма — 2, 3 до +2, 3 мэкв/л Первичный процесс Вторичный процесс (компенсация) Избыток при недыхательном +ВЕ оснований алкалозе дыхательного ацидоза Дефицит при недыхательном - ВЕ оснований ацидозе дыхательного алкалоза
ВЕ – (Base Exces) избыток/дефицит оснований Показатели КОС Норма — 2, 3 до +2, 3 мэкв/л Первичный процесс Вторичный процесс (компенсация) Избыток при недыхательном +ВЕ оснований алкалозе дыхательного ацидоза Дефицит при недыхательном - ВЕ оснований ацидозе дыхательного алкалоза
 ВЕ – (Base Exces) Показатели КОС избыток/дефицит оснований Норма — 2, 3 до +2, 3 мэкв/л V (ммоль) = BE x m x К, где BE - избыток/дефицит оснований, ммоль/л m – масса тела, кг К – коэффициент объема внеклеточной жидкости (0, 3) Величина К 0, 3 Концентрация р-ра 8, 4 % (молярный) 0, 6 4% 0, 5 5% 0, 8 3%
ВЕ – (Base Exces) Показатели КОС избыток/дефицит оснований Норма — 2, 3 до +2, 3 мэкв/л V (ммоль) = BE x m x К, где BE - избыток/дефицит оснований, ммоль/л m – масса тела, кг К – коэффициент объема внеклеточной жидкости (0, 3) Величина К 0, 3 Концентрация р-ра 8, 4 % (молярный) 0, 6 4% 0, 5 5% 0, 8 3%
 Нарушения КОС, их диагностика. Коррекция нарушений КОС. Роль нарушений КОС и их коррекции при критических состояниях.
Нарушения КОС, их диагностика. Коррекция нарушений КОС. Роль нарушений КОС и их коррекции при критических состояниях.
 Формы ацидоза и алкалоза Особенности изменений Простые Формы ацидоза и алкалоза Причины расстройств [HCO 3] расстройства КОС р. Н = ——— [CO 2] Недыхательный 1. Накопление сильных кислот ацидоз — 2. Потеря НСО 3 Результат уменьшения числителя Недыхательный алкалоз 1. Экзогенное введение щелочи 2. Накопление НСО 3— 3. Потеря сильных кислот Результат увеличения числителя Респираторный ацидоз 1. Увеличение СО 2 ↑ Результат увеличения знаменателя Респираторный алкалоз 1. Уменьшение СО 2 ↓ Результат уменьшения знаменателя
Формы ацидоза и алкалоза Особенности изменений Простые Формы ацидоза и алкалоза Причины расстройств [HCO 3] расстройства КОС р. Н = ——— [CO 2] Недыхательный 1. Накопление сильных кислот ацидоз — 2. Потеря НСО 3 Результат уменьшения числителя Недыхательный алкалоз 1. Экзогенное введение щелочи 2. Накопление НСО 3— 3. Потеря сильных кислот Результат увеличения числителя Респираторный ацидоз 1. Увеличение СО 2 ↑ Результат увеличения знаменателя Респираторный алкалоз 1. Уменьшение СО 2 ↓ Результат уменьшения знаменателя
 НАРУШЕНИЯ КОС
НАРУШЕНИЯ КОС
 Недыхательный ацидоз патологический процесс, который обусловлен накоплением сильной кислоты или потерей бикарбоната и характеризуется увеличением концентрации водородных ионов в крови и тканях. —
Недыхательный ацидоз патологический процесс, который обусловлен накоплением сильной кислоты или потерей бикарбоната и характеризуется увеличением концентрации водородных ионов в крови и тканях. —
 ПРИЧИНЫ НЕДЫХАТЕЛЬНОГО АЦИДОЗА I. Накопление сильных кислот А. Экзогенное: 1. Развитие NH 4 Cl — ацидоза при введении избытка соляной кислоты. Б. Эндогенное: 1. Неполное окисление жиров — кетоацидоз. 2. Неполное окисление углеводов — лактоацидоз. 3. Накопление неорганических кислот — продуктов нормального метаболизма (H 2 SO 4 и Н 3 РО 4) при почечной недостаточности. II. Потеря, бикарбоната • 1. Канальцевый ацидоз при нарушениях реабсорбции НСО 3—. • 2. Панкреатический дренаж, желчный дренаж, диаррея.
ПРИЧИНЫ НЕДЫХАТЕЛЬНОГО АЦИДОЗА I. Накопление сильных кислот А. Экзогенное: 1. Развитие NH 4 Cl — ацидоза при введении избытка соляной кислоты. Б. Эндогенное: 1. Неполное окисление жиров — кетоацидоз. 2. Неполное окисление углеводов — лактоацидоз. 3. Накопление неорганических кислот — продуктов нормального метаболизма (H 2 SO 4 и Н 3 РО 4) при почечной недостаточности. II. Потеря, бикарбоната • 1. Канальцевый ацидоз при нарушениях реабсорбции НСО 3—. • 2. Панкреатический дренаж, желчный дренаж, диаррея.
 Недыхательный алкалоз патологический процесс, который обусловлен накоплением сильного основания или потерей кислоты и характеризуется уменьшением концентрации водородных ионов в крови и тканях.
Недыхательный алкалоз патологический процесс, который обусловлен накоплением сильного основания или потерей кислоты и характеризуется уменьшением концентрации водородных ионов в крови и тканях.
 Причины недыхательного алкалоза: 1. Экзогенное введение избытка оснований. 2. Потеря соляной кислоты (рвота). 3. Калиевое истощение — обусловлено потерей калия через почки или внепочечными путями при использовании диуретиков или кортикостероидов.
Причины недыхательного алкалоза: 1. Экзогенное введение избытка оснований. 2. Потеря соляной кислоты (рвота). 3. Калиевое истощение — обусловлено потерей калия через почки или внепочечными путями при использовании диуретиков или кортикостероидов.
 Респираторный ацидоз — патологический процесс, при котором увеличение концентрации водородных ионов развивается в результате уменьшения альвеолярной вентиляции по отношению к, скорости образования СО 2 в тканях.
Респираторный ацидоз — патологический процесс, при котором увеличение концентрации водородных ионов развивается в результате уменьшения альвеолярной вентиляции по отношению к, скорости образования СО 2 в тканях.
 Причины респираторного ацидоза: I. Нарушения в аппарате внешнего дыхания. 1. Травмы грудной клетки. 2. Параличи и парезы дыхательных мышц. 3. Гиперкапническая стадия постшоковой дыхательной недостаточности. 4. Отек легких. 5. Нарушения проходимости дыхательных путей. II. Нарушения функций ЦНС: 1. Травмы головного мозга. 2. Угнетение дыхательного центра (наркотики, интоксикация).
Причины респираторного ацидоза: I. Нарушения в аппарате внешнего дыхания. 1. Травмы грудной клетки. 2. Параличи и парезы дыхательных мышц. 3. Гиперкапническая стадия постшоковой дыхательной недостаточности. 4. Отек легких. 5. Нарушения проходимости дыхательных путей. II. Нарушения функций ЦНС: 1. Травмы головного мозга. 2. Угнетение дыхательного центра (наркотики, интоксикация).
 Респираторный алкалоз — патологический процесс, при котором снижение концентрации водородных ионов обусловлено первичным увеличением альвеолярной вентиляции по отношению к скорости образования СО 2 в тканях.
Респираторный алкалоз — патологический процесс, при котором снижение концентрации водородных ионов обусловлено первичным увеличением альвеолярной вентиляции по отношению к скорости образования СО 2 в тканях.
 Причиной респираторного алкалоза является альвеолярная гипервентиляция: • • • Гипоксемия. Раздражение рецепторных полей легких. Травмы ЦНС. Эмоциональное возбуждение, боль. Интоксикации. Ятрогения (ИВЛ/ВВЛ в режиме гипервентиляции)
Причиной респираторного алкалоза является альвеолярная гипервентиляция: • • • Гипоксемия. Раздражение рецепторных полей легких. Травмы ЦНС. Эмоциональное возбуждение, боль. Интоксикации. Ятрогения (ИВЛ/ВВЛ в режиме гипервентиляции)
 Клинический пример Респираторный ацидоз
Клинический пример Респираторный ацидоз
 Респираторный ацидоз Перед интубацией трахеи ИВЛ Самостоятельное дыхание
Респираторный ацидоз Перед интубацией трахеи ИВЛ Самостоятельное дыхание
 Литература (основная) • Анестезиология и реаниматология: Учебник/ Б. С. Уваров и др. : Под общ. ред. И. М. Чижа: СПб, Вмед. А, 1995. - С. 91 -98 • Оценка лабораторных данных при проведении анестезии и послеоперационной интенсивной терапии: Учебное пособие – Л. , ВМА, 1986. - С. 34 -42 • Руководство по анестезиологии. Под ред. Бунатяна А. А. - М, Медицина, 1994 – С. 123128. • Рябов Г. А. Синдромы критических состояний /М. , «Медицина» . - 1994. -С. 58 -62, 84 -86, 117167 • Руководство по анестезиологии. Под ред. Полушина Ю. С.
Литература (основная) • Анестезиология и реаниматология: Учебник/ Б. С. Уваров и др. : Под общ. ред. И. М. Чижа: СПб, Вмед. А, 1995. - С. 91 -98 • Оценка лабораторных данных при проведении анестезии и послеоперационной интенсивной терапии: Учебное пособие – Л. , ВМА, 1986. - С. 34 -42 • Руководство по анестезиологии. Под ред. Бунатяна А. А. - М, Медицина, 1994 – С. 123128. • Рябов Г. А. Синдромы критических состояний /М. , «Медицина» . - 1994. -С. 58 -62, 84 -86, 117167 • Руководство по анестезиологии. Под ред. Полушина Ю. С.
 Литература (дополнительная) • • • Агапов Ю. Я. Кислотно-щелочной баланс. М. , 1968, с. 111 -161. Зильбер А. П. Клиническая физиология в анестезиологии и реаниматологии /М. , "Медицина". - 1984. - С. 176 -181, 446 -453. Костюченко А. Л. Новая концепция кислотно-основного равновесия и ее реализация в клинической практике (пособие для врачей). СПб, 2001, 31 с. Руксин В. В. Неотложная кардиология. - СПБ: Невский диалект, 1998. Руководство по пульмонологии. /Под ред. Н. В. Путова, -. : Медицина. - 1977. Руководство по реаниматологии. Под ред. Т. М. Дарбиняна, М. 1974, с. 73 -65. Рут Г. Кислотно-щелочное состояние и электролитный баланс, М. , 1978, 117 с. Руководство по клинической физиологии дыхания. Ред. Л. Л. Шик, Н. Н. Канаев, М. , "Медицина", I 960 с. 188 -209. Рябов Г. А. , Семенов В. Н. , Терентьева Л. М. Экстренная анестезиология /М. , «Медицина» . -1983. - С. 13 -25, 88 -95, 96 -104, 130 -144, 270 -282. Хартиг В. Современная инфузионная терапия, парентераль-ное питание. (Пособие для хирургической практики по лечению нарушений водного, электролитного, кислотно-щелочного и энергетического баланса. ) Издание 4 -е, переработанное и расширенное. Перев. с нем. Москва «Медицина» 1982.
Литература (дополнительная) • • • Агапов Ю. Я. Кислотно-щелочной баланс. М. , 1968, с. 111 -161. Зильбер А. П. Клиническая физиология в анестезиологии и реаниматологии /М. , "Медицина". - 1984. - С. 176 -181, 446 -453. Костюченко А. Л. Новая концепция кислотно-основного равновесия и ее реализация в клинической практике (пособие для врачей). СПб, 2001, 31 с. Руксин В. В. Неотложная кардиология. - СПБ: Невский диалект, 1998. Руководство по пульмонологии. /Под ред. Н. В. Путова, -. : Медицина. - 1977. Руководство по реаниматологии. Под ред. Т. М. Дарбиняна, М. 1974, с. 73 -65. Рут Г. Кислотно-щелочное состояние и электролитный баланс, М. , 1978, 117 с. Руководство по клинической физиологии дыхания. Ред. Л. Л. Шик, Н. Н. Канаев, М. , "Медицина", I 960 с. 188 -209. Рябов Г. А. , Семенов В. Н. , Терентьева Л. М. Экстренная анестезиология /М. , «Медицина» . -1983. - С. 13 -25, 88 -95, 96 -104, 130 -144, 270 -282. Хартиг В. Современная инфузионная терапия, парентераль-ное питание. (Пособие для хирургической практики по лечению нарушений водного, электролитного, кислотно-щелочного и энергетического баланса. ) Издание 4 -е, переработанное и расширенное. Перев. с нем. Москва «Медицина» 1982.


