КОС.ppt
- Количество слайдов: 35
Кислотно-основное состояние (КОС)

ОБЩИЕ СВЕДЕНИЯ О КОС • КОС - определенное соотношение концентрации протонов водорода (Н+) гидроксильных анионов (ОН-) в биологических средах организма, которое выражает р. Н крови.

• р. Н это отрицательный десятичный логарифм концентрации водородных ионов (протонов) в растворе, выраженной в моль/литр. • Цифра р. Н показывает, в какую отрицательную степень надо возвести основание десятичного логарифма, а оно равно соответственно 10, чтобы получить концентрацию ионов водорода в моль/литр.

p. H определяется уравнением Гендерсона —Гассельбальха

Зачем это все? р. Н является наиболее жесткой физико-химической константой. Концентрация Н+ во внеклеточной жидкости составляет одну миллионную от содержания натрия и калия, а регуляция на два порядка точнее.

ЗНАЧЕНИЕ ПОСТОЯНСТВА КОС ДЛЯ ОРГАНИЗМА 1. р. Н определяет физико-химические свойства коллоидных структур; 2. р. Н определяет активность, конформацию белков; 3. р. Н определяет чувствительность клеточных рецепторов; 4. р. Н определяет проницаемость клеточных мембран; 5. р. Н регулирует сосудистый тонус; 6. р. Н определяет состояние дыхательного центра; 7. р. Н влияет на состояние ЦНС

«Физиологическая шкала» – четыре диапазона: Адаптировано из лекции К. М. Лебединского

Механизмы КОС 1. физико-химические буферные системы организма; 2. физиологические механизмы регуляции.

Физико-химические буферные системы организма Вода: 1. образование иона гидроксония. 2. образование иона аммония; 3. разведение.

Первая линия защиты – буферные системы – Бикарбонатная – Гемоглобиновая – Белковая – Фосфатная
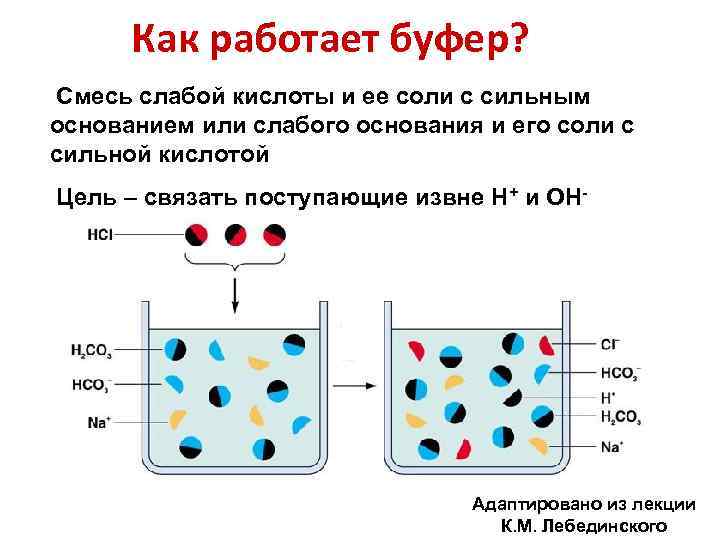
Как работает буфер? Смесь слабой кислоты и ее соли с сильным основанием или слабого основания и его соли с сильной кислотой Цель – связать поступающие извне Н+ и ОН- Адаптировано из лекции К. М. Лебединского

Гидрокарбонатный буфер крови и межклеточной жидкости • Н 2 СО 3/Na. HCO 3, соотношение 1/20. • Состав: угольная кислота и гидрокарбонат натрия. • В клетках вместо натрия - калий или магний. • Удельный вес - 7 -9 % общей буферной емкости крови. Емкость бикарбонатного буфера 25%. Его компоненты и определяются в качестве индикаторов КОС, что имеет большое диагностическое значение.

Гемоглобин • его емкость составляет до 75 % всей буферной емкости крови. Его компоненты: • восстановленный и оксигенированный гемоглобин: НHb/КНb. О 2. Восстановленный гемоглобин ведет себя как кислота, а оксигенированный - как основание

Белки Главный внутриклеточный буфер. Составляют 3/4 буферной емкости внутриклеточной жидкости. • - карбоксильная группа (R-СООН) в зависимости от условий обеспечивает нейтрализацию как избытка кислот, так и избытка щелочей; • - аминогруппа (R-NH 2)обеспечивает основные свойства. • -выступают в роли сильного основания и по другому механизму –в виде натриевой или калиевой соли

Фосфатный внутриклеточный буфер Na. H 2 P 04/Na 2 HPO 4, соотношение 1/4: • - Na. H 2 P 04 – кислый компонент (натрий дигидрофосфат, однозамещенный фосфат); • Na 2 HPO 4 – основной компонент (натрий гидрофосфат, двузамещенный фосфат). Он есть и в крови, но там он поддерживает, прежде всего «регенерацию» гидрокарбонатного буфера.

Вторая линия защитыфизиологические механизмы регуляции • • • Легкие Почки Печень ЖКТ Кожа
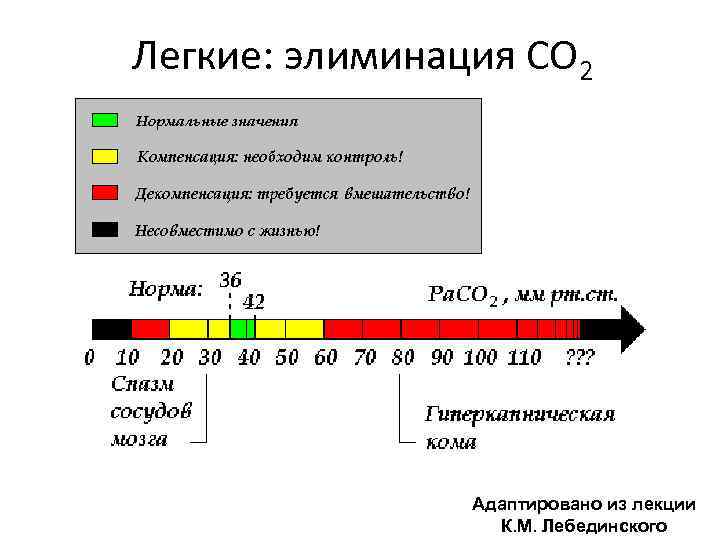
Легкие: элиминация СО 2 Адаптировано из лекции К. М. Лебединского

Почки • имеют три механизма устранения сдвига КОС: 1. ацидогенез; 2. аммониогенез; 3. сопряженный процесс: одновременная секреция кислых фосфатов с реабсорбцией гидрокарбонатов

Участи печени в поддержании КОС 1. в ней действуют внутри и внеклеточные буферные системы; 2. метаболизм гепатоцитов напрямую определяет возможность смещения или наоборот поддержания р. Н. Это определено следующим: − составляющие белкового буфера – синтезируются в печени; − образуется аммиак нейтрализующий кислоты; − гликонеогенез; − выведение нелетучих кислот и оснований

Участие ЖКТ в поддержании КОС: • за счет секреции соляной кислоты; • за счет секреции кишечником сока с большим содержанием гидрокарбонатов • за счет всасываемой жидкости; • за счет реабсорбции компонентов буферных систем; • за счет секреции поджелудочной железы

ПАРАМЕТРЫ КОС ОПРЕДЕЛЯЕМЫЕ В КЛИНИКЕ 1. актуальный р. Н; 2. парциальное давление (напряжение) углекислоты в крови; 3. парциальное давление (напряжение) кислорода в крови; 4. стандартный бикарбонат плазмы крови (SB) – концентрация бикарбоната в плазме крови 21, 3 -21, 8 ммоль/л в условиях температуры 37, 0, р. СО 2=40 мм рт. ст. , р. О 2=98 мм рт. ст. ; 5. буферные основания крови (BB) – это сумма анионов: бикарбонатов и белков – в норме 40 -60 ммоль/л; 6. нормальные буферные основания (NBB) – это сумма всех анионов крови, которые обладают буферными свойствами. Эта сумма равна – 155 ммоль/л. Она включает анионы: хлора, бикарбоната, белков, фосфатов, сульфатов, органических кислот; 7. избыток или дефицит оснований (BE)=BB-NBB. В норме от +2, 3 до – 2, 3 ммоль/л; 8. актуальный бикарбонат (АВ) –– отражает концентрацию бикарбоната в плазме крови в физиологическом состоянии. В норме равен 19 -25 ммоль/л
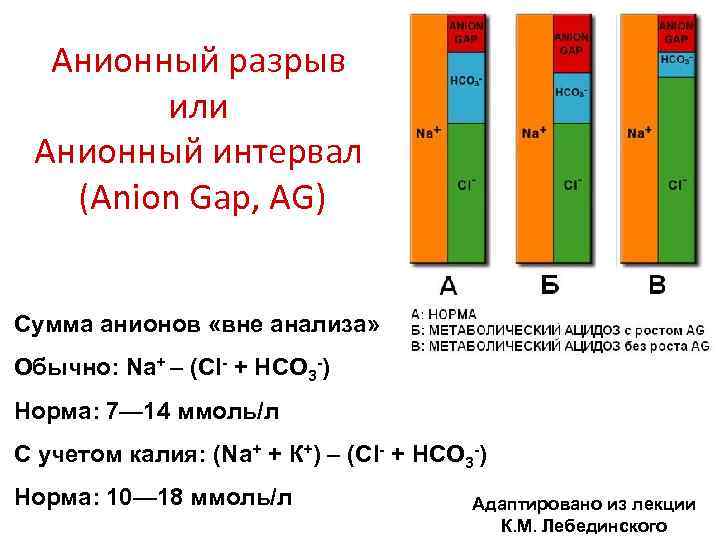
Анионный разрыв или Анионный интервал (Anion Gap, AG) Сумма анионов «вне анализа» Обычно: Na+ – (Cl- + HCO 3 -) Норма: 7— 14 ммоль/л С учетом калия: (Na+ + К+) – (Cl- + HCO 3 -) Норма: 10— 18 ммоль/л Адаптировано из лекции К. М. Лебединского
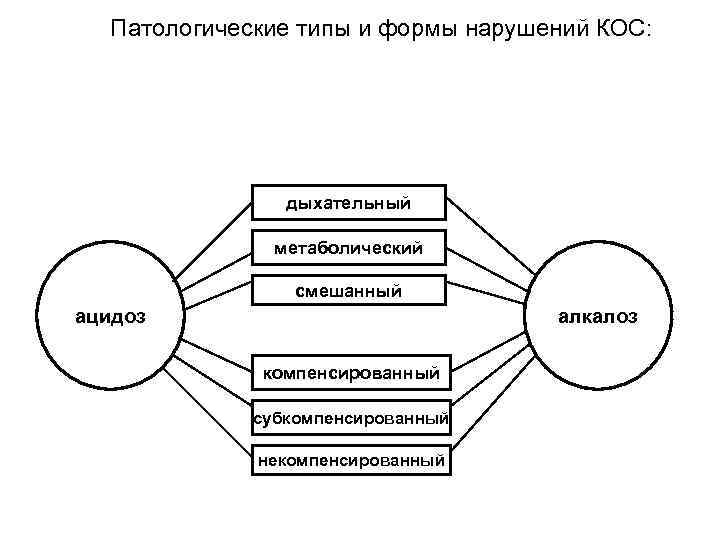
Патологические типы и формы нарушений КОС: дыхательный метаболический смешанный ацидоз алкалоз компенсированный субкомпенсированный некомпенсированный
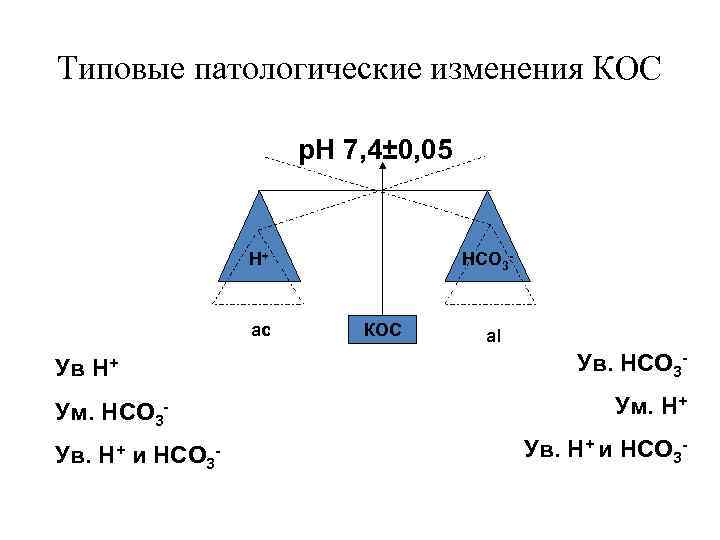
Типовые патологические изменения КОС р. Н 7, 4± 0, 05 Н+ ас Ув Н+ Ум. НСО 3 Ув. H+ и НСО 3 - КОС аl Ув. НСО 3 Ум. Н+ Ув. Н+ и НСО 3 -

Метаболический ацидоз БЕЗ увеличения анионного разрыва: BE < – 2, 3 ммоль/л, AG < 14 ммоль/л Потери НСО 3 - через ЖКТ (диарея, свищи, ОКН, уретероэнтеростомия, ионообменные смолы) Почечные потери НСО 3 - (тубулярный ацидоз, ингибиторы КА, избыток Cl-) Нарушения функций почек (пиелонефрит, низкая активность ренина плазмы) Дефицит альдостерона (гипоальдостеронизм, верошпирон) Редкие причины (гипералиментация, быстрая гипергидратация и др. )

Метаболический ацидоз С увеличением анионного разрыва: BE < – 2, 3 ммоль/л, AG > 14 ммоль/л Повышенная продукция кислот (кетоацидозы, лактатацидоз, азотемия, ферментопатии) Отравления кислотами (муравьиная, щавелевая, этиленгликоль, метанол, салицилаты и др. ) Нарушения выведения кислот (ОПН и ХПН)
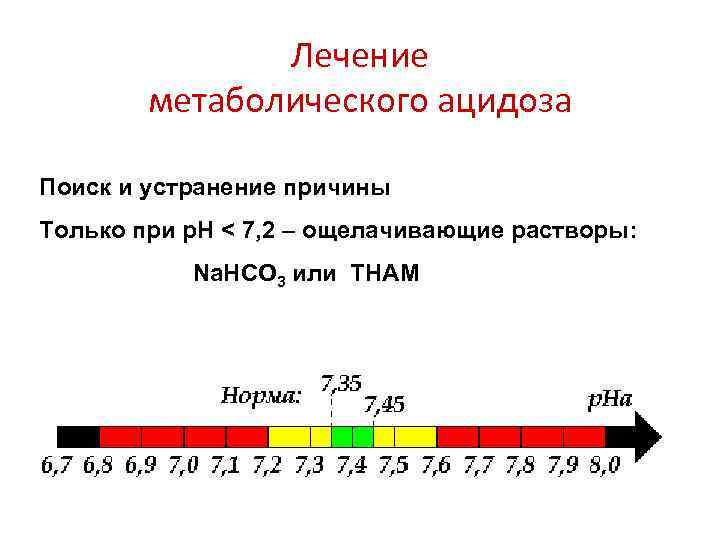
Лечение метаболического ацидоза Поиск и устранение причины Только при р. Н < 7, 2 – ощелачивающие растворы: Na. HCO 3 или THAM

Гидрокарбонат натрия ( «сода» ) Растворы Na. HCO 3 бывают 3% и 4% Каждый 1% дает 0, 12 ммоль/мл Расчет: число ммоль Na. HCO 3 = BE 0, 2 МТ Дает перегрузку натрием (гиперосмолярность!) и СО 2 За рубежом доступен KHCO 3 Никогда не лить «просто так» , кроме случаев СЛР (и то, очень спорный вопрос)!

Трисамин (трометамин, трис-буфер, трисгидроксиаминометан, ТНАМ) Корригирует внутриклеточный ацидоз! р. Н раствора 10, 2— 10, 7 Изотоничный плазме 3, 66% раствор = 0, 3 ммоль/мл Расчет: число мл 3, 66% ТНАМ = BE МТ Интервал между инфузиями не менее 48— 72 ч! Не перегружает натрием и СО 2! Оптимален при глубокой гиперкапнии
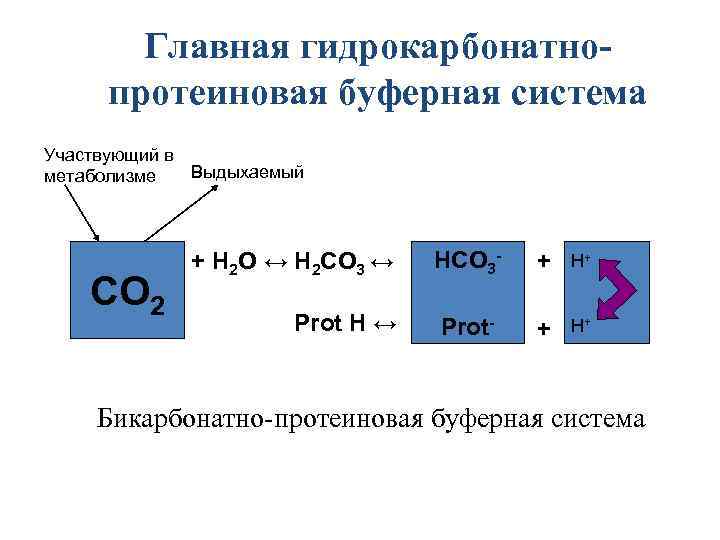
Главная гидрокарбонатнопротеиновая буферная система Участвующий в Выдыхаемый метаболизме СО 2 + Н 2 О ↔ Н 2 СО 3 ↔ НСО 3 - + H+ Prot H ↔ Prot- + H+ Бикарбонатно-протеиновая буферная система

Метаболический алкалоз: ВЕ > 2, 3 ммоль/л Избыточное поступление оснований (антациды) Потери кислот из ЖКТ (рвота, дренаж) Нарушение ацидогенеза (салуретики, тиазиды) Почечный тубулярный алкалоз (дефицит К+ или Cl-, избыток Na+, альдостеронизм, синдром Кушинга, глюкокортикоиды) Быстрая дегидратация Быстрая коррекция хронической гиперкапнии Массивная трансфузия цитратной крови Непаратиреоидная гиперкальциемия
Лечение метаболического алкалоза Поиск и устранение причины Компенсация дефицита К+ Только при р. Н > 7, 6 – растворы, подкисляющие среду: HCl? . . .

Респираторный алкалоз: Pa. CO 2 < 36 mm Hg Гипервентиляция альвеол

Респираторный ацидоз: Pa. CO 2 > 42 mm Hg Гиповентиляция альвеол – абсолютная или относительная Нужен ли при этом Na. HCO 3 ? ? ?

? ? ?
КОС.ppt