Лекция 5 Кислотно-основное равновесие.ppt
- Количество слайдов: 67
 Кислотно-основное равновесие Лекция 5 1
Кислотно-основное равновесие Лекция 5 1
 План лекции 1. Теории кислот и оснований 1. Теория электролитической диссоциации Аррениуса 2. Протолитическая теория кислот и оснований Бренстеда-Лоури 3. Электронная теория Льюиса и общая теория Усановича 2. Ионное произведение воды. Водородный и гидроксидный показатели 3. Теории индикаторов 2
План лекции 1. Теории кислот и оснований 1. Теория электролитической диссоциации Аррениуса 2. Протолитическая теория кислот и оснований Бренстеда-Лоури 3. Электронная теория Льюиса и общая теория Усановича 2. Ионное произведение воды. Водородный и гидроксидный показатели 3. Теории индикаторов 2
 Теории кислот и оснований Содержание понятий «кислота» и «основание» в процессе развития химической науки существенно менялось, оставаясь одним из основных вопросов химии. 1. Теория электролитической диссоциации Аррениуса (1887); 2. Протолитическая теория кислот Бренстеда-Лоури (1923 - 1928); 3. Электронная теория кислот и оснований Льюиса (1916); 4. Общая теория Усановича (1938). и оснований 3
Теории кислот и оснований Содержание понятий «кислота» и «основание» в процессе развития химической науки существенно менялось, оставаясь одним из основных вопросов химии. 1. Теория электролитической диссоциации Аррениуса (1887); 2. Протолитическая теория кислот Бренстеда-Лоури (1923 - 1928); 3. Электронная теория кислот и оснований Льюиса (1916); 4. Общая теория Усановича (1938). и оснований 3
 I) Теория электролитической диссоциации Аррениуса • При растворении в воде (или расплавлении) вещества распадаются на катионы и анионы. Из всех ионов Аррениус выделил ионы H+ и OH– как продукты автодиссоциации воды: H 2 O ↔H+ + OH– • Согласно теории Аррениуса, все кислоты Сванте Август образуют в растворе катионы водорода H+, Аррениус а все основания – гидроксид-ионы OH–: (1859 -1927) Кислоты: HСl ↔ H+ + Cl– HNO 3 ↔H+ + NO 3– Основания: Na. OH ↔Na+ + OH– NH 3∙H 2 O ↔NH 4+ + OH– 4
I) Теория электролитической диссоциации Аррениуса • При растворении в воде (или расплавлении) вещества распадаются на катионы и анионы. Из всех ионов Аррениус выделил ионы H+ и OH– как продукты автодиссоциации воды: H 2 O ↔H+ + OH– • Согласно теории Аррениуса, все кислоты Сванте Август образуют в растворе катионы водорода H+, Аррениус а все основания – гидроксид-ионы OH–: (1859 -1927) Кислоты: HСl ↔ H+ + Cl– HNO 3 ↔H+ + NO 3– Основания: Na. OH ↔Na+ + OH– NH 3∙H 2 O ↔NH 4+ + OH– 4
 Недостатки теории Аррениуса 1. В соответствии с принципом Ле-Шателье следует, что чем больше вводить вещества в раствор, тем в большей степени будет протекать распад на ионы. Но экспериментальные данные показали обратное: в разбавленном растворе с малой концентрацией электролита степень диссоциации слабой кислоты или основания больше, чем в концентрированном растворе. 2. По идее Аррениуса, вода является лишь средой (растворителем) и химически не участвует в реакциях диссоциации кислот и оснований. Однако, известно, что при растворении слабых кислот происходит химическая реакция между молекулами кислоты и воды: HAn + H 2 O = H 3 O+ + An−. 5
Недостатки теории Аррениуса 1. В соответствии с принципом Ле-Шателье следует, что чем больше вводить вещества в раствор, тем в большей степени будет протекать распад на ионы. Но экспериментальные данные показали обратное: в разбавленном растворе с малой концентрацией электролита степень диссоциации слабой кислоты или основания больше, чем в концентрированном растворе. 2. По идее Аррениуса, вода является лишь средой (растворителем) и химически не участвует в реакциях диссоциации кислот и оснований. Однако, известно, что при растворении слабых кислот происходит химическая реакция между молекулами кислоты и воды: HAn + H 2 O = H 3 O+ + An−. 5
 Недостатки теории Аррениуса 3. 4. Кислые соли диссоциируют в воде ступенчато, как и многоосновные кислоты: Na. HCO 3 ↔Na+ + HCO 3–, HCO 3– ↔H+ + CO 32–. При этом в растворе должна создаваться кислая среда, обусловленная избытком ионов H+. Однако, в растворе Na. HCO 3 среда щелочная. В рамки теории Аррениуса не укладываются реакции гидролиза солей, образованных слабыми кислотами или слабыми основаниями. Al. Cl 3 + H 2 O ↔ (Al. OH)Cl 2 + HCl Al 3+ + H 2 O ↔Al. OH 2+ + H+ 6
Недостатки теории Аррениуса 3. 4. Кислые соли диссоциируют в воде ступенчато, как и многоосновные кислоты: Na. HCO 3 ↔Na+ + HCO 3–, HCO 3– ↔H+ + CO 32–. При этом в растворе должна создаваться кислая среда, обусловленная избытком ионов H+. Однако, в растворе Na. HCO 3 среда щелочная. В рамки теории Аррениуса не укладываются реакции гидролиза солей, образованных слабыми кислотами или слабыми основаниями. Al. Cl 3 + H 2 O ↔ (Al. OH)Cl 2 + HCl Al 3+ + H 2 O ↔Al. OH 2+ + H+ 6
 Недостатки теории Аррениуса 5. По теории Аррениуса, реакции нейтрализации проходят только в водном растворе: KOH + HNO 3 ↔KNO 3 + H 2 O OH– + H+ ↔H 2 O Однако известно множество реакций, весьма схожих с реакциями нейтрализации, но протекающих либо в неводных растворителях, либо вообще не в растворе. Например: KOH(т) + HCl(г) = KCl(т) + H 2 O(г); NH 3(г) + HBr(г) ↔NH 4+(г) + Br–(г); HNO 3(ж) + CH 3 COOH ↔NO 3–(ж) + CH 3 COOH 2+(ж). 7
Недостатки теории Аррениуса 5. По теории Аррениуса, реакции нейтрализации проходят только в водном растворе: KOH + HNO 3 ↔KNO 3 + H 2 O OH– + H+ ↔H 2 O Однако известно множество реакций, весьма схожих с реакциями нейтрализации, но протекающих либо в неводных растворителях, либо вообще не в растворе. Например: KOH(т) + HCl(г) = KCl(т) + H 2 O(г); NH 3(г) + HBr(г) ↔NH 4+(г) + Br–(г); HNO 3(ж) + CH 3 COOH ↔NO 3–(ж) + CH 3 COOH 2+(ж). 7
 II) Протолитическая теория кислот и оснований Бренстеда-Лоури • Главную роль в определении понятий "кислота" и "основание" играет простейшая химическая частица H+ – катион водорода (протон). • Кислота – это водородсодержащая Иоганн Николаус частица вещества (молекула или ион), Бренстед (1879 -1947) способная отдавать протон, быть донором протона. HCl. O 4 ↔ H+ + Cl. O 4–; H 2 O ↔ H+ + OH–; NH 4+ ↔ H+ + NH 3; H 2 PO 4– ↔ H+ + HPO 42–; Томасом Мартином [Al(H 2 O)6]3+ ↔ H+ + [Al(H 2 O)5 OH]2+. 8 Лоури (1874 -1936)
II) Протолитическая теория кислот и оснований Бренстеда-Лоури • Главную роль в определении понятий "кислота" и "основание" играет простейшая химическая частица H+ – катион водорода (протон). • Кислота – это водородсодержащая Иоганн Николаус частица вещества (молекула или ион), Бренстед (1879 -1947) способная отдавать протон, быть донором протона. HCl. O 4 ↔ H+ + Cl. O 4–; H 2 O ↔ H+ + OH–; NH 4+ ↔ H+ + NH 3; H 2 PO 4– ↔ H+ + HPO 42–; Томасом Мартином [Al(H 2 O)6]3+ ↔ H+ + [Al(H 2 O)5 OH]2+. 8 Лоури (1874 -1936)
 • Основание – это частица, способная принимать протон (быть акцептором протона). NH 3 + H+ ↔ NH 4+; OH– + H+ ↔ H 2 O; HPO 42– + H+ ↔ H 2 PO 4–; [Al(H 2 O)5 OH]2+ + H+ ↔ [Al(H 2 O)6]3+. • Кислоты и основания объединяют под названием протолиты. • Соединения, которые могут быть и кислотами, и основаниями, называют амфолитами. Они способны как отдавать, так и принимать протоны. • Примеры амфолитов: – вода H 2 O, аммиак NH 3, – продукты ступенчатой диссоциации многоосновных кислот (H 2 PO 4–) и др. 9
• Основание – это частица, способная принимать протон (быть акцептором протона). NH 3 + H+ ↔ NH 4+; OH– + H+ ↔ H 2 O; HPO 42– + H+ ↔ H 2 PO 4–; [Al(H 2 O)5 OH]2+ + H+ ↔ [Al(H 2 O)6]3+. • Кислоты и основания объединяют под названием протолиты. • Соединения, которые могут быть и кислотами, и основаниями, называют амфолитами. Они способны как отдавать, так и принимать протоны. • Примеры амфолитов: – вода H 2 O, аммиак NH 3, – продукты ступенчатой диссоциации многоосновных кислот (H 2 PO 4–) и др. 9
 • В теории электролитической диссоциации нейтрализация рассматривается как процесс соединения катионов Н+ с анионами ОН–, с образованием недиссоциированных молекул воды Н 2 О. • Согласно протолитической теории реакция нейтрализации рассматривается как переход протона Н+ от кислоты к основанию. • Химическая реакция между протолитами носит название протолитической реакции. 10
• В теории электролитической диссоциации нейтрализация рассматривается как процесс соединения катионов Н+ с анионами ОН–, с образованием недиссоциированных молекул воды Н 2 О. • Согласно протолитической теории реакция нейтрализации рассматривается как переход протона Н+ от кислоты к основанию. • Химическая реакция между протолитами носит название протолитической реакции. 10
 • В любой протолитической реакции всегда есть две сопряженные пары "кислота"/"основание": HA/A– и HB+/B. • Кислота 1 HA переходит в сопряженное основание 1 A–. • Основание 2 B переходит в сопряженную кислоту2 HB+. • В реакции между сопряженными парами направление переноса протона Н+ определяется величиной сродства к протону Н+ – энтальпией реакции присоединения протона. • Протолитическое равновесие всегда смещено в сторону более слабого протолита! 11
• В любой протолитической реакции всегда есть две сопряженные пары "кислота"/"основание": HA/A– и HB+/B. • Кислота 1 HA переходит в сопряженное основание 1 A–. • Основание 2 B переходит в сопряженную кислоту2 HB+. • В реакции между сопряженными парами направление переноса протона Н+ определяется величиной сродства к протону Н+ – энтальпией реакции присоединения протона. • Протолитическое равновесие всегда смещено в сторону более слабого протолита! 11
 • Сила кислот и оснований оценивается по реакции с водой. Протолитическая реакция вида: где К – константа равновесия кислотно-основной пары. [Основание]/[Кислота] – отношение равновесных концентраций сопряженной пары. • Для кислот константа К аналогична константе диссоциации Ка. Обратный логарифм величины К называют силовым показателем и обозначают р. К: 12
• Сила кислот и оснований оценивается по реакции с водой. Протолитическая реакция вида: где К – константа равновесия кислотно-основной пары. [Основание]/[Кислота] – отношение равновесных концентраций сопряженной пары. • Для кислот константа К аналогична константе диссоциации Ка. Обратный логарифм величины К называют силовым показателем и обозначают р. К: 12
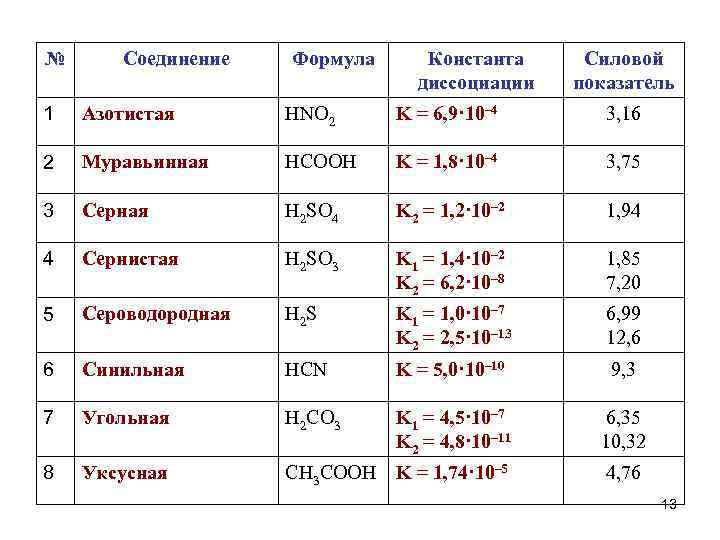 № Соединение Формула Константа диссоциации Силовой показатель 1 Азотистая HNO 2 K = 6, 9· 10– 4 3, 16 2 Муравьинная HCOOH K = 1, 8· 10– 4 3, 75 3 Серная H 2 SO 4 K 2 = 1, 2· 10– 2 1, 94 4 Сернистая H 2 SO 3 K 1 = 1, 4· 10– 2 K 2 = 6, 2· 10– 8 1, 85 7, 20 5 Сероводородная H 2 S K 1 = 1, 0· 10– 7 K 2 = 2, 5· 10– 13 6, 99 12, 6 6 Синильная HCN K = 5, 0· 10– 10 9, 3 7 Угольная H 2 СO 3 K 1 = 4, 5· 10– 7 K 2 = 4, 8· 10– 11 6, 35 10, 32 8 Уксусная CH 3 COOH K = 1, 74· 10– 5 4, 76 13
№ Соединение Формула Константа диссоциации Силовой показатель 1 Азотистая HNO 2 K = 6, 9· 10– 4 3, 16 2 Муравьинная HCOOH K = 1, 8· 10– 4 3, 75 3 Серная H 2 SO 4 K 2 = 1, 2· 10– 2 1, 94 4 Сернистая H 2 SO 3 K 1 = 1, 4· 10– 2 K 2 = 6, 2· 10– 8 1, 85 7, 20 5 Сероводородная H 2 S K 1 = 1, 0· 10– 7 K 2 = 2, 5· 10– 13 6, 99 12, 6 6 Синильная HCN K = 5, 0· 10– 10 9, 3 7 Угольная H 2 СO 3 K 1 = 4, 5· 10– 7 K 2 = 4, 8· 10– 11 6, 35 10, 32 8 Уксусная CH 3 COOH K = 1, 74· 10– 5 4, 76 13
 • В кислотно-основной паре сильной кислоте соответствует слабое основание и наоборот. • Более сильной кислотой является тот протолит, который легче отдает протон. • Более сильным основанием является протолит, легче принимающий протон и сильнее его удерживающий. • В отличие от теории электролитической диссоциации, протолитическая теория показала, что продукты взаимодействия кислот и оснований следует рассматривать как новые кислоты и основания. • «Нейтрализации» в смысле исчезновения кислот и оснований не происходит. • К кислотам относят доноры Н+: HCO 3–, H 3 O+, NH 4+ и др. • К основаниям относят акцепторы протонов Н+: NH 3, Cl–, CH 3 COO– и др. 14
• В кислотно-основной паре сильной кислоте соответствует слабое основание и наоборот. • Более сильной кислотой является тот протолит, который легче отдает протон. • Более сильным основанием является протолит, легче принимающий протон и сильнее его удерживающий. • В отличие от теории электролитической диссоциации, протолитическая теория показала, что продукты взаимодействия кислот и оснований следует рассматривать как новые кислоты и основания. • «Нейтрализации» в смысле исчезновения кислот и оснований не происходит. • К кислотам относят доноры Н+: HCO 3–, H 3 O+, NH 4+ и др. • К основаниям относят акцепторы протонов Н+: NH 3, Cl–, CH 3 COO– и др. 14
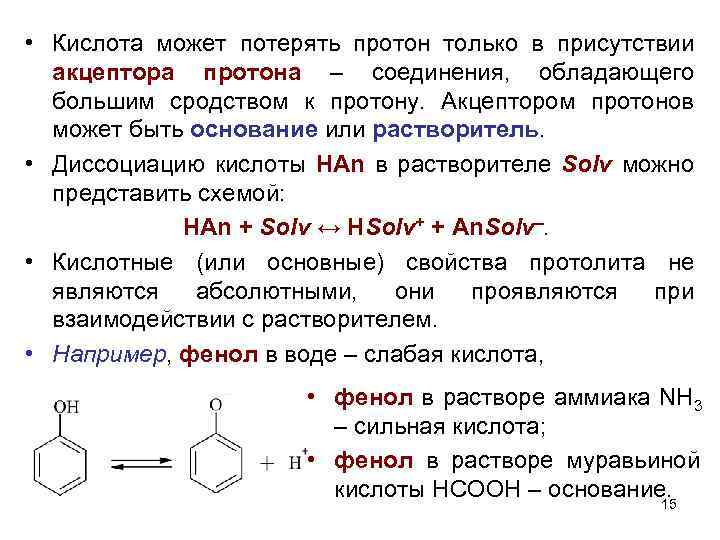 • Кислота может потерять протон только в присутствии акцептора протона – соединения, обладающего большим сродством к протону. Акцептором протонов может быть основание или растворитель. • Диссоциацию кислоты НАn в растворителе Solv можно представить схемой: HAn + Solv ↔ HSolv+ + An. Solv–. • Кислотные (или основные) свойства протолита не являются абсолютными, они проявляются при взаимодействии с растворителем. • Например, фенол в воде – слабая кислота, • фенол в растворе аммиака NH 3 – сильная кислота; • фенол в растворе муравьиной кислоты HCOOH – основание. 15
• Кислота может потерять протон только в присутствии акцептора протона – соединения, обладающего большим сродством к протону. Акцептором протонов может быть основание или растворитель. • Диссоциацию кислоты НАn в растворителе Solv можно представить схемой: HAn + Solv ↔ HSolv+ + An. Solv–. • Кислотные (или основные) свойства протолита не являются абсолютными, они проявляются при взаимодействии с растворителем. • Например, фенол в воде – слабая кислота, • фенол в растворе аммиака NH 3 – сильная кислота; • фенол в растворе муравьиной кислоты HCOOH – основание. 15
 Применение теории кислот и оснований к неводным растворам • Важнейшей особенностью растворителя является способность к передаче протона от одной молекулы растворителя другой: HSolv + HSolv = H 2 Solv+ + Solv–. • В качестве неводных растворителей используют: – безводный жидкий аммиак NH 3, – безводная уксусная кислота CH 3 COOH, – этиловый спирт C 2 H 5 OH, – ацетон CH 3 COCH 3, – хлороформ CH 3 Cl, – четыреххлористый углерод CCl 4, 16 – пиридин C 6 H 5 N и др.
Применение теории кислот и оснований к неводным растворам • Важнейшей особенностью растворителя является способность к передаче протона от одной молекулы растворителя другой: HSolv + HSolv = H 2 Solv+ + Solv–. • В качестве неводных растворителей используют: – безводный жидкий аммиак NH 3, – безводная уксусная кислота CH 3 COOH, – этиловый спирт C 2 H 5 OH, – ацетон CH 3 COCH 3, – хлороформ CH 3 Cl, – четыреххлористый углерод CCl 4, 16 – пиридин C 6 H 5 N и др.
 • Процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая – свойства основания, называют автопротолизом. HSolv + HSolv = H 2 Solv+ + Solv–. • Катион H 2 Solv+ называют «ион лиония» , а анион Solv– носит название «лиат-ион» . • Для воды ион лиония называется ион гидроксония и обозначается H 3 О+. • Диссоциация воды: H 2 O + H 2 O ↔ H 3 О+ + OH–. (ион гидроксония) (гидроксид-ион) • Диссоциация жидкого аммиака: NH 3 + NH 3 ↔ NH 4+ (ион аммония) + NH 2– (амид -ион). • Диссоциация безводной уксусной кислоты: CH 3 COOН + CH 3 COOН ↔ CH 3 COOН 2+ + CH 3 COO–. (ион ацетония) (ацетат-ион) 17
• Процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая – свойства основания, называют автопротолизом. HSolv + HSolv = H 2 Solv+ + Solv–. • Катион H 2 Solv+ называют «ион лиония» , а анион Solv– носит название «лиат-ион» . • Для воды ион лиония называется ион гидроксония и обозначается H 3 О+. • Диссоциация воды: H 2 O + H 2 O ↔ H 3 О+ + OH–. (ион гидроксония) (гидроксид-ион) • Диссоциация жидкого аммиака: NH 3 + NH 3 ↔ NH 4+ (ион аммония) + NH 2– (амид -ион). • Диссоциация безводной уксусной кислоты: CH 3 COOН + CH 3 COOН ↔ CH 3 COOН 2+ + CH 3 COO–. (ион ацетония) (ацетат-ион) 17
 • Поведение иона аммония NH 4+ в жидком аммиаке аналогично поведению иона гидроксония H 3 О+ в воде. – Хлорид аммония NH 4 Cl, растворенный в жидком аммиаке, проявляет свойства сильной кислоты, как хлористый водород HCl в водных растворах. – Амид калия KNH 2 в жидком аммиаке проявляет свойства сильного основания, как гидроксид калия KOH в водном растворе. • Основные свойства проявляет ацетат калия CH 3 COOK в безводной уксусной кислоте. • Основания: KOH в воде, KNH 2 в жидком аммиаке, CH 3 COOK в безводной уксусной кислоте, проявляют типичные свойства оснований: – окрашивают фенолфталеин в малиновый цвет, – нейтрализуют кислоты, 18 – обладают высокой электропроводностью.
• Поведение иона аммония NH 4+ в жидком аммиаке аналогично поведению иона гидроксония H 3 О+ в воде. – Хлорид аммония NH 4 Cl, растворенный в жидком аммиаке, проявляет свойства сильной кислоты, как хлористый водород HCl в водных растворах. – Амид калия KNH 2 в жидком аммиаке проявляет свойства сильного основания, как гидроксид калия KOH в водном растворе. • Основные свойства проявляет ацетат калия CH 3 COOK в безводной уксусной кислоте. • Основания: KOH в воде, KNH 2 в жидком аммиаке, CH 3 COOK в безводной уксусной кислоте, проявляют типичные свойства оснований: – окрашивают фенолфталеин в малиновый цвет, – нейтрализуют кислоты, 18 – обладают высокой электропроводностью.
 • В результате реакции нейтрализации всегда образуется соль и молекула растворителя: Например: • В водном растворе реакция нейтрализации сопровождается образованием молекулы воды: HСl + KOH = KСl + H 2 O (кислота) (основание) (соль) (растворитель) • В жидком аммиаке реакция нейтрализации сопровождается образованием аммиака: NH 4 Сl + KNH 2 = KСl + 2 NH 3 (кислота) (основание) (соль) (растворитель) • В безводной уксусной кислоте реакция нейтрализации дает молекулу уксусной кислоты: HСl. О 4 + CH 3 COOK = KСl. О 4 + CH 3 COOН (кислота) (основание) (соль) (растворитель) 19
• В результате реакции нейтрализации всегда образуется соль и молекула растворителя: Например: • В водном растворе реакция нейтрализации сопровождается образованием молекулы воды: HСl + KOH = KСl + H 2 O (кислота) (основание) (соль) (растворитель) • В жидком аммиаке реакция нейтрализации сопровождается образованием аммиака: NH 4 Сl + KNH 2 = KСl + 2 NH 3 (кислота) (основание) (соль) (растворитель) • В безводной уксусной кислоте реакция нейтрализации дает молекулу уксусной кислоты: HСl. О 4 + CH 3 COOK = KСl. О 4 + CH 3 COOН (кислота) (основание) (соль) (растворитель) 19
 • Кислотой в неводных растворах называют соединения, диссоциирующие с образованием катиона, соответствующего катиону растворителя. • Основанием в неводных растворах называют соединения, диссоциирующие с образованием аниона, соответствующего аниону растворителя. • С точки зрения кислотно-основных свойств растворители можно разделить на четыре группы: – протогенные растворители (HF, H 2 SO 4, HCOOH), – протофильные растворители (NH 3, N 2 H 4), – амфипротные растворители (H 2 O, C 2 H 5 OH), – апротонные растворители. (C 6 H 6, С 7 H 16, CHCl 3). • Протогенные растворители – вещества кислотного характера, их молекулам свойственно отдавать свои протоны: HF + C 2 H 5 OH = F– + C 2 H 5 OH 2+ 20 (кислота) (основание)
• Кислотой в неводных растворах называют соединения, диссоциирующие с образованием катиона, соответствующего катиону растворителя. • Основанием в неводных растворах называют соединения, диссоциирующие с образованием аниона, соответствующего аниону растворителя. • С точки зрения кислотно-основных свойств растворители можно разделить на четыре группы: – протогенные растворители (HF, H 2 SO 4, HCOOH), – протофильные растворители (NH 3, N 2 H 4), – амфипротные растворители (H 2 O, C 2 H 5 OH), – апротонные растворители. (C 6 H 6, С 7 H 16, CHCl 3). • Протогенные растворители – вещества кислотного характера, их молекулам свойственно отдавать свои протоны: HF + C 2 H 5 OH = F– + C 2 H 5 OH 2+ 20 (кислота) (основание)
 • Протофильные растворители – вещества основного характера, их молекулам свойственно присоединять чужие протоны. • Представители: – аммиак NH 3, гидразин N 2 H 4, – третичные амины (пиридин С 6 Н 5 N), – кетоны (ацетон CH 3 COCH 3), – простые эфиры (диоксан C 4 H 8 O 2, диэтиловый эфир C 2 H 5 O). 21
• Протофильные растворители – вещества основного характера, их молекулам свойственно присоединять чужие протоны. • Представители: – аммиак NH 3, гидразин N 2 H 4, – третичные амины (пиридин С 6 Н 5 N), – кетоны (ацетон CH 3 COCH 3), – простые эфиры (диоксан C 4 H 8 O 2, диэтиловый эфир C 2 H 5 O). 21
 • Амфипротные растворители – вещества, обладающие как кислотными, так и основными свойствами, их молекулы могут, как отдавать свои протоны, так и присоединять чужие. • Представители: H 2 O, CH 3 OH, C 2 H 5 OH, амины, карбоновые кислоты и др. 22
• Амфипротные растворители – вещества, обладающие как кислотными, так и основными свойствами, их молекулы могут, как отдавать свои протоны, так и присоединять чужие. • Представители: H 2 O, CH 3 OH, C 2 H 5 OH, амины, карбоновые кислоты и др. 22
 • Апротонные (индифферентные) растворители – вещества, не обладающие ни кислотными, ни основными свойствами. • Представители: – бензол C 6 H 6, гексан С 7 H 16, хлороформ CHCl 3, – углеводороды и их галогенопроизводные. • Молекулы этих нейтральных по характеру веществ не отдают и не присоединяют протоны, они не обладают свойством диссоциировать. Поэтому растворенные в них кислоты или основания не диссоциируют на ионы. 23
• Апротонные (индифферентные) растворители – вещества, не обладающие ни кислотными, ни основными свойствами. • Представители: – бензол C 6 H 6, гексан С 7 H 16, хлороформ CHCl 3, – углеводороды и их галогенопроизводные. • Молекулы этих нейтральных по характеру веществ не отдают и не присоединяют протоны, они не обладают свойством диссоциировать. Поэтому растворенные в них кислоты или основания не диссоциируют на ионы. 23
 III. Электронная теория кислот и оснований Льюиса • Электронная теория кислот и оснований, выдвинутая Льюисом в 1916 году отвергает «культ протона» . Она основывается на рассмотрении электронного строения частиц и не считает наличие водорода обязательным признаком кислоты. Гилберт Ньютон Льюис (1875 -1946) • Кислота – частица с незаполненной внешней электронной оболочкой, способная принимать пару электронов (кислота = акцептор электронов). • Основание – частицы со свободной парой электронов, которую можно отдать для образования химической связи (основание = донор электронов). 24
III. Электронная теория кислот и оснований Льюиса • Электронная теория кислот и оснований, выдвинутая Льюисом в 1916 году отвергает «культ протона» . Она основывается на рассмотрении электронного строения частиц и не считает наличие водорода обязательным признаком кислоты. Гилберт Ньютон Льюис (1875 -1946) • Кислота – частица с незаполненной внешней электронной оболочкой, способная принимать пару электронов (кислота = акцептор электронов). • Основание – частицы со свободной парой электронов, которую можно отдать для образования химической связи (основание = донор электронов). 24
 • К кислотам по Льюису относятся: – молекулы, образованные атомами с незаполненной восьмиэлектронной оболочкой (BF 3, SO 3); – катионы-комплексообразователи (Fe 3+, Co 2+, Ag+, др. ); – галогениды с ненасыщенными связями (Ti. Cl 4, Sn. Cl 4); – молекулы с поляризованными двойными связями (CO 2, SO 2) и др. • К основаниям по Льюису относят: – молекулы, содержащие свободные электронные пары (NH 3, H 2 O); – анионы (Сl–, F–); – органические соединения с двойными и тройными связями (ацетон СН 3 СОСН 3); – ароматические соединения (анилин С 6 Н 5 NH 2, фенол С 6 Н 5 ОН). 25
• К кислотам по Льюису относятся: – молекулы, образованные атомами с незаполненной восьмиэлектронной оболочкой (BF 3, SO 3); – катионы-комплексообразователи (Fe 3+, Co 2+, Ag+, др. ); – галогениды с ненасыщенными связями (Ti. Cl 4, Sn. Cl 4); – молекулы с поляризованными двойными связями (CO 2, SO 2) и др. • К основаниям по Льюису относят: – молекулы, содержащие свободные электронные пары (NH 3, H 2 O); – анионы (Сl–, F–); – органические соединения с двойными и тройными связями (ацетон СН 3 СОСН 3); – ароматические соединения (анилин С 6 Н 5 NH 2, фенол С 6 Н 5 ОН). 25
 • Протон H+ в теории Льюиса является кислотой, (акцептор электронов), гидроксид ион OH– – основание (донор электронов): НО–(↑↓) + Н+ ↔ НО(↑↓)Н. • Взаимодействие между кислотой и основанием заключается в образовании химической донорноакцепторной связи между реагирующими частицами. • Реакция между кислотой и основанием в общем виде: B(↑↓)основание + Aкислота ↔ D(↑↓)A. • Примеры: Н 3 N(↑↓) + HCl ↔ [Н 3 N(↑↓)H]Cl; (СН 3)3 N(↑↓) + BCl 3 ↔ (CН 3)3 N(↑↓)BCl 3. Ag+ + 2 NH 3(↑↓) ↔ [NH 3(↑↓)Ag(↑↓)NH 3]+. • Рассмотренные теории не противоречат, а дополняют друга и имеют внутреннюю связь. • Кислоты по Бренстеду, можно рассматривать как частный случай кислот Льюиса. 26
• Протон H+ в теории Льюиса является кислотой, (акцептор электронов), гидроксид ион OH– – основание (донор электронов): НО–(↑↓) + Н+ ↔ НО(↑↓)Н. • Взаимодействие между кислотой и основанием заключается в образовании химической донорноакцепторной связи между реагирующими частицами. • Реакция между кислотой и основанием в общем виде: B(↑↓)основание + Aкислота ↔ D(↑↓)A. • Примеры: Н 3 N(↑↓) + HCl ↔ [Н 3 N(↑↓)H]Cl; (СН 3)3 N(↑↓) + BCl 3 ↔ (CН 3)3 N(↑↓)BCl 3. Ag+ + 2 NH 3(↑↓) ↔ [NH 3(↑↓)Ag(↑↓)NH 3]+. • Рассмотренные теории не противоречат, а дополняют друга и имеют внутреннюю связь. • Кислоты по Бренстеду, можно рассматривать как частный случай кислот Льюиса. 26
 Недостатки теории Льюиса • Для отнесении вещества к кислоте или основанию используется механизм его образования, что ставит классификацию на кислоты и основания в тесную зависимость от взглядов на природу химической связи. • Теория Льюиса не имеет количественного критерия оценки силы кислот и оснований, который мог бы служить основой для аналитических расчетов кислотноосновных равновесий. Принцип жестких и мягких кислот и оснований Пирсона (принцип ЖМКО) • В 1963 году Р. Пирсон конкретизировал свойства льюисовских кислот и оснований, введя представления о жестких и мягких кислотах и основаниях. 27
Недостатки теории Льюиса • Для отнесении вещества к кислоте или основанию используется механизм его образования, что ставит классификацию на кислоты и основания в тесную зависимость от взглядов на природу химической связи. • Теория Льюиса не имеет количественного критерия оценки силы кислот и оснований, который мог бы служить основой для аналитических расчетов кислотноосновных равновесий. Принцип жестких и мягких кислот и оснований Пирсона (принцип ЖМКО) • В 1963 году Р. Пирсон конкретизировал свойства льюисовских кислот и оснований, введя представления о жестких и мягких кислотах и основаниях. 27
 Принцип ЖМКО (Принцип Пирсона) Кислоты Основания Жесткие кислоты Жесткие основания Мягкие кислоты Мягкие основания • При оценке "жесткости" или "мягкости" кислот и оснований учитывают: – химический состав молекул; – электронное строение; – сравнительную устойчивость образуемых кислотноосновных комплексов: А + : В = А: В, • А – кислота Льюиса, • : В - основание Льюиса, • А: В – кислотно-основной комплекс. 28
Принцип ЖМКО (Принцип Пирсона) Кислоты Основания Жесткие кислоты Жесткие основания Мягкие кислоты Мягкие основания • При оценке "жесткости" или "мягкости" кислот и оснований учитывают: – химический состав молекул; – электронное строение; – сравнительную устойчивость образуемых кислотноосновных комплексов: А + : В = А: В, • А – кислота Льюиса, • : В - основание Льюиса, • А: В – кислотно-основной комплекс. 28
 Принцип ЖМКО (Принцип Пирсона) • Жесткие кислоты – кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. • Молекулярная орбиталь жестких кислот, на которую переходят электроны донора, имеет низкий уровень энергии. • Мягкие кислоты – кислоты Льюиса, содержащие акцепторные атомы большого размера с малым положительным зарядом, с небольшой электроотрицательностью и высокой поляризуемостью. • Молекулярная орбиталь мягких кислот, принимающая электроны донора, имеет высокий уровень энергии. 29
Принцип ЖМКО (Принцип Пирсона) • Жесткие кислоты – кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. • Молекулярная орбиталь жестких кислот, на которую переходят электроны донора, имеет низкий уровень энергии. • Мягкие кислоты – кислоты Льюиса, содержащие акцепторные атомы большого размера с малым положительным зарядом, с небольшой электроотрицательностью и высокой поляризуемостью. • Молекулярная орбиталь мягких кислот, принимающая электроны донора, имеет высокий уровень энергии. 29
 • Жесткие основания – донорные частицы, в которых атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость. Валентные электроны удерживаются прочно, продукт окисляется с трудом. • Орбиталь, пара электронов которой передается акцептору, имеет низкий уровень энергии. Донорными атомами в жестких основаниях могут быть O, N, F, Cl. • Мягкие основания – донорные частицы, в которых атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость, они легко окисляются; валентные электроны удерживаются слабо. • Орбиталь, пара электронов которой передается акцептору, обладает высоким уровнем энергии. Донорными атомами в мягких основаниях выступают атомы C, S, I. 30
• Жесткие основания – донорные частицы, в которых атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость. Валентные электроны удерживаются прочно, продукт окисляется с трудом. • Орбиталь, пара электронов которой передается акцептору, имеет низкий уровень энергии. Донорными атомами в жестких основаниях могут быть O, N, F, Cl. • Мягкие основания – донорные частицы, в которых атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость, они легко окисляются; валентные электроны удерживаются слабо. • Орбиталь, пара электронов которой передается акцептору, обладает высоким уровнем энергии. Донорными атомами в мягких основаниях выступают атомы C, S, I. 30
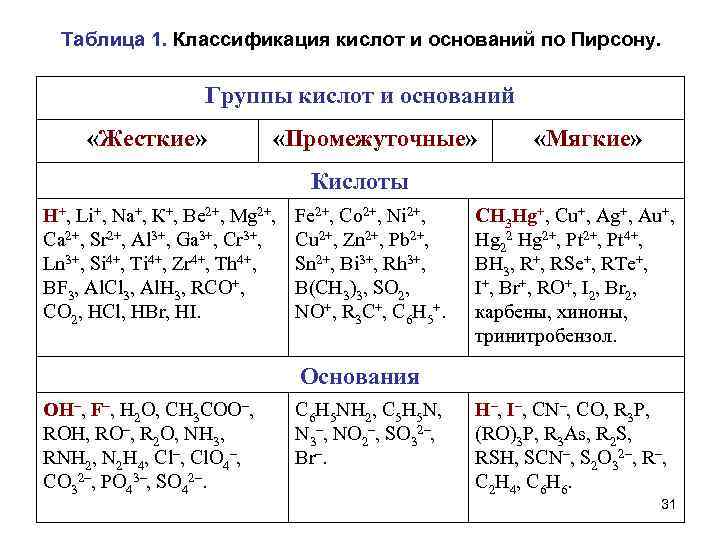 Таблица 1. Классификация кислот и оснований по Пирсону. Группы кислот и оснований «Жесткие» «Промежуточные» «Мягкие» Кислоты H+, Li+, Na+, К+, Ве 2+, Mg 2+, Са 2+, Sr 2+, Al 3+, Ga 3+, Сr 3+, Ln 3+, Si 4+, Ti 4+, Zr 4+, Th 4+, BF 3, Al. Cl 3, Al. H 3, RCO+, CO 2, HCl, HBr, HI. Fe 2+, Со 2+, Ni 2+, Cu 2+, Zn 2+, Pb 2+, Sn 2+, Bi 3+, Rh 3+, B(CH 3)3, SO 2, NO+, R 3 C+, C 6 H 5+. CH 3 Hg+, Cu+, Ag+, Au+, Hg 22 Hg 2+, Pt 4+, BH 3, R+, RSe+, RTe+, I+, Br+, RO+, I 2, Br 2, карбены, хиноны, тринитробензол. Основания OH–, F–, H 2 O, CH 3 COO–, ROH, RO–, R 2 O, NH 3, RNH 2, N 2 H 4, Cl–, Cl. O 4–, CO 32–, PO 43–, SO 42–. C 6 H 5 NH 2, C 5 H 5 N, N 3–, NO 2–, SO 32–, Br–. H–, I–, CN–, CO, R 3 P, (RO)3 P, R 3 As, R 2 S, RSH, SCN–, S 2 O 32–, R–, C 2 H 4 , C 6 H 6. 31
Таблица 1. Классификация кислот и оснований по Пирсону. Группы кислот и оснований «Жесткие» «Промежуточные» «Мягкие» Кислоты H+, Li+, Na+, К+, Ве 2+, Mg 2+, Са 2+, Sr 2+, Al 3+, Ga 3+, Сr 3+, Ln 3+, Si 4+, Ti 4+, Zr 4+, Th 4+, BF 3, Al. Cl 3, Al. H 3, RCO+, CO 2, HCl, HBr, HI. Fe 2+, Со 2+, Ni 2+, Cu 2+, Zn 2+, Pb 2+, Sn 2+, Bi 3+, Rh 3+, B(CH 3)3, SO 2, NO+, R 3 C+, C 6 H 5+. CH 3 Hg+, Cu+, Ag+, Au+, Hg 22 Hg 2+, Pt 4+, BH 3, R+, RSe+, RTe+, I+, Br+, RO+, I 2, Br 2, карбены, хиноны, тринитробензол. Основания OH–, F–, H 2 O, CH 3 COO–, ROH, RO–, R 2 O, NH 3, RNH 2, N 2 H 4, Cl–, Cl. O 4–, CO 32–, PO 43–, SO 42–. C 6 H 5 NH 2, C 5 H 5 N, N 3–, NO 2–, SO 32–, Br–. H–, I–, CN–, CO, R 3 P, (RO)3 P, R 3 As, R 2 S, RSH, SCN–, S 2 O 32–, R–, C 2 H 4 , C 6 H 6. 31
 • Строгой количественной оценки "жесткости" и "мягкости" кислот и оснований пока не существует. Их можно лишь приблизительно расположить в ряды. Например, мягкость оснований убывает в ряду: I– > Br– > Cl– > F–. • Объяснить такой порядок можно изменением электроотрицательности и поляризуемости. • Понятия жесткие и мягкие кислоты и основания неравноценны понятиям сильные и слабые кислоты и основания. Это две независимые характеристики кислот и оснований. • Принцип Пирсона (принцип ЖМКО): «Жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями» . 32
• Строгой количественной оценки "жесткости" и "мягкости" кислот и оснований пока не существует. Их можно лишь приблизительно расположить в ряды. Например, мягкость оснований убывает в ряду: I– > Br– > Cl– > F–. • Объяснить такой порядок можно изменением электроотрицательности и поляризуемости. • Понятия жесткие и мягкие кислоты и основания неравноценны понятиям сильные и слабые кислоты и основания. Это две независимые характеристики кислот и оснований. • Принцип Пирсона (принцип ЖМКО): «Жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями» . 32
 IV. Общая теория Усановича • Наиболее общая теория кислот и оснований была сформулирована Усановичем в 1938 г. • В основе теории лежит представление: «Всякое кислотно-основное взаимодействие – это реакция солеобразования» . • Кислота по Усановичу – это частица, Михаил Ильич которая может отщеплять катионы, Усанович включая протон, или присоединять (1894— 1981) анионы, включая электрон. • Основание по Усановичу – это частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы. 33
IV. Общая теория Усановича • Наиболее общая теория кислот и оснований была сформулирована Усановичем в 1938 г. • В основе теории лежит представление: «Всякое кислотно-основное взаимодействие – это реакция солеобразования» . • Кислота по Усановичу – это частица, Михаил Ильич которая может отщеплять катионы, Усанович включая протон, или присоединять (1894— 1981) анионы, включая электрон. • Основание по Усановичу – это частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы. 33
 • По теории Усановича к кислотно-основным взаимодействиям относятся и все окислительновосстановительные реакции. • Теория Усановича отменяет один из основополагающих принципов классической химии – представления о классах кислот и оснований. • По Усановичу, кислоты и основания – это не классы соединений; кислотность и основность – это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера в реакции. Недостатки общей теории Усановича: – слишком общий характер теории; – недостаточная четкость формулировки понятий «кислота» и «основание» ; – не включает неионогенные кислотно-основные превращения; 34 – не позволяет делать количественные предсказания.
• По теории Усановича к кислотно-основным взаимодействиям относятся и все окислительновосстановительные реакции. • Теория Усановича отменяет один из основополагающих принципов классической химии – представления о классах кислот и оснований. • По Усановичу, кислоты и основания – это не классы соединений; кислотность и основность – это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера в реакции. Недостатки общей теории Усановича: – слишком общий характер теории; – недостаточная четкость формулировки понятий «кислота» и «основание» ; – не включает неионогенные кислотно-основные превращения; 34 – не позволяет делать количественные предсказания.
 Ионное произведение воды • Процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая – свойства основания, называют автопротолизом. HSolv + HSolv = H 2 Solv+ + Solv–. • Для воды: H 2 O + H 2 O ↔ H 3 О+ + OH–. (ион гидроксония) (гидроксид-ион) • При этом одна молекула выступает в качестве донора протона, другая – в качестве акцептора протона. H 2 O ↔ OH– + H+ • Ка (H 2 O) при 22 ºС = 1, 82∙ 10– 16. 35
Ионное произведение воды • Процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая – свойства основания, называют автопротолизом. HSolv + HSolv = H 2 Solv+ + Solv–. • Для воды: H 2 O + H 2 O ↔ H 3 О+ + OH–. (ион гидроксония) (гидроксид-ион) • При этом одна молекула выступает в качестве донора протона, другая – в качестве акцептора протона. H 2 O ↔ OH– + H+ • Ка (H 2 O) при 22 ºС = 1, 82∙ 10– 16. 35
![Ионное произведение воды H 2 O ↔ OH– + H+ Ка[Н 2 О] = Ионное произведение воды H 2 O ↔ OH– + H+ Ка[Н 2 О] =](https://present5.com/presentation/3/82137600_179745804.pdf-img/82137600_179745804.pdf-36.jpg) Ионное произведение воды H 2 O ↔ OH– + H+ Ка[Н 2 О] = [H+][OH–] Kw = Ка∙[Н 2 О] = 1, 82∙ 10– 16 ∙ 55, 55 моль/л = 1, 0∙ 10– 14. Kw = [H+][OH–] = 1, 0∙ 10– 14. Ионное произведение воды Кw – величина постоянная (при данной температуре) для воды и любых водных растворов, равная произведению концентраций ионов водорода [H+] и гидроксид-ионов [OH–]. • Это позволяет рассчитать концентрацию ионов [H+] и [OH–] в любых водных растворах: 36
Ионное произведение воды H 2 O ↔ OH– + H+ Ка[Н 2 О] = [H+][OH–] Kw = Ка∙[Н 2 О] = 1, 82∙ 10– 16 ∙ 55, 55 моль/л = 1, 0∙ 10– 14. Kw = [H+][OH–] = 1, 0∙ 10– 14. Ионное произведение воды Кw – величина постоянная (при данной температуре) для воды и любых водных растворов, равная произведению концентраций ионов водорода [H+] и гидроксид-ионов [OH–]. • Это позволяет рассчитать концентрацию ионов [H+] и [OH–] в любых водных растворах: 36
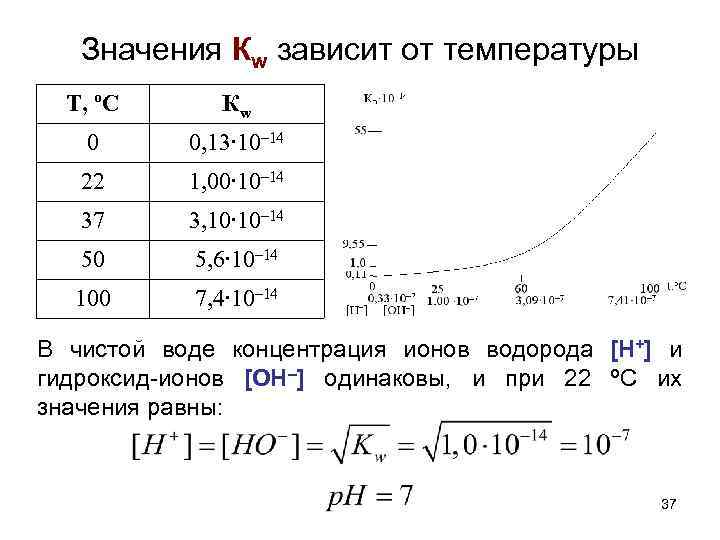 Значения Кw зависит от температуры T, ºС Кw 0 0, 13∙ 10– 14 22 1, 00∙ 10– 14 37 3, 10∙ 10– 14 50 5, 6∙ 10– 14 100 7, 4∙ 10– 14 В чистой воде концентрация ионов водорода [H+] и гидроксид-ионов [OH–] одинаковы, и при 22 ºC их значения равны: 37
Значения Кw зависит от температуры T, ºС Кw 0 0, 13∙ 10– 14 22 1, 00∙ 10– 14 37 3, 10∙ 10– 14 50 5, 6∙ 10– 14 100 7, 4∙ 10– 14 В чистой воде концентрация ионов водорода [H+] и гидроксид-ионов [OH–] одинаковы, и при 22 ºC их значения равны: 37
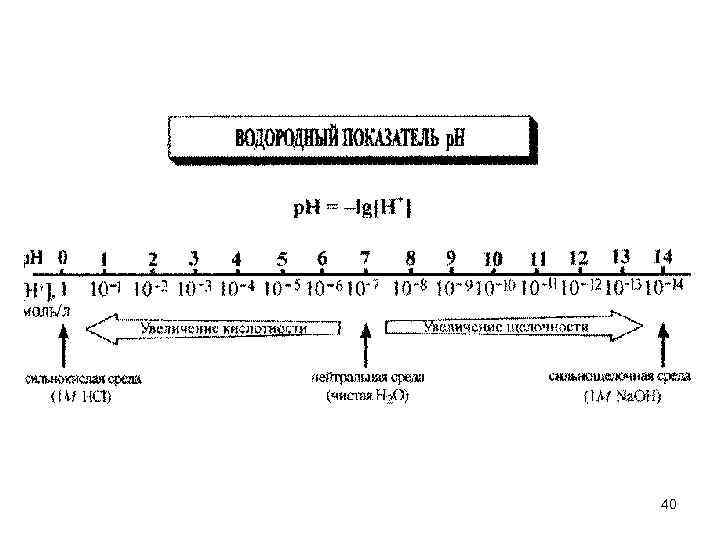
![• Кислотность водных растворов определяют по: • концентрации ионов водорода [H+]; • водородному • Кислотность водных растворов определяют по: • концентрации ионов водорода [H+]; • водородному](https://present5.com/presentation/3/82137600_179745804.pdf-img/82137600_179745804.pdf-38.jpg) • Кислотность водных растворов определяют по: • концентрации ионов водорода [H+]; • водородному показателю р. Н. – Нейтральная среда характеризуется равенством концентраций ионов водорода и гидроксид-ионов: [H+] = [OH–] = 10– 7 моль/л (при 22 ºC). – Кислая среда характеризуется соотношением: [H+] > [OH–], [H+] > 10– 7 моль/л. – Щелочная среда характеризуется соотношением: [H+] < [OH–], [H+] < 10– 7 моль/л. • Водородный показатель (р. Н) – количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе: 38
• Кислотность водных растворов определяют по: • концентрации ионов водорода [H+]; • водородному показателю р. Н. – Нейтральная среда характеризуется равенством концентраций ионов водорода и гидроксид-ионов: [H+] = [OH–] = 10– 7 моль/л (при 22 ºC). – Кислая среда характеризуется соотношением: [H+] > [OH–], [H+] > 10– 7 моль/л. – Щелочная среда характеризуется соотношением: [H+] < [OH–], [H+] < 10– 7 моль/л. • Водородный показатель (р. Н) – количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе: 38
 • Наряду с водородным показателем р. Н используют гидроксильный показатель р. ОН: • В любом водном растворе при 22 ºC: • Логарифмируем: • В нейтральной среде: • В кислой среде [H+] > 10– 7, р. Н < 7, чем больше кислотность среды, тем меньше значение р. Н. • В щелочной среде [H+] < 10– 7, р. Н > 7, чем больше основность среды, тем больше значение р. Н. 39
• Наряду с водородным показателем р. Н используют гидроксильный показатель р. ОН: • В любом водном растворе при 22 ºC: • Логарифмируем: • В нейтральной среде: • В кислой среде [H+] > 10– 7, р. Н < 7, чем больше кислотность среды, тем меньше значение р. Н. • В щелочной среде [H+] < 10– 7, р. Н > 7, чем больше основность среды, тем больше значение р. Н. 39
 40
40
 Таблица 1. Значение р. Н в различных системах Система Дождевая вода Морская вода Торфяная вода р. Н 5, 5 – 6, 0 8, 0 ± 0, 5 4, 5 ± 1, 0 Сок огуречный Сок яблочный Сок лимонный Кровь человека Молоко Слюна Желудочный сок Моча 6, 9 ± 0, 2 3, 5 ± 1, 0 2, 5 ± 0, 5 7, 35 ± 0, 08 6, 6 – 6, 9 6, 35 – 6, 85 1, 0 – 2, 0 4, 8 – 8, 0 41
Таблица 1. Значение р. Н в различных системах Система Дождевая вода Морская вода Торфяная вода р. Н 5, 5 – 6, 0 8, 0 ± 0, 5 4, 5 ± 1, 0 Сок огуречный Сок яблочный Сок лимонный Кровь человека Молоко Слюна Желудочный сок Моча 6, 9 ± 0, 2 3, 5 ± 1, 0 2, 5 ± 0, 5 7, 35 ± 0, 08 6, 6 – 6, 9 6, 35 – 6, 85 1, 0 – 2, 0 4, 8 – 8, 0 41
 Вычисления р. Н растворов сильных кислот и оснований • Сильные кислоты и основания в водных растворах практически полностью диссоциированы на ионы. • Расчет р. Н растворов сильных кислот и оснований осуществляют по формуле: где – активность ионов H+, где fа – коэффициент активности ионов водорода H+, – молярная концентрация ионов водорода. • В очень разбавленных растворах сильных кислот и оснований: 42
Вычисления р. Н растворов сильных кислот и оснований • Сильные кислоты и основания в водных растворах практически полностью диссоциированы на ионы. • Расчет р. Н растворов сильных кислот и оснований осуществляют по формуле: где – активность ионов H+, где fа – коэффициент активности ионов водорода H+, – молярная концентрация ионов водорода. • В очень разбавленных растворах сильных кислот и оснований: 42
 Вычисления р. Н растворов слабых кислот и оснований • Слабые кислоты и основания диссоциируют в водных растворах лишь в незначительной степени. • Расчет р. Н растворов слабых кислот и оснований осуществляют по формуле: Для раствора слабой кислоты: где Ka – константа ионизации слабой кислоты HAn, CHAn – концентрация слабой кислоты HAn. Для раствора слабого основания: 43
Вычисления р. Н растворов слабых кислот и оснований • Слабые кислоты и основания диссоциируют в водных растворах лишь в незначительной степени. • Расчет р. Н растворов слабых кислот и оснований осуществляют по формуле: Для раствора слабой кислоты: где Ka – константа ионизации слабой кислоты HAn, CHAn – концентрация слабой кислоты HAn. Для раствора слабого основания: 43
 Кислотно-основные индикаторы • Кислотно-основные индикаторы – синтетические органические красители, являющиеся слабыми кислотами или основаниями, меняющие видимую окраску в зависимости от р. Н раствора. • Требования, предъявляемые к КО индикаторам: – Окраска индикатора должна быть интенсивной и различаться в кислой и щелочной среде. – Изменение окраски должно быть быстрым, четким и обратимым. – Окраска индикатора должна меняться в узком интервале изменения р. Н раствора, в присутствии минимального избытка кислоты или щелочи. – Индикатор должен быть стабильным, не разлагаться в водном растворе и на воздухе. 44
Кислотно-основные индикаторы • Кислотно-основные индикаторы – синтетические органические красители, являющиеся слабыми кислотами или основаниями, меняющие видимую окраску в зависимости от р. Н раствора. • Требования, предъявляемые к КО индикаторам: – Окраска индикатора должна быть интенсивной и различаться в кислой и щелочной среде. – Изменение окраски должно быть быстрым, четким и обратимым. – Окраска индикатора должна меняться в узком интервале изменения р. Н раствора, в присутствии минимального избытка кислоты или щелочи. – Индикатор должен быть стабильным, не разлагаться в водном растворе и на воздухе. 44
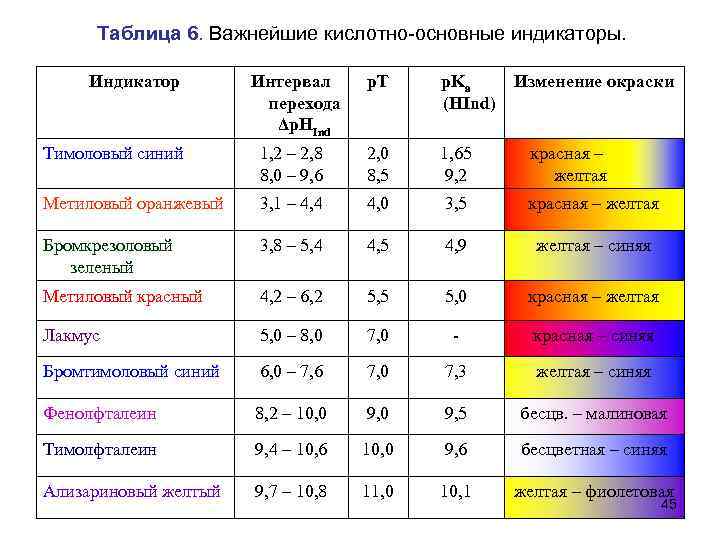 Таблица 6. Важнейшие кислотно-основные индикаторы. Индикатор Интервал перехода Δp. HInd p. T p. Ka Изменение окраски (HInd) Тимоловый синий 1, 2 – 2, 8 8, 0 – 9, 6 2, 0 8, 5 1, 65 9, 2 красная – желтая Метиловый оранжевый 3, 1 – 4, 4 4, 0 3, 5 красная – желтая Бромкрезоловый зеленый 3, 8 – 5, 4 4, 5 4, 9 желтая – синяя Метиловый красный 4, 2 – 6, 2 5, 5 5, 0 красная – желтая Лакмус 5, 0 – 8, 0 7, 0 - красная – синяя Бромтимоловый синий 6, 0 – 7, 6 7, 0 7, 3 желтая – синяя Фенолфталеин 8, 2 – 10, 0 9, 5 бесцв. – малиновая Тимолфталеин 9, 4 – 10, 6 10, 0 9, 6 бесцветная – синяя Ализариновый желтый 9, 7 – 10, 8 11, 0 10, 1 желтая – фиолетовая 45
Таблица 6. Важнейшие кислотно-основные индикаторы. Индикатор Интервал перехода Δp. HInd p. T p. Ka Изменение окраски (HInd) Тимоловый синий 1, 2 – 2, 8 8, 0 – 9, 6 2, 0 8, 5 1, 65 9, 2 красная – желтая Метиловый оранжевый 3, 1 – 4, 4 4, 0 3, 5 красная – желтая Бромкрезоловый зеленый 3, 8 – 5, 4 4, 5 4, 9 желтая – синяя Метиловый красный 4, 2 – 6, 2 5, 5 5, 0 красная – желтая Лакмус 5, 0 – 8, 0 7, 0 - красная – синяя Бромтимоловый синий 6, 0 – 7, 6 7, 0 7, 3 желтая – синяя Фенолфталеин 8, 2 – 10, 0 9, 5 бесцв. – малиновая Тимолфталеин 9, 4 – 10, 6 10, 0 9, 6 бесцветная – синяя Ализариновый желтый 9, 7 – 10, 8 11, 0 10, 1 желтая – фиолетовая 45
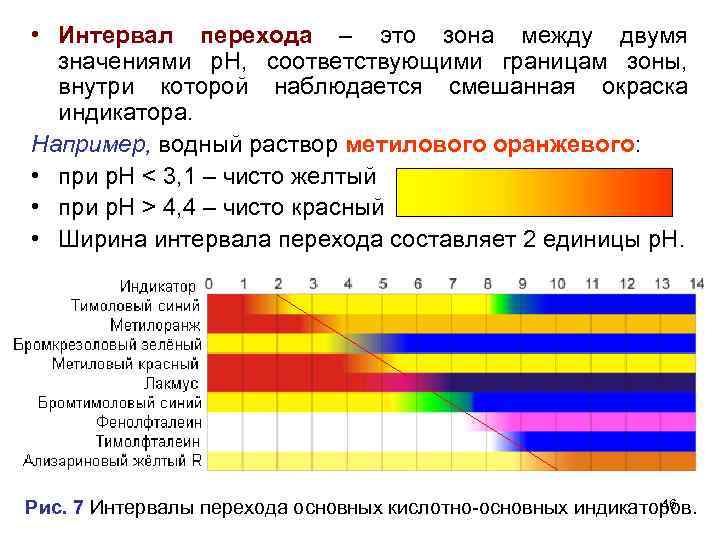 • Интервал перехода – это зона между двумя значениями р. Н, соответствующими границам зоны, внутри которой наблюдается смешанная окраска индикатора. Например, водный раствор метилового оранжевого: • при р. Н < 3, 1 – чисто желтый • при р. Н > 4, 4 – чисто красный • Ширина интервала перехода составляет 2 единицы р. Н. 46 Рис. 7 Интервалы перехода основных кислотно-основных индикаторов.
• Интервал перехода – это зона между двумя значениями р. Н, соответствующими границам зоны, внутри которой наблюдается смешанная окраска индикатора. Например, водный раствор метилового оранжевого: • при р. Н < 3, 1 – чисто желтый • при р. Н > 4, 4 – чисто красный • Ширина интервала перехода составляет 2 единицы р. Н. 46 Рис. 7 Интервалы перехода основных кислотно-основных индикаторов.
 Теории индикаторов Ионная теория Ионно-хромофорная теория Хромофорная теория 47
Теории индикаторов Ионная теория Ионно-хромофорная теория Хромофорная теория 47
 Ионная теория индикаторов Вильгельм Оствальд (1853 -1932) • Ионная теория индикаторов предложена Оствальдом в 1894 г. и основана на теории электролитической диссоциации Арениуса. • Кислотно-основные индикаторы рассматриваются как слабые органические кислоты, основания или амфотерные соединения, подвергающиеся ионизации в водных растворах, причем нейтральная и ионизированная формы индикатора обладают различной окраской. 48
Ионная теория индикаторов Вильгельм Оствальд (1853 -1932) • Ионная теория индикаторов предложена Оствальдом в 1894 г. и основана на теории электролитической диссоциации Арениуса. • Кислотно-основные индикаторы рассматриваются как слабые органические кислоты, основания или амфотерные соединения, подвергающиеся ионизации в водных растворах, причем нейтральная и ионизированная формы индикатора обладают различной окраской. 48
 • Индикаторы-кислоты диссоциируют по уравнению: • В кислой среде (р. Н < 7), равновесие в уравнении смещается влево, в сторону кислой формы индикатора НInd, окраска раствора красная. • В щелочной среде (р. Н > 7), равновесие смещается вправо, в сторону основной формы индикатора Ind–, окраска раствора синяя. • В нейтральной среде (р. Н = 7) число молекул НInd и ионов Ind–одинаково, смесь красной и синей окраски даст фиолетовый оттенок раствора. • Индикаторы-основания: 49
• Индикаторы-кислоты диссоциируют по уравнению: • В кислой среде (р. Н < 7), равновесие в уравнении смещается влево, в сторону кислой формы индикатора НInd, окраска раствора красная. • В щелочной среде (р. Н > 7), равновесие смещается вправо, в сторону основной формы индикатора Ind–, окраска раствора синяя. • В нейтральной среде (р. Н = 7) число молекул НInd и ионов Ind–одинаково, смесь красной и синей окраски даст фиолетовый оттенок раствора. • Индикаторы-основания: 49
 Недостатки ионной теории индикаторов • Ионная теория констатирует различие окрасок кислой и основной форм, но не объясняет природы и причины изменения самой окраски. • Ионная теория не связывает окраску индикаторов с их строением. • Ионные реакции являются мгновенными, а изменение окраски во многих случаях протекает сравнительно медленно. 50
Недостатки ионной теории индикаторов • Ионная теория констатирует различие окрасок кислой и основной форм, но не объясняет природы и причины изменения самой окраски. • Ионная теория не связывает окраску индикаторов с их строением. • Ионные реакции являются мгновенными, а изменение окраски во многих случаях протекает сравнительно медленно. 50
 Хромофорная теория индикаторов • Наличие окраски индикаторов, обусловлено присутствием в молекулах органических веществ хромофорных групп и ауксохромных групп. • Хромофорные группы (хромофоры) содержат кратные связи и обеспечивают поглощение видимого света из-за сравнительно легкого возбуждения электронов π-связи. • Ауксохромные группы сами по себе не придают окраску молекуле органического соединения, но влияют на свойства хромофоров (усиливают или ослабляют интенсивность окраски). • Ауксохромные группы влияют на распределение электронной плотности в молекуле, что приводит к изменению оттенка или интенсивность окраски. 51
Хромофорная теория индикаторов • Наличие окраски индикаторов, обусловлено присутствием в молекулах органических веществ хромофорных групп и ауксохромных групп. • Хромофорные группы (хромофоры) содержат кратные связи и обеспечивают поглощение видимого света из-за сравнительно легкого возбуждения электронов π-связи. • Ауксохромные группы сами по себе не придают окраску молекуле органического соединения, но влияют на свойства хромофоров (усиливают или ослабляют интенсивность окраски). • Ауксохромные группы влияют на распределение электронной плотности в молекуле, что приводит к изменению оттенка или интенсивность окраски. 51
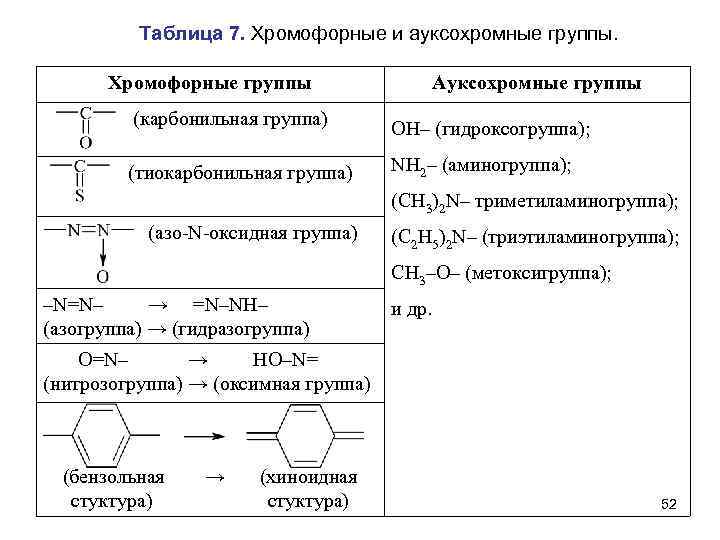 Таблица 7. Хромофорные и ауксохромные группы. Хромофорные группы Ауксохромные группы (карбонильная группа) OH– (гидроксогруппа); (тиокарбонильная группа) NH 2– (аминогруппа); (СН 3)2 N– триметиламиногруппа); (азо-N-оксидная группа) (С 2 Н 5)2 N– (триэтиламиногруппа); СН 3–O– (метоксигруппа); –N=N– → =N–NН– (азогруппа) → (гидразогруппа) и др. O=N– → НO–N= (нитрозогруппа) → (оксимная группа) (бензольная стуктура) → (хиноидная стуктура) 52
Таблица 7. Хромофорные и ауксохромные группы. Хромофорные группы Ауксохромные группы (карбонильная группа) OH– (гидроксогруппа); (тиокарбонильная группа) NH 2– (аминогруппа); (СН 3)2 N– триметиламиногруппа); (азо-N-оксидная группа) (С 2 Н 5)2 N– (триэтиламиногруппа); СН 3–O– (метоксигруппа); –N=N– → =N–NН– (азогруппа) → (гидразогруппа) и др. O=N– → НO–N= (нитрозогруппа) → (оксимная группа) (бензольная стуктура) → (хиноидная стуктура) 52
 • Индикаторы в растворе могут присутствовать в виде разных таутомерных форм, находящихся в равновесии. • Таутомерия (греч. таутис – тот же самый, мерос мера) - явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. • Например, циановая и изоциановая кислоты: • Таутомерные формы кислотно-основных индикаторов различаются строением хромофорных групп и в зависимости от кислотности среды имеют различную окраску. 53
• Индикаторы в растворе могут присутствовать в виде разных таутомерных форм, находящихся в равновесии. • Таутомерия (греч. таутис – тот же самый, мерос мера) - явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. • Например, циановая и изоциановая кислоты: • Таутомерные формы кислотно-основных индикаторов различаются строением хромофорных групп и в зависимости от кислотности среды имеют различную окраску. 53
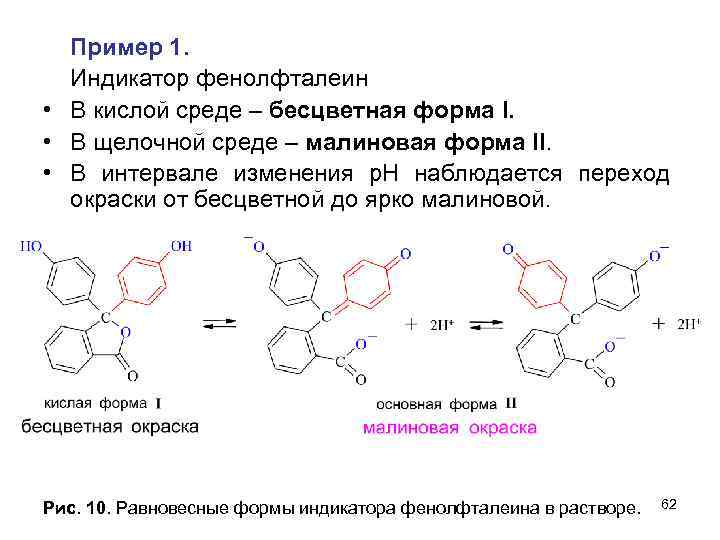
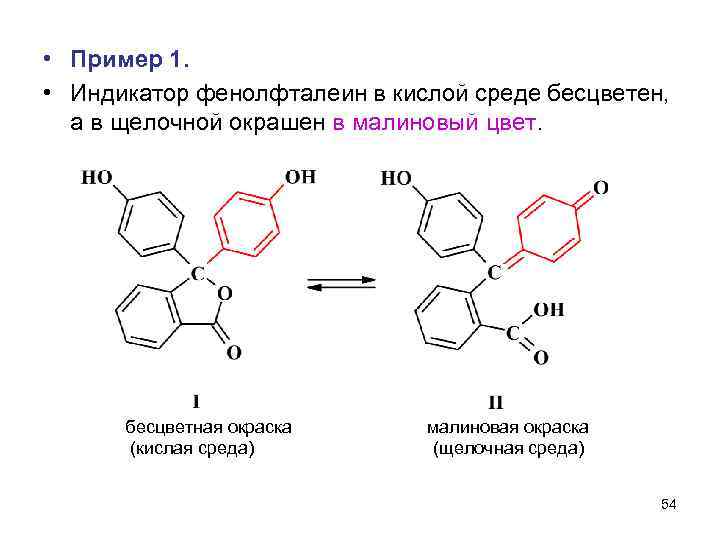 • Пример 1. • Индикатор фенолфталеин в кислой среде бесцветен, а в щелочной окрашен в малиновый цвет. бесцветная окраска (кислая среда) малиновая окраска (щелочная среда) 54
• Пример 1. • Индикатор фенолфталеин в кислой среде бесцветен, а в щелочной окрашен в малиновый цвет. бесцветная окраска (кислая среда) малиновая окраска (щелочная среда) 54
 • Пример 2. • Индикатор метиловый оранжевый является натриевой солью диметиламиноазобензолсульфокислоты (СН 3)2 N –С 6 Н 4–N=N–С 6 Н 4 SО 3 Nа. • При диссоциации этой соли в водном растворе образуется анион. В кислой среде анион присоединяет протон и переходит в кислоту, которая существует в виде двух таутомерных форм. • Таутомерная форма I имеет в качестве хромофорной азагруппу –N=N–, придающую индикатору желтый цвет. • Таутомерная форма II в качестве хромофорной имеет гидразогруппу =N–NН–, придающую индикатору красный цвет. 55
• Пример 2. • Индикатор метиловый оранжевый является натриевой солью диметиламиноазобензолсульфокислоты (СН 3)2 N –С 6 Н 4–N=N–С 6 Н 4 SО 3 Nа. • При диссоциации этой соли в водном растворе образуется анион. В кислой среде анион присоединяет протон и переходит в кислоту, которая существует в виде двух таутомерных форм. • Таутомерная форма I имеет в качестве хромофорной азагруппу –N=N–, придающую индикатору желтый цвет. • Таутомерная форма II в качестве хромофорной имеет гидразогруппу =N–NН–, придающую индикатору красный цвет. 55
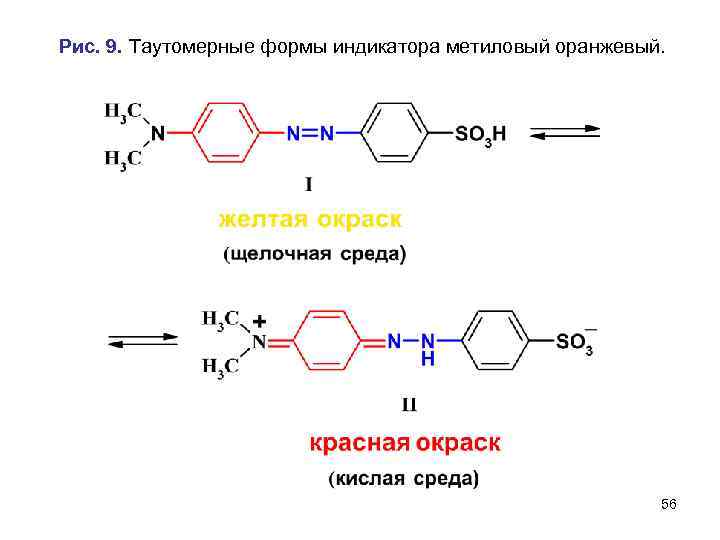 Рис. 9. Таутомерные формы индикатора метиловый оранжевый. 56
Рис. 9. Таутомерные формы индикатора метиловый оранжевый. 56
 Достоинства хромофорной теории • Хромофорная теория объясняет наличие окраски разных форм индикаторов и связывает цвет индикатора с его строением. • Хромофорная теория объясняет, почему изменение цвета индикатора может происходить не мгновенно, а во времени. • Таутомерные превращения – это внутримолекулярные перегруппировки, которые протекают с участием молекул, а не ионов, и потому осуществляются медленнее во времени, чем мгновенные ионные реакции. 57
Достоинства хромофорной теории • Хромофорная теория объясняет наличие окраски разных форм индикаторов и связывает цвет индикатора с его строением. • Хромофорная теория объясняет, почему изменение цвета индикатора может происходить не мгновенно, а во времени. • Таутомерные превращения – это внутримолекулярные перегруппировки, которые протекают с участием молекул, а не ионов, и потому осуществляются медленнее во времени, чем мгновенные ионные реакции. 57
 Недостатки хромофорной теории • Хромофорная теория не объясняет, почему таутомерные превращения и изменение окраски индикатора происходят при изменении р. Н раствора. • Иногда изменение окраски индикатора происходит мгновенно, по типу ионных реакций, что не укладывается в рамки хромофорной теории. • Хромофорная теория не дает количественной оценки процессу изменения окраски. 58
Недостатки хромофорной теории • Хромофорная теория не объясняет, почему таутомерные превращения и изменение окраски индикатора происходят при изменении р. Н раствора. • Иногда изменение окраски индикатора происходит мгновенно, по типу ионных реакций, что не укладывается в рамки хромофорной теории. • Хромофорная теория не дает количественной оценки процессу изменения окраски. 58
 Ионно-хромофорная теория индикаторов • Теория, созданная Исааком Кольтгофом в 20 -х гг. ХХ века, объединила представления ионной и хромофорной теорий. Исаак Кольтгоф (1894 – 1993) • Кислотно-основные индикаторы – это слабые кислоты и основания, при этом нейтральная молекула индикатора и ее ионизированная форма содержат разные хромофорные группы. 59
Ионно-хромофорная теория индикаторов • Теория, созданная Исааком Кольтгофом в 20 -х гг. ХХ века, объединила представления ионной и хромофорной теорий. Исаак Кольтгоф (1894 – 1993) • Кислотно-основные индикаторы – это слабые кислоты и основания, при этом нейтральная молекула индикатора и ее ионизированная форма содержат разные хромофорные группы. 59
 • Молекулы индикатора в водном растворе способны либо отдавать ионы водорода (индикатор – слабая кислота), либо принимать их (индикатор – слабое основание), подвергаясь при этом таутомерным превращениям. • Индикатор – слабая одноосновная кислота HInd. В водном растворе устанавливается равновесие: • НInd – кислая форма I индикатора, • Ind– – анион кислой формы I индикатора, • Ind*– – основная форма II индикатора, таутомерная аниону кислой формы I индикатора. 60
• Молекулы индикатора в водном растворе способны либо отдавать ионы водорода (индикатор – слабая кислота), либо принимать их (индикатор – слабое основание), подвергаясь при этом таутомерным превращениям. • Индикатор – слабая одноосновная кислота HInd. В водном растворе устанавливается равновесие: • НInd – кислая форма I индикатора, • Ind– – анион кислой формы I индикатора, • Ind*– – основная форма II индикатора, таутомерная аниону кислой формы I индикатора. 60
 • Изменение окраски кислотно-основных индикаторов происходит не мгновенно, так как переход индикатора из одной таутомерной формы в другую требует времени. • В кислой среде (р. Н < 7) равновесие смещается влево, в сторону кислой формы I (НInd), раствор принимает окраску молекул НInd. • В щелочной среде (р. Н > 7) равновесие смещается вправо, в сторону основной формы II (Ind*–) и в щелочной среде раствор принимает окраску анионов (Ind*–). • В интервале р. Н в районе величины показателя титрования р. Т, когда в растворе существуют обе формы I и II, наблюдается переход окраски индикатора из одной формы в другую. 61
• Изменение окраски кислотно-основных индикаторов происходит не мгновенно, так как переход индикатора из одной таутомерной формы в другую требует времени. • В кислой среде (р. Н < 7) равновесие смещается влево, в сторону кислой формы I (НInd), раствор принимает окраску молекул НInd. • В щелочной среде (р. Н > 7) равновесие смещается вправо, в сторону основной формы II (Ind*–) и в щелочной среде раствор принимает окраску анионов (Ind*–). • В интервале р. Н в районе величины показателя титрования р. Т, когда в растворе существуют обе формы I и II, наблюдается переход окраски индикатора из одной формы в другую. 61
 Пример 1. Индикатор фенолфталеин • В кислой среде – бесцветная форма I. • В щелочной среде – малиновая форма II. • В интервале изменения р. Н наблюдается переход окраски от бесцветной до ярко малиновой. Рис. 10. Равновесные формы индикатора фенолфталеина в растворе. 62
Пример 1. Индикатор фенолфталеин • В кислой среде – бесцветная форма I. • В щелочной среде – малиновая форма II. • В интервале изменения р. Н наблюдается переход окраски от бесцветной до ярко малиновой. Рис. 10. Равновесные формы индикатора фенолфталеина в растворе. 62
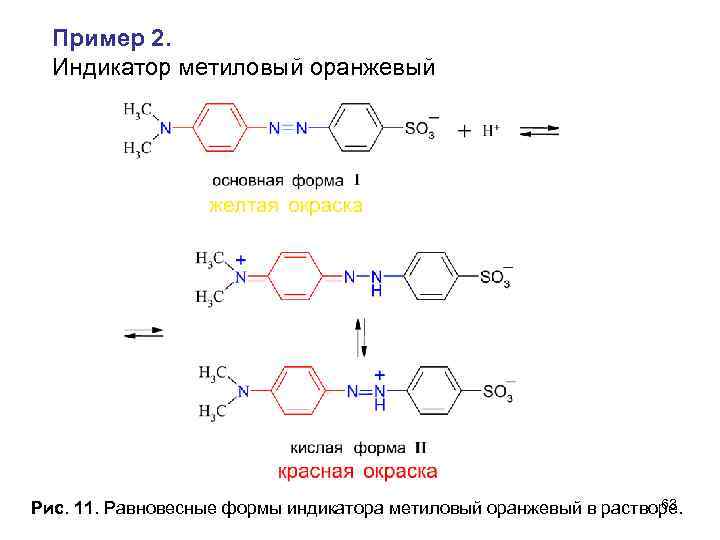 Пример 2. Индикатор метиловый оранжевый 63 Рис. 11. Равновесные формы индикатора метиловый оранжевый в растворе.
Пример 2. Индикатор метиловый оранжевый 63 Рис. 11. Равновесные формы индикатора метиловый оранжевый в растворе.
 • Равновесие в растворе индикатора характеризует константа кислотности Ka(HInd). • Для уравнения диссоциации слабой кислоты HInd: константа кислотности определяется как: Логарифмируя данное выражение, получаем выражения для расчета р. Н: 64
• Равновесие в растворе индикатора характеризует константа кислотности Ka(HInd). • Для уравнения диссоциации слабой кислоты HInd: константа кислотности определяется как: Логарифмируя данное выражение, получаем выражения для расчета р. Н: 64
 • Человеческий глаз воспринимает окраску доминирующей формы индикатора тогда, когда концентрация этой формы примерно в 10 раз превышает концентрацию другой формы. • – цвет основной формы Ind– • – цвет кислой формы НInd • – смешанная окраска • Интервал значений р. Н = интервал перехода окраски индикатора: 65
• Человеческий глаз воспринимает окраску доминирующей формы индикатора тогда, когда концентрация этой формы примерно в 10 раз превышает концентрацию другой формы. • – цвет основной формы Ind– • – цвет кислой формы НInd • – смешанная окраска • Интервал значений р. Н = интервал перехода окраски индикатора: 65
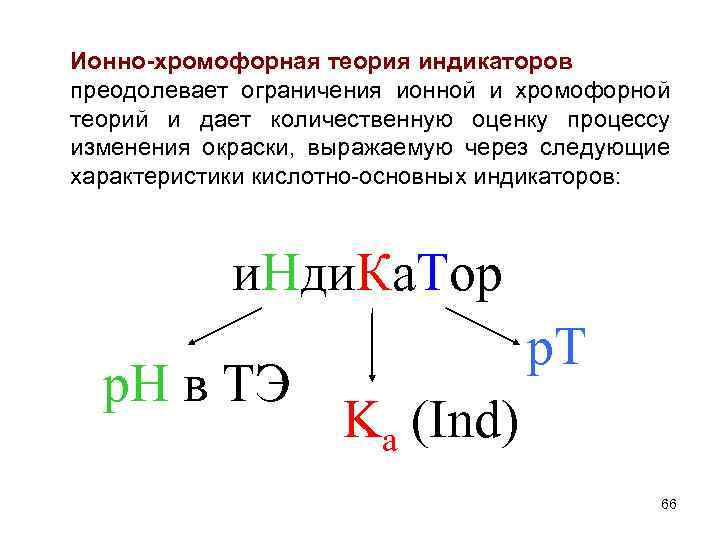 Ионно-хромофорная теория индикаторов преодолевает ограничения ионной и хромофорной теорий и дает количественную оценку процессу изменения окраски, выражаемую через следующие характеристики кислотно-основных индикаторов: и. Нди. Ка. Тор р. Н в ТЭ p. T Kа (Ind) 66
Ионно-хромофорная теория индикаторов преодолевает ограничения ионной и хромофорной теорий и дает количественную оценку процессу изменения окраски, выражаемую через следующие характеристики кислотно-основных индикаторов: и. Нди. Ка. Тор р. Н в ТЭ p. T Kа (Ind) 66
 67
67


