2. Растворы. Шкала рН.ppt
- Количество слайдов: 27
 КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду. . . можно рассматривать как слабую кислоту или слабое основание. С. Аррениус Ионное произведение воды Вода в малой степени ионизирована по уравнению: H 2 O H+ + OH–. Константа диссоциации Кдисс, в соответствии с законом действующих масс, выразится уравнением: 1
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду. . . можно рассматривать как слабую кислоту или слабое основание. С. Аррениус Ионное произведение воды Вода в малой степени ионизирована по уравнению: H 2 O H+ + OH–. Константа диссоциации Кдисс, в соответствии с законом действующих масс, выразится уравнением: 1
 При 25 °С Кд =1. 8· 10 -16 Концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной и равной: . [Н 2 О] =1000/18=55. 56 моль/л [Н+][ОН–] = Кд·[Н 2 О] = 1. 8· 10– 16 · 55. 56 = 10– 14. Кд·[Н 2 О] =Kw Ионное произведение воды: Kw=[Н+][ОН–] = 10– 14 ( 25° С ) В чистой воде при температуре 25 °С: Моль-экв/л. 2
При 25 °С Кд =1. 8· 10 -16 Концентрацию молекул воды как в чистой воде, так и в разбавленных водных растворах можно считать величиной постоянной и равной: . [Н 2 О] =1000/18=55. 56 моль/л [Н+][ОН–] = Кд·[Н 2 О] = 1. 8· 10– 16 · 55. 56 = 10– 14. Кд·[Н 2 О] =Kw Ионное произведение воды: Kw=[Н+][ОН–] = 10– 14 ( 25° С ) В чистой воде при температуре 25 °С: Моль-экв/л. 2
 В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H 2 O H+ + OH– смещается: В кислой среде: [Н+] >10– 7, [ОН‑] < 10– 7, В щелочной среде зависимость обратная 3
В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H 2 O H+ + OH– смещается: В кислой среде: [Н+] >10– 7, [ОН‑] < 10– 7, В щелочной среде зависимость обратная 3
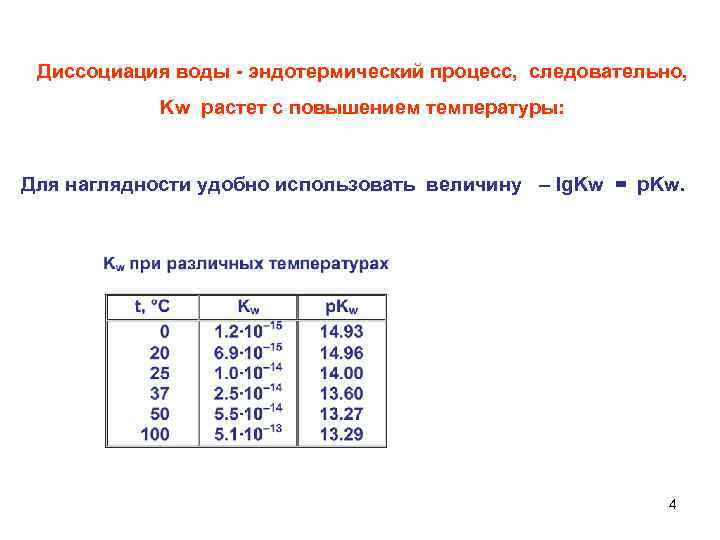 Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину – lg. Kw = p. Kw. 4
Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину – lg. Kw = p. Kw. 4
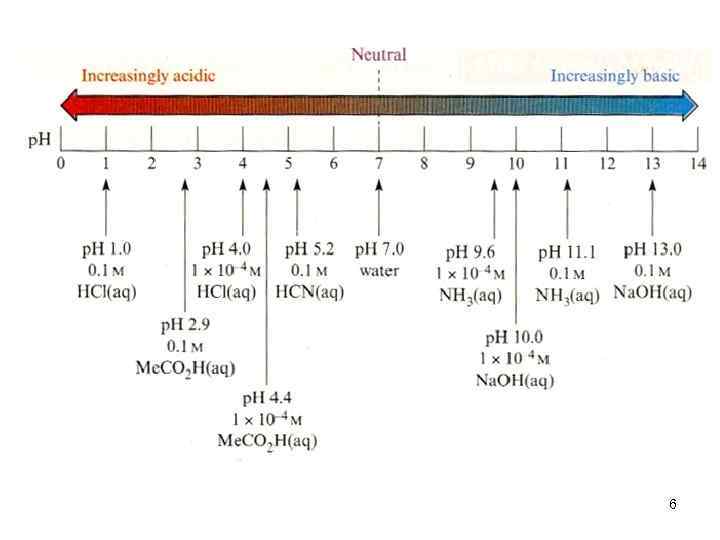
 Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - р. H и р. ОН, p. H - power Hydrogene!!! р – отрицательный логарифм (-lg) Шкала р. Н = – lg[H+] р. Н<7, р. ОН>7 р. Н + р. ОН = 14 р. Н = 7 р. ОН = – lg[OH–] р. Н>7, р. ОН<7 5
Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - р. H и р. ОН, p. H - power Hydrogene!!! р – отрицательный логарифм (-lg) Шкала р. Н = – lg[H+] р. Н<7, р. ОН>7 р. Н + р. ОН = 14 р. Н = 7 р. ОН = – lg[OH–] р. Н>7, р. ОН<7 5
 6
6
 7
7
 Для чистой воды р. Н=7 Дождевая вода за счет растворенного СО 2 имеет р. Н ~ 5. 5 – 6. 0 8
Для чистой воды р. Н=7 Дождевая вода за счет растворенного СО 2 имеет р. Н ~ 5. 5 – 6. 0 8
 Мрамор Са. СО 3 под действием слабокислой дождевой среды переходит в растворимый гидрокарбонат Са(НСО 3)2 9
Мрамор Са. СО 3 под действием слабокислой дождевой среды переходит в растворимый гидрокарбонат Са(НСО 3)2 9
 Александр Федорович Тур (1894– 1974) ü 1930 -1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка ü 1934 -1939 - заведующий кафедрой пропедевтики детских болезней ü 1939 -1974 - заведующий кафедрой госпитальной педиатрии А. Ф. Тур разрабатывал следующие научные проблемы: ü физиологические особенности и воспитание здоровых детей ü гематология и диететика здорового и больного ребенка ü физиология и патология здорового и больного ребенка ü выхаживание новорожденных и недоношенных детей ü дистрофия у детей в годы блокады ü рахит и его профилактика, детская эндокринология Лауреат Ленинской премии (1970 г. ) 10
Александр Федорович Тур (1894– 1974) ü 1930 -1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка ü 1934 -1939 - заведующий кафедрой пропедевтики детских болезней ü 1939 -1974 - заведующий кафедрой госпитальной педиатрии А. Ф. Тур разрабатывал следующие научные проблемы: ü физиологические особенности и воспитание здоровых детей ü гематология и диететика здорового и больного ребенка ü физиология и патология здорового и больного ребенка ü выхаживание новорожденных и недоношенных детей ü дистрофия у детей в годы блокады ü рахит и его профилактика, детская эндокринология Лауреат Ленинской премии (1970 г. ) 10
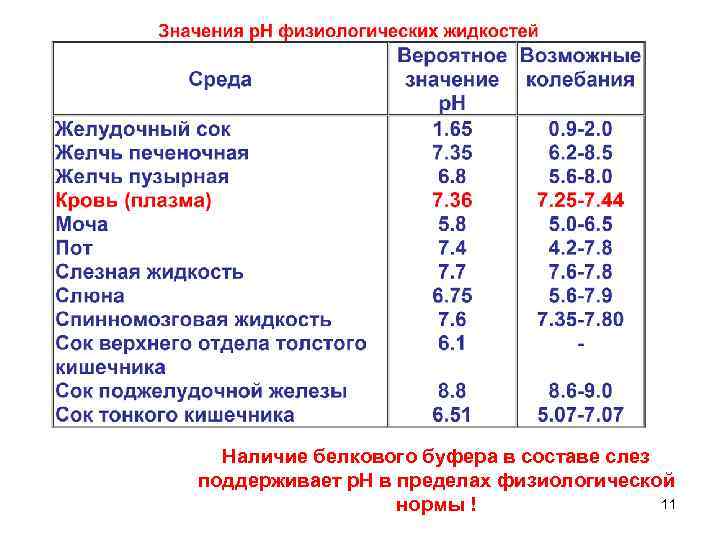 Наличие белкового буфера в составе слез поддерживает р. Н в пределах физиологической 11 нормы !
Наличие белкового буфера в составе слез поддерживает р. Н в пределах физиологической 11 нормы !
![Расчет р. Н в сильных электролитах Сильные: Рассчитать р. Н, р. ОН, [OH-] для Расчет р. Н в сильных электролитах Сильные: Рассчитать р. Н, р. ОН, [OH-] для](https://present5.com/presentation/171951711_215875953/image-12.jpg) Расчет р. Н в сильных электролитах Сильные: Рассчитать р. Н, р. ОН, [OH-] для 0, 001 м НNO 3 р. Н = 14 - р. ОН = 14 - р. Н 12
Расчет р. Н в сильных электролитах Сильные: Рассчитать р. Н, р. ОН, [OH-] для 0, 001 м НNO 3 р. Н = 14 - р. ОН = 14 - р. Н 12
 13
13
![Расчет [ Н+] и р. Н для растворов слабых электролитов Кислоты Смесь кислот 14 Расчет [ Н+] и р. Н для растворов слабых электролитов Кислоты Смесь кислот 14](https://present5.com/presentation/171951711_215875953/image-14.jpg) Расчет [ Н+] и р. Н для растворов слабых электролитов Кислоты Смесь кислот 14
Расчет [ Н+] и р. Н для растворов слабых электролитов Кислоты Смесь кислот 14
 Основания Для смеси оснований 15
Основания Для смеси оснований 15
 Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение р. Н раствора: p. H = -lg[H+] Потенциальная кислотность – концентрация катионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе. Сильные кислоты: [H+]акт = [H+]общ, [H+]пот=0. Слабые кислоты: [H+]общ = [H+]пот + [H+]акт [H+]пот > > [H+]акт 16
Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение р. Н раствора: p. H = -lg[H+] Потенциальная кислотность – концентрация катионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе. Сильные кислоты: [H+]акт = [H+]общ, [H+]пот=0. Слабые кислоты: [H+]общ = [H+]пот + [H+]акт [H+]пот > > [H+]акт 16
 Основные функции воды в организме ü Обеспечение процессов всасывания и механического передвижения питательных веществ ü Поддержание оптимального осмотического давления в крови и тканях ü Обеспечение функционирования белков, нуклеиновых кислот, полисахаридов ü Участие в процессах биосинтеза, ферментативного катализа, гидролиза ü Поддержание температуры тела 17
Основные функции воды в организме ü Обеспечение процессов всасывания и механического передвижения питательных веществ ü Поддержание оптимального осмотического давления в крови и тканях ü Обеспечение функционирования белков, нуклеиновых кислот, полисахаридов ü Участие в процессах биосинтеза, ферментативного катализа, гидролиза ü Поддержание температуры тела 17
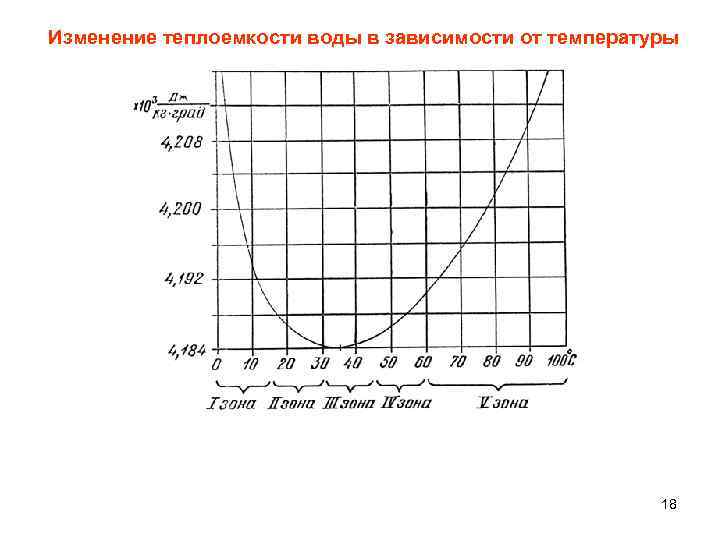 Изменение теплоемкости воды в зависимости от температуры 18
Изменение теплоемкости воды в зависимости от температуры 18
 Значение растворов в жизнедеятельности организмов. ü Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. ü Усвоение пищи связано с переходом питательных веществ в растворенное состояние. ü Биохимические реакции в живых организмах протекают в растворах. ü Биожидкости участвуют в транспорте: - кислорода, питательных веществ (жиров, аминокислот), - лекарственных препаратов к органам и тканям, - выведении из организма метаболитов: мочевины, билирубина, углекислого газа ü Плазма крови является средой для клеток - лимфоцитов, 19 эритроцитов, тромбоцитов.
Значение растворов в жизнедеятельности организмов. ü Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. ü Усвоение пищи связано с переходом питательных веществ в растворенное состояние. ü Биохимические реакции в живых организмах протекают в растворах. ü Биожидкости участвуют в транспорте: - кислорода, питательных веществ (жиров, аминокислот), - лекарственных препаратов к органам и тканям, - выведении из организма метаболитов: мочевины, билирубина, углекислого газа ü Плазма крови является средой для клеток - лимфоцитов, 19 эритроцитов, тромбоцитов.
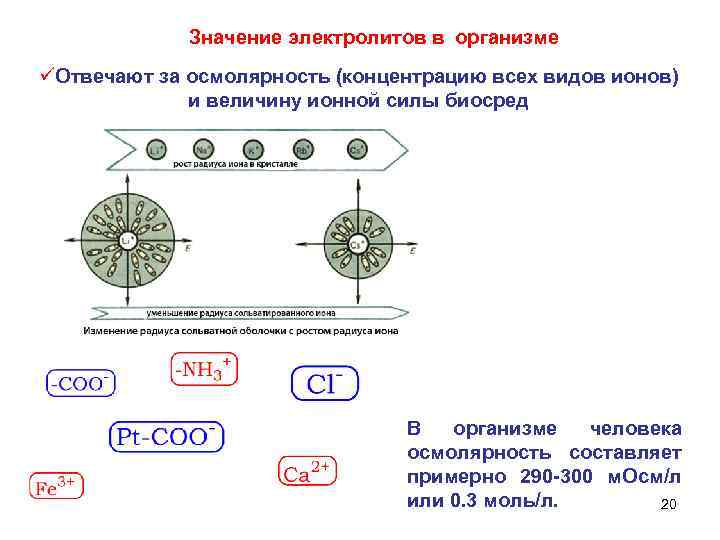 Значение электролитов в организме üОтвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред В организме человека осмолярность составляет примерно 290 -300 м. Осм/л или 0. 3 моль/л. 20
Значение электролитов в организме üОтвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред В организме человека осмолярность составляет примерно 290 -300 м. Осм/л или 0. 3 моль/л. 20
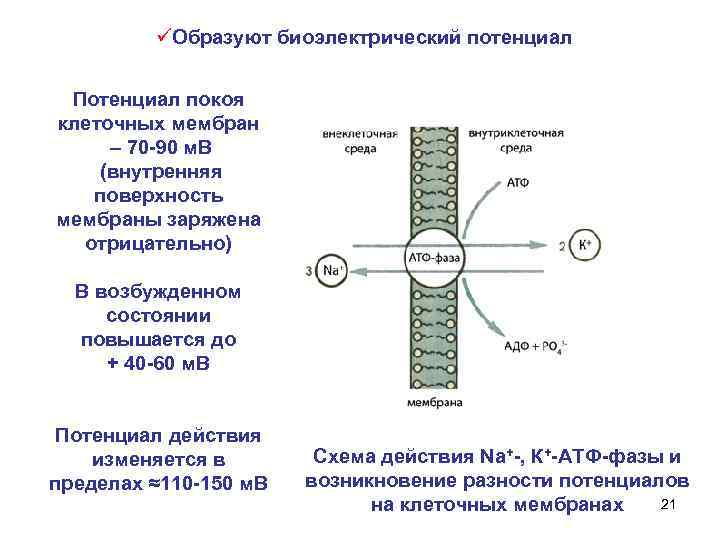 üОбразуют биоэлектрический потенциал Потенциал покоя клеточных мембран – 70 -90 м. В (внутренняя поверхность мембраны заряжена отрицательно) В возбужденном состоянии повышается до + 40 -60 м. В Потенциал действия изменяется в пределах ≈110 -150 м. В Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов 21 на клеточных мембранах
üОбразуют биоэлектрический потенциал Потенциал покоя клеточных мембран – 70 -90 м. В (внутренняя поверхность мембраны заряжена отрицательно) В возбужденном состоянии повышается до + 40 -60 м. В Потенциал действия изменяется в пределах ≈110 -150 м. В Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов 21 на клеточных мембранах
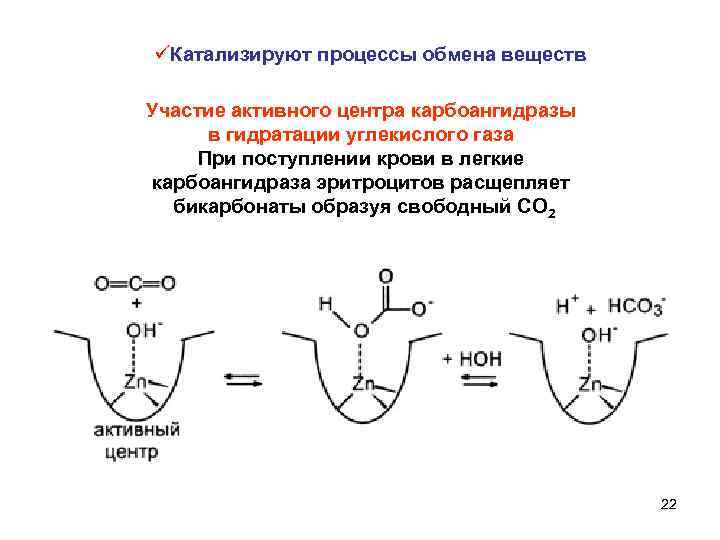 üКатализируют процессы обмена веществ Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет бикарбонаты образуя свободный СО 2 22
üКатализируют процессы обмена веществ Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет бикарбонаты образуя свободный СО 2 22
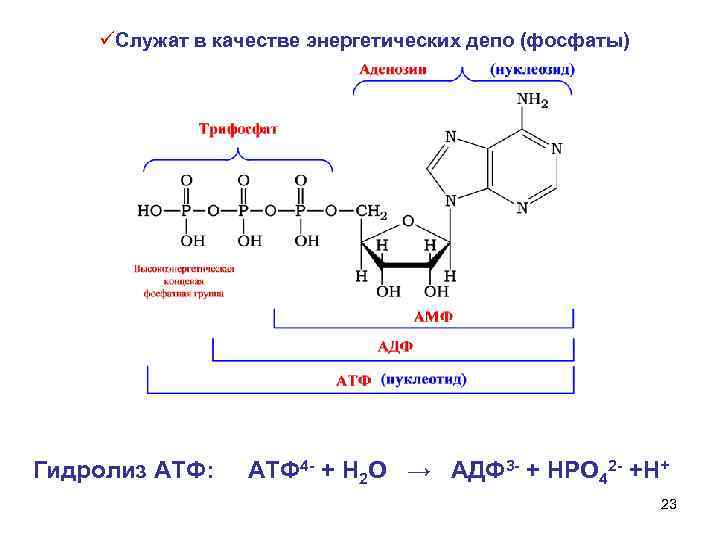 üСлужат в качестве энергетических депо (фосфаты) Гидролиз АТФ: АТФ 4 - + Н 2 О → АДФ 3 - + НРО 42 - +Н+ 23
üСлужат в качестве энергетических депо (фосфаты) Гидролиз АТФ: АТФ 4 - + Н 2 О → АДФ 3 - + НРО 42 - +Н+ 23
 ü Участвуют в свертывающей системы крови 24
ü Участвуют в свертывающей системы крови 24
 üСтабилизируют костные ткани Образование защитного эмалевого слоя Лечение кариеса фторидами 25
üСтабилизируют костные ткани Образование защитного эмалевого слоя Лечение кариеса фторидами 25
 Выпускники 2018 года 26
Выпускники 2018 года 26
 Спасибо за внимание! 27
Спасибо за внимание! 27


