Кислородсодержащие соединения серы.pptx
- Количество слайдов: 14
 Кислородсодержащие соединения серы Оксиды, кислоты, соли
Кислородсодержащие соединения серы Оксиды, кислоты, соли
 Сернистый газ SO 2 и серный ангидрид SO 3 Физические свойства и методы получения
Сернистый газ SO 2 и серный ангидрид SO 3 Физические свойства и методы получения
 Физические свойства Параметр сравнения Сернистый газ Серный ангидрид Название по международной номенклатуре Оксид серы (IV) Оксид серы (VI) Физические свойства при н. у. (t° = 0°С, р = 1 атм. ) бесцветный газ с резким удушающим запахом загорающейся спички бесцветное, похожее на лёд твердое вещество, на воздухе сильно «дымит» Физические свойства при ст. у. (t° = 25°С, р = 1 атм. ) бесцветный газ с резким удушающим запахом загорающейся спички легколетучая бесцветная жидкость с удушающим запахом Токсичность Очень токсичен. Симптомы отравления: насморк, кашель, охриплость, сильное першение в горле, своеобразный привкус Токсичен
Физические свойства Параметр сравнения Сернистый газ Серный ангидрид Название по международной номенклатуре Оксид серы (IV) Оксид серы (VI) Физические свойства при н. у. (t° = 0°С, р = 1 атм. ) бесцветный газ с резким удушающим запахом загорающейся спички бесцветное, похожее на лёд твердое вещество, на воздухе сильно «дымит» Физические свойства при ст. у. (t° = 25°С, р = 1 атм. ) бесцветный газ с резким удушающим запахом загорающейся спички легколетучая бесцветная жидкость с удушающим запахом Токсичность Очень токсичен. Симптомы отравления: насморк, кашель, охриплость, сильное першение в горле, своеобразный привкус Токсичен
 Физические свойства Параметр сравнения Сернистый газ Серный ангидрид t°плавления t°кипения − 75, 5°С − 10, 01 °C 16, 9°С 45°С Отношение к воде Растворяется в воде с образованием нестойкой сернистой кислоты SO 2 + H 2 O ⇄ H 2 SO 3 При t° = 20° в 100 мл H 2 O растворяется SO 2 Очень гигроскопичен – энергично реагирует с водой, образуя серную кислоту SO 3 + H 2 O → H 2 SO 4 Нахождение в природе Один из основных компонентов вулканических газов В природе в свободном виде не встречается Термическая устойчивость Устойчив
Физические свойства Параметр сравнения Сернистый газ Серный ангидрид t°плавления t°кипения − 75, 5°С − 10, 01 °C 16, 9°С 45°С Отношение к воде Растворяется в воде с образованием нестойкой сернистой кислоты SO 2 + H 2 O ⇄ H 2 SO 3 При t° = 20° в 100 мл H 2 O растворяется SO 2 Очень гигроскопичен – энергично реагирует с водой, образуя серную кислоту SO 3 + H 2 O → H 2 SO 4 Нахождение в природе Один из основных компонентов вулканических газов В природе в свободном виде не встречается Термическая устойчивость Устойчив
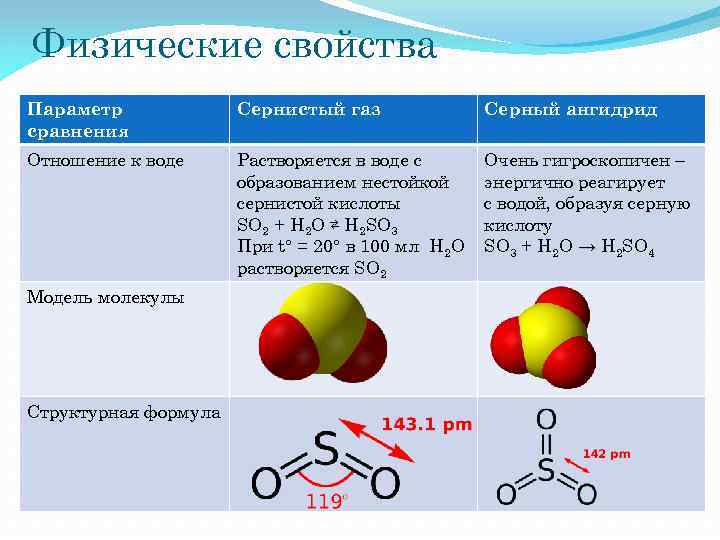 Физические свойства Параметр сравнения Сернистый газ Серный ангидрид Отношение к воде Растворяется в воде с образованием нестойкой сернистой кислоты SO 2 + H 2 O ⇄ H 2 SO 3 При t° = 20° в 100 мл H 2 O растворяется SO 2 Очень гигроскопичен – энергично реагирует с водой, образуя серную кислоту SO 3 + H 2 O → H 2 SO 4 Модель молекулы Структурная формула
Физические свойства Параметр сравнения Сернистый газ Серный ангидрид Отношение к воде Растворяется в воде с образованием нестойкой сернистой кислоты SO 2 + H 2 O ⇄ H 2 SO 3 При t° = 20° в 100 мл H 2 O растворяется SO 2 Очень гигроскопичен – энергично реагирует с водой, образуя серную кислоту SO 3 + H 2 O → H 2 SO 4 Модель молекулы Структурная формула
 Химические свойства Параметр сравнения Сернистый газ Серный ангидрид Характер оксида кислотный Отношение к воде SO 2 + H 2 O ⇄ H 2 SO 3 + H 2 O → H 2 SO 4 Отношение к основным оксидам K 2 O + SO 2 → K 2 SO 3 Отношение к амфотерным оксидам SO 2 + Zn. O → Zn. SO 3 + Zn. O → Zn. SO 4 Отношение к раствору щелочи 2 Na. OH + SO 2 → → Na 2 SO 3 + H 2 O Na. OH + SO 2 → → Na. HSO 3 K 2 O + SO 3 → K 2 SO 4 2 Na. OH + SO 3 → → Na 2 SO 4 +H 2 O Na. OH + SO 3 → → Na. HSO 4
Химические свойства Параметр сравнения Сернистый газ Серный ангидрид Характер оксида кислотный Отношение к воде SO 2 + H 2 O ⇄ H 2 SO 3 + H 2 O → H 2 SO 4 Отношение к основным оксидам K 2 O + SO 2 → K 2 SO 3 Отношение к амфотерным оксидам SO 2 + Zn. O → Zn. SO 3 + Zn. O → Zn. SO 4 Отношение к раствору щелочи 2 Na. OH + SO 2 → → Na 2 SO 3 + H 2 O Na. OH + SO 2 → → Na. HSO 3 K 2 O + SO 3 → K 2 SO 4 2 Na. OH + SO 3 → → Na 2 SO 4 +H 2 O Na. OH + SO 3 → → Na. HSO 4
 Химические свойства Параметр сравнения Сернистый газ Серный ангидрид Степень окисления серы и роль оксида в ОВР В молекулах S+4 O 2 атомы серы имеют промежуточную степень окисления, сернистый ангидрид – и окислитель, и восстановитель (ОВД) В молекулах S+6 O 3 атомы серы имеют высшую степень окисления, серный ангидрид –окислитель Отношение к сероводороду S+4 O 2 + 2 H 2 S− 2 → 3 S 0 + + 2 H 2 O H 2 S – восстановитель SO 2 – окислитель 3 S+6 O 3+ H 2 S− 2 → 4 S+4 O 2 + + H 2 O H 2 S – восстановитель SO 3 – окислитель Отношение к кислороду 2 S+4 O 2 + О 2 ⇄ 2 S+6 O 3 SO 2 – восстановитель O 2 – окислитель S+6 O 3+ О 2 ≠ Отношение к хлору S+4 O 2 + Cl 2 + 2 H 2 O → 2 HCl + H 2 SO 4 SO 2 – восстановитель Cl 2 – окислитель S+6 O 3+ Cl 2 ≠
Химические свойства Параметр сравнения Сернистый газ Серный ангидрид Степень окисления серы и роль оксида в ОВР В молекулах S+4 O 2 атомы серы имеют промежуточную степень окисления, сернистый ангидрид – и окислитель, и восстановитель (ОВД) В молекулах S+6 O 3 атомы серы имеют высшую степень окисления, серный ангидрид –окислитель Отношение к сероводороду S+4 O 2 + 2 H 2 S− 2 → 3 S 0 + + 2 H 2 O H 2 S – восстановитель SO 2 – окислитель 3 S+6 O 3+ H 2 S− 2 → 4 S+4 O 2 + + H 2 O H 2 S – восстановитель SO 3 – окислитель Отношение к кислороду 2 S+4 O 2 + О 2 ⇄ 2 S+6 O 3 SO 2 – восстановитель O 2 – окислитель S+6 O 3+ О 2 ≠ Отношение к хлору S+4 O 2 + Cl 2 + 2 H 2 O → 2 HCl + H 2 SO 4 SO 2 – восстановитель Cl 2 – окислитель S+6 O 3+ Cl 2 ≠
 Методы получения Название метода Сернистый газ Серный ангидрид Сжигание серы S + O 2 → SO 2 — Обжиг сульфидов (пирита) 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + + 8 SO 2↑ — Каталитическое окисление сернистого газа Действие концентрированной серной кислоты на малоактивные металлы при нагревании Действие сильных кислот на сульфиты и гидросульфиты — V 2 O 5 2 S+4 O 2 + О 2 ⇄ 2 S+6 O 3 2 H 2 SO 4 концентрированная + Cu → → Cu. SO 4 + SO 2↑ + 2 H 2 O — Na 2 SO 3 + H 2 SO 4 → → Na 2 SO 4 + H 2 O + SO 2↑ —
Методы получения Название метода Сернистый газ Серный ангидрид Сжигание серы S + O 2 → SO 2 — Обжиг сульфидов (пирита) 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + + 8 SO 2↑ — Каталитическое окисление сернистого газа Действие концентрированной серной кислоты на малоактивные металлы при нагревании Действие сильных кислот на сульфиты и гидросульфиты — V 2 O 5 2 S+4 O 2 + О 2 ⇄ 2 S+6 O 3 2 H 2 SO 4 концентрированная + Cu → → Cu. SO 4 + SO 2↑ + 2 H 2 O — Na 2 SO 3 + H 2 SO 4 → → Na 2 SO 4 + H 2 O + SO 2↑ —
 Сернистая кислота Н 2 SO 3 и Серная кислота Н 2 SO 4 Физические свойства и методы получения
Сернистая кислота Н 2 SO 3 и Серная кислота Н 2 SO 4 Физические свойства и методы получения
 Физические свойства Параметр сравнения Сернистая кислота Серная кислота Физические свойства Известна только в разбавленных водных растворах, растворы H 2 SO 3 всегда имеют резкий специфический запах Бесцветная, тяжелая, нелетучая маслянистая жидкость без запаха; при попадании на кожу, мгновенно разъедает её. Основность и сила кислоты Двухосновная кислота средней силы, ближе к слабым Двухосновная кислота сильная Диссоциация Ступенчатая, обратимая Ступенчатая, практически необратимая (по I ступени); обратимая (по II ступени); H 2 SO 3 ⇄ H 1+ + HSO 31– (I) K 1 = 1, 6∙ 10– 2 HSO 31– ⇄ H 1+ + SO 32– (II) K 2 = 6, 3∙ 10– 8 H 2 SO 4 → H 1+ + HSO 41– (I) K 1 = 1∙ 103 HSO 41– ⇄ H 1+ + SO 42– (II) К₂ = 1, 2∙ 10− 2
Физические свойства Параметр сравнения Сернистая кислота Серная кислота Физические свойства Известна только в разбавленных водных растворах, растворы H 2 SO 3 всегда имеют резкий специфический запах Бесцветная, тяжелая, нелетучая маслянистая жидкость без запаха; при попадании на кожу, мгновенно разъедает её. Основность и сила кислоты Двухосновная кислота средней силы, ближе к слабым Двухосновная кислота сильная Диссоциация Ступенчатая, обратимая Ступенчатая, практически необратимая (по I ступени); обратимая (по II ступени); H 2 SO 3 ⇄ H 1+ + HSO 31– (I) K 1 = 1, 6∙ 10– 2 HSO 31– ⇄ H 1+ + SO 32– (II) K 2 = 6, 3∙ 10– 8 H 2 SO 4 → H 1+ + HSO 41– (I) K 1 = 1∙ 103 HSO 41– ⇄ H 1+ + SO 42– (II) К₂ = 1, 2∙ 10− 2
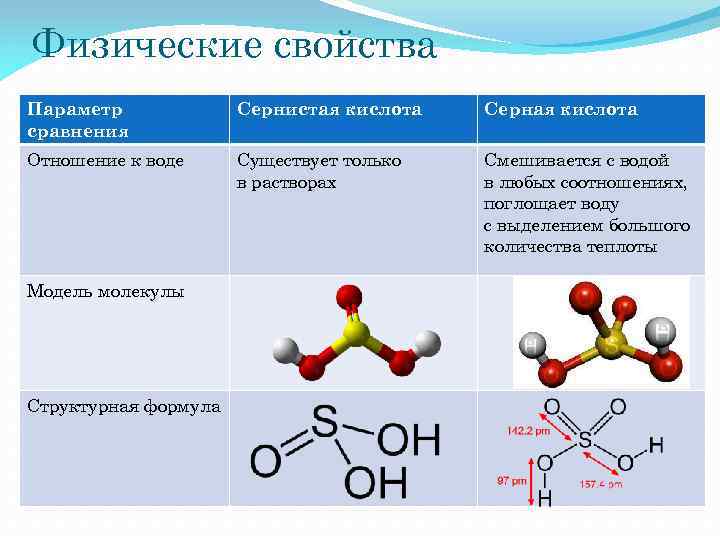 Физические свойства Параметр сравнения Сернистая кислота Серная кислота Отношение к воде Существует только в растворах Смешивается с водой в любых соотношениях, поглощает воду с выделением большого количества теплоты Модель молекулы Структурная формула
Физические свойства Параметр сравнения Сернистая кислота Серная кислота Отношение к воде Существует только в растворах Смешивается с водой в любых соотношениях, поглощает воду с выделением большого количества теплоты Модель молекулы Структурная формула
 Сопоставление силы сернистой и серной кислот Сернистая кислота Na 2 CO 3 + H 2 O + SO 2 → → Na 2 SO 3 + CO 2↑ + H 2 O Сернистая кислота – сильнее слабой угольной кислоты Na 2 SO 3 + 2 HCl → → 2 Na. Cl + SO 2↑ + H 2 O Na 2 SO 3 + H 2 SO 4 → → Na 2 SO 4 + SO 2↑ + H 2 O Сернистая кислота – слабее сильной соляной кислоты или серной кислоты Серная кислота Na 2 CO 3 + H 2 SO 4 → → Na 2 SO 4 + CO 2↑ + H 2 O Серная кислота – сильнее слабой угольной кислоты Ba. Cl 2 + H 2 SO 4 → → 2 HCl + Ba. SO 4↓ Ag 2 SO 4 + 2 HCl → → 2 Ag. Cl↓ + H 2 SO 4 Серная кислота – не слабее сильной соляной кислоты
Сопоставление силы сернистой и серной кислот Сернистая кислота Na 2 CO 3 + H 2 O + SO 2 → → Na 2 SO 3 + CO 2↑ + H 2 O Сернистая кислота – сильнее слабой угольной кислоты Na 2 SO 3 + 2 HCl → → 2 Na. Cl + SO 2↑ + H 2 O Na 2 SO 3 + H 2 SO 4 → → Na 2 SO 4 + SO 2↑ + H 2 O Сернистая кислота – слабее сильной соляной кислоты или серной кислоты Серная кислота Na 2 CO 3 + H 2 SO 4 → → Na 2 SO 4 + CO 2↑ + H 2 O Серная кислота – сильнее слабой угольной кислоты Ba. Cl 2 + H 2 SO 4 → → 2 HCl + Ba. SO 4↓ Ag 2 SO 4 + 2 HCl → → 2 Ag. Cl↓ + H 2 SO 4 Серная кислота – не слабее сильной соляной кислоты
 Методы получения Название метода Серная кислота Получение серной кислоты из железного купороса (1) термическое разложение сульфата железа 4 Fe. SO 4· 7 H 2 O → 2 Fe 2 O 3+ 4 SO 2 + 28 H 2 O+ O 2 (2) последующее охлаждение смеси 2 SO 2 + 2 H 2 O+ O 2 → 2 H 2 SO 4 Получение серной кислоты из сульфидов металлов (1) обжиг сульфидов 4 Fe. S + 7 O 2 → 2 Fe 2 O 3 + 4 SO 2 (t°C) (2) Каталитическое окисление сернистого газа кислородом воздуха 2 SO 2 + O 2 ⇄ 2 SO 3 (t°C, V 2 O 5 − катализатор) (3) Гидратация серного ангидрида – поглощение серного ангидрида раствором серной кислоты SO 3 + H 2 O → H 2 SO 4 Название метода Сернистая кислота Действие сильных кислот на сульфиты и гидросульфиты Практически сернистая кислота − раствор SO 2 в H 2 O Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + SO 2↑
Методы получения Название метода Серная кислота Получение серной кислоты из железного купороса (1) термическое разложение сульфата железа 4 Fe. SO 4· 7 H 2 O → 2 Fe 2 O 3+ 4 SO 2 + 28 H 2 O+ O 2 (2) последующее охлаждение смеси 2 SO 2 + 2 H 2 O+ O 2 → 2 H 2 SO 4 Получение серной кислоты из сульфидов металлов (1) обжиг сульфидов 4 Fe. S + 7 O 2 → 2 Fe 2 O 3 + 4 SO 2 (t°C) (2) Каталитическое окисление сернистого газа кислородом воздуха 2 SO 2 + O 2 ⇄ 2 SO 3 (t°C, V 2 O 5 − катализатор) (3) Гидратация серного ангидрида – поглощение серного ангидрида раствором серной кислоты SO 3 + H 2 O → H 2 SO 4 Название метода Сернистая кислота Действие сильных кислот на сульфиты и гидросульфиты Практически сернистая кислота − раствор SO 2 в H 2 O Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + SO 2↑



