FEU-2012-Lektsia_8-9.ppt
- Количество слайдов: 35

КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ.

Классификация Гидроксилсодержащие Карбонилсодержащие Карбоксилсодержащие 1) Спирты (одно- и много- атомные, предельные и непредельные, низкои высокомолекулярные) Примеры: СН 3 ОН, СН 2=СН-СН 2 ОН СН 2 -СН 2 | | OH OH 1) Альдегиды (R-C-H) || O 1) Карбоновые кислоты Примеры: СН 3 -С 17 Н 35 СООН О=С - С=О НО/ ОН 2) Фенолы (одно- и многоатомные) 2) Кетоны (R 1 -C=O ) R 2 Пример: СН 3 -С=О СН 3 2) Мыла - соли высших карбоновых кислот (RCOOMe) 3) Простые эфиры - производные спиртов или фенолов R 1 - O -R 2, например СН 3 -О-СН 3 3) Жиры – сложные эфиры трехатомного спирта - глицерина и высших карбоновых кислот Сложные эфиры - производные карбоновых кислот и спиртов R 1 -C=O O R 2, например СН 3 -С=О О-СН 2 -СН 3 этилацетат

Номенклатура • Номенклатура спиртов Рационально-радикальная: называется радикал, соединенный с гидроксильной группой, к названию добавляется окончание «овый спирт» . Систематическая номенклатура: 1. Выбирают самую длинную цепь углеродных атомов, соединенную с гидроксильной группой. 2. Цепочку нумеруют с той стороны, к которой ближе гидроксильная группа. 3. Перечисляют заместители в алфавитном порядке. Цифрой показывают их положение в цепи. 4. Называют самую длинную цепь, к названию добавляют суффикс «ол» . Цифрой указывают положение гидроксильной группы в цепи.

Примеры названий спиртов: Формула По систематической Тривиальное название По рационально-радикальной СН 3 -ОН метанол древесный спирт метиловый спирт СН 3 -СН 2 -ОН этанол винный этиловый СН 3 -СН-СН 3 | OH 2 -пропанол изопропиловый СН 2 -СН-CH 2 | | | OH OH OH 1, 2, 3 -пропантриол глицерин

Номенклатура альдегидов Систематическая номенклатура: 1. Выбирают самую длинную цепочку углеродных атомов, соединенную с карбонильной группой. 2. Цепочку нумеруют, начиная с карбонильной группы. 3. Называют заместители в алфавитном порядке. Цифрой показывают их положение в цепи. 4. Называют самую длинную цепь, прибавляя к ней окончание «аль» .
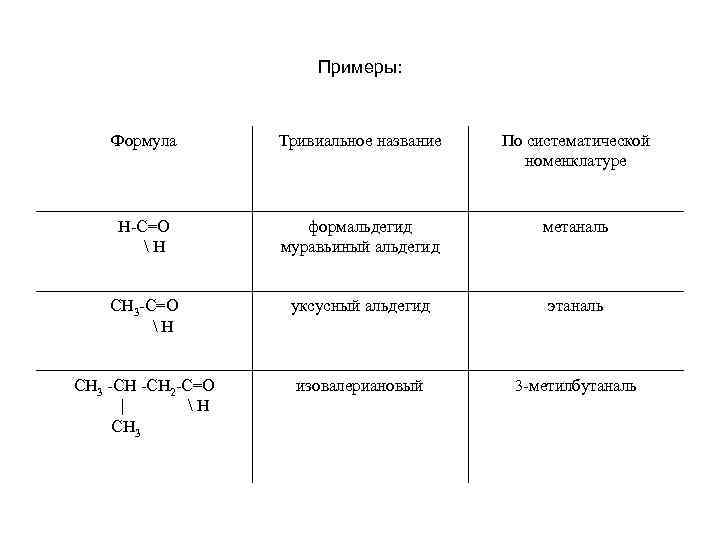
Примеры: Формула Тривиальное название По систематической номенклатуре Н-С=О Н формальдегид муравьиный альдегид метаналь СН 3 -С=О Н уксусный альдегид этаналь СН 3 -СН 2 -С=О | Н CH 3 изовалериановый 3 -метилбутаналь
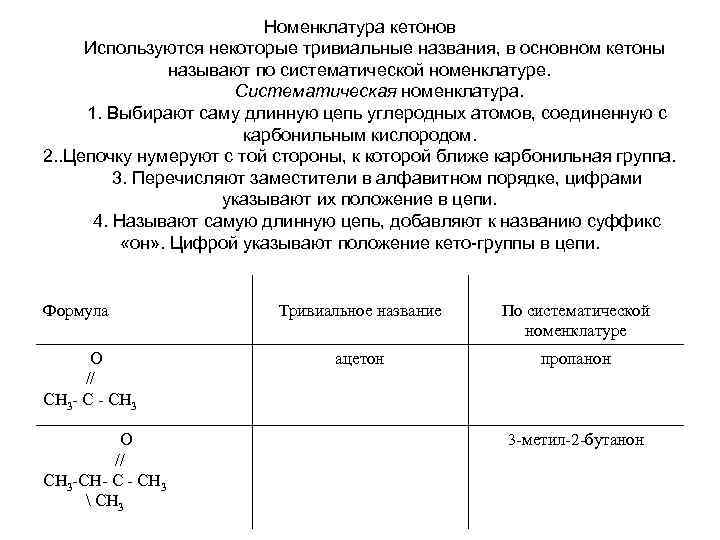
Номенклатура кетонов Используются некоторые тривиальные названия, в основном кетоны называют по систематической номенклатуре. Систематическая номенклатура. 1. Выбирают саму длинную цепь углеродных атомов, соединенную с карбонильным кислородом. 2. . Цепочку нумеруют с той стороны, к которой ближе карбонильная группа. 3. Перечисляют заместители в алфавитном порядке, цифрами указывают их положение в цепи. 4. Называют самую длинную цепь, добавляют к названию суффикс «он» . Цифрой указывают положение кето-группы в цепи. Формула О // СН 3 - С - СН 3 О // СН 3 -СН- С - СН 3 СН 3 Тривиальное название По систематической номенклатуре ацетон пропанон 3 -метил-2 -бутанон
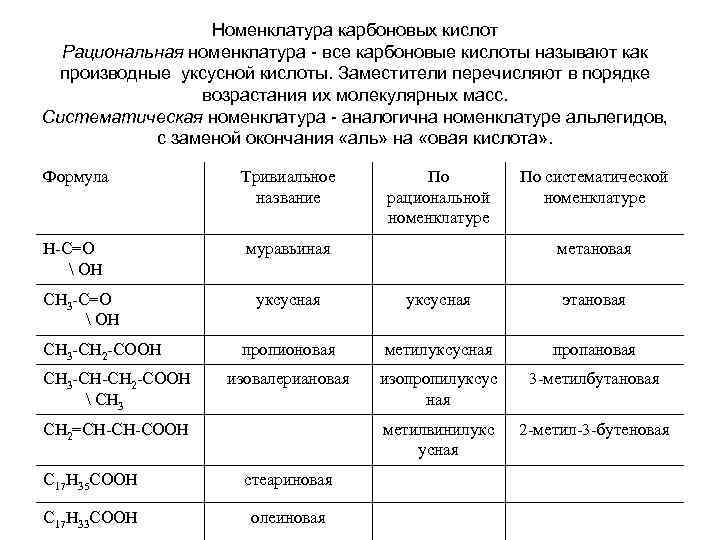
Номенклатура карбоновых кислот Рациональная номенклатура - все карбоновые кислоты называют как производные уксусной кислоты. Заместители перечисляют в порядке возрастания их молекулярных масс. Систематическая номенклатура - аналогична номенклатуре альлегидов, с заменой окончания «аль» на «овая кислота» . Формула Тривиальное название Н-С=О ОН муравьиная СН 3 -С=О ОН СН 3 -СН 2 -СООН СН 3 -СН-СН 2 -СООН СН 3 По рациональной номенклатуре По систематической номенклатуре метановая уксусная этановая пропионовая метилуксусная пропановая изовалериановая изопропилуксус ная 3 -метилбутановая метилвинилукс усная 2 -метил-3 -бутеновая СН 2=СН-СН-СООН С 17 Н 35 СООН стеариновая С 17 Н 33 СООН олеиновая
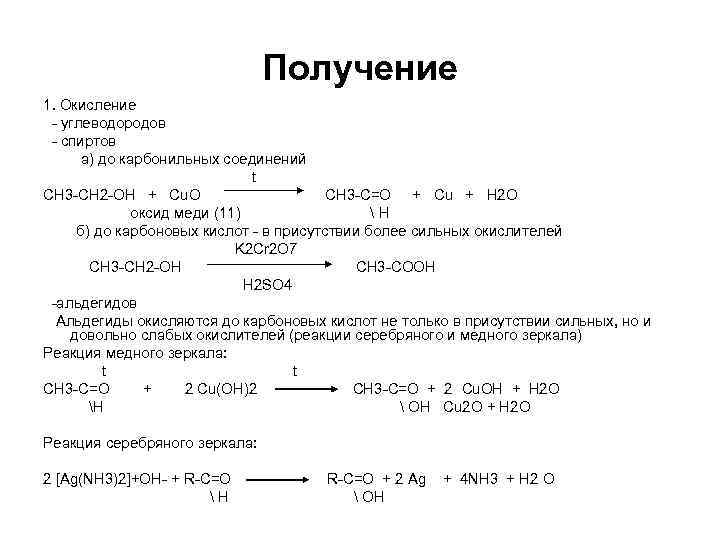
Получение 1. Окисление - углеводородов - спиртов а) до карбонильных соединений t СН 3 -СН 2 -ОН + Cu. O СН 3 -С=О + Cu + H 2 O оксид меди (11) H б) до карбоновых кислот - в присутствии более сильных окислителей K 2 Cr 2 O 7 СН 3 -СН 2 -ОН СН 3 -СООН H 2 SO 4 -альдегидов Альдегиды окисляются до карбоновых кислот не только в присутствии сильных, но и довольно слабых окислителей (реакции серебряного и медного зеркала) Реакция медного зеркала: t t CH 3 -C=O + 2 Cu(OH)2 CH 3 -C=O + 2 Cu. OH + H 2 O H OH Cu 2 O + H 2 O Реакция серебряного зеркала: 2 [Ag(NH 3)2]+OH- + R-C=О Н R-C=O + 2 Ag OH + 4 NH 3 + H 2 O

2. Гидрирование альдегидов и кетонов до соответствующих первичных или вторичных спиртов. Ni СН 3 - С=О + Н 2 СН 3 -СН 2 ОН Н 3. Взаимодействие с водой. а) Гидратация алкенов - проходит до спиртов Гидратация алкинов - проходит с образованием соответствующих карбонильных соединений. б) Гидролиз геминальных галогенпроизводных - моногалогенпроизводных (в щелочной среде) - до спиртов СН 3 -СН 2 -Br + КОН СН 3 -СН 2 -ОН + КBr Н 2 О - дигалогенпроизводных - до альдегидов или кетонов СН 3 -СН-Br + 2 H-OH [ СН 3 -СН-OH] СН 3 -С=O | -2 HBr | -H 2 O H Br OH -тригалогенпроизводных - с образованием карбоновых кислот Br OH | | СН 3 -С-Br + 3 H-OH [CН 3 -С-OН] СН 3 -С=O | -3 НBr | -Н 2 О ОН Br OH в) гидролиз цианпроизводных - с образованием карбоновых кислот CH 3 -C≡N + 3 H 2 O CH 3 -COOH + NH 4 OH

4. Получение фенолов. а) Сплавление солей сульфокислот с щелочами. б) Щелочной гидролиз хлорбензола в) Кумольный метод - окисление изопропилбензола (кумола) кислородом с последующим разложением гидроперекиси конц. серной кислотой.

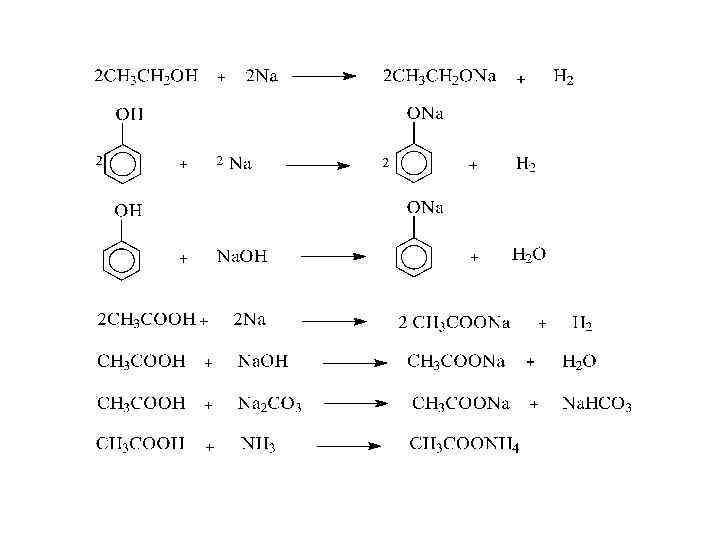
1 У. Химические свойства кислородсодержащих соединений. 1. Кислотные свойства спиртов, фенолов, карбоновых кислот. Спирты являются слабыми кислотами, и водород в их гидроксильных группах замещается только при воздействии активных металлов. Фенолы уже сильнее, как кислоты, и реагируют с замещением водорода не только с активными металлами, но и с щелочами. Карбоновые кислоты образуют соли и в реакциях с активными металлами, и с щелочами, и с содой, и с аммиаком.

2. Реакции дегидратации спиртов. • Реакции дегидратации спиртов проводят при нагревании их с кислотными катализаторами. При невысоких температурах проходит межмолекулярная дегидратация с образованием простых эфиров, а при повышенных температурах идет внутримолекулярная дегидратация с образованием алкенов. • а) межмолекулярная дегидратация: • диэтиловый эфир • б) внутримолекулярная дегидратация

3. Реакции этерификации. • Реакции этерификации - взаимодействие кислот со спиртами с образованием сложных эфиров - относятся к важнейшим в органической химии, проходят в присутствии кислотных катализаторов.

4. Реакции окисления и восстановления. • Реакции окисления и восстановления широко используются в органическом синтезе для получения различных кислородсодержащих соединений. Со многими из этих реакций мы уже встречались в данном курсе. • Ниже приводится схема возможных переходов от одного класса кислородсодержащих соединений к другому либо в результате реакций окисления ([O]), либо реакций восстановления ([H]) в общем виде.

5. Реакции альдегидов и кетонов. • Альдегиды и кетоны принадлежат к весьма реакционноспособным соединениям. • Они вступают в: 1)реакции присоединения по месту разрыва двойной связи в карбонильной группе С=О, 2) реакции замещения водорода в углеродной цепи или кислорода в карбонильной группе, 3) реакции окисления, 4)реакции полимеризации, 5) конденсации и поликонденсации. Для примера приведем здесь две различного типа реакции.
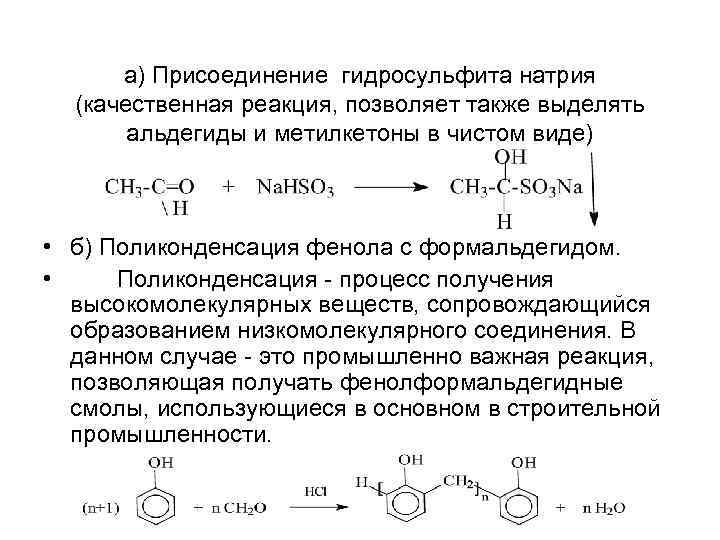
а) Присоединение гидросульфита натрия (качественная реакция, позволяет также выделять альдегиды и метилкетоны в чистом виде) • б) Поликонденсация фенола с формальдегидом. • Поликонденсация - процесс получения высокомолекулярных веществ, сопровождающийся образованием низкомолекулярного соединения. В данном случае - это промышленно важная реакция, позволяющая получать фенолформальдегидные смолы, использующиеся в основном в строительной промышленности.

МЫЛА. • Мыла - это соли высших карбоновых кислот. Различают растворимые (соли щелочных металлов) и нерастворимые в воде мыла. Растворимые в воде мыла делятся на твердые (натриевые) и жидкие (калиевые) R-C=O R - C=O O-Na O-K • Наиболее часто для получения мыл используют стеариновую (С 17 Hзз. СООН) • или пальмитиновую (С 15 Н 31 СООН) кислоты.

ЖИРЫ. • Жиры - это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот: Если R- в жире представляет собой остаток от высшей предельной кислоты, то жир - твердый, если от непредельной - то жир жидкий. Жидкие жиры называются маслами. Наиболее известны следующие жиры: коровье масло, говяжье сало, бараний и свиной жир (твердые жиры), подсолнечное, оливковое, миндальное, пальмовое масла (жидкие жиры).

В прежние времена жиры получали либо из растений (жидкие жиры, или растительные масла), либо из убитых животных. В настоящее время искусственные жиры получают по реакции этерификации глицерина различными высокомолекулярными кислотами. У. Применение кислородсодержащих соединений. Кислородсодержащие соединения играют огромную роль в жизни человека. Жиры, углеводы, которые содержатся в самом человеке - это кислородсодержащие органические соединения. Наша пища во многом состоит из кислородсодержащих соединений. Искусственные ткани, поверхностно-активные вещества, лекарства, красители, клеи, лаки, душистые вещества - чаще всего это также кислородсодержащие органические соединения.

АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Классификация азотсодержащих органических соединений. Азотсодержащие соединения: 1. Нитросоединения (-NO 2 ) 2. Амины ( -NH 2) 3. Гетероатомные соединения одним или несколькими атомами азота в цикле

• • • НИТРОСОЕДИНЕНИЯ Нитросоединения – это производные углеводородов, содержащие одну или несколько нитро- групп –NO 2. Номенклатура нитросоединений такая же, как и у соответствующих углеводородов, с добавлением приставки «нитро» и указанием ее положения. Получают нитросоединения в основном прямым нитрованием алканов, циклоалканов или аренов (см. соответствующие разделы). Важнейшее химическое свойство нитросоединений – восстановление их в амины. Используют нитросоединения в качестве растворителей, в различных органических синтезах, но главным образом - для получения аминов.

А М И Н Ы. • Амины – это органические соединения, в молекулах которых содержится одна или несколько амино-групп. • Амины рассматриваются также как органические производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал. В зависимости от этого различают первичные, вторичные и третичные амины. • В химическом отношении амины являются органическими основаниями. • Наиболее известным и широко используемым является первичный ароматический амин анилин.
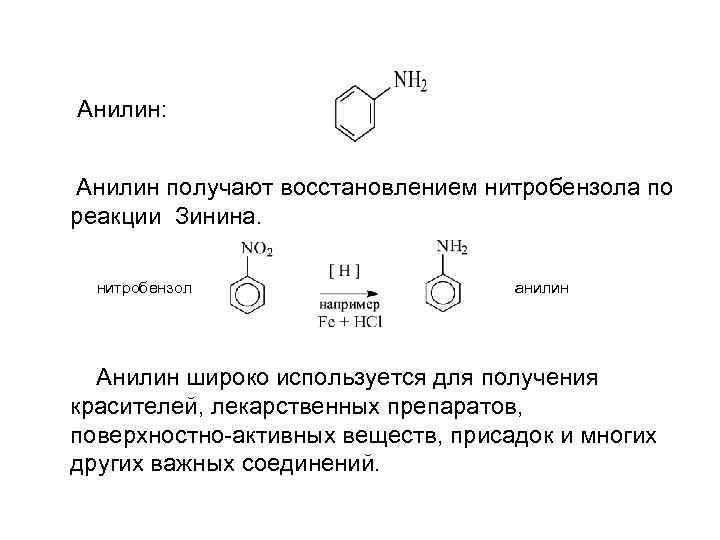
Анилин: Анилин получают восстановлением нитробензола по реакции Зинина. нитробензол анилин Анилин широко используется для получения красителей, лекарственных препаратов, поверхностно-активных веществ, присадок и многих других важных соединений.

ГЕТЕРОЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. • Наиболее известными азотсодержащими гетероциклами являются пятичленный гетероцикл пиррол и шестичленный гетероцикл пиридин. • Пиррол - это ароматическое соединение, нейтральное (или слабокислое) по химическим свойствам. • пиррол
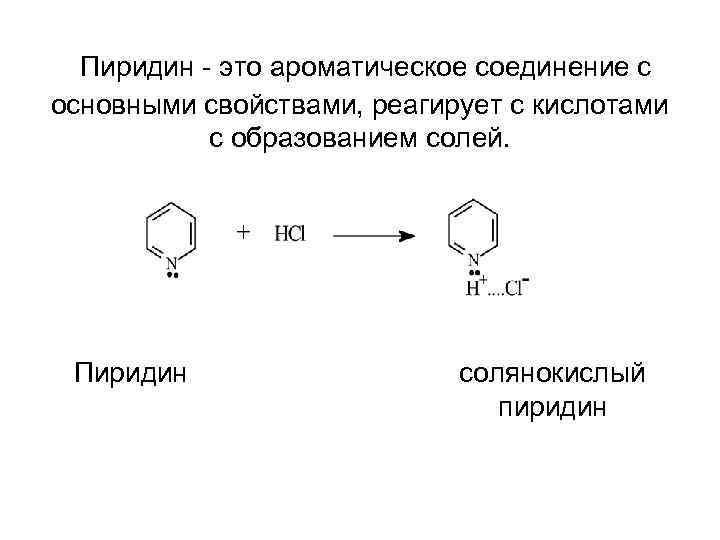
Пиридин - это ароматическое соединение с основными свойствами, реагирует с кислотами с образованием солей. Пиридин солянокислый пиридин

ГЕТЕРОАТОМНЫЕ С О Е Д И Н Е Н И Я Н Е Ф Т Е Й. Нефти состоят в основном из углеводородов, однако в небольших количествах в них содержатся и гетероатомные соединения. Кроме углерода и водорода, в нефтях содержатся также сера, кислород, азот, металлы и, в очень малых количествах, некоторые другие элементы, например галогены. 1. Серосодержащие соединения нефтей. В нефтях обычно содержится от 0, 05 до 3% серы. (Однако в некоторых нефтях общее содержание серы может доходить до 8%). Сернистые соединения крайне нежелательны, так как они токсичны и вызывают коррозию аппаратуры. В связи с этим к нефтям, поставляемым на нефтезаводы, а тем более на продажу за рубеж, предъявляются особые требования по содержанию в них серы.

В настоящее время в зависимости от массовой доли серы нефти в России подразделяют на следующие классы: Малосернистые - нефти, содержащие до 0, 6 % серы включительно Сернистые содержащие от 0, 61 до 1, 80 % серы Высокосернистые содержащие от 1, 81 до 3, 50 % серы Особо высокосернистые - содержащие свыше 3. 50 % серы. Основная масса серы содержится во фракциях топлив и масел (до 60%).

Основные типы сернистых соединений нефти: S - элементарная сера Н 2 S - сероводород, содержится в нефтях в растворенном состоянии или появляется в процессе термической переработки. R-S-H - меркаптаны, или тиоспирты. Соединения активные, похожи по химическим свойствам на спирты, имеют крайне неприятный запах, похожий на запах сероводорода, токсичнее сероводорода. R-S-R - сульфиды, или тиоэфиры R-S-S-R - дисульфиды производные тиофена
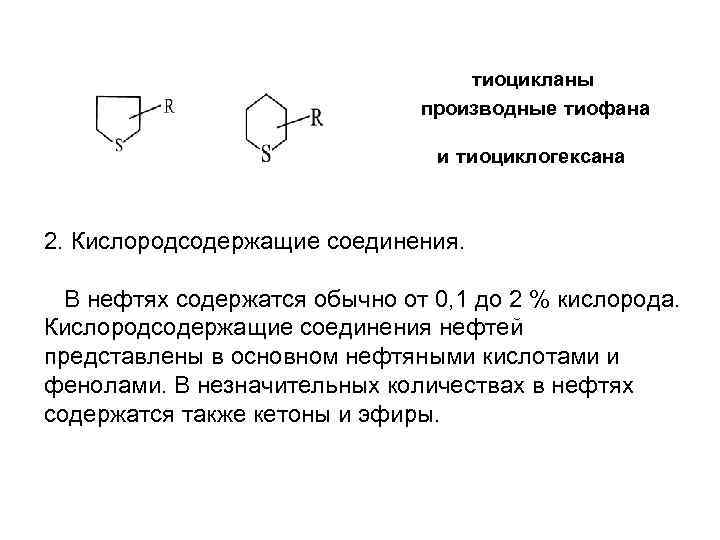
тиоцикланы производные тиофана и тиоциклогексана 2. Кислородсодержащие соединения. В нефтях содержатся обычно от 0, 1 до 2 % кислорода. Кислородсодержащие соединения нефтей представлены в основном нефтяными кислотами и фенолами. В незначительных количествах в нефтях содержатся также кетоны и эфиры.
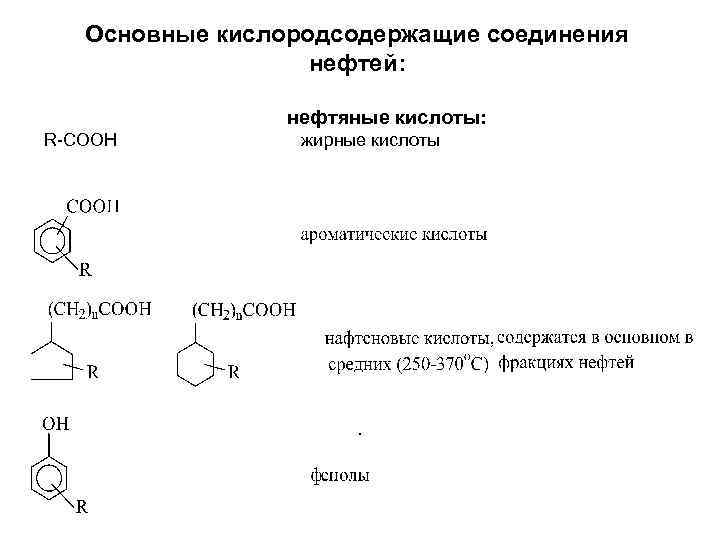
Основные кислородсодержащие соединения нефтей: нефтяные кислоты: R-СООН жирные кислоты .

Нефтяные кислоты и фенолы обладают слабыми кислотными свойствами. Разделить их можно по действию раствора соды. Кислоты реагируют с содой с образованием солей и последние растворяются в воде Фенолы имеют более слабые кислотные свойства, с содой не реагируют и в водном растворе соды растворяются плохо. • 3. Азотсодержащие соединения нефтей. В нефтях содержится от 0, 3 до 1, 5 % азота.
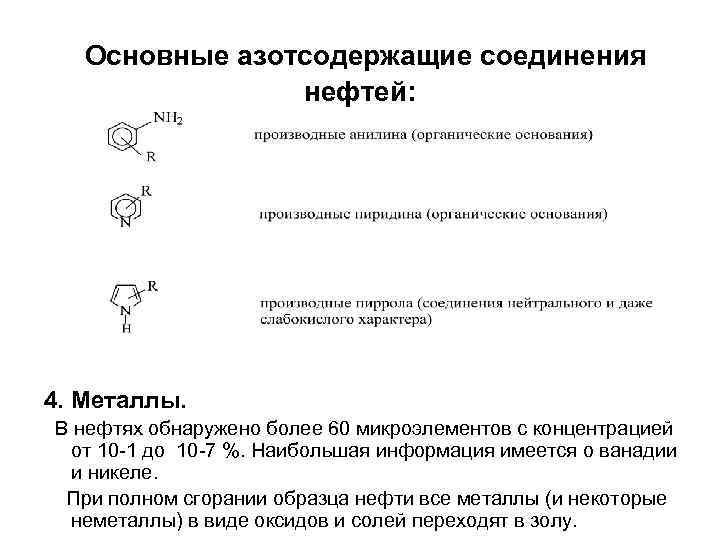
Основные азотсодержащие соединения нефтей: 4. Металлы. В нефтях обнаружено более 60 микроэлементов с концентрацией от 10 -1 до 10 -7 %. Наибольшая информация имеется о ванадии и никеле. При полном сгорании образца нефти все металлы (и некоторые неметаллы) в виде оксидов и солей переходят в золу.

5. Смолисто-асфальтовые вещества. Их получают в виде гудрона после отгонки легких, средних и масляных фракций нефти. Количество этих веществ в нефти может достигать 40 %. Основные типы смолисто-асфальтовых веществ: Асфальтены - высокомолекулярные вещества, не растворимые в легких алканах С 5 - С 6 Нейтральные смолы Асфальтогеновые кислоты - растворимы в растворах щелочей • Смолисто-асфальтовые вещества по структуре похожи на высокомолекулярные углеводороды смешанного строения, но содержащие в своем составе, помимо атомов углерода и водорода, значительные количества атомов и серы, и кислорода, и азота.
FEU-2012-Lektsia_8-9.ppt