Спирты. 2012 новая версия.pptx
- Количество слайдов: 42
 Кислородсодержащие органические соединения 1. Спирты 1
Кислородсодержащие органические соединения 1. Спирты 1
 *Спирты (от лат. spiritus — дух; устар. алкого ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H. * Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами. * По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007), в сотне самых важных химических соединений четыре позиции занимают спирты (холестерин, этанол, глицерин и метанол).
*Спирты (от лат. spiritus — дух; устар. алкого ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H. * Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами. * По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007), в сотне самых важных химических соединений четыре позиции занимают спирты (холестерин, этанол, глицерин и метанол).
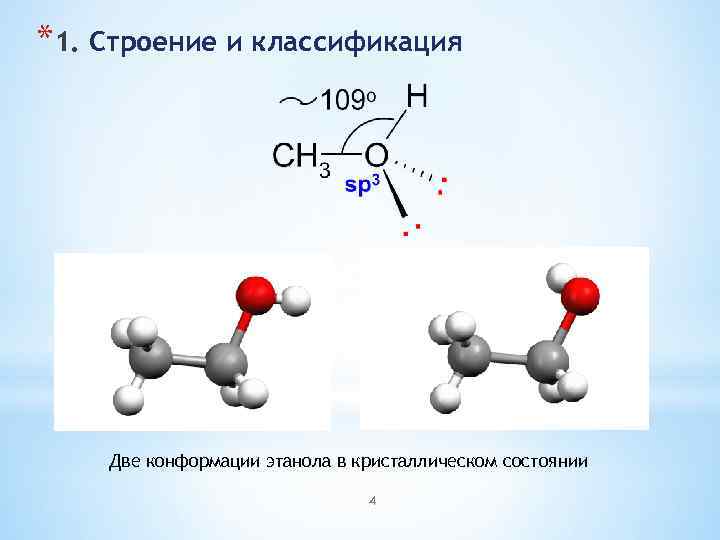 *1. Строение и классификация Две конформации этанола в кристаллическом состоянии 4
*1. Строение и классификация Две конформации этанола в кристаллическом состоянии 4
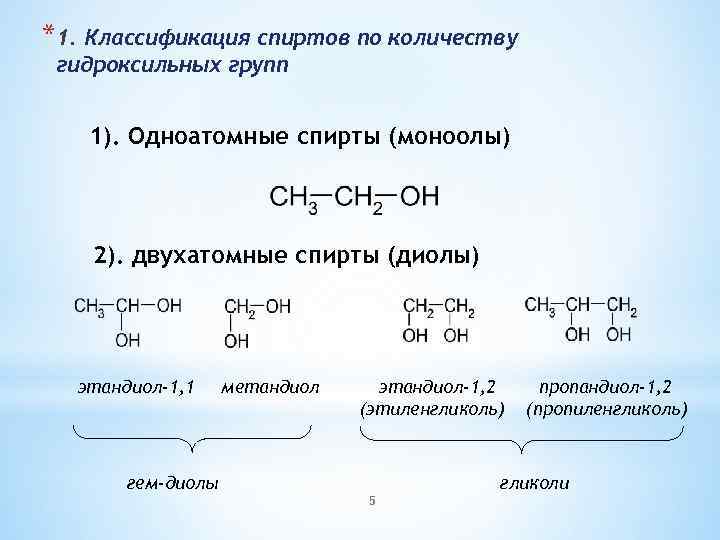 *1. Классификация спиртов по количеству гидроксильных групп 1). Одноатомные спирты (моноолы) 2). двухатомные спирты (диолы) этандиол-1, 1 метандиол этандиол-1, 2 (этиленгликоль) гем-диолы пропандиол-1, 2 (пропиленгликоль) гликоли 5
*1. Классификация спиртов по количеству гидроксильных групп 1). Одноатомные спирты (моноолы) 2). двухатомные спирты (диолы) этандиол-1, 1 метандиол этандиол-1, 2 (этиленгликоль) гем-диолы пропандиол-1, 2 (пропиленгликоль) гликоли 5
 3). Многоатомные спирты пропантриол-1, 2, 3 (глицерин) бутантетраол-1, 2, 3, 4 (эритрит) Четырехатомный спирт пэнтаэритрит 6
3). Многоатомные спирты пропантриол-1, 2, 3 (глицерин) бутантетраол-1, 2, 3, 4 (эритрит) Четырехатомный спирт пэнтаэритрит 6
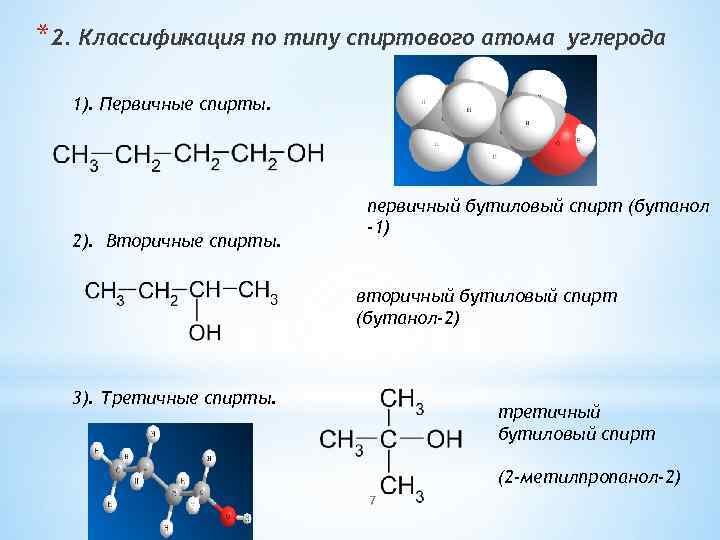 *2. Классификация по типу спиртового атома углерода 1). Первичные спирты. 2). Вторичные спирты. первичный бутиловый спирт (бутанол -1) вторичный бутиловый спирт (бутанол-2) 3). Третичные спирты. третичный бутиловый спирт (2 -метилпропанол-2) 7
*2. Классификация по типу спиртового атома углерода 1). Первичные спирты. 2). Вторичные спирты. первичный бутиловый спирт (бутанол -1) вторичный бутиловый спирт (бутанол-2) 3). Третичные спирты. третичный бутиловый спирт (2 -метилпропанол-2) 7
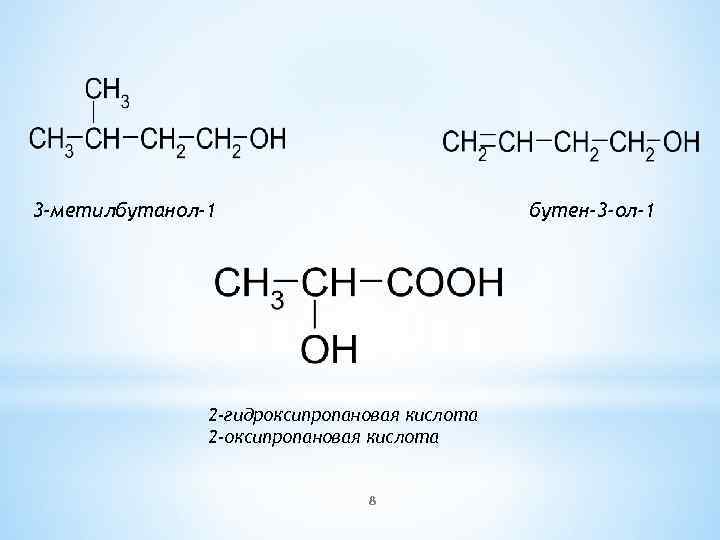 3 -метилбутанол-1 бутен-3 -ол-1 2 -гидроксипропановая кислота 2 -оксипропановая кислота 8
3 -метилбутанол-1 бутен-3 -ол-1 2 -гидроксипропановая кислота 2 -оксипропановая кислота 8
 Нахождение в природе * Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако и в свободном состоянии их можно встретить достаточно часто. Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum). Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводы, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Кроме того, этанол является естественным метаболитом и содержится в тканях и крови животных и человека.
Нахождение в природе * Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако и в свободном состоянии их можно встретить достаточно часто. Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum). Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводы, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Кроме того, этанол является естественным метаболитом и содержится в тканях и крови животных и человека.
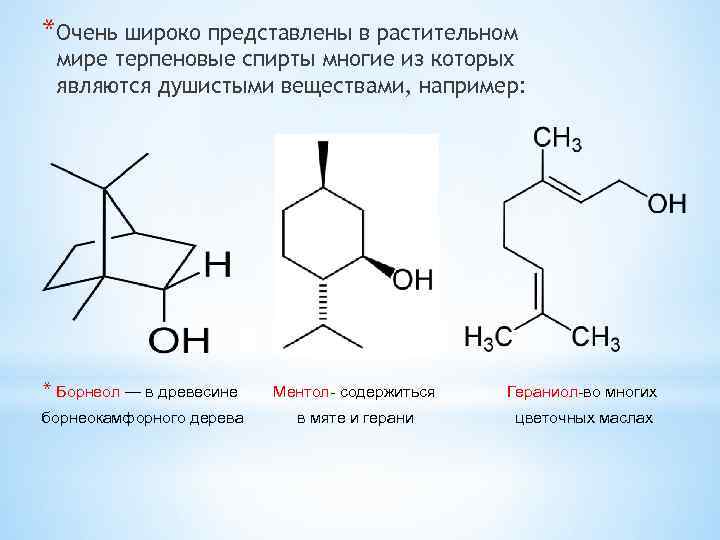 *Очень широко представлены в растительном мире терпеновые спирты многие из которых являются душистыми веществами, например: * Борнеол — в древесине Ментол- содержиться Гераниол-во многих борнеокамфорного дерева в мяте и герани цветочных маслах
*Очень широко представлены в растительном мире терпеновые спирты многие из которых являются душистыми веществами, например: * Борнеол — в древесине Ментол- содержиться Гераниол-во многих борнеокамфорного дерева в мяте и герани цветочных маслах
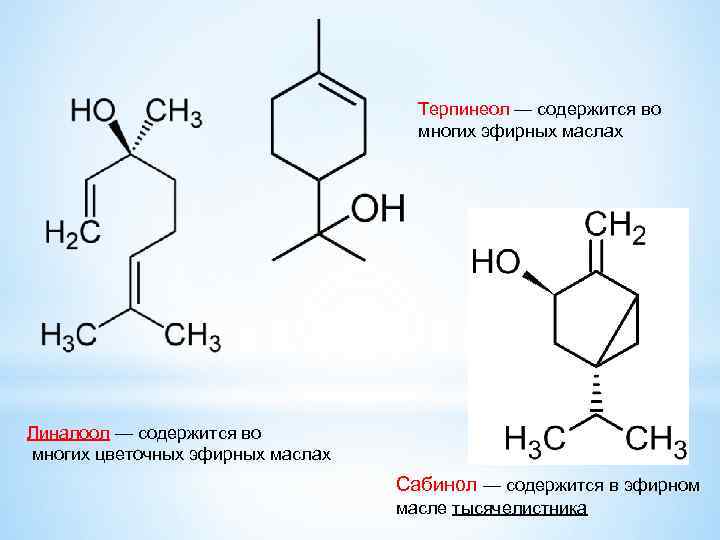 Терпинеол — содержится во многих эфирных маслах Линалоол — содержится во многих цветочных эфирных маслах Сабинол — содержится в эфирном масле тысячелистника
Терпинеол — содержится во многих эфирных маслах Линалоол — содержится во многих цветочных эфирных маслах Сабинол — содержится в эфирном масле тысячелистника
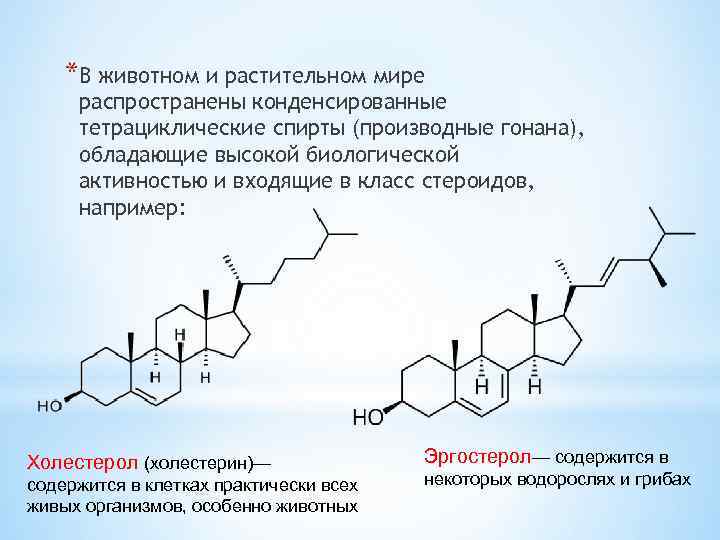 *В животном и растительном мире распространены конденсированные тетрациклические спирты (производные гонана), обладающие высокой биологической активностью и входящие в класс стероидов, например: Холестерол (холестерин)— содержится в клетках практически всех живых организмов, особенно животных Эргостерол— содержится в некоторых водорослях и грибах
*В животном и растительном мире распространены конденсированные тетрациклические спирты (производные гонана), обладающие высокой биологической активностью и входящие в класс стероидов, например: Холестерол (холестерин)— содержится в клетках практически всех живых организмов, особенно животных Эргостерол— содержится в некоторых водорослях и грибах
 *3. Изомерия 3. 1. Cтруктурная изомерия 3. 1. 1. Изомерия положения заместителей пентанол-1 пентанол-2 пентанол-3 3. 1. 2. Изомерия углеродного скелета бутанол-1 2 -метилпропанол-1 13
*3. Изомерия 3. 1. Cтруктурная изомерия 3. 1. 1. Изомерия положения заместителей пентанол-1 пентанол-2 пентанол-3 3. 1. 2. Изомерия углеродного скелета бутанол-1 2 -метилпропанол-1 13
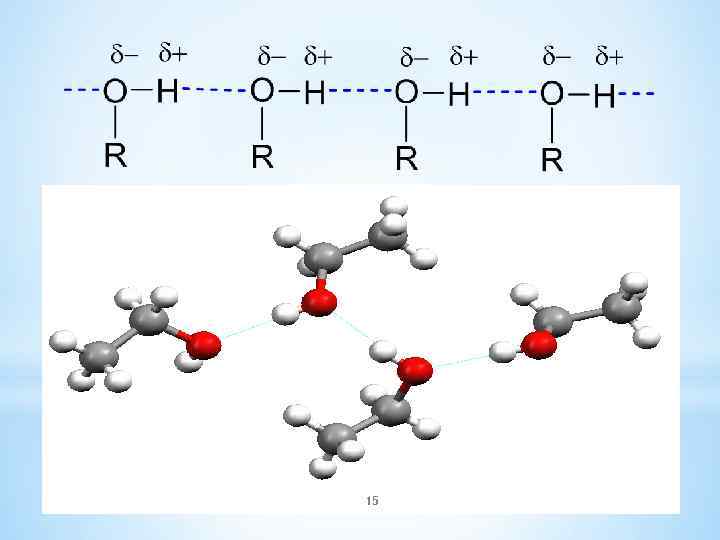
 *4. Физические и биологические свойства *Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях. *С увеличением количества атомов углерода спирты всё более начинают напоминать углеводороды. *Растворимость амилового спирта (пентанола-1) – 2, 7 г/ 100 мл, *растворимость октанола-1 – 0, 059 г/ 100 г. 14 13. 02. 2018
*4. Физические и биологические свойства *Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях. *С увеличением количества атомов углерода спирты всё более начинают напоминать углеводороды. *Растворимость амилового спирта (пентанола-1) – 2, 7 г/ 100 мл, *растворимость октанола-1 – 0, 059 г/ 100 г. 14 13. 02. 2018
 15
15
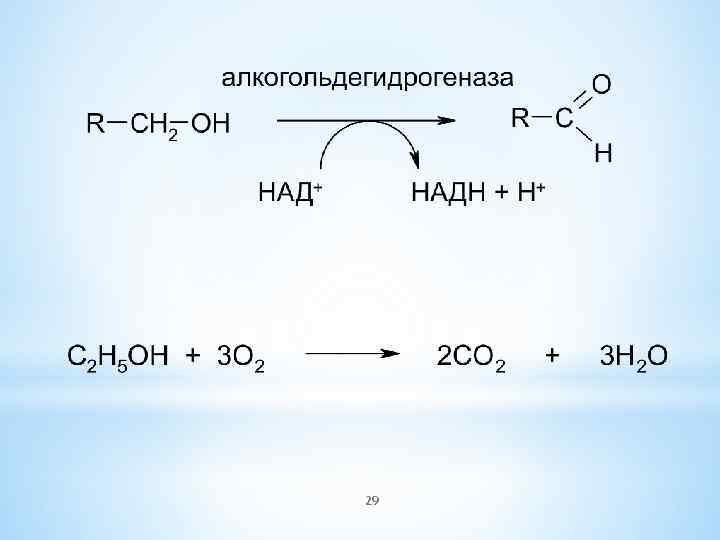
 * Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза, поражением сетчатки глаза и дистрофией зрительного нерва. * Летальная доза приёме внутрь — 100 мл (без предварительного приёма этанола). * Клиника интоксикации * Опьянение выражено слабо. Метиловый спирт обычно вызывает алкогольное оглушение без типичного опьянения. Далее наступает латентный период, который длится в среднем 12 -24 часа (от 1 часа до 40 часов). * С окончанием латентного периода усиливаются симптомы интоксикации — тошнота, рвота, боли в животе, головная боль, головокружение, боль в икроножных мышцах. Нарушается зрение (снижение остроты зрения, неясность видения, мелькание «мушек» перед глазами, диплопия, слепота); отмечаются мидриаз и ослабленная реакция зрачков на свет. * Сознание спутано, возможно психомоторное возбуждение или кома, судороги или гипертонус мышц конечностей. Развивается быстропрогрессирующая острая сердечно-сосудистая недостаточность в сочетании с центральными нарушениями дыхания. Смерть наступает от остановки дыхания, отёка мозга. 16
* Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза, поражением сетчатки глаза и дистрофией зрительного нерва. * Летальная доза приёме внутрь — 100 мл (без предварительного приёма этанола). * Клиника интоксикации * Опьянение выражено слабо. Метиловый спирт обычно вызывает алкогольное оглушение без типичного опьянения. Далее наступает латентный период, который длится в среднем 12 -24 часа (от 1 часа до 40 часов). * С окончанием латентного периода усиливаются симптомы интоксикации — тошнота, рвота, боли в животе, головная боль, головокружение, боль в икроножных мышцах. Нарушается зрение (снижение остроты зрения, неясность видения, мелькание «мушек» перед глазами, диплопия, слепота); отмечаются мидриаз и ослабленная реакция зрачков на свет. * Сознание спутано, возможно психомоторное возбуждение или кома, судороги или гипертонус мышц конечностей. Развивается быстропрогрессирующая острая сердечно-сосудистая недостаточность в сочетании с центральными нарушениями дыхания. Смерть наступает от остановки дыхания, отёка мозга. 16
 *Этиловый спирт оказывает опьяняющее действие. “вино веселит сердце человека” (Псалом 103: 15) *В высоких концентрациях этанол оказывает анестезирующее действие. *Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности психическим расстройствам и соматическим заболеваниям. 17
*Этиловый спирт оказывает опьяняющее действие. “вино веселит сердце человека” (Псалом 103: 15) *В высоких концентрациях этанол оказывает анестезирующее действие. *Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности психическим расстройствам и соматическим заболеваниям. 17
 *Кислотные свойства спиртов Спирты подобно воде способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты способны диссоциировать по связи O−H с образованием алкоксид-иона: Кислотные характеристики спиртов оценивают по константе кислотности : В водном растворе кислотные свойства спиртов снижаются с увеличением молекулярной массы и разветвлённости углеводородной цепи: CH 3 OH > CH 3 CH 2 CH 2 OH > (CH 3)2 CHOH > (CH 3)3 COHВ газообразной фазе наблюдается обратный эффект (это связано с образованием межмолекулярной водородной связи в растворе и конденсированном состоянии): CH 3 OH < CH 3 CH 2 CH 2 OH < (CH 3)2 CHOH < (CH 3)3 COH
*Кислотные свойства спиртов Спирты подобно воде способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты способны диссоциировать по связи O−H с образованием алкоксид-иона: Кислотные характеристики спиртов оценивают по константе кислотности : В водном растворе кислотные свойства спиртов снижаются с увеличением молекулярной массы и разветвлённости углеводородной цепи: CH 3 OH > CH 3 CH 2 CH 2 OH > (CH 3)2 CHOH > (CH 3)3 COHВ газообразной фазе наблюдается обратный эффект (это связано с образованием межмолекулярной водородной связи в растворе и конденсированном состоянии): CH 3 OH < CH 3 CH 2 CH 2 OH < (CH 3)2 CHOH < (CH 3)3 COH
 *Химические свойства спиртов *Кислотные свойства спиртов этоксид натрия 19
*Химические свойства спиртов *Кислотные свойства спиртов этоксид натрия 19
 *Осно вные свойства спиртов Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы скислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды. Спирты довольно слабые основания и их относительная основность, в отличие от кислотности, сохраняется как в растворе, так и газовой фазе: CH 3 OH < CH 3 CH 2 CH 2 OH < (CH 3)2 CHOH < (CH 3)3 COH
*Осно вные свойства спиртов Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы скислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды. Спирты довольно слабые основания и их относительная основность, в отличие от кислотности, сохраняется как в растворе, так и газовой фазе: CH 3 OH < CH 3 CH 2 CH 2 OH < (CH 3)2 CHOH < (CH 3)3 COH
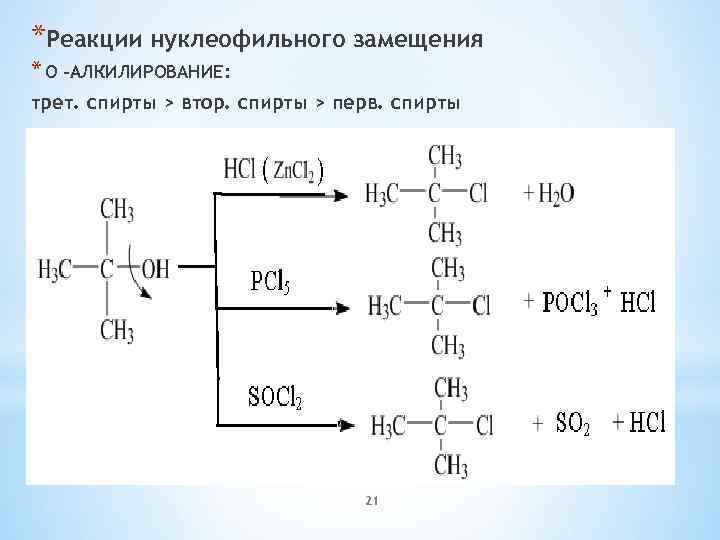 *Реакции нуклеофильного замещения * О –АЛКИЛИРОВАНИЕ: трет. спирты > втор. спирты > перв. спирты 21
*Реакции нуклеофильного замещения * О –АЛКИЛИРОВАНИЕ: трет. спирты > втор. спирты > перв. спирты 21
 О – ацилирование: *Реакция с органическими кислотами (реакция этерификации) *втор. спирты > перв. спирты > трет. спирты > фенолы уксусная кислота этанол этилацетат 22
О – ацилирование: *Реакция с органическими кислотами (реакция этерификации) *втор. спирты > перв. спирты > трет. спирты > фенолы уксусная кислота этанол этилацетат 22
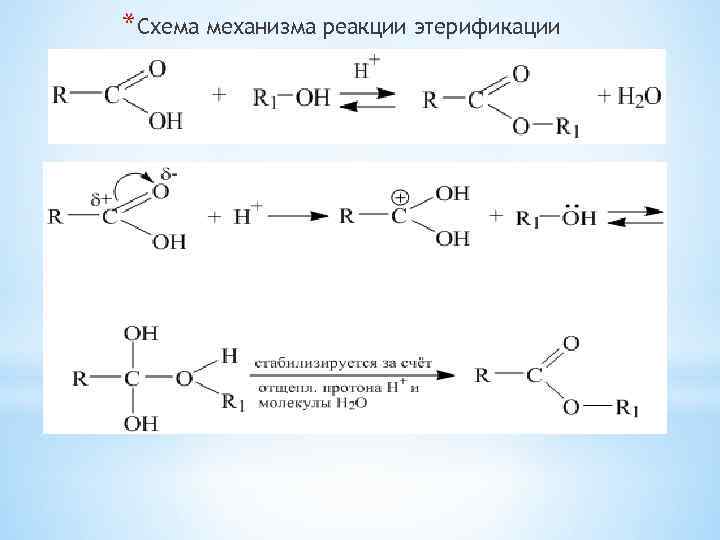 *Схема механизма реакции этерификации
*Схема механизма реакции этерификации
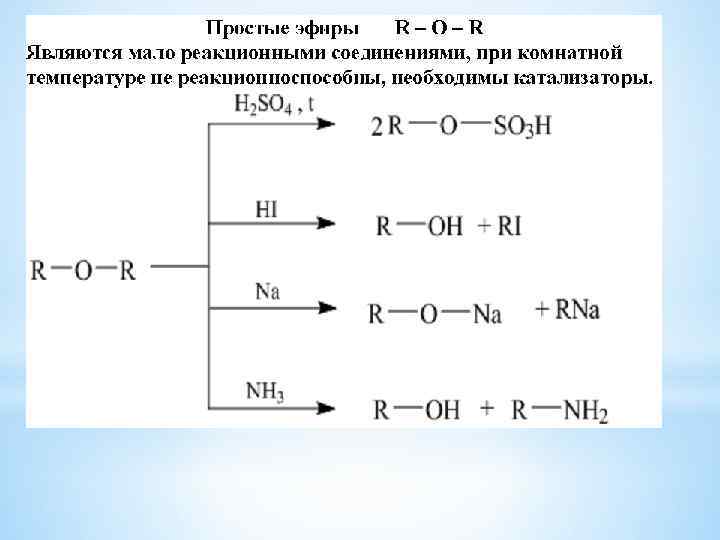
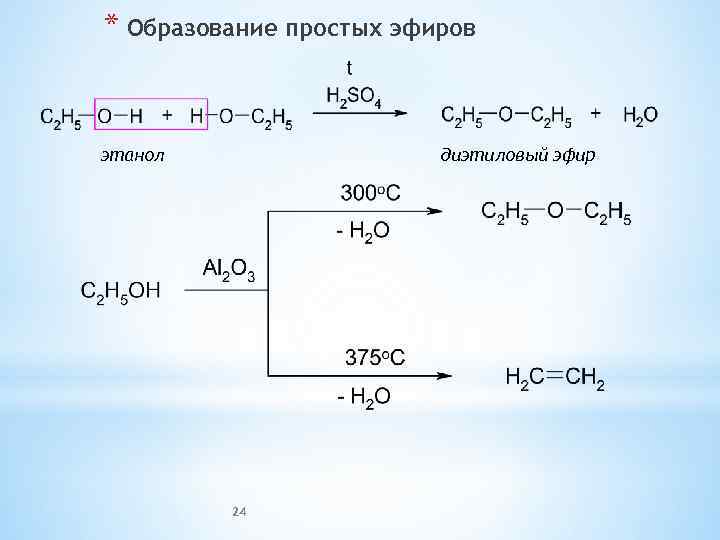 * Образование простых эфиров этанол диэтиловый эфир 24
* Образование простых эфиров этанол диэтиловый эфир 24
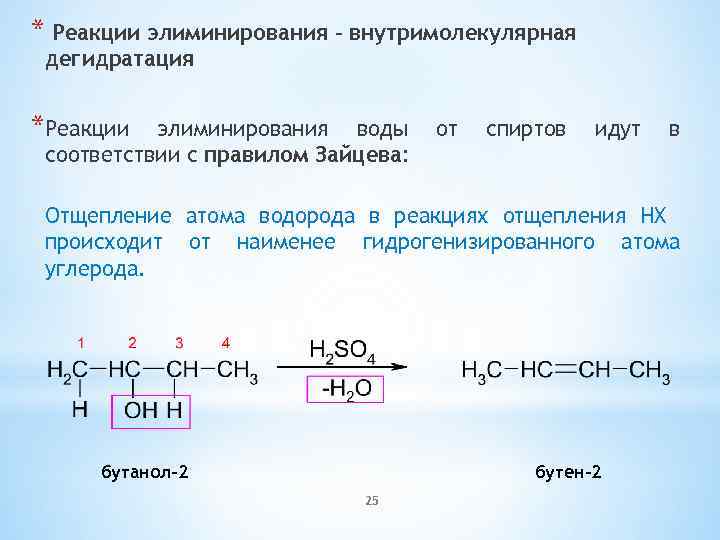 * Реакции элиминирования – внутримолекулярная дегидратация *Реакции элиминирования воды соответствии с правилом Зайцева: от спиртов идут в Отщепление атома водорода в реакциях отщепления HX происходит от наименее гидрогенизированного атома углерода. бутанол-2 бутен-2 25
* Реакции элиминирования – внутримолекулярная дегидратация *Реакции элиминирования воды соответствии с правилом Зайцева: от спиртов идут в Отщепление атома водорода в реакциях отщепления HX происходит от наименее гидрогенизированного атома углерода. бутанол-2 бутен-2 25
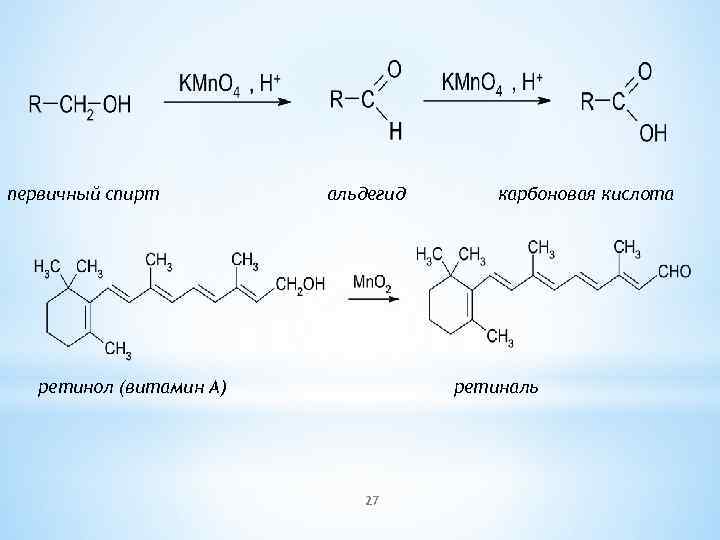 первичный спирт альдегид ретинол (витамин А) карбоновая кислота ретиналь 27
первичный спирт альдегид ретинол (витамин А) карбоновая кислота ретиналь 27
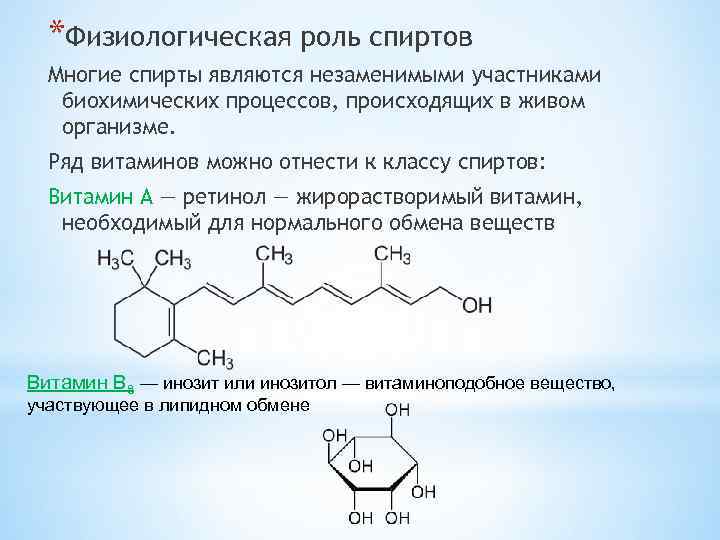 *Физиологическая роль спиртов Многие спирты являются незаменимыми участниками биохимических процессов, происходящих в живом организме. Ряд витаминов можно отнести к классу спиртов: Витамин А — ретинол — жирорастворимый витамин, необходимый для нормального обмена веществ Витамин B 8 — инозит или инозитол — витаминоподобное вещество, участвующее в липидном обмене
*Физиологическая роль спиртов Многие спирты являются незаменимыми участниками биохимических процессов, происходящих в живом организме. Ряд витаминов можно отнести к классу спиртов: Витамин А — ретинол — жирорастворимый витамин, необходимый для нормального обмена веществ Витамин B 8 — инозит или инозитол — витаминоподобное вещество, участвующее в липидном обмене
 29
29
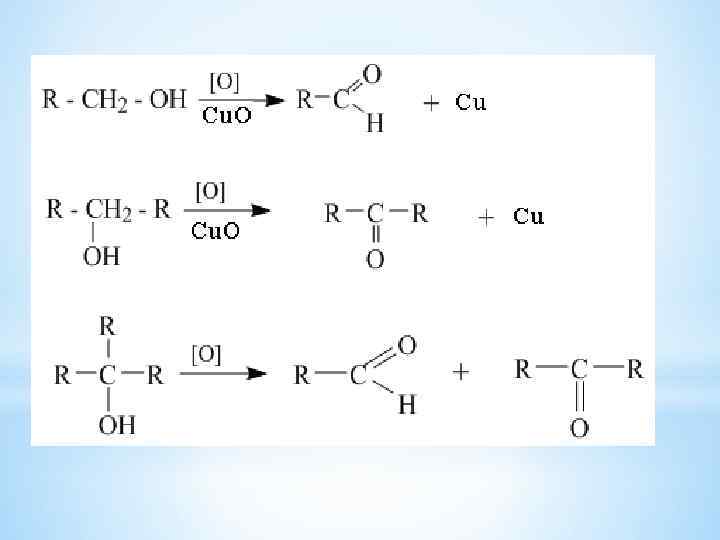
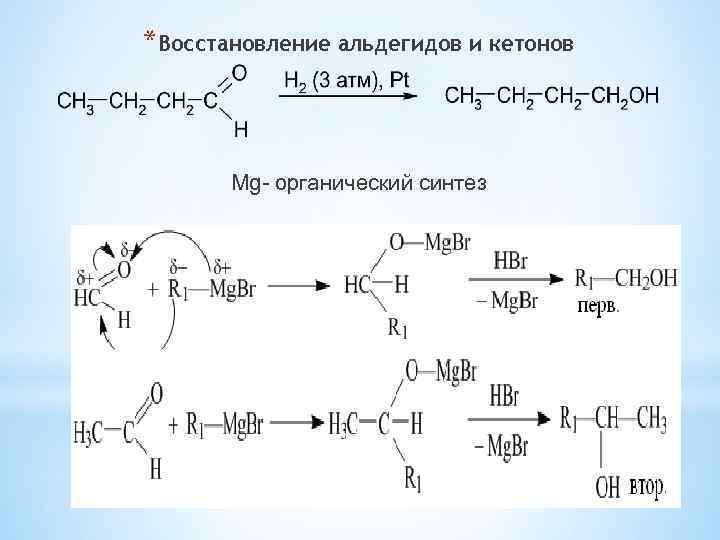 *Восстановление альдегидов и кетонов Мg- органический синтез 30
*Восстановление альдегидов и кетонов Мg- органический синтез 30
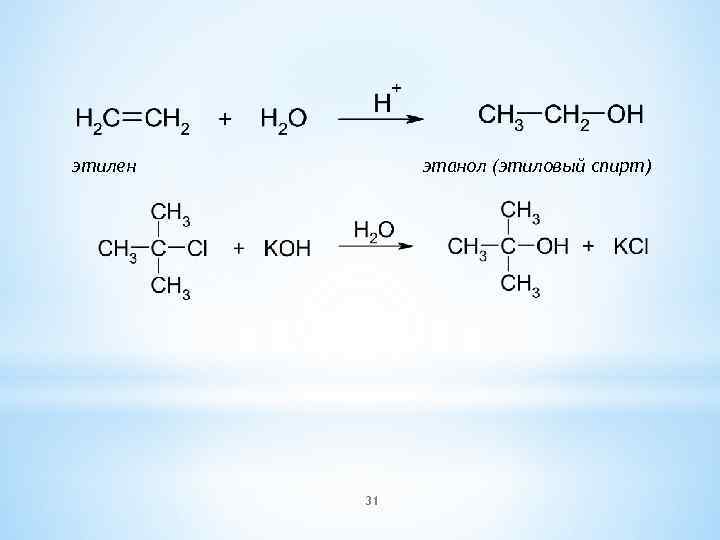 этилен этанол (этиловый спирт) 31
этилен этанол (этиловый спирт) 31
 *МНОГОАТОМНЫЕ СПИРТЫ *1. Изомерия и номенклатура этиленгликоль глицерин 32 эритрит
*МНОГОАТОМНЫЕ СПИРТЫ *1. Изомерия и номенклатура этиленгликоль глицерин 32 эритрит
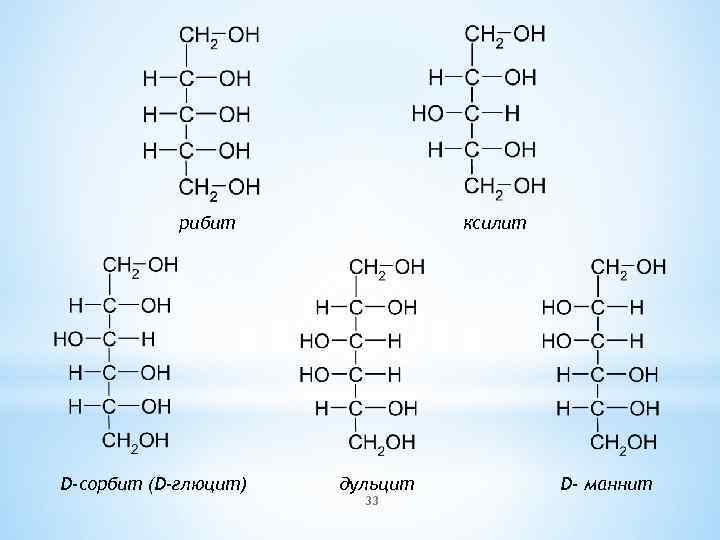 рибит D-сорбит (D-глюцит) ксилит дульцит 33 D- маннит
рибит D-сорбит (D-глюцит) ксилит дульцит 33 D- маннит
 *2. Физические и биологические свойства * Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую жидкость. Многоатомные спирты с количеством гидроксигрупп больше трёх являются твёрдыми телами. * Многоатомные спирты прекрасно растворяются в воде. Это обусловлено наличием нескольких полярных групп OH. Водные растворы этиленгликоля не замерзают при очень низкой температуре, поэтому используются как антифризы, которые используются в системах охлаждения двигателей внутреннего сгорания. * Почти все многоатомные спирты обладают сладким вкусом. Поэтому ксилит и сорбит используются в питании больных диабетом. 34
*2. Физические и биологические свойства * Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую жидкость. Многоатомные спирты с количеством гидроксигрупп больше трёх являются твёрдыми телами. * Многоатомные спирты прекрасно растворяются в воде. Это обусловлено наличием нескольких полярных групп OH. Водные растворы этиленгликоля не замерзают при очень низкой температуре, поэтому используются как антифризы, которые используются в системах охлаждения двигателей внутреннего сгорания. * Почти все многоатомные спирты обладают сладким вкусом. Поэтому ксилит и сорбит используются в питании больных диабетом. 34
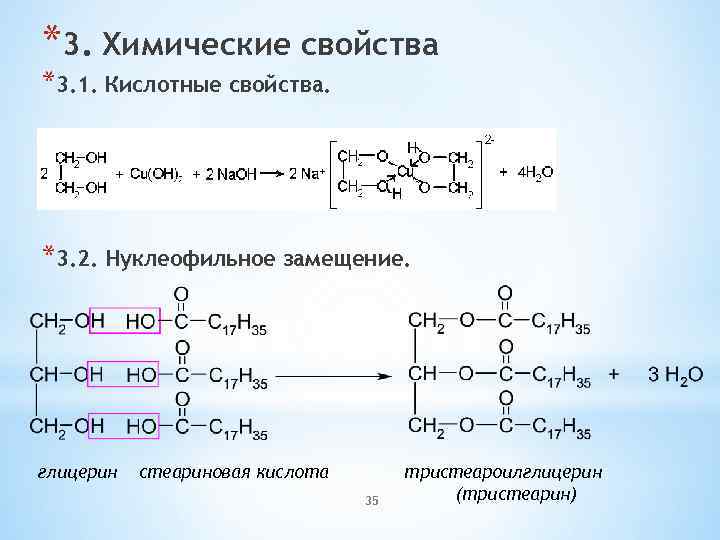 *3. Химические свойства *3. 1. Кислотные свойства. *3. 2. Нуклеофильное замещение. глицерин стеариновая кислота 35 тристеароилглицерин (тристеарин)
*3. Химические свойства *3. 1. Кислотные свойства. *3. 2. Нуклеофильное замещение. глицерин стеариновая кислота 35 тристеароилглицерин (тристеарин)
 Нитроглицерин используется во взрывчатых веществах динамитах и бездымных порохах - баллиститах. Динамит и баллистит были изобретены А. Нобелем в 1867 и 1888 годах. В медицине нитроглицерин используется как сосудорасширяющее средство, используется приступах стенокардии. 36 А. Нобель (1833 – 1896)
Нитроглицерин используется во взрывчатых веществах динамитах и бездымных порохах - баллиститах. Динамит и баллистит были изобретены А. Нобелем в 1867 и 1888 годах. В медицине нитроглицерин используется как сосудорасширяющее средство, используется приступах стенокардии. 36 А. Нобель (1833 – 1896)
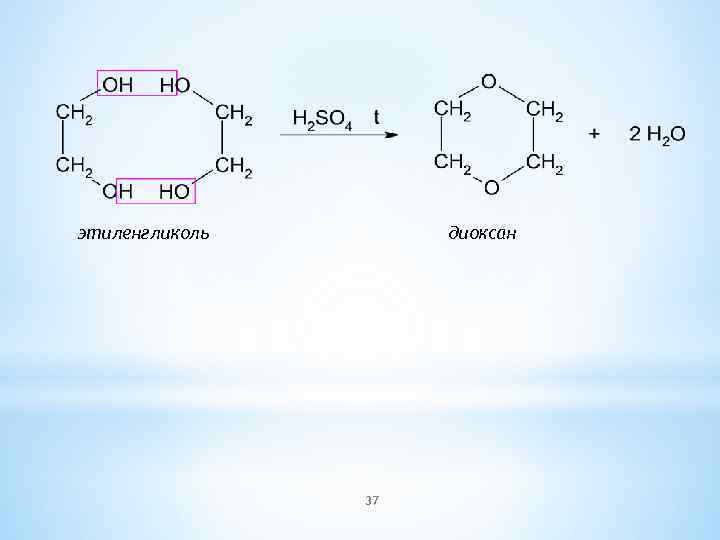 этиленгликоль диоксан 37
этиленгликоль диоксан 37
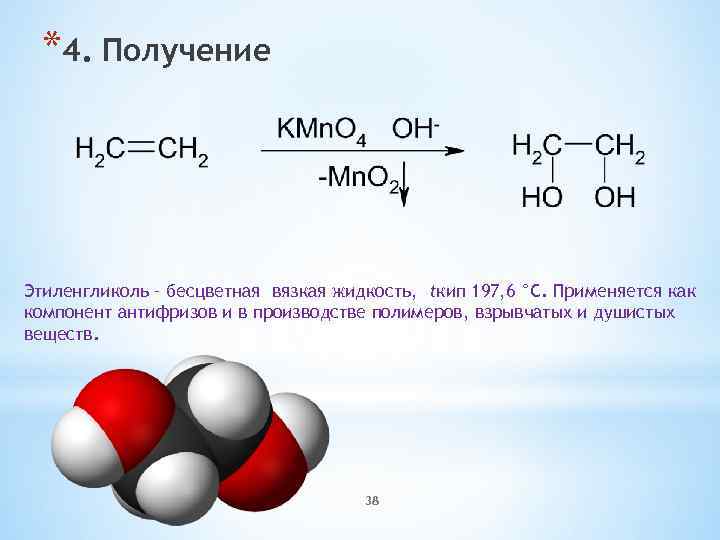 *4. Получение Этиленгликоль – бесцветная вязкая жидкость, tкип 197, 6 °С. Применяется как компонент антифризов и в производстве полимеров, взрывчатых и душистых веществ. 38
*4. Получение Этиленгликоль – бесцветная вязкая жидкость, tкип 197, 6 °С. Применяется как компонент антифризов и в производстве полимеров, взрывчатых и душистых веществ. 38
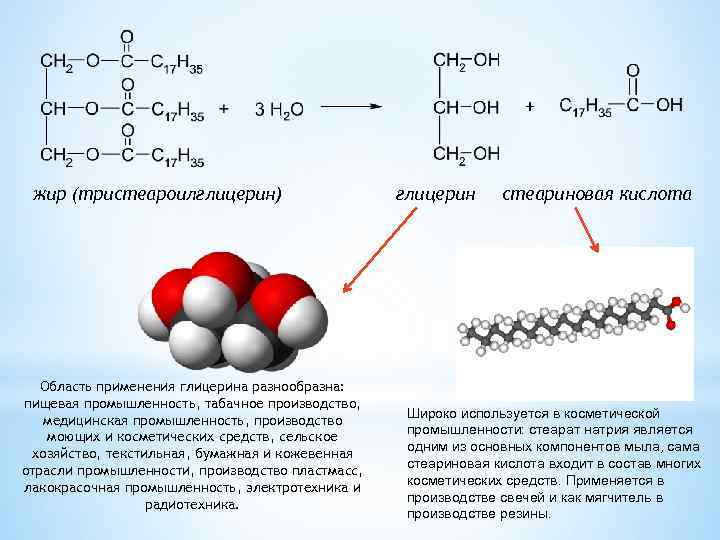 жир (тристеароилглицерин) Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника. глицерин стеариновая кислота Широко используется в косметической промышленности: стеарат натрия является одним из основных компонентов мыла, сама стеариновая кислота входит в состав многих косметических средств. Применяется в производстве свечей и как мягчитель в производстве резины.
жир (тристеароилглицерин) Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника. глицерин стеариновая кислота Широко используется в косметической промышленности: стеарат натрия является одним из основных компонентов мыла, сама стеариновая кислота входит в состав многих косметических средств. Применяется в производстве свечей и как мягчитель в производстве резины.
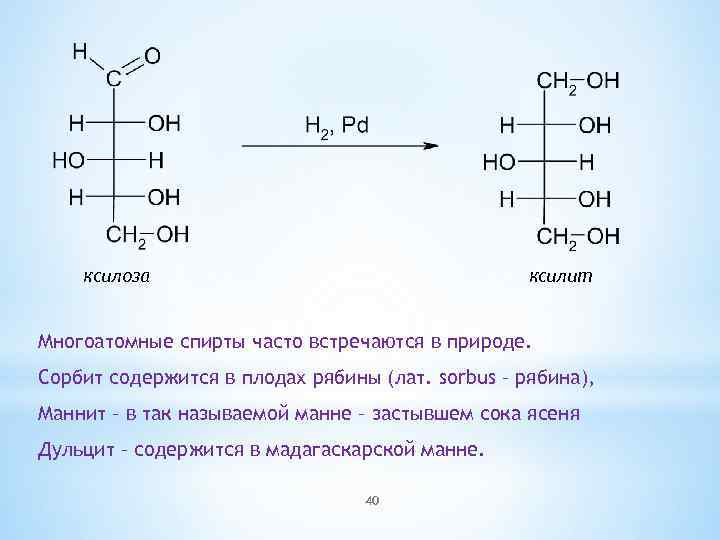 ксилоза ксилит Многоатомные спирты часто встречаются в природе. Сорбит содержится в плодах рябины (лат. sorbus – рябина), Маннит – в так называемой манне – застывшем сока ясеня Дульцит – содержится в мадагаскарской манне. 40
ксилоза ксилит Многоатомные спирты часто встречаются в природе. Сорбит содержится в плодах рябины (лат. sorbus – рябина), Маннит – в так называемой манне – застывшем сока ясеня Дульцит – содержится в мадагаскарской манне. 40