галогены-4.pptx
- Количество слайдов: 16
 Кислородные соединения хлора Оксиды, кислоты, соли
Кислородные соединения хлора Оксиды, кислоты, соли
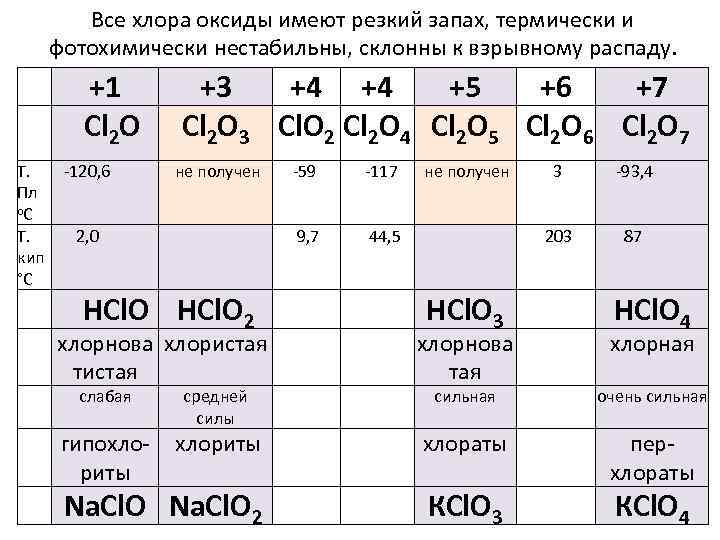 Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. +1 Сl 2 О Т. Пл о. С Т. кип °С -120, 6 +3 +4 +4 +5 +6 +7 Сl 2 О 3 Сl. O 2 Сl 2 O 4 Сl 2 O 5 Сl 2 O 6 Сl 2 O 7 не получен НСl. О 2 -117 9, 7 2, 0 -59 не получен 44, 5 -93, 4 203 НСl. О 3 3 87 НСl. О 4 хлорнова хлористая тистая хлорнова тая сильная очень сильная гипохлориты хлораты Na. Cl. O 2 КСl. О 3 перхлораты слабая средней силы хлорная КСl. О 4
Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. +1 Сl 2 О Т. Пл о. С Т. кип °С -120, 6 +3 +4 +4 +5 +6 +7 Сl 2 О 3 Сl. O 2 Сl 2 O 4 Сl 2 O 5 Сl 2 O 6 Сl 2 O 7 не получен НСl. О 2 -117 9, 7 2, 0 -59 не получен 44, 5 -93, 4 203 НСl. О 3 3 87 НСl. О 4 хлорнова хлористая тистая хлорнова тая сильная очень сильная гипохлориты хлораты Na. Cl. O 2 КСl. О 3 перхлораты слабая средней силы хлорная КСl. О 4
 § Все соединениям с хлором в положительных степенях являются очень сильными окислителями. § Наиболее сильно окислительные свойства выражены у хлорноватистой кислоты, хотя она слабая и неустойчивая. § Свободные кислородсодержащие кислоты хлора неустойчивы и, кроме хлорной кислоты, существуют только в растворе. Все они являются сильными окислителями. § Сила кислот и их окислительные свойства различные понятия. § В ряду HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 устойчивость и сила кислот растет, а реакционная способность уменьшается.
§ Все соединениям с хлором в положительных степенях являются очень сильными окислителями. § Наиболее сильно окислительные свойства выражены у хлорноватистой кислоты, хотя она слабая и неустойчивая. § Свободные кислородсодержащие кислоты хлора неустойчивы и, кроме хлорной кислоты, существуют только в растворе. Все они являются сильными окислителями. § Сила кислот и их окислительные свойства различные понятия. § В ряду HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 устойчивость и сила кислот растет, а реакционная способность уменьшается.
 Отношение галогенов к воде ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие , F 2 − окислитель, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие , Cl 20 − окислитель, восстановитель; реакция – диспропорционирования, ü Br 20 + H 2 O ↔ HBr +1 O + HBr − 1 хорошо растворим, взаимодействия практически не происходит; Br 20 − окислитель, восстановитель; реакция – диспропорционирования, ü I 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит; ü At 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит
Отношение галогенов к воде ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие , F 2 − окислитель, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие , Cl 20 − окислитель, восстановитель; реакция – диспропорционирования, ü Br 20 + H 2 O ↔ HBr +1 O + HBr − 1 хорошо растворим, взаимодействия практически не происходит; Br 20 − окислитель, восстановитель; реакция – диспропорционирования, ü I 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит; ü At 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит
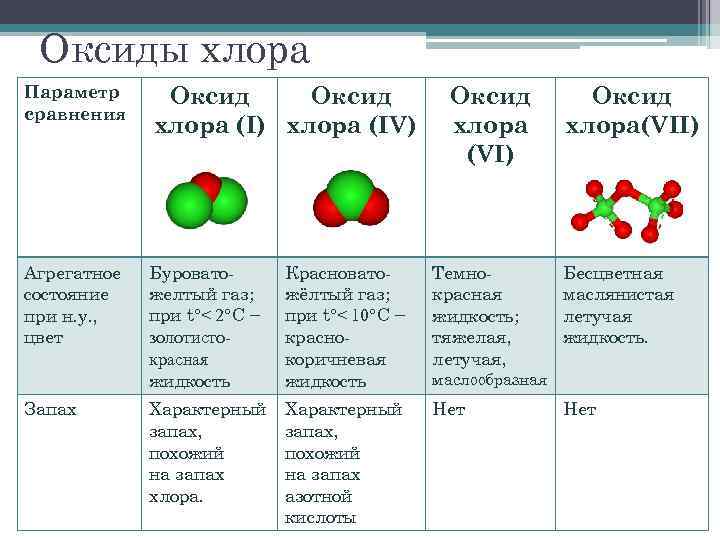 Оксиды хлора Параметр сравнения Оксид хлора (I) хлора (IV) Агрегатное состояние при н. у. , цвет Буроватожелтый газ; при t°< 2°C − золотистокрасная жидкость Красноватожёлтый газ; при t°< 10°C − краснокоричневая жидкость Темнокрасная жидкость; тяжелая, летучая, Характерный запах, похожий на запах хлора. Характерный запах, похожий на запах азотной кислоты Нет Запах Оксид хлора (VI) Оксид хлора(VII) Бесцветная маслянистая летучая жидкость. маслообразная Нет
Оксиды хлора Параметр сравнения Оксид хлора (I) хлора (IV) Агрегатное состояние при н. у. , цвет Буроватожелтый газ; при t°< 2°C − золотистокрасная жидкость Красноватожёлтый газ; при t°< 10°C − краснокоричневая жидкость Темнокрасная жидкость; тяжелая, летучая, Характерный запах, похожий на запах хлора. Характерный запах, похожий на запах азотной кислоты Нет Запах Оксид хлора (VI) Оксид хлора(VII) Бесцветная маслянистая летучая жидкость. маслообразная Нет
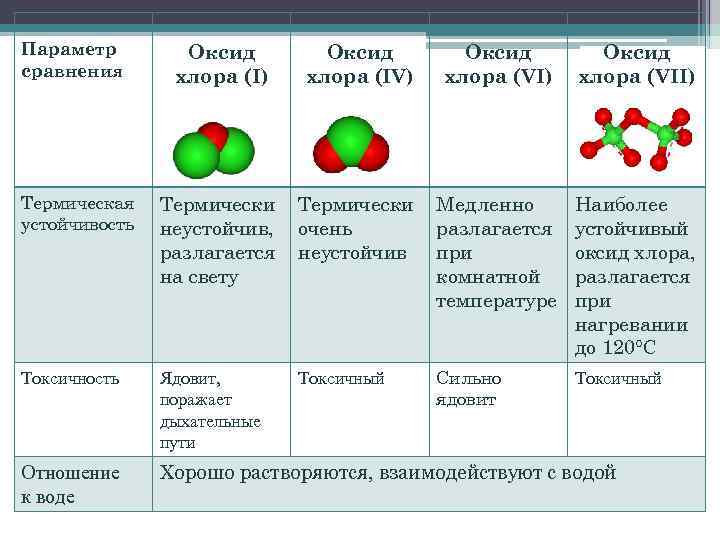 Параметр сравнения Оксид хлора (I) Оксид хлора (IV) Оксид хлора (VII) Термическая устойчивость Термически неустойчив, разлагается на свету Термически очень неустойчив Медленно разлагается при комнатной температуре Наиболее устойчивый оксид хлора, разлагается при нагревании до 120°С Токсичность Ядовит, поражает дыхательные пути Токсичный Сильно ядовит Токсичный Отношение к воде Хорошо растворяются, взаимодействуют с водой
Параметр сравнения Оксид хлора (I) Оксид хлора (IV) Оксид хлора (VII) Термическая устойчивость Термически неустойчив, разлагается на свету Термически очень неустойчив Медленно разлагается при комнатной температуре Наиболее устойчивый оксид хлора, разлагается при нагревании до 120°С Токсичность Ядовит, поражает дыхательные пути Токсичный Сильно ядовит Токсичный Отношение к воде Хорошо растворяются, взаимодействуют с водой
 Методы получения оксидов хлора Оксид хлора Название метода, УХР Оксид хлора (I) Взаимодействие оксида ртути (II) c хлором при 0°С: Hg. O(твердый) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O↑ Оксид хлора (IV) 1) Взаимодействие хлората калия со щавелевой кислотой: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2↑ + CO 2↑ + H 2 O (лабораторный метод); 2) Пропускание сернистого газа SO 2 в подкисленный раствор хлората натрия: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2↑ (промышленный метод) Оксид хлора (VI) Окисление оксида хлора (IV) озоном: 2 Cl. O 2+2 O 3 = 2 O 2 + Cl 2 O 6 Оксид хлора (VII) Взаимодействие хлорной кислоты с фосфорным ангидридом – оксидом фосфора (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
Методы получения оксидов хлора Оксид хлора Название метода, УХР Оксид хлора (I) Взаимодействие оксида ртути (II) c хлором при 0°С: Hg. O(твердый) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O↑ Оксид хлора (IV) 1) Взаимодействие хлората калия со щавелевой кислотой: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2↑ + CO 2↑ + H 2 O (лабораторный метод); 2) Пропускание сернистого газа SO 2 в подкисленный раствор хлората натрия: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2↑ (промышленный метод) Оксид хлора (VI) Окисление оксида хлора (IV) озоном: 2 Cl. O 2+2 O 3 = 2 O 2 + Cl 2 O 6 Оксид хлора (VII) Взаимодействие хлорной кислоты с фосфорным ангидридом – оксидом фосфора (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
 Химические свойства оксидов хлора • Cl 2 O – оксид хлора (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не ОВР, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не ОВР, • Cl. O 2 – оксид хлора (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ОВР, Cl+4 – и восстановитель, и окислитель 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ОВР, Cl+4 – и восстановитель, и окислитель • Cl 2 O 6 – оксид хлора (VI) Cl 2+6 O 6 + H 2 O = HCl+5 O 3 + HCl+7 O 4 ОВР, Cl+6 – и восстановитель, и окислитель Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ОВР, Cl+6 – и восстановитель, и окислитель • Cl 2 O 7 – оксид хлора (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не ОВР, а Cl 2+7 O 7 + 2 KOH = 2 KCl+7 O 4 + H 2 O не ОВР,
Химические свойства оксидов хлора • Cl 2 O – оксид хлора (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не ОВР, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не ОВР, • Cl. O 2 – оксид хлора (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ОВР, Cl+4 – и восстановитель, и окислитель 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ОВР, Cl+4 – и восстановитель, и окислитель • Cl 2 O 6 – оксид хлора (VI) Cl 2+6 O 6 + H 2 O = HCl+5 O 3 + HCl+7 O 4 ОВР, Cl+6 – и восстановитель, и окислитель Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ОВР, Cl+6 – и восстановитель, и окислитель • Cl 2 O 7 – оксид хлора (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не ОВР, а Cl 2+7 O 7 + 2 KOH = 2 KCl+7 O 4 + H 2 O не ОВР,
 Кислородсодержащие кислоты хлора Физические свойства, методы получения Химические свойства– отношение к нагреванию, растворам щелочей и к основным оксидам
Кислородсодержащие кислоты хлора Физические свойства, методы получения Химические свойства– отношение к нагреванию, растворам щелочей и к основным оксидам
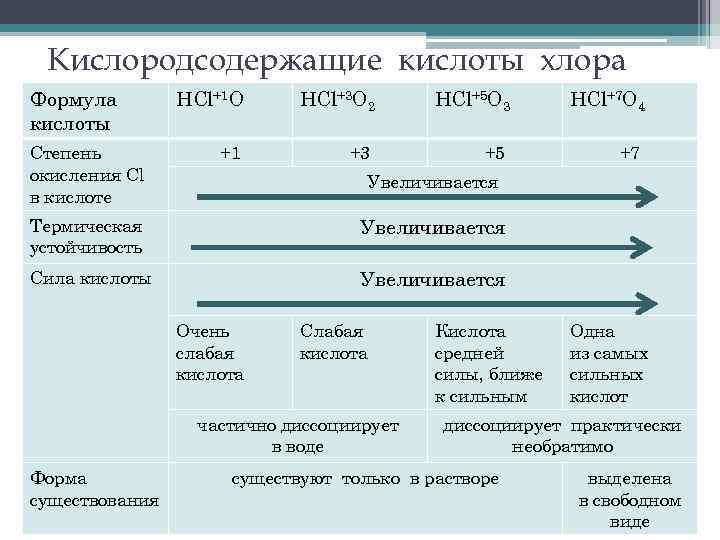 Кислородсодержащие кислоты хлора Формула кислоты Степень окисления Cl в кислоте НСl+1 О НCl+3 O 2 НCl+5 O 3 НCl+7 O 4 +1 +3 +5 +7 Увеличивается Термическая устойчивость Увеличивается Сила кислоты Увеличивается Очень слабая кислота Слабая кислота частично диссоциирует в воде Форма существования Кислота средней силы, ближе к сильным Одна из самых сильных кислот диссоциирует практически необратимо существуют только в растворе выделена в свободном виде
Кислородсодержащие кислоты хлора Формула кислоты Степень окисления Cl в кислоте НСl+1 О НCl+3 O 2 НCl+5 O 3 НCl+7 O 4 +1 +3 +5 +7 Увеличивается Термическая устойчивость Увеличивается Сила кислоты Увеличивается Очень слабая кислота Слабая кислота частично диссоциирует в воде Форма существования Кислота средней силы, ближе к сильным Одна из самых сильных кислот диссоциирует практически необратимо существуют только в растворе выделена в свободном виде
 Хлорноватистая кислота получается при растворении оксида хлора (I) в воде (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хлорноватистая кислота − хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора) (2): (2) Cl 2 + H 2 O ⇌ HCl. O + HCl Образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода — сильный окислитель, применяется для обеззараживания воды и отбеливания тканей.
Хлорноватистая кислота получается при растворении оксида хлора (I) в воде (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хлорноватистая кислота − хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора) (2): (2) Cl 2 + H 2 O ⇌ HCl. O + HCl Образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода — сильный окислитель, применяется для обеззараживания воды и отбеливания тканей.
 Хлористая кислота Раствор кислоты получают из её солей − хлоритов Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ А также по реакции: 2 Cl. O 2 + Н 2 O → НCl. O 2 + НCl. O 3 Хлористая кислота является кислотой средней силы, ближе к слабой Хлориты используют для отбеливания.
Хлористая кислота Раствор кислоты получают из её солей − хлоритов Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ А также по реакции: 2 Cl. O 2 + Н 2 O → НCl. O 2 + НCl. O 3 Хлористая кислота является кислотой средней силы, ближе к слабой Хлориты используют для отбеливания.
 Хлорноватая кислота водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: В 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры, например в 40%-ной кислоте воспламеняется, фильтровальная бумага. Хлорноватую кислоту в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba(Cl. O 3)2 + H 2 SО 4 = Ba. SO 4↓+ 2 HCl. O 3.
Хлорноватая кислота водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: В 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры, например в 40%-ной кислоте воспламеняется, фильтровальная бумага. Хлорноватую кислоту в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba(Cl. O 3)2 + H 2 SО 4 = Ba. SO 4↓+ 2 HCl. O 3.
 Хлорная кислота Безводная хлорная кислота получается при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой или водных растворов хлорной кислоты с олеумом, а также при взаимодействии оксида хлора (VII) с водой: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + Н 2 O → 2 НCl. O 4
Хлорная кислота Безводная хлорная кислота получается при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой или водных растворов хлорной кислоты с олеумом, а также при взаимодействии оксида хлора (VII) с водой: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + Н 2 O → 2 НCl. O 4
 Термическая устойчивость кислот – отношение к нагреванию Хлорная кислота (HCl. O 4) Ø Удается выделить в свободном виде; Ø При умеренном нагревании с фосфорным ангидридом разлагается § 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хлорноватая кислота (HCl. O 3 ) Ø При слабом нагревании разлагается § 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлористая кислота (HCl. O 2) Ø Очень неустойчива, разлагается при комнатной температуре на свету § 4 НСl. O 2 = НCl + НСl. O 3 + 2 Cl. O 2 + H 2 O Хлорноватистая кислота (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под действием света)
Термическая устойчивость кислот – отношение к нагреванию Хлорная кислота (HCl. O 4) Ø Удается выделить в свободном виде; Ø При умеренном нагревании с фосфорным ангидридом разлагается § 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хлорноватая кислота (HCl. O 3 ) Ø При слабом нагревании разлагается § 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлористая кислота (HCl. O 2) Ø Очень неустойчива, разлагается при комнатной температуре на свету § 4 НСl. O 2 = НCl + НСl. O 3 + 2 Cl. O 2 + H 2 O Хлорноватистая кислота (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под действием света)
 Отношение к растворам щелочей При взаимодействии кислородсодержащих кислот хлора с растворами щелочей по реакции обмена образуется соль этой кислоты и вода. Происходит реакция нейтрализации. HCl. O 2 + Na. OH = Na. Cl. O 2 + H 2 O; HCl. O 3 + KOH = KCl. O 3 + H 2 O; Отношение к основным оксидам При взаимодействии кислородсодержащих кислот хлора с основными оксидами по реакции обмена образуется соль этой кислоты и вода. 2 HCl. O + Na 2 O = 2 Na. Cl. O + H 2 O; 2 HCl. O 4 + Cu. O = Cu(Cl. O 4)2 + H 2 O
Отношение к растворам щелочей При взаимодействии кислородсодержащих кислот хлора с растворами щелочей по реакции обмена образуется соль этой кислоты и вода. Происходит реакция нейтрализации. HCl. O 2 + Na. OH = Na. Cl. O 2 + H 2 O; HCl. O 3 + KOH = KCl. O 3 + H 2 O; Отношение к основным оксидам При взаимодействии кислородсодержащих кислот хлора с основными оксидами по реакции обмена образуется соль этой кислоты и вода. 2 HCl. O + Na 2 O = 2 Na. Cl. O + H 2 O; 2 HCl. O 4 + Cu. O = Cu(Cl. O 4)2 + H 2 O


