кисл. соед. галогенов03.ppt
- Количество слайдов: 30
 Кислородные соединения галогенов
Кислородные соединения галогенов
 Прим. : реакции разбросаны по всей презентации! F 2 Cl 2 Br 2 I 2 At 2 К списку - повторение Окислы окислов хлора - новое Кислоты Олимпиадникам К таблице Соли кислот --------- Тривиальные названия
Прим. : реакции разбросаны по всей презентации! F 2 Cl 2 Br 2 I 2 At 2 К списку - повторение Окислы окислов хлора - новое Кислоты Олимпиадникам К таблице Соли кислот --------- Тривиальные названия
 Окислы галогенов F 2 Соединения с положительными степенями окисления кислорода и F-1 принадлежат к фторидам (не оксидам, т. к. окислитель в этих соединениях - фтор). Обладают сильной окислительной способностью. 1. OF 2 – бесцветный газ с характерным запахом; сильно токсичен. 2 OF 2 200˚C O 2 + 2 F 2 Получение фторированием растворов щелочей: 2 F 2 + 2 Na. OH = OF 2 + 2 Na. F + H 2 О ---------------------------------------------------------------- Дополнение олимпиадникам
Окислы галогенов F 2 Соединения с положительными степенями окисления кислорода и F-1 принадлежат к фторидам (не оксидам, т. к. окислитель в этих соединениях - фтор). Обладают сильной окислительной способностью. 1. OF 2 – бесцветный газ с характерным запахом; сильно токсичен. 2 OF 2 200˚C O 2 + 2 F 2 Получение фторированием растворов щелочей: 2 F 2 + 2 Na. OH = OF 2 + 2 Na. F + H 2 О ---------------------------------------------------------------- Дополнение олимпиадникам
 Окислы галогенов Cl 2 Все оксиды хлора имеют резкий запах, термически и фотохимически (свет) нестабильны, склонны к взрывному распаду, имеют положительную ˄Hобр. Полученные оксиды: Cl 2 O, Cl. O 2, Cl 2 O 7, Cl 2 O + H 2 O = 2 HCl. O 2 + H 2 O = HCl. O 2 + HCl. O 3 (Наподобие NO 2) Cl 2 O 7 + H 2 O = 2 HCl. O 4 Из школьной программы: Cl 2 O, Cl 2 O 3, Cl 2 O 5, Cl 2 O 7 Cl 2 O 3 + H 2 O = 2 HCl. O 2 Cl 2 O 5 + H 2 O = 2 HCl. O 3 + Другие свойства кислотных оксидов
Окислы галогенов Cl 2 Все оксиды хлора имеют резкий запах, термически и фотохимически (свет) нестабильны, склонны к взрывному распаду, имеют положительную ˄Hобр. Полученные оксиды: Cl 2 O, Cl. O 2, Cl 2 O 7, Cl 2 O + H 2 O = 2 HCl. O 2 + H 2 O = HCl. O 2 + HCl. O 3 (Наподобие NO 2) Cl 2 O 7 + H 2 O = 2 HCl. O 4 Из школьной программы: Cl 2 O, Cl 2 O 3, Cl 2 O 5, Cl 2 O 7 Cl 2 O 3 + H 2 O = 2 HCl. O 2 Cl 2 O 5 + H 2 O = 2 HCl. O 3 + Другие свойства кислотных оксидов
 Окислы галогенов Br 2 Все оксиды брома – малоустойчивые соединения, поэтому Br 2 O 7 до сих пор не удалось синтезировать. Все эндотермичны. 1. Br 2 O – газ коричневого цвета; сильный окислитель: 5 Br 2 O + I 2 = I 2 O 5 +5 Br 2; Br 2 O + H 2 O = 2 HBr. O; +ДР. СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ Получение: Hg. O + 2 Br 2 = Br 2 O + Hg. Br 2 4 Br. O 2 = 2 Br 2 O + 3 O 2 (в вакууме) 2. Br. O 2 – неустойчивое светло-желтое твердое вещество при t <- 40˚C. 2 Br. O 2 + H 2 O = HBr. O 2 + HBr. O 3 Li 2 O + 2 Br. O 2 = Li. Br. O 2 + Li. Br. O 3 Br 2 + 4 O 3 = -78˚C 2 Br. O 2 +4 O 2 ---------------------------------------------------------------- Дополнение олимпиадникам
Окислы галогенов Br 2 Все оксиды брома – малоустойчивые соединения, поэтому Br 2 O 7 до сих пор не удалось синтезировать. Все эндотермичны. 1. Br 2 O – газ коричневого цвета; сильный окислитель: 5 Br 2 O + I 2 = I 2 O 5 +5 Br 2; Br 2 O + H 2 O = 2 HBr. O; +ДР. СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ Получение: Hg. O + 2 Br 2 = Br 2 O + Hg. Br 2 4 Br. O 2 = 2 Br 2 O + 3 O 2 (в вакууме) 2. Br. O 2 – неустойчивое светло-желтое твердое вещество при t <- 40˚C. 2 Br. O 2 + H 2 O = HBr. O 2 + HBr. O 3 Li 2 O + 2 Br. O 2 = Li. Br. O 2 + Li. Br. O 3 Br 2 + 4 O 3 = -78˚C 2 Br. O 2 +4 O 2 ---------------------------------------------------------------- Дополнение олимпиадникам
 Окислы галогенов I 2 Оксиды йода, кроме I 2 O 5 , самого устойчивого оксида галогенов, также неустойчивы. Соединения также эндотермичны, кроме I 2 O 5. Полученные соединения: IO 2, I 2 O 4, I 2 O 5, I 2 O 7 I 2 O 5 (пентаоксид дийода) – бесцветные кристаллы, темнеют на свету из-за разложения; хорошо растворимы в воде. Получение: 2 HIO 3 =240 -250˚C I 2 O 5 +H 2 O 7 I 2 + 5 Cl 2 O 7 = 7 I 2 O 5 +5 Cl 2 Реакция: I 2 O 5 + H 2 O = 2 HIO 3 ---------------------------------------------------------------- Дополнение олимпиадникам
Окислы галогенов I 2 Оксиды йода, кроме I 2 O 5 , самого устойчивого оксида галогенов, также неустойчивы. Соединения также эндотермичны, кроме I 2 O 5. Полученные соединения: IO 2, I 2 O 4, I 2 O 5, I 2 O 7 I 2 O 5 (пентаоксид дийода) – бесцветные кристаллы, темнеют на свету из-за разложения; хорошо растворимы в воде. Получение: 2 HIO 3 =240 -250˚C I 2 O 5 +H 2 O 7 I 2 + 5 Cl 2 O 7 = 7 I 2 O 5 +5 Cl 2 Реакция: I 2 O 5 + H 2 O = 2 HIO 3 ---------------------------------------------------------------- Дополнение олимпиадникам
 Cl 2 O (оксид хлора (I); ангидрид хлорноватистой кислоты) – желтовато- коричневый газ с резким запахом (хлор). Нестабилен: 2 Cl 2 O = 2 Cl 2 + O 2 В промышленности получают водные растворы хлорированием карбонатов щелочных и щелочноземельных металлов: Na 2 CO 3 + Cl 2 = Na. Cl. O + Na. Cl + CO 2 Получение взаимодействием хлора с сухим Hg. O: Hg. O + 2 Cl 2 =0˚С Hg. Cl 2+ Cl 2 O Использование: производство гипохлорита кальция. ----------------------------------------------------------------- Cl. O 2 (диоксид хлора) – желто-оранжевый газ с неприятным запахом. В конц. виде взрывается; постепенно разлагается на свету. В растворах щелочей. образует хлориты и хлораты. Промышленное получение: 2 Na. Cl. O 3 +SO 2 + H 2 SO 4 = 2 Na. HSO 4 +2 Cl. O 2 Для малых количеств: 2 Na. Cl. O 2 +Cl 2 = 2 Na. Cl +2 Cl. O 2 Использование: отбелка и стерилизации целлюлозы, тканей, муки.
Cl 2 O (оксид хлора (I); ангидрид хлорноватистой кислоты) – желтовато- коричневый газ с резким запахом (хлор). Нестабилен: 2 Cl 2 O = 2 Cl 2 + O 2 В промышленности получают водные растворы хлорированием карбонатов щелочных и щелочноземельных металлов: Na 2 CO 3 + Cl 2 = Na. Cl. O + Na. Cl + CO 2 Получение взаимодействием хлора с сухим Hg. O: Hg. O + 2 Cl 2 =0˚С Hg. Cl 2+ Cl 2 O Использование: производство гипохлорита кальция. ----------------------------------------------------------------- Cl. O 2 (диоксид хлора) – желто-оранжевый газ с неприятным запахом. В конц. виде взрывается; постепенно разлагается на свету. В растворах щелочей. образует хлориты и хлораты. Промышленное получение: 2 Na. Cl. O 3 +SO 2 + H 2 SO 4 = 2 Na. HSO 4 +2 Cl. O 2 Для малых количеств: 2 Na. Cl. O 2 +Cl 2 = 2 Na. Cl +2 Cl. O 2 Использование: отбелка и стерилизации целлюлозы, тканей, муки.
 Cl 2 O 7 (оксид хлора (VII); хлорный ангидрид) – бесцветная маслянистая жидкость; при хранении медленно разлагается, окрашивается, а особенно загрязненный продуктами распада взрывается; более устойчив, чем Cl 2 O и Cl. O 2 Разложение: 2 Cl 2 O 7 = 7 O 2 + 2 Cl 2 Возможное получение (практического применения нет): нагревание хлорной кислоты с фосфорным ангидридом или олеумом: 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3
Cl 2 O 7 (оксид хлора (VII); хлорный ангидрид) – бесцветная маслянистая жидкость; при хранении медленно разлагается, окрашивается, а особенно загрязненный продуктами распада взрывается; более устойчив, чем Cl 2 O и Cl. O 2 Разложение: 2 Cl 2 O 7 = 7 O 2 + 2 Cl 2 Возможное получение (практического применения нет): нагревание хлорной кислоты с фосфорным ангидридом или олеумом: 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3
 Кислоты галогенов Некоторые кислоты можно получить путем взаимодействия необходимого галогена с водой: F 2 - окисляет воду (реакция может протекать со взрывом); Cl 2 - медленно взаимодействует; Br 2, I 2 - практически не реагируют. Фтор реагирует с кислородом с образованием HF, O 3, O 2, F 2 O, H 2 O 2: F 2 + H 2 O = 2 HF + [O] По «зеленому сборнику» : [O] + F 2 = OF 2 2 F 2 + 2 H 2 О = 4 HF + O 2↑ H 2 O + [O] = H 2 O 2 У Кузьменко и Еремина: 2[O] = O 2 3 F 2 + 3 H 2 O = OF 2↑ + 4 HF + H 2 O 2 3[O] = O 3 НО для школы: 2 F 2 + H 2 O = 2 HF + OF 2
Кислоты галогенов Некоторые кислоты можно получить путем взаимодействия необходимого галогена с водой: F 2 - окисляет воду (реакция может протекать со взрывом); Cl 2 - медленно взаимодействует; Br 2, I 2 - практически не реагируют. Фтор реагирует с кислородом с образованием HF, O 3, O 2, F 2 O, H 2 O 2: F 2 + H 2 O = 2 HF + [O] По «зеленому сборнику» : [O] + F 2 = OF 2 2 F 2 + 2 H 2 О = 4 HF + O 2↑ H 2 O + [O] = H 2 O 2 У Кузьменко и Еремина: 2[O] = O 2 3 F 2 + 3 H 2 O = OF 2↑ + 4 HF + H 2 O 2 3[O] = O 3 НО для школы: 2 F 2 + H 2 O = 2 HF + OF 2
 Хлор реагирует с водой с образованием (не <1/3) HСl, HCl. O: Cl 2 + H 2 O HCl + HCl. O -25 к. Дж (хлорная вода) Опустим в хлорную воду лакмусовую бумажку: она сначала покраснеет, а потом обесцветится – хлор разрушает красители. HCl. O – очень сильный окислитель. Благодаря ей влажный хлор обладает отбеливающими свойствами (реакция идет намного быстрее): 2 HCl. O =свет 2 HCl +O 2↑ Т. о. , реакцию хлорной воды на свету (или при нагревании) можно представить так: 2 Cl 2 + 2 H 2 O =свет 4 HCl + O 2 Применение: хлор применяется для обеззараживания питьевой воды (хлорирование), отбелки тканей и бумажной массы. ---------------------------------------------------------------- Дополнение олимпиадникам
Хлор реагирует с водой с образованием (не <1/3) HСl, HCl. O: Cl 2 + H 2 O HCl + HCl. O -25 к. Дж (хлорная вода) Опустим в хлорную воду лакмусовую бумажку: она сначала покраснеет, а потом обесцветится – хлор разрушает красители. HCl. O – очень сильный окислитель. Благодаря ей влажный хлор обладает отбеливающими свойствами (реакция идет намного быстрее): 2 HCl. O =свет 2 HCl +O 2↑ Т. о. , реакцию хлорной воды на свету (или при нагревании) можно представить так: 2 Cl 2 + 2 H 2 O =свет 4 HCl + O 2 Применение: хлор применяется для обеззараживания питьевой воды (хлорирование), отбелки тканей и бумажной массы. ---------------------------------------------------------------- Дополнение олимпиадникам
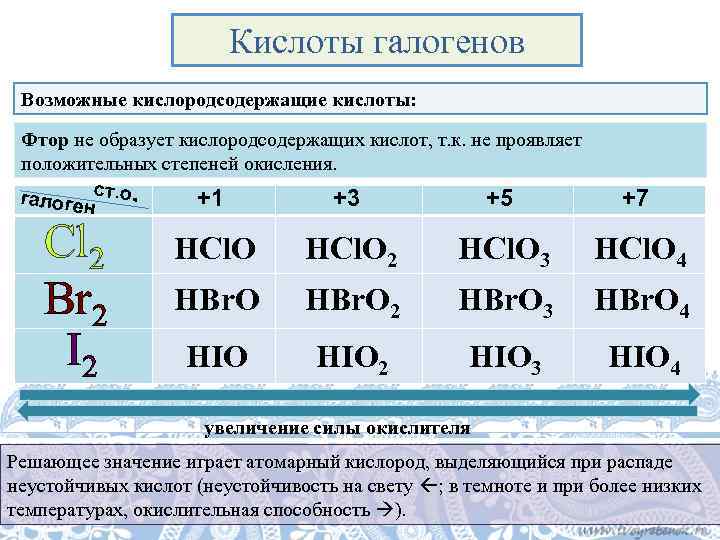 Кислоты галогенов Возможные кислородсодержащие кислоты: Фтор не образует кислородсодержащих кислот, т. к. не проявляет положительных степеней окисления. галогенст. о. +1 +3 +5 +7 Cl 2 HCl. O 3 HCl. O 4 Br 2 HBr. O 3 HBr. O 4 I 2 HIO 2 HIO 3 HIO 4 увеличение силы окислителя Решающее значение играет атомарный кислород, выделяющийся при распаде неустойчивых кислот (неустойчивость на свету ; в темноте и при более низких температурах, окислительная способность ).
Кислоты галогенов Возможные кислородсодержащие кислоты: Фтор не образует кислородсодержащих кислот, т. к. не проявляет положительных степеней окисления. галогенст. о. +1 +3 +5 +7 Cl 2 HCl. O 3 HCl. O 4 Br 2 HBr. O 3 HBr. O 4 I 2 HIO 2 HIO 3 HIO 4 увеличение силы окислителя Решающее значение играет атомарный кислород, выделяющийся при распаде неустойчивых кислот (неустойчивость на свету ; в темноте и при более низких температурах, окислительная способность ).
 Сила кислот; кислоты хлора Для примера рассмотрим структурные формулы кислот хлора: Хлорноватистая H – O – Cl Для диссоциации по кислотному типу необходим разрыв связи О – Н. Т. к. в ряду кислот от HCl. O до Хлористая H – O – Cl = O HCl. O 4 увеличивается число атомов кислорода, связанных с =O центральным атомом хлора, то от Хлорноватая H – O – Cl = O первичной связи O – Cl оттягивается некоторая доля =O электронной плотности. В результате этого часть электронной Хлорная H – O – Cl = O плотности оттягивается от связи О – =O Н, которая ослабляется. Такая закономерность – усиление кислотных свойств с возрастанием степени окисления центрального атома – характерна не только для хлора, но и для других элементов: другие галогены, азот, сера и т. д.
Сила кислот; кислоты хлора Для примера рассмотрим структурные формулы кислот хлора: Хлорноватистая H – O – Cl Для диссоциации по кислотному типу необходим разрыв связи О – Н. Т. к. в ряду кислот от HCl. O до Хлористая H – O – Cl = O HCl. O 4 увеличивается число атомов кислорода, связанных с =O центральным атомом хлора, то от Хлорноватая H – O – Cl = O первичной связи O – Cl оттягивается некоторая доля =O электронной плотности. В результате этого часть электронной Хлорная H – O – Cl = O плотности оттягивается от связи О – =O Н, которая ослабляется. Такая закономерность – усиление кислотных свойств с возрастанием степени окисления центрального атома – характерна не только для хлора, но и для других элементов: другие галогены, азот, сера и т. д.
 Кислоты брома и йода При увеличении же радиуса Эn+ при неизменном заряде На рисунке схематично изображена часть молекулы расстояние Э(ОН) центрами ионов увеличивается => гидроксида между n. Диссоциация этой части молекулы связь ослабляется в первую очередь между ионами Эn+ может проходить с разрывом связи Э – О (отщепляется и O ОН- и гидроксид проявляет свойства основания), ион 2 -, что облегчит диссоциацию по основному типу. Эn+ O 2 - H+ либо с разрывом О – Н (отщепляется Н + и гидроксид проявляет свойства кислоты). Т. о. , по силе кислот: HCl. O>HBr. O>HIO Каждый из возможных путей диссоциации будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени С возрастанием радиуса иону O 2 - усилится неизменном заряде усиливаются окисления Э притяжение сиона элемента при(+ усилится отталкивание с H+): основные проявит свойства кислоты. гидроксид свойства и ослабевают кислотные свойства гидроксида. С увеличением степени окисления элемента усиливаются кислотные свойства и ослабевают основные свойства гидроксида.
Кислоты брома и йода При увеличении же радиуса Эn+ при неизменном заряде На рисунке схематично изображена часть молекулы расстояние Э(ОН) центрами ионов увеличивается => гидроксида между n. Диссоциация этой части молекулы связь ослабляется в первую очередь между ионами Эn+ может проходить с разрывом связи Э – О (отщепляется и O ОН- и гидроксид проявляет свойства основания), ион 2 -, что облегчит диссоциацию по основному типу. Эn+ O 2 - H+ либо с разрывом О – Н (отщепляется Н + и гидроксид проявляет свойства кислоты). Т. о. , по силе кислот: HCl. O>HBr. O>HIO Каждый из возможных путей диссоциации будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени С возрастанием радиуса иону O 2 - усилится неизменном заряде усиливаются окисления Э притяжение сиона элемента при(+ усилится отталкивание с H+): основные проявит свойства кислоты. гидроксид свойства и ослабевают кислотные свойства гидроксида. С увеличением степени окисления элемента усиливаются кислотные свойства и ослабевают основные свойства гидроксида.
 Некоторые необходимые реакции I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl Cl 2 + KI + H 2 O = HCl + HIO + KCl 6 HNO 3 конц + HI = HIO 3 + 6 NO 2 + 3 H 2 O 10 HNO 3 конц + I 2 = 10 NO 2 + 2 HIO 3 + 4 H 2 O I 2 +5 H 2 O 2 = 2 HIO 3 + 4 H 2 O 8 HIO 3 + 5 H 2 S = 4 I 2 + 5 H 2 SO 4 + 4 H 2 O
Некоторые необходимые реакции I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl Cl 2 + KI + H 2 O = HCl + HIO + KCl 6 HNO 3 конц + HI = HIO 3 + 6 NO 2 + 3 H 2 O 10 HNO 3 конц + I 2 = 10 NO 2 + 2 HIO 3 + 4 H 2 O I 2 +5 H 2 O 2 = 2 HIO 3 + 4 H 2 O 8 HIO 3 + 5 H 2 S = 4 I 2 + 5 H 2 SO 4 + 4 H 2 O
 HCl. O – слабее угольной; соли – гипохлориты; ангидрид - Cl 2 O. Нестойкое соединение, существует только в растворах; в растворах постепенно разлагается тремя различными типами превращений: HOCl =ᶹ(квант) HCl + [O] 2 HCl. O =Ca. Cl 2 H 2 O + Cl 2 O 3 HOCl =t˚ 2 HCl + HCl. O 3 Именно поэтому различаются реакции: 3 Cl 2 + 6 KOH =t˚ 5 KCl + KCl. O 3 + 3 H 2 O 2 Сl 2 + 4 KOH = 2 KCl + 2 KOCl + 2 H 2 O Нижний раствор применяется для беления, т. к. под действием CO 2 из воздуха образуется хлорноватистая кислота, о белильных и обесцвечивающих свойствах которой уже говорилось. KOCl + CO 2 + H 2 O = KHCO 3 + HOCl
HCl. O – слабее угольной; соли – гипохлориты; ангидрид - Cl 2 O. Нестойкое соединение, существует только в растворах; в растворах постепенно разлагается тремя различными типами превращений: HOCl =ᶹ(квант) HCl + [O] 2 HCl. O =Ca. Cl 2 H 2 O + Cl 2 O 3 HOCl =t˚ 2 HCl + HCl. O 3 Именно поэтому различаются реакции: 3 Cl 2 + 6 KOH =t˚ 5 KCl + KCl. O 3 + 3 H 2 O 2 Сl 2 + 4 KOH = 2 KCl + 2 KOCl + 2 H 2 O Нижний раствор применяется для беления, т. к. под действием CO 2 из воздуха образуется хлорноватистая кислота, о белильных и обесцвечивающих свойствах которой уже говорилось. KOCl + CO 2 + H 2 O = KHCO 3 + HOCl
 HCl. O 2 – слабая кислота; ангидрид этой кислоты неизвестен. Соли – хлориты. Существует только в растворе, мало устойчива: Получают из ее солей хлоритов (используются для отбелки тканей): Ba(Cl. O 2) 2 + H 2 SO 4 = Ba. SO 4↓ + 2 HCl. O 2 ----------------------------------------------------------------- HCl. O 3 - проявляет свойства сильных кислоты и окислителя; ангидрид ее неизвестен; соли – хлораты. В конц. растворах с увеличением температуры растет окислительная способность; при большой концентрации кислота разлагается: 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Получают кислоту при разложении хлорноватистой кислоты, взаимодействии хлората бария с разбавленной серной: Ba(Cl. O 3)2 + H 2 SO 4 = Ba. SO 4↓ + 2 HCl. O 3
HCl. O 2 – слабая кислота; ангидрид этой кислоты неизвестен. Соли – хлориты. Существует только в растворе, мало устойчива: Получают из ее солей хлоритов (используются для отбелки тканей): Ba(Cl. O 2) 2 + H 2 SO 4 = Ba. SO 4↓ + 2 HCl. O 2 ----------------------------------------------------------------- HCl. O 3 - проявляет свойства сильных кислоты и окислителя; ангидрид ее неизвестен; соли – хлораты. В конц. растворах с увеличением температуры растет окислительная способность; при большой концентрации кислота разлагается: 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Получают кислоту при разложении хлорноватистой кислоты, взаимодействии хлората бария с разбавленной серной: Ba(Cl. O 3)2 + H 2 SO 4 = Ba. SO 4↓ + 2 HCl. O 3
 HCl. O 4 – бесцветная, дымящаяся на воздухе жидкость. Одна из самых сильных кислот. Соли – перхлораты; безводная малоустойчива, иногда взрывается: 4 HCl. O 4 = 4 Cl. O 2 + 3 O 2 + 2 H 2 O Ангидрид Cl 2 O 7 получим нагреванием с P 2 O 5, отнимающим воду: 2 HCl. O 4 + P 2 O 5 = 2 HPO 3 + Cl 2 O 7 ---------------------------------------------------------------- Дополнение олимпиадникам
HCl. O 4 – бесцветная, дымящаяся на воздухе жидкость. Одна из самых сильных кислот. Соли – перхлораты; безводная малоустойчива, иногда взрывается: 4 HCl. O 4 = 4 Cl. O 2 + 3 O 2 + 2 H 2 O Ангидрид Cl 2 O 7 получим нагреванием с P 2 O 5, отнимающим воду: 2 HCl. O 4 + P 2 O 5 = 2 HPO 3 + Cl 2 O 7 ---------------------------------------------------------------- Дополнение олимпиадникам
 HIO - является уже амфотерным соединением (вспомним картинку слайда 16), у которого основные свойства несколько преобладают над кислотными; существует только в очень разбавленных растворах. Соли – гипойодиты. 5 HIO = HIO 3 + 2 I 2 + 2 H 2 O ----------------------------------------------------------------- HBr. O – неустойчивая кислота; известна только в водном растворе концентрацией не выше 30%. Соли – гипобромиты. 3 HBr. O = HBr. O 3 + 2 HBr ----------------------------------------------------------------- HIO 2 – существует только в момент образования и разлагается. Соли – йодиты. ----------------------------------------------------------------- HBr. O 2 – неустойчивая кислота; существует только в водных растворах. Соли – бромиты.
HIO - является уже амфотерным соединением (вспомним картинку слайда 16), у которого основные свойства несколько преобладают над кислотными; существует только в очень разбавленных растворах. Соли – гипойодиты. 5 HIO = HIO 3 + 2 I 2 + 2 H 2 O ----------------------------------------------------------------- HBr. O – неустойчивая кислота; известна только в водном растворе концентрацией не выше 30%. Соли – гипобромиты. 3 HBr. O = HBr. O 3 + 2 HBr ----------------------------------------------------------------- HIO 2 – существует только в момент образования и разлагается. Соли – йодиты. ----------------------------------------------------------------- HBr. O 2 – неустойчивая кислота; существует только в водных растворах. Соли – бромиты.
 HBr. O 3 и HIO 3 можно получить путем окисления бромной или йодной воды хлором: Br 2 + 5 Cl 2 + 6 H 2 O = 2 HBr. O 3 + 10 HCl HBr. O 3 (слегка желтоватая; соли – хлораты) очень похожа по свойствам на HCl. O 3, а кислотные свойства HIO 3 (соли – хлораты) выражены значительно слабее. Это бесцветные кристаллы; при осторожном нагревании можно получить йодноватый ангидрид: 2 HIO 3 =t˚C I 2 O 5 + H 2 O ----------------------------------------------------------------- HBr. O 4 (соли – перхлораты) изучена мало, в отличие от HIO 4 (соли – перхлораты) может быть получена: 2 HCl. O 4 + I 2 = 2 HIO 4 + Cl 2 Или электролизом раствора HIO 3: HIO 3 + H 2 O = H 2(катод) + HIO 4(анод) Из раствора выделяется гидрат HIO 4 • 2 H 2 O. Его рассматривают как ортойодную кислоту H 5 IO 6, т. к. все атомы водорода замещаются металлами с образованием солей (например, Ag 5 IO 6).
HBr. O 3 и HIO 3 можно получить путем окисления бромной или йодной воды хлором: Br 2 + 5 Cl 2 + 6 H 2 O = 2 HBr. O 3 + 10 HCl HBr. O 3 (слегка желтоватая; соли – хлораты) очень похожа по свойствам на HCl. O 3, а кислотные свойства HIO 3 (соли – хлораты) выражены значительно слабее. Это бесцветные кристаллы; при осторожном нагревании можно получить йодноватый ангидрид: 2 HIO 3 =t˚C I 2 O 5 + H 2 O ----------------------------------------------------------------- HBr. O 4 (соли – перхлораты) изучена мало, в отличие от HIO 4 (соли – перхлораты) может быть получена: 2 HCl. O 4 + I 2 = 2 HIO 4 + Cl 2 Или электролизом раствора HIO 3: HIO 3 + H 2 O = H 2(катод) + HIO 4(анод) Из раствора выделяется гидрат HIO 4 • 2 H 2 O. Его рассматривают как ортойодную кислоту H 5 IO 6, т. к. все атомы водорода замещаются металлами с образованием солей (например, Ag 5 IO 6).
 Соли галогенов Кислородные соединения хлора и брома – окислители, часто использующиеся в технике и лабораториях. Cl 2 Кислородсодержащие соли галогенов: гипохлориты, хлораты, перхлораты Гипохлориты: неустойчивые соединения, многие при нагреве разлагаются со взрывом; большинство образуют кристаллогидраты. Na. OCl (KOCl): бытовой и промышленный отбеливатель и дезинфектант, средство очистки и обеззараживания воды, окислитель для некоторых процессов промышленного и химического производства. 2 Na. OH + Cl 2 = Na. Cl. O + Na. Cl + H 2 O – «Лабарракова вода» 2 KOH + Cl 2 = KCl. O + KCl + H 2 O – «Жавелевая вода» K 2 CO 3 + Cl 2 = KCl + KCl. O + CO 2 Na. Cl. O + CO 2 + H 2 O = Na. HCO 3 + HCl. O 3 Na. Cl. O =50˚C Na. Cl. O 3 + 2 Na. Cl – хлоросодержащие отбеливатели эффективны только в холодной воде, т. к. при нагревании разрушаются. 3 Na. Cl. O + 2 NH 3 =t˚C N 2 + Na. Cl + 3 H 2 O (!!!)
Соли галогенов Кислородные соединения хлора и брома – окислители, часто использующиеся в технике и лабораториях. Cl 2 Кислородсодержащие соли галогенов: гипохлориты, хлораты, перхлораты Гипохлориты: неустойчивые соединения, многие при нагреве разлагаются со взрывом; большинство образуют кристаллогидраты. Na. OCl (KOCl): бытовой и промышленный отбеливатель и дезинфектант, средство очистки и обеззараживания воды, окислитель для некоторых процессов промышленного и химического производства. 2 Na. OH + Cl 2 = Na. Cl. O + Na. Cl + H 2 O – «Лабарракова вода» 2 KOH + Cl 2 = KCl. O + KCl + H 2 O – «Жавелевая вода» K 2 CO 3 + Cl 2 = KCl + KCl. O + CO 2 Na. Cl. O + CO 2 + H 2 O = Na. HCO 3 + HCl. O 3 Na. Cl. O =50˚C Na. Cl. O 3 + 2 Na. Cl – хлоросодержащие отбеливатели эффективны только в холодной воде, т. к. при нагревании разрушаются. 3 Na. Cl. O + 2 NH 3 =t˚C N 2 + Na. Cl + 3 H 2 O (!!!)
 Сa. ОCl 2 (хлорная ( «белильная» ) известь; хлорка): смешанная соль; белый порошок с резким запахом и окислительными свойствами (Ca. Cl(Cl. O), Ca(Cl. O)Cl): 2 Ca(OH)2 + 2 Cl 2 = Ca. Cl 2 + Ca(OCl)2 + 2 H 2 O – «Хлорная известь» Часть молекул HCl. O отщепляет воду: 2 HCl. O = Cl 2 O + H 2 O - Cl 2 O обусловливает запах хлорки. 2 Ca. OCl 2 + CO 2 + H 2 O = Ca. CO 3 + Ca. Cl 2 +2 HOCl Ca. OCl 2 + 2 HCl = Ca. Cl 2 + H 2 O ---------------------------------------------------------------- Дополнение олимпиадникам
Сa. ОCl 2 (хлорная ( «белильная» ) известь; хлорка): смешанная соль; белый порошок с резким запахом и окислительными свойствами (Ca. Cl(Cl. O), Ca(Cl. O)Cl): 2 Ca(OH)2 + 2 Cl 2 = Ca. Cl 2 + Ca(OCl)2 + 2 H 2 O – «Хлорная известь» Часть молекул HCl. O отщепляет воду: 2 HCl. O = Cl 2 O + H 2 O - Cl 2 O обусловливает запах хлорки. 2 Ca. OCl 2 + CO 2 + H 2 O = Ca. CO 3 + Ca. Cl 2 +2 HOCl Ca. OCl 2 + 2 HCl = Ca. Cl 2 + H 2 O ---------------------------------------------------------------- Дополнение олимпиадникам
 Хлораты: в растворах окислительные свойства выражены слабо; все ядовиты; довольно стабильны. Хорошо растворимы, кроме KCl. O 3. Все хлораты щелочных металлов разлагаются на Me. Cl и O 2 с выделением большого количества тепла, проходя стадию перхлоратов. KCl. O 3 (бертолетова соль): блестящие пластинчатые кристаллы; плохо растворим в воде. Используют для изготовления бенгальских огней, хлопушек, артиллерийских снарядов, содержится в головках спичек. Смеси с углем, серой и орг. веществами – взрывчаты; раньше использовалась для получения кислорода: 2 KCl. O 3 =250˚CMn. O 2 2 KCl + 3 O 2↑ (температура разложения понижается в присутствии катализаторов, как-то: Mn. O 2, Fe 2 O 3, Cu. O) 4 KCl. O 3 =600˚C KCl + 3 KCl. O 4 (без катализатора) Применение: в составе взрывчатых веществ, зажигательных смесей, для химического травления металлов, получения кислорода в лабораторных масштабах. ---------------------------------------------------------------- Дополнение олимпиадникам
Хлораты: в растворах окислительные свойства выражены слабо; все ядовиты; довольно стабильны. Хорошо растворимы, кроме KCl. O 3. Все хлораты щелочных металлов разлагаются на Me. Cl и O 2 с выделением большого количества тепла, проходя стадию перхлоратов. KCl. O 3 (бертолетова соль): блестящие пластинчатые кристаллы; плохо растворим в воде. Используют для изготовления бенгальских огней, хлопушек, артиллерийских снарядов, содержится в головках спичек. Смеси с углем, серой и орг. веществами – взрывчаты; раньше использовалась для получения кислорода: 2 KCl. O 3 =250˚CMn. O 2 2 KCl + 3 O 2↑ (температура разложения понижается в присутствии катализаторов, как-то: Mn. O 2, Fe 2 O 3, Cu. O) 4 KCl. O 3 =600˚C KCl + 3 KCl. O 4 (без катализатора) Применение: в составе взрывчатых веществ, зажигательных смесей, для химического травления металлов, получения кислорода в лабораторных масштабах. ---------------------------------------------------------------- Дополнение олимпиадникам
 Na. Cl. O 3 : бесцветные кристаллы, хорошо растворимые в воде. Получение: Na 2 CO 3 + 2 HCl. O 3 = 2 Na. Cl. O 3 + H 2 O + CO 2 Разложение может протекать двумя путями: 4 Na. Cl. O 3 =t˚C, Mn. O 2 3 Na. Cl. O 4 + Na. Cl – наиболее вероятное разложение; (но возможно другое разложение: 2 Na. Cl. O 3 =t˚C Na. Cl. O 4 + Na. Cl + O 2)
Na. Cl. O 3 : бесцветные кристаллы, хорошо растворимые в воде. Получение: Na 2 CO 3 + 2 HCl. O 3 = 2 Na. Cl. O 3 + H 2 O + CO 2 Разложение может протекать двумя путями: 4 Na. Cl. O 3 =t˚C, Mn. O 2 3 Na. Cl. O 4 + Na. Cl – наиболее вероятное разложение; (но возможно другое разложение: 2 Na. Cl. O 3 =t˚C Na. Cl. O 4 + Na. Cl + O 2)
 Перхлораты: бесцветны, если катион бесцветен; сильные окислители. Применяют для производства безопасных взрывчатых веществ (так, KCl. O 4 – более сильный окислитель, чем KCl. O 3 ; в то же время стоек при хранении и не взрывается от трения и удара). Все, кроме солей К, Rb и Cs гигроскопичны и образуют гидраты. NH 4 Cl. O 4 (ПХА): бесцветные кристаллы ромбоэдрической формы. Включен в состав твердых ракетных топлив, взрывчатых веществ. Получение: NH 3 + HCl. O 4 = NH 4 Cl. O 4 2 NH 4 Cl. O 4 =t˚C Cl 2 + N 2 + 2 O 2 + 4 H 2 O KCl. O 4 (ПХК): бесцветное кристаллическое вещество с кристаллами ромбической формы. Используется для фейерверков, твердых ракетных топлив (но чаще ПХА), воспламенителей, хлопушек, петард, в медицине (радиопротектор и средство от токсического зоба) Получение: нагреванием хлоратов или электролизом их растворов. KCl. O 4 =t˚C KCl + 2 O 2 ---------------------------------------------------------------- Дополнение олимпиадникам
Перхлораты: бесцветны, если катион бесцветен; сильные окислители. Применяют для производства безопасных взрывчатых веществ (так, KCl. O 4 – более сильный окислитель, чем KCl. O 3 ; в то же время стоек при хранении и не взрывается от трения и удара). Все, кроме солей К, Rb и Cs гигроскопичны и образуют гидраты. NH 4 Cl. O 4 (ПХА): бесцветные кристаллы ромбоэдрической формы. Включен в состав твердых ракетных топлив, взрывчатых веществ. Получение: NH 3 + HCl. O 4 = NH 4 Cl. O 4 2 NH 4 Cl. O 4 =t˚C Cl 2 + N 2 + 2 O 2 + 4 H 2 O KCl. O 4 (ПХК): бесцветное кристаллическое вещество с кристаллами ромбической формы. Используется для фейерверков, твердых ракетных топлив (но чаще ПХА), воспламенителей, хлопушек, петард, в медицине (радиопротектор и средство от токсического зоба) Получение: нагреванием хлоратов или электролизом их растворов. KCl. O 4 =t˚C KCl + 2 O 2 ---------------------------------------------------------------- Дополнение олимпиадникам
 Реакции на повторение 3 Br 2 + 6 Na. OH = Na. Br. O 3 + 5 Na. Br + 3 H 2 O 3 I 2 + 6 Na. OH =0˚C Na. IO 3 + 5 Na. I + 3 H 2 O 3 Zn + KCl. O 3 + 6 KOH + 3 H 2 O = 3 K 2[Zn(OH)4] + KCl 2 Cr. Cl 3 + 3 Na. Cl. O + 10 Na. OH = 2 Na 2 Cr. O 4 + 9 Na. Cl + 5 H 2 O 2 + KCl. O = O 2 +KCl + H 2 O 3 P 2 O 3 + 2 KCl. O 3 =t˚C 2 KCl + 3 P 2 O 5 2 Fe. S + 3 KCl. O 3 =t˚C Fe 2 O 3 + 2 SO 3 + 3 KCl 2 Fe(OH)2 + Na. Br. O + H 2 O = 2 Fe(OH)3 + Na. Br H 2 O 2 + 2 Fe(OH)2 = 2 Fe(OH)3 5 KBr + KBr. O 3 + 3 H 2 SO 4 = 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O 7 Na 2 SO 3 + 2 KIO 4 + H 2 SO 4 = 7 Na 2 SO 4 + K 2 SO 4 + I 2 + H 2 O 3 Mn. O 2 + KCl. O 3 + 6 KOH = KCl + 3 K 2 Mn. O 4 + 3 H 2 O
Реакции на повторение 3 Br 2 + 6 Na. OH = Na. Br. O 3 + 5 Na. Br + 3 H 2 O 3 I 2 + 6 Na. OH =0˚C Na. IO 3 + 5 Na. I + 3 H 2 O 3 Zn + KCl. O 3 + 6 KOH + 3 H 2 O = 3 K 2[Zn(OH)4] + KCl 2 Cr. Cl 3 + 3 Na. Cl. O + 10 Na. OH = 2 Na 2 Cr. O 4 + 9 Na. Cl + 5 H 2 O 2 + KCl. O = O 2 +KCl + H 2 O 3 P 2 O 3 + 2 KCl. O 3 =t˚C 2 KCl + 3 P 2 O 5 2 Fe. S + 3 KCl. O 3 =t˚C Fe 2 O 3 + 2 SO 3 + 3 KCl 2 Fe(OH)2 + Na. Br. O + H 2 O = 2 Fe(OH)3 + Na. Br H 2 O 2 + 2 Fe(OH)2 = 2 Fe(OH)3 5 KBr + KBr. O 3 + 3 H 2 SO 4 = 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O 7 Na 2 SO 3 + 2 KIO 4 + H 2 SO 4 = 7 Na 2 SO 4 + K 2 SO 4 + I 2 + H 2 O 3 Mn. O 2 + KCl. O 3 + 6 KOH = KCl + 3 K 2 Mn. O 4 + 3 H 2 O
 Использованные тривиальные названия Жавелевая вода Водный р-р солей KCl. O и KCl Лабарракова вода Водный р-р солей Na. Cl. O и Na. Cl Бромная вода Водный р-р HBr и HBr. O Хлорная вода Водный р-р HCl + HCl. O Белильная Водный р-р смешанной соли Ca. Cl(Cl. O) известь= хлорная известь Бертолетова соль KCl. O 3 Ангидрон Mg(Cl. O 4)2
Использованные тривиальные названия Жавелевая вода Водный р-р солей KCl. O и KCl Лабарракова вода Водный р-р солей Na. Cl. O и Na. Cl Бромная вода Водный р-р HBr и HBr. O Хлорная вода Водный р-р HCl + HCl. O Белильная Водный р-р смешанной соли Ca. Cl(Cl. O) известь= хлорная известь Бертолетова соль KCl. O 3 Ангидрон Mg(Cl. O 4)2
 Олимпиадникам O 2 F 2 – диоксидифторид; стабилен только при низких температурах. Образуется при окислении кислорода фтором в электрическом разряде. Оранжевый газ; красная жидкость. O 3 F 2 (фторид озона) – триоксидифторид; вязкая тягучая жидкость яркого кроваво-красного цвета. И т. д. : O 4 F 2, O 5 F 2, O 6 F 2, O 4 F 4 … ----------------------------------------------------------------- Br 2 O 4 – бледно-желтые кристаллы, разлагается при комнатной температуре. 4 O 3 + 3 Br 2 = 3 Br 2 O 4 ----------------------------------------------------------------- Реакции с I 2 O 5 : 4 IF 5 + 5 Si. O 2 =150 -175˚C 2 I 2 O 5 + 5 Si. F 4 2 I 2 O 5 + 2 F 2 =0˚C 4 IO 2 F + O 2 5 CO + I 2 O 5 = I 2 + 5 CO 2 (исп. для количественного анализа) ----------------------------------------------------------------- Разложение HCl. O 2 : 4 HCl. O 2 = HCl + HCl. O 3 + 2 Cl. O 2 + H 2 O
Олимпиадникам O 2 F 2 – диоксидифторид; стабилен только при низких температурах. Образуется при окислении кислорода фтором в электрическом разряде. Оранжевый газ; красная жидкость. O 3 F 2 (фторид озона) – триоксидифторид; вязкая тягучая жидкость яркого кроваво-красного цвета. И т. д. : O 4 F 2, O 5 F 2, O 6 F 2, O 4 F 4 … ----------------------------------------------------------------- Br 2 O 4 – бледно-желтые кристаллы, разлагается при комнатной температуре. 4 O 3 + 3 Br 2 = 3 Br 2 O 4 ----------------------------------------------------------------- Реакции с I 2 O 5 : 4 IF 5 + 5 Si. O 2 =150 -175˚C 2 I 2 O 5 + 5 Si. F 4 2 I 2 O 5 + 2 F 2 =0˚C 4 IO 2 F + O 2 5 CO + I 2 O 5 = I 2 + 5 CO 2 (исп. для количественного анализа) ----------------------------------------------------------------- Разложение HCl. O 2 : 4 HCl. O 2 = HCl + HCl. O 3 + 2 Cl. O 2 + H 2 O
 Бром в воде растворяется ограниченно, но лучше других галогенов. Частично реагируя в водой, образует «бромную воду» : Br 2 + H 2 O = HBr + HBr. O (бромная вода) Йод же в воде практически нерастворим (растворимость увеличивается при добавлении йодид-ионов, что объясняется образованием йодидных комплексов, например: K[I]3) и не способен окислить воду даже при нагревании; поэтому «йодной воды» не существует. ----------------------------------------------------------------- Самая сильная кислота (по данным книги рекордов Гиннеса) – 80%-ный раствор пентафруорида сурьмы фтористоводородной кислоты (HFSb. F 5). Активность ее не может быть измерена, но даже 50%-ный раствор в 1018 раз сильнее концентрированной H 2 SO 4. ----------------------------------------------------------------- Хлориты: белые или желтоватые кристаллы; устойчивы при обычных условиях в безводном состоянии и в водных растворах. Сильные окислители. Твердые хлориты, особенно тяжелых металлов, при нагревании или ударе разлагаются со взрывом. Щелочные растворы разлагаются на свету: 6 KCl. O 2 = 2 KCl. O 3 + 4 KCl + 3 O 2
Бром в воде растворяется ограниченно, но лучше других галогенов. Частично реагируя в водой, образует «бромную воду» : Br 2 + H 2 O = HBr + HBr. O (бромная вода) Йод же в воде практически нерастворим (растворимость увеличивается при добавлении йодид-ионов, что объясняется образованием йодидных комплексов, например: K[I]3) и не способен окислить воду даже при нагревании; поэтому «йодной воды» не существует. ----------------------------------------------------------------- Самая сильная кислота (по данным книги рекордов Гиннеса) – 80%-ный раствор пентафруорида сурьмы фтористоводородной кислоты (HFSb. F 5). Активность ее не может быть измерена, но даже 50%-ный раствор в 1018 раз сильнее концентрированной H 2 SO 4. ----------------------------------------------------------------- Хлориты: белые или желтоватые кристаллы; устойчивы при обычных условиях в безводном состоянии и в водных растворах. Сильные окислители. Твердые хлориты, особенно тяжелых металлов, при нагревании или ударе разлагаются со взрывом. Щелочные растворы разлагаются на свету: 6 KCl. O 2 = 2 KCl. O 3 + 4 KCl + 3 O 2
 Na. Cl. O 2 : бесцветные кристаллы; кристаллогидрат: Na. Cl. O 2 • 3 H 2 O. Используется для отбеливания тканей, бумаги, целлюлозы, дезинфекции сточных труб, в парфюмерии (полоскание, зубные пасты, спреи), в качестве окислителя. 3 Na. Cl. O 2 =t˚C 2 Na. Cl. O 3 + Na. Cl Промышленный способ (C= Zn=Pb 2 O): 4 Cl. O 2 + C + 4 Na. OH + Ca(OH)2 = 4 Na. Cl. O 2 + Ca. CO 3 + 3 H 2 O 2 Cl. O 2 + Na 2 O 2 = 2 Na. Cl. O 2 + O 2 -----------------------------------------------------------------
Na. Cl. O 2 : бесцветные кристаллы; кристаллогидрат: Na. Cl. O 2 • 3 H 2 O. Используется для отбеливания тканей, бумаги, целлюлозы, дезинфекции сточных труб, в парфюмерии (полоскание, зубные пасты, спреи), в качестве окислителя. 3 Na. Cl. O 2 =t˚C 2 Na. Cl. O 3 + Na. Cl Промышленный способ (C= Zn=Pb 2 O): 4 Cl. O 2 + C + 4 Na. OH + Ca(OH)2 = 4 Na. Cl. O 2 + Ca. CO 3 + 3 H 2 O 2 Cl. O 2 + Na 2 O 2 = 2 Na. Cl. O 2 + O 2 -----------------------------------------------------------------
 Промышленное получение KCl. O 3: 3 KCl. O =t˚C KCl. O 3 + 2 KCl ----------------------------------------------------------------- Mg(Cl. O 4)2 (ангидрон): белая пористая масса, очень энергично поглощает воду, образуя кристаллогидрат Mg(Cl. O 4)2 • 6 H 2 O. Применяется для просушивания газов от следов воды и жидкостей. ----------------------------------------------------------------- Хлоросодержащие отбеливатели сильно разрушают ткани и способствуют образованию ядовитых веществ – диоксинов, поэтому их заменяют кислородными, представляющими собой соли пероксокислот (- О – О - ). Все кислородсодержащие соли хлора при сильном нагревании разлагаются на хлорид и кислород. Br 2 + 2 Na. OH = 0˚C Na. Br. O + Na. Br + H 2 O 3 Na. Br. O =20˚C Na. Br. O 3 + 2 Na. Br В ЕГЭ до Na. Br. O 3 !!!
Промышленное получение KCl. O 3: 3 KCl. O =t˚C KCl. O 3 + 2 KCl ----------------------------------------------------------------- Mg(Cl. O 4)2 (ангидрон): белая пористая масса, очень энергично поглощает воду, образуя кристаллогидрат Mg(Cl. O 4)2 • 6 H 2 O. Применяется для просушивания газов от следов воды и жидкостей. ----------------------------------------------------------------- Хлоросодержащие отбеливатели сильно разрушают ткани и способствуют образованию ядовитых веществ – диоксинов, поэтому их заменяют кислородными, представляющими собой соли пероксокислот (- О – О - ). Все кислородсодержащие соли хлора при сильном нагревании разлагаются на хлорид и кислород. Br 2 + 2 Na. OH = 0˚C Na. Br. O + Na. Br + H 2 O 3 Na. Br. O =20˚C Na. Br. O 3 + 2 Na. Br В ЕГЭ до Na. Br. O 3 !!!


