кислородные соединения азота.pptx
- Количество слайдов: 16
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
 ПОДУМАЙ И ОТВЕТЬ • Какие оксиды азота Вам известны ? Назовите каждый оксид • Укажите валентность и степень окисления азота в каждом оксиде • Заполните таблицу, допишите соответствующие уравнения.
ПОДУМАЙ И ОТВЕТЬ • Какие оксиды азота Вам известны ? Назовите каждый оксид • Укажите валентность и степень окисления азота в каждом оксиде • Заполните таблицу, допишите соответствующие уравнения.
 Оксид азота (I) N 2 O • • • N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Несолеобразующий оксид. 2 N 2 O= N 2 O + Сu=
Оксид азота (I) N 2 O • • • N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Несолеобразующий оксид. 2 N 2 O= N 2 O + Сu=
 Оксид азота (II) • NO – оксид азота (I I) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Несолеобразующий оксид. • NO+ O 2=
Оксид азота (II) • NO – оксид азота (I I) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Несолеобразующий оксид. • NO+ O 2=
 Оксид азота (III) • N 2 O 3 – оксид азота (III) жидкость темно-синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. Кислотный оксид, при взаимодействии с водой образуется азотистая кислота. • N 2 O 3 = • N 2 O 3 + H 2 O =
Оксид азота (III) • N 2 O 3 – оксид азота (III) жидкость темно-синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. Кислотный оксид, при взаимодействии с водой образуется азотистая кислота. • N 2 O 3 = • N 2 O 3 + H 2 O =
 Оксид азота (IV) NO 2 – оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. NO 2 + H 2 O = Проявляет все свойства кислотных оксидов
Оксид азота (IV) NO 2 – оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. NO 2 + H 2 O = Проявляет все свойства кислотных оксидов
 Оксид азота (V) • N 2 O 5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. Продуктом реакции между кислотным оксидом и водой является кислота
Оксид азота (V) • N 2 O 5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. Продуктом реакции между кислотным оксидом и водой является кислота
 НАЗОВИТЕ КИСЛОТЫ, ОБРАЗУЕМЫЕ АЗОТОМ И СРАВНИТЕ ИХ СВОЙСТВА Параметры сравнения Химическая формула Степень окисления азота Валентность азота Температура кипения Устойчивость Химические свойства Азотистая кислота Азотная кислота
НАЗОВИТЕ КИСЛОТЫ, ОБРАЗУЕМЫЕ АЗОТОМ И СРАВНИТЕ ИХ СВОЙСТВА Параметры сравнения Химическая формула Степень окисления азота Валентность азота Температура кипения Устойчивость Химические свойства Азотистая кислота Азотная кислота
 Азотная кислота. HNO 3 Азотная 4 HNO 3=4 NO 2+2 H 2 O+O 2 кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно растворяется в воде, tкип= 82. 6 0 С. Растворы азотной кислоты хранят в банке из темного стекла, т. е. она разлагается на свету:
Азотная кислота. HNO 3 Азотная 4 HNO 3=4 NO 2+2 H 2 O+O 2 кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно растворяется в воде, tкип= 82. 6 0 С. Растворы азотной кислоты хранят в банке из темного стекла, т. е. она разлагается на свету:
 Задание. Составьте уравнения реакций по схемам. • • HNO 3 + Mg(OH)2— HNO 3 + Mg. O— HNO 3 + Na 2 CO 3— HNO 3 + K 2 Si. O 3 —
Задание. Составьте уравнения реакций по схемам. • • HNO 3 + Mg(OH)2— HNO 3 + Mg. O— HNO 3 + Na 2 CO 3— HNO 3 + K 2 Si. O 3 —
 Проверьте уравнения • • 2 HNO 3 + Mg(OH)2 Mg(NO 3)2+2 H 2 O 2 HNO 3 + Mg. O Mg(NO 3)2+2 H 2 O 2 HNO 3 + Na 2 CO 3 2 Na. NO 3+CO 2+H 2 O 2 HNO 3 + K 2 Si. O 3 КNO 3+ H 2 Si. O 3
Проверьте уравнения • • 2 HNO 3 + Mg(OH)2 Mg(NO 3)2+2 H 2 O 2 HNO 3 + Mg. O Mg(NO 3)2+2 H 2 O 2 HNO 3 + Na 2 CO 3 2 Na. NO 3+CO 2+H 2 O 2 HNO 3 + K 2 Si. O 3 КNO 3+ H 2 Si. O 3
 Особенности взаимодействия азотной кислоты с металлами. • Выделяются разнообразные соединения азота - NO 2, NO, N 2 NH 3 • С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.
Особенности взаимодействия азотной кислоты с металлами. • Выделяются разнообразные соединения азота - NO 2, NO, N 2 NH 3 • С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.
 В глазах древних исследователей азотная кислота – это жидкость, обладающая великой силой в руках человека Старинное название азотной кислоты «крепкая водка» Алхимики писали: «Крепкая водка пожирает луну. Выпуская лисий хвост…» Луна- серебро Пожирает – растворяет Лисий хвост- оксид азота (IV) Составьте уравнение этой реакции.
В глазах древних исследователей азотная кислота – это жидкость, обладающая великой силой в руках человека Старинное название азотной кислоты «крепкая водка» Алхимики писали: «Крепкая водка пожирает луну. Выпуская лисий хвост…» Луна- серебро Пожирает – растворяет Лисий хвост- оксид азота (IV) Составьте уравнение этой реакции.
 Применение азотной кислоты имеет два лица: созидательное и разрушительное • В начале как разрушитель азотная кислота была основой для получения……. . • А затем для получения ………. • Шведский химик А. Нобель использовал это для получения……. .
Применение азотной кислоты имеет два лица: созидательное и разрушительное • В начале как разрушитель азотная кислота была основой для получения……. . • А затем для получения ………. • Шведский химик А. Нобель использовал это для получения……. .
 Применение азотной кислоты имеет два лица: созидательное и разрушительное • В начале как разрушитель азотная кислота была основой для получения……. . • А затем для получения ………. • Шведский химик А. Нобель использовал это для получения……. . п о р о х д и н а м и т
Применение азотной кислоты имеет два лица: созидательное и разрушительное • В начале как разрушитель азотная кислота была основой для получения……. . • А затем для получения ………. • Шведский химик А. Нобель использовал это для получения……. . п о р о х д и н а м и т
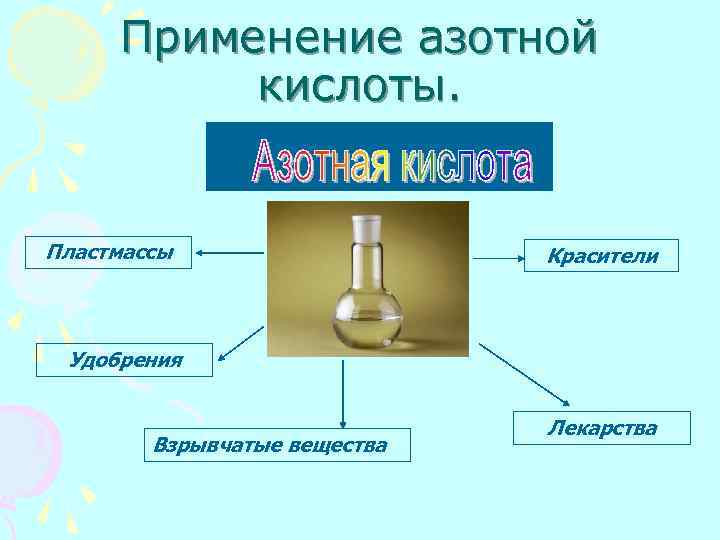 Применение азотной кислоты. Пластмассы Красители Удобрения Взрывчатые вещества Лекарства
Применение азотной кислоты. Пластмассы Красители Удобрения Взрывчатые вещества Лекарства


