Кислородные соединения азота.pptx
- Количество слайдов: 22
 Кислородные соединения азота.
Кислородные соединения азота.
 Оксид азота (I) N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Несолеобразующий оксид. 2 N 2 O=2 N 2+O 2 (баланс) N 2 O + Сu= N 2 + Сu. O (баланс)
Оксид азота (I) N 2 O – оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Несолеобразующий оксид. 2 N 2 O=2 N 2+O 2 (баланс) N 2 O + Сu= N 2 + Сu. O (баланс)
 Оксид азота (II) NO – оксид азота (I I) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Несолеобразующий оксид. 2 NO+ O 2= 2 NO 2 (баланс)
Оксид азота (II) NO – оксид азота (I I) бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Несолеобразующий оксид. 2 NO+ O 2= 2 NO 2 (баланс)
 Оксид азота (III) N 2 O 3 – оксид азота (III) жидкость темно- синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. Кислотный оксид, при взаимодействии с водой образуется азотистая кислота. N 2 O 3 + H 2 O =HNO 2
Оксид азота (III) N 2 O 3 – оксид азота (III) жидкость темно- синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. Кислотный оксид, при взаимодействии с водой образуется азотистая кислота. N 2 O 3 + H 2 O =HNO 2
 Оксид азота (IV) NO 2 – оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. 2 NO 2 + H 2 O = HNO 2 + HNO 3(баланс) Проявляет все свойства кислотных оксидов: 2 KOH(разб. ) + 2 NO 2 = KNO 2 + KNO 3 + H 2 O K 2 O + 2 NO 2 = KNO 2 + KNO 3
Оксид азота (IV) NO 2 – оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. 2 NO 2 + H 2 O = HNO 2 + HNO 3(баланс) Проявляет все свойства кислотных оксидов: 2 KOH(разб. ) + 2 NO 2 = KNO 2 + KNO 3 + H 2 O K 2 O + 2 NO 2 = KNO 2 + KNO 3
 Оксид азота (V) N 2 O 5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. N 2 O 5 + H 2 O = 2 HNO 3 Продуктом реакции между кислотным оксидом и водой является кислота
Оксид азота (V) N 2 O 5 – оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. N 2 O 5 + H 2 O = 2 HNO 3 Продуктом реакции между кислотным оксидом и водой является кислота
 НАЗОВИТЕ КИСЛОТЫ, ОБРАЗУЕМЫЕ АЗОТОМ И СРАВНИТЕ ИХ СВОЙСТВА Параметры сравнения Химическая формула Степень окисления азота Валентность азота Температура кипения Устойчивость Химические свойства Азотистая кислота Азотная кислота
НАЗОВИТЕ КИСЛОТЫ, ОБРАЗУЕМЫЕ АЗОТОМ И СРАВНИТЕ ИХ СВОЙСТВА Параметры сравнения Химическая формула Степень окисления азота Валентность азота Температура кипения Устойчивость Химические свойства Азотистая кислота Азотная кислота
 Азотная кислота. HNO 3 Азотная кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно растворяется в воде, tкип= 82. 6 0 С. Растворы азотной кислоты хранят в банке из темного стекла, т. е. она разлагается на свету: 4 HNO 3=4 NO 2+2 H 2 O+O 2
Азотная кислота. HNO 3 Азотная кислота – бесцветная гигроскопичная жидкость, имеет резкий запах, «дымит» на воздухе, неограниченно растворяется в воде, tкип= 82. 6 0 С. Растворы азотной кислоты хранят в банке из темного стекла, т. е. она разлагается на свету: 4 HNO 3=4 NO 2+2 H 2 O+O 2
 Азотистая кислота. HNO 2 Азотистая кислота в чистом виде не выделена, существует только в разбавленных водных растворах, в растворе имеет голубую окраску, устойчива при 0 °С. Является слабой кислотой. t кип. 158 °C
Азотистая кислота. HNO 2 Азотистая кислота в чистом виде не выделена, существует только в разбавленных водных растворах, в растворе имеет голубую окраску, устойчива при 0 °С. Является слабой кислотой. t кип. 158 °C
 Химические свойства азотной кислоты: 1) Свойства HNO 3 как электролита Диссоциация: HNO 3 = H+ + NO 3 – 2) с оксидами металлов: Cu. O + 2 HNO 3 = Cu(NO 3)2 + H 2 O Cu. O + 2 H+ = Cu 2+ + H 2 O 3) с основаниями: Cu(OH)2 + 2 HNO 3 = Cu(NO 3)2 + 2 H 2 O Cu(OH)2 + 2 H+ = Cu 2+ + 2 H 2 O 4) с солями: Na 2 CO 3 + 2 HNO 3 = 2 Na. NO 3 + CO 2↑ + H 2 O CO 32 - + 2 H+ = CO 2 + H 2 O
Химические свойства азотной кислоты: 1) Свойства HNO 3 как электролита Диссоциация: HNO 3 = H+ + NO 3 – 2) с оксидами металлов: Cu. O + 2 HNO 3 = Cu(NO 3)2 + H 2 O Cu. O + 2 H+ = Cu 2+ + H 2 O 3) с основаниями: Cu(OH)2 + 2 HNO 3 = Cu(NO 3)2 + 2 H 2 O Cu(OH)2 + 2 H+ = Cu 2+ + 2 H 2 O 4) с солями: Na 2 CO 3 + 2 HNO 3 = 2 Na. NO 3 + CO 2↑ + H 2 O CO 32 - + 2 H+ = CO 2 + H 2 O
 Химические свойства HNO 3 5. Окислительные свойства Взаимодействует с металлами: K Ca Na Mg Al Zn Cr Fe Pb H 2 Cu Hg Ag Au Ме + HNO 3 → Me(NO 3)n + H 2 O + Nx. Oy Cu + 4 HNO 3(конц) = Cu(NO 3)2 + 2 H 2 O + 2 NO 2↑ 3 Cu + 8 HNO 3(разб) = 3 Cu(NO 3)2 + 4 H 2 O + NO↑ Me + HNO 3 = Me(NO 3)2 + H 2↑
Химические свойства HNO 3 5. Окислительные свойства Взаимодействует с металлами: K Ca Na Mg Al Zn Cr Fe Pb H 2 Cu Hg Ag Au Ме + HNO 3 → Me(NO 3)n + H 2 O + Nx. Oy Cu + 4 HNO 3(конц) = Cu(NO 3)2 + 2 H 2 O + 2 NO 2↑ 3 Cu + 8 HNO 3(разб) = 3 Cu(NO 3)2 + 4 H 2 O + NO↑ Me + HNO 3 = Me(NO 3)2 + H 2↑
 Химические свойства HNO 3 6) Окислительные свойства Взаимодействует с неметаллами: (S, P, C) C + 4 HNO 3 → CO 2 + 2 H 2 O + 4 NO 2 7) Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Химические свойства HNO 3 6) Окислительные свойства Взаимодействует с неметаллами: (S, P, C) C + 4 HNO 3 → CO 2 + 2 H 2 O + 4 NO 2 7) Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
 Концентри рованная (> 60%) Разбавлен ная (5 -60%) Очень разбавлен ная (<5 %) до Fe NO NO, N 2 O , N 2 NH 3 (NH 4 NO 3) Pb - Ag NO 2 NO NO Металл Fe, Cr, Al, Au, Pt, Ir, Ta (на Fe, Cr, Al, Au, не действует холоде) Pt, Ir, Ta 0→ с Al при t NO
Концентри рованная (> 60%) Разбавлен ная (5 -60%) Очень разбавлен ная (<5 %) до Fe NO NO, N 2 O , N 2 NH 3 (NH 4 NO 3) Pb - Ag NO 2 NO NO Металл Fe, Cr, Al, Au, Pt, Ir, Ta (на Fe, Cr, Al, Au, не действует холоде) Pt, Ir, Ta 0→ с Al при t NO

 Химические свойства азотистой кислоты: 1) Разложение при нагревании: 3 HNO 2 = HNO 3 + 2 NO + H 2 O. 2) Взаимодействие с основаниями: HNO 2 + Na. OH = Na. NO 2 + H 2 O. 3) Восстановительные свойства. Сильный восстановитель: HNO 2 + Cl 2 + H 2 O = HNO 3 + 2 HCl.
Химические свойства азотистой кислоты: 1) Разложение при нагревании: 3 HNO 2 = HNO 3 + 2 NO + H 2 O. 2) Взаимодействие с основаниями: HNO 2 + Na. OH = Na. NO 2 + H 2 O. 3) Восстановительные свойства. Сильный восстановитель: HNO 2 + Cl 2 + H 2 O = HNO 3 + 2 HCl.
 4) Окислительные свойства. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями): 2 НNO 2 + 2 KI + H 2 SO 4 = K 2 SO 4 + I 2 + 2 NO + 2 H 2 O.
4) Окислительные свойства. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями): 2 НNO 2 + 2 KI + H 2 SO 4 = K 2 SO 4 + I 2 + 2 NO + 2 H 2 O.
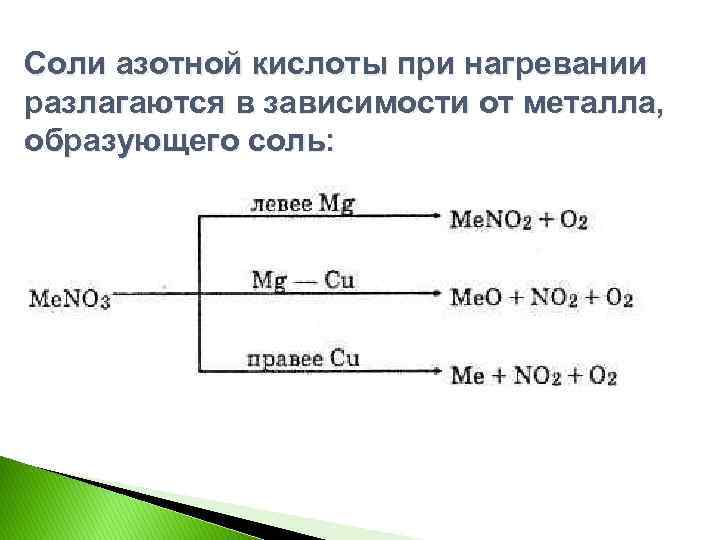 Соли азотной кислоты при нагревании разлагаются в зависимости от металла, образующего соль:
Соли азотной кислоты при нагревании разлагаются в зависимости от металла, образующего соль:
 2. Расположите соединения азота в порядке возрастания степеней окисления I вариант N 2, NH 3, KNO 3, NO, HNO 2 II вариант NO 2, N 2 O, HNO 3, NH 4 Cl, N 2 O 3
2. Расположите соединения азота в порядке возрастания степеней окисления I вариант N 2, NH 3, KNO 3, NO, HNO 2 II вариант NO 2, N 2 O, HNO 3, NH 4 Cl, N 2 O 3
 3. Составьте уравнения реакций по схеме. Назовите вещество Х I вариант N 2 → X → NH 4 Cl II вариант NO 2 → X → NH 4 NO 3
3. Составьте уравнения реакций по схеме. Назовите вещество Х I вариант N 2 → X → NH 4 Cl II вариант NO 2 → X → NH 4 NO 3
 Задание. Составьте уравнения реакций по схемам. HNO 3 + Mg(OH)2— HNO 3 + Mg. O— HNO 3 + Na 2 CO 3— HNO 3 + K 2 Si. O 3 —
Задание. Составьте уравнения реакций по схемам. HNO 3 + Mg(OH)2— HNO 3 + Mg. O— HNO 3 + Na 2 CO 3— HNO 3 + K 2 Si. O 3 —
 Проверьте уравнения 2 HNO 3 + Mg(OH)2 Mg(NO 3)2+2 H 2 O 2 HNO 3 + Mg. O Mg(NO 3)2+2 H 2 O 2 HNO 3 + Na 2 CO 3 2 Na. NO 3+CO 2+H 2 O 2 HNO 3 + K 2 Si. O 3 КNO 3+ H 2 Si. O 3
Проверьте уравнения 2 HNO 3 + Mg(OH)2 Mg(NO 3)2+2 H 2 O 2 HNO 3 + Mg. O Mg(NO 3)2+2 H 2 O 2 HNO 3 + Na 2 CO 3 2 Na. NO 3+CO 2+H 2 O 2 HNO 3 + K 2 Si. O 3 КNO 3+ H 2 Si. O 3
 Домашнее задание: § 27, № 2, 7, с. 158
Домашнее задание: § 27, № 2, 7, с. 158


