азот шикарно.pptx
- Количество слайдов: 20
 Кислородные соединения азота. Автор : Гвоздева Е. А. , учитель химии МБОУ ООШ Г. Кирсанова 2014 http: //linda 6035. ucoz. ru/
Кислородные соединения азота. Автор : Гвоздева Е. А. , учитель химии МБОУ ООШ Г. Кирсанова 2014 http: //linda 6035. ucoz. ru/
 Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N 2 O +2 NO +3 N 2 O 3 +4 NO 2, N 2 O 4 +5 N 2 O 5 http: //linda 6035. ucoz. ru/
Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N 2 O +2 NO +3 N 2 O 3 +4 NO 2, N 2 O 4 +5 N 2 O 5 http: //linda 6035. ucoz. ru/
 +1 N 2 O оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Получение: NH 4 NO = N 2 O +2 H 2 O Химические свойства: 1. разложение при нагревании 2 N 2+1 O = 2 N 20+O 2 2. с водородом N 2+1 O +H 2 = N 20 +H 2 O http: //linda 6035. ucoz. ru/ несолеобразующий
+1 N 2 O оксид азота (I), закись азота или «веселящий газ» , возбуждающе действует на нервную систему человека, используют в медицине как анестезирующее средство. Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Получение: NH 4 NO = N 2 O +2 H 2 O Химические свойства: 1. разложение при нагревании 2 N 2+1 O = 2 N 20+O 2 2. с водородом N 2+1 O +H 2 = N 20 +H 2 O http: //linda 6035. ucoz. ru/ несолеобразующий
 +2 NO бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Получение: 1. В природе: 2. В промышленности: N 2 + O 2 = 2 NO 4 NH 3 + 5 O 2 = 4 NO +6 H 2 O Химические свойства: 1. легко окисляется: 2. окислитель: 2 N+2 O + O 2 = 2 N+4 O 2 2 N+2 O + 2 SO 2 = 2 SO 3 +N 20 http: //linda 6035. ucoz. ru/ несолеобразующий
+2 NO бесцветный газ, термически устойчивый, плохо растворим в воде, практически мгновенно взаимодействует с кислородом (при комнатной температуре). Получение: 1. В природе: 2. В промышленности: N 2 + O 2 = 2 NO 4 NH 3 + 5 O 2 = 4 NO +6 H 2 O Химические свойства: 1. легко окисляется: 2. окислитель: 2 N+2 O + O 2 = 2 N+4 O 2 2 N+2 O + 2 SO 2 = 2 SO 3 +N 20 http: //linda 6035. ucoz. ru/ несолеобразующий
 +3 N 2 O 3 жидкость темно-синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. При взаимодействии с водой образуется азотистая кислота. Получение: NO 2 + NO N 2 O 3 Химические свойства: ВСЕ свойства кислотных оксидов. http: //linda 6035. ucoz. ru/ кислотный оксид
+3 N 2 O 3 жидкость темно-синего цвета, термически неустойчивая, t кип. = 3, 5 0 С, т. е. существует в жидком состоянии только при охлаждении, в обычных условиях переходит в газообразное состояние. При взаимодействии с водой образуется азотистая кислота. Получение: NO 2 + NO N 2 O 3 Химические свойства: ВСЕ свойства кислотных оксидов. http: //linda 6035. ucoz. ru/ кислотный оксид
 +4 NO 2 оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. токсичен Получение: 1. 2 NO + O 2 = 2 NO 2 2. Cu + 4 HNO 3(к) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O Химические свойства: 1. с водой 2. с щелочами http: //linda 6035. ucoz. ru/ 2 NO 2 + H 2 O = HNO 3 + HNO 2 2 NO 2 + 2 Na. OH = Na. NO 3 + Na. NO 2 + H 2 O 3. димеризация 2 NO 2 N 2 O 4
+4 NO 2 оксид азота (IV) или диоксид азота, бурый газ, хорошо растворим в воде, полностью реагирует с ней. Является сильным окислителем. токсичен Получение: 1. 2 NO + O 2 = 2 NO 2 2. Cu + 4 HNO 3(к) = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O Химические свойства: 1. с водой 2. с щелочами http: //linda 6035. ucoz. ru/ 2 NO 2 + H 2 O = HNO 3 + HNO 2 2 NO 2 + 2 Na. OH = Na. NO 3 + Na. NO 2 + H 2 O 3. димеризация 2 NO 2 N 2 O 4
 +5 N 2 O 5 оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. Получение: 1. 2 NO 2 + O 3 = N 2 O 5 + O 2 2. 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5 Химические свойства: 1. легко разлагается 2 N 2 O 5 = 4 NO 2 + O 2 2. сильный окислитель http: //linda 6035. ucoz. ru/ кислотный оксид
+5 N 2 O 5 оксид азота (V), азотный ангидрид, белое твердое вещество ( tпл. = 410 С). Проявляет кислотные свойства, является очень сильным окислителем. Получение: 1. 2 NO 2 + O 3 = N 2 O 5 + O 2 2. 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5 Химические свойства: 1. легко разлагается 2 N 2 O 5 = 4 NO 2 + O 2 2. сильный окислитель http: //linda 6035. ucoz. ru/ кислотный оксид
 Состав. Строение. Свойства. HNO 3 O H — O— N O степень окисления азота +5 валентность азота IV химическая связь ковалентная полярная Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. Температура плавления − 41, 59 °C, кипения +82, 6 °C с частичным разложением. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет: 4 HNO 3 = 4 NO 2 + 2 H 2 O Азотная кислота ядовита. http: //linda 6035. ucoz. ru/
Состав. Строение. Свойства. HNO 3 O H — O— N O степень окисления азота +5 валентность азота IV химическая связь ковалентная полярная Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. Температура плавления − 41, 59 °C, кипения +82, 6 °C с частичным разложением. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет: 4 HNO 3 = 4 NO 2 + 2 H 2 O Азотная кислота ядовита. http: //linda 6035. ucoz. ru/
 Азотная кислота (HNO 3) Классификация по: наличию кислорода: кислородсодержащая основности: растворимости в воде: одноосновная растворимая летучести: степени электролитической диссоциации: http: //linda 6035. ucoz. ru/ летучая сильная
Азотная кислота (HNO 3) Классификация по: наличию кислорода: кислородсодержащая основности: растворимости в воде: одноосновная растворимая летучести: степени электролитической диссоциации: http: //linda 6035. ucoz. ru/ летучая сильная
 Получение азотной кислоты в промышленности NH 3 NO NO 2 1. Контактное окисление аммиака до оксида азота (II): 4 NH 3+ 5 O 2 = 4 NO + 6 H 2 O 2. Окисление оксида азота (II) в оксид азота (IV): 2 NO+O 2 = 2 NO 2 3. Адсорбция (поглощение) оксида азота (IV) водой при избытке кислорода 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 http: //linda 6035. ucoz. ru/ HNO 3
Получение азотной кислоты в промышленности NH 3 NO NO 2 1. Контактное окисление аммиака до оксида азота (II): 4 NH 3+ 5 O 2 = 4 NO + 6 H 2 O 2. Окисление оксида азота (II) в оксид азота (IV): 2 NO+O 2 = 2 NO 2 3. Адсорбция (поглощение) оксида азота (IV) водой при избытке кислорода 4 NO 2 + 2 H 2 O + O 2 = 4 HNO 3 http: //linda 6035. ucoz. ru/ HNO 3
 В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Na. NO 3 + H 2 SO 4 = Na. HSO 4 + HNO 3 http: //linda 6035. ucoz. ru/
В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. Na. NO 3 + H 2 SO 4 = Na. HSO 4 + HNO 3 http: //linda 6035. ucoz. ru/
 Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. 1. Свойства HNO 3 как электролита: 1) Диссоциация: HNO 3 = H+ + NO 3 – 2) с основными и амфотерными оксидами 2 HNO 3 + Cu. O = Cu(NO 3)2 + H 2 O 6 HNO 3 + Al 2 O 3 = 2 Al(NO 3)3 + 3 H 2 O 1 2 3 3) с основаниями HNO 3 + Na. OH = Na. NO 3 + H 2 O 2 HNO 3 + Zn(OH)2 = Zn(NO 3)2 + 2 H 2 O 4) с солями 2 HNO 3 + Na 2 Si. O 3 = H 2 Si. O 3↓ + 2 Na. NO 3 http: //linda 6035. ucoz. ru/
Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. 1. Свойства HNO 3 как электролита: 1) Диссоциация: HNO 3 = H+ + NO 3 – 2) с основными и амфотерными оксидами 2 HNO 3 + Cu. O = Cu(NO 3)2 + H 2 O 6 HNO 3 + Al 2 O 3 = 2 Al(NO 3)3 + 3 H 2 O 1 2 3 3) с основаниями HNO 3 + Na. OH = Na. NO 3 + H 2 O 2 HNO 3 + Zn(OH)2 = Zn(NO 3)2 + 2 H 2 O 4) с солями 2 HNO 3 + Na 2 Si. O 3 = H 2 Si. O 3↓ + 2 Na. NO 3 http: //linda 6035. ucoz. ru/
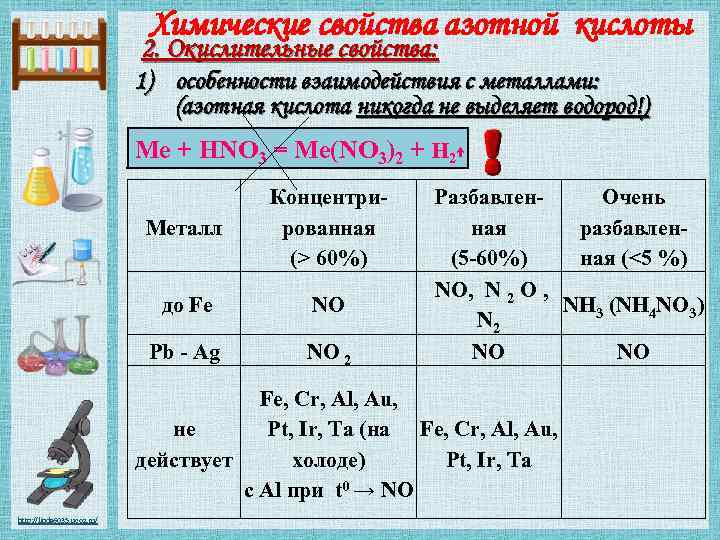 Химические свойства азотной кислоты 2. Окислительные свойства: 1) особенности взаимодействия с металлами: (азотная кислота никогда не выделяет водород!) Me + HNO 3 = Me(NO 3)2 + H 2↑ Металл Концентрированная (> 60%) до Fe NO Pb - Ag NO 2 Разбавлен. Очень ная разбавлен(5 -60%) ная (<5 %) NO, N 2 O , NH 3 (NH 4 NO 3) N 2 NO NO Fe, Cr, Al, Au, не Pt, Ir, Ta (на Fe, Cr, Al, Au, действует холоде) Pt, Ir, Ta с Al при t 0 → NO http: //linda 6035. ucoz. ru/
Химические свойства азотной кислоты 2. Окислительные свойства: 1) особенности взаимодействия с металлами: (азотная кислота никогда не выделяет водород!) Me + HNO 3 = Me(NO 3)2 + H 2↑ Металл Концентрированная (> 60%) до Fe NO Pb - Ag NO 2 Разбавлен. Очень ная разбавлен(5 -60%) ная (<5 %) NO, N 2 O , NH 3 (NH 4 NO 3) N 2 NO NO Fe, Cr, Al, Au, не Pt, Ir, Ta (на Fe, Cr, Al, Au, действует холоде) Pt, Ir, Ta с Al при t 0 → NO http: //linda 6035. ucoz. ru/
 Химические свойства азотной кислоты С металлами, стоящими в ряду напряжений левее водорода: С металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO 3 Разбавленная HNO 3 http: //linda 6035. ucoz. ru/
Химические свойства азотной кислоты С металлами, стоящими в ряду напряжений левее водорода: С металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO 3 Разбавленная HNO 3 http: //linda 6035. ucoz. ru/
 Химические свойства азотной кислоты 2. Окислительные свойства 2) Особенности взаимодействия с неметаллами (S, P, C): 3 P + 5 HNO 3 + H 2 O = 3 H 3 PO 4 + 5 NO C + 4 HNO 3 = CO 2 + H 2 O + 4 NO 2 5 HNO 3 + 3 P + 2 H 2 O → 3 H 3 PO 4 + 5 NO 3) Взаимодействует с органическими веществами (скипидар вспыхивает): http: //linda 6035. ucoz. ru/
Химические свойства азотной кислоты 2. Окислительные свойства 2) Особенности взаимодействия с неметаллами (S, P, C): 3 P + 5 HNO 3 + H 2 O = 3 H 3 PO 4 + 5 NO C + 4 HNO 3 = CO 2 + H 2 O + 4 NO 2 5 HNO 3 + 3 P + 2 H 2 O → 3 H 3 PO 4 + 5 NO 3) Взаимодействует с органическими веществами (скипидар вспыхивает): http: //linda 6035. ucoz. ru/
 Применение азотной кислоты 1 Производство азотных и комплексных удобрений. 2 Производство взрывчатых веществ 3 Производство красителей 4 Производство лекарств 5 Производство пленок, нитролаков, нитроэмалей 6 Производство искусственных волокон 7 Как компонент нитрующей смеси, для траления металлов в металлургии http: //linda 6035. ucoz. ru/
Применение азотной кислоты 1 Производство азотных и комплексных удобрений. 2 Производство взрывчатых веществ 3 Производство красителей 4 Производство лекарств 5 Производство пленок, нитролаков, нитроэмалей 6 Производство искусственных волокон 7 Как компонент нитрующей смеси, для траления металлов в металлургии http: //linda 6035. ucoz. ru/
 Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Свойства: ВСЕ растворимы в воде. Селитры – соли азотной кислоты и щелочных металлов. Na. NO 3 – натриевая селитра KNO 3 – калийная селитра NH 4 NO 3 – аммиачная селитра Ca(NO 3)2 – кальциевая селитра http: //linda 6035. ucoz. ru/
Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Свойства: ВСЕ растворимы в воде. Селитры – соли азотной кислоты и щелочных металлов. Na. NO 3 – натриевая селитра KNO 3 – калийная селитра NH 4 NO 3 – аммиачная селитра Ca(NO 3)2 – кальциевая селитра http: //linda 6035. ucoz. ru/
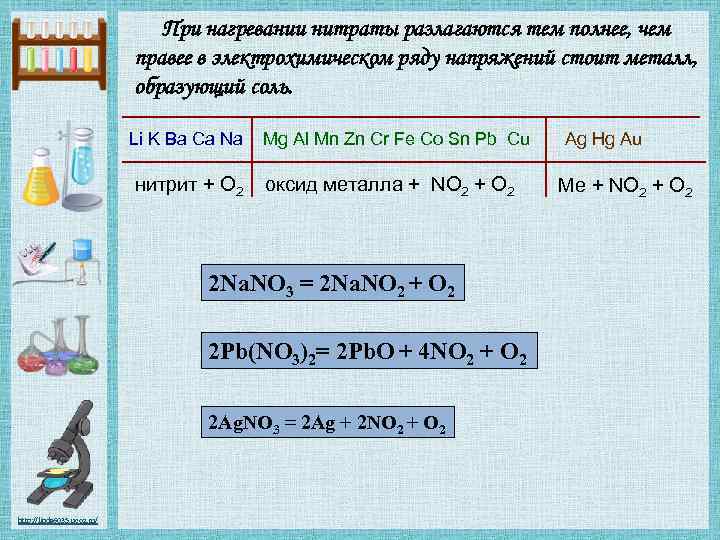 При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль. Li K Ba Ca Na нитрит + О 2 Mg Al Mn Zn Cr Fe Co Sn Pb Cu оксид металла + NO 2 + O 2 2 Na. NO 3 = 2 Na. NO 2 + O 2 2 Pb(NO 3)2= 2 Pb. O + 4 NO 2 + O 2 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2 http: //linda 6035. ucoz. ru/ Ag Hg Au Ме + NO 2 + O 2
При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль. Li K Ba Ca Na нитрит + О 2 Mg Al Mn Zn Cr Fe Co Sn Pb Cu оксид металла + NO 2 + O 2 2 Na. NO 3 = 2 Na. NO 2 + O 2 2 Pb(NO 3)2= 2 Pb. O + 4 NO 2 + O 2 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2 http: //linda 6035. ucoz. ru/ Ag Hg Au Ме + NO 2 + O 2
 Селитры используются как удобрения. KNO 3 применяется для приготовления черного пороха. http: //linda 6035. ucoz. ru/
Селитры используются как удобрения. KNO 3 применяется для приготовления черного пороха. http: //linda 6035. ucoz. ru/
 Домашнее задание: § 26, упр. 2, 4 стр. 121. http: //linda 6035. ucoz. ru/
Домашнее задание: § 26, упр. 2, 4 стр. 121. http: //linda 6035. ucoz. ru/


