 Кислород Химия 8 класс 24. 04. 2013 1
Кислород Химия 8 класс 24. 04. 2013 1
 Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер № 8, Ar = 16. 2. Строение атома: +8 О ) ) 26 1 S 2 S 2 2 P 4 валентность II, степень окисления -2 (редко +2; +1; -1). 3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов. (Примеры? ) 16. 02. 2018 2
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер № 8, Ar = 16. 2. Строение атома: +8 О ) ) 26 1 S 2 S 2 2 P 4 валентность II, степень окисления -2 (редко +2; +1; -1). 3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов. (Примеры? ) 16. 02. 2018 2
 Кислород как элемент (продолжение). 4. В земной коре его 49%, в воде – 89%. 5. В составе воздуха (в виде простого вещества) – 20 -21% по объёму. Состав воздуха: О 2 – 20 -21 %; N 2 – 78%; CO 2 – 0, 03%, остальное приходится на инертные газы, пары воды, примеси. Дополнительно … Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры. 16. 02. 2018 3
Кислород как элемент (продолжение). 4. В земной коре его 49%, в воде – 89%. 5. В составе воздуха (в виде простого вещества) – 20 -21% по объёму. Состав воздуха: О 2 – 20 -21 %; N 2 – 78%; CO 2 – 0, 03%, остальное приходится на инертные газы, пары воды, примеси. Дополнительно … Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры. 16. 02. 2018 3
 Способы получения и собирания кислорода. Кислород в природе образуется в процессе фотосинтеза. В промышленности его получают перегонкой сжиженного воздуха при t = - 1830 С. В лаборатории кислород получают реакциями разложения: а) воды под действием электрического тока (электролиз): 2 H 2 O → 2 H 2 + O 2 б) пероксида водорода под действием Mn. O 2 : Mn. O 2 2 Н 2 О 2 16. 02. 2018 → 2 Н 2 О + О 2 4
Способы получения и собирания кислорода. Кислород в природе образуется в процессе фотосинтеза. В промышленности его получают перегонкой сжиженного воздуха при t = - 1830 С. В лаборатории кислород получают реакциями разложения: а) воды под действием электрического тока (электролиз): 2 H 2 O → 2 H 2 + O 2 б) пероксида водорода под действием Mn. O 2 : Mn. O 2 2 Н 2 О 2 16. 02. 2018 → 2 Н 2 О + О 2 4
 Способы получения и собирания кислорода (продолжение). ! Катализатор – вещество, изменяющее скорость реакции, но само при этом не расходующееся. в) перманганата калия при нагревании: 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2 Разложение этой соли идёт при нагревании её выше 2000 С. Подумайте … Как проверить, собрался ли кислород в сосуде? 16. 02. 2018 5
Способы получения и собирания кислорода (продолжение). ! Катализатор – вещество, изменяющее скорость реакции, но само при этом не расходующееся. в) перманганата калия при нагревании: 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2 Разложение этой соли идёт при нагревании её выше 2000 С. Подумайте … Как проверить, собрался ли кислород в сосуде? 16. 02. 2018 5
 Опыты получения кислорода. 16. 02. 2018 6
Опыты получения кислорода. 16. 02. 2018 6
 Проверка собравшегося кислорода 16. 02. 2018 7
Проверка собравшегося кислорода 16. 02. 2018 7
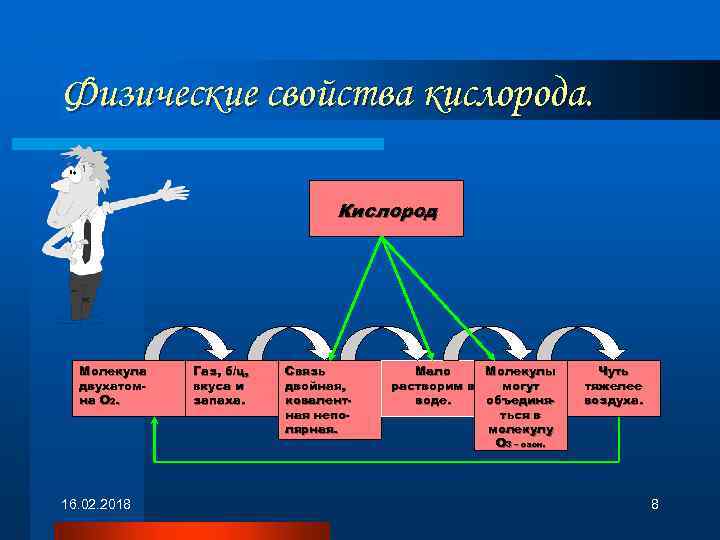 Физические свойства кислорода. Кислород Молекула двухатомна О 2. 16. 02. 2018 Газ, б/ц, вкуса и запаха. Связь двойная, ковалентная неполярная. Молекулы Мало могут растворим в объединяводе. ться в молекулу О 3 – озон. Чуть тяжелее воздуха. 8
Физические свойства кислорода. Кислород Молекула двухатомна О 2. 16. 02. 2018 Газ, б/ц, вкуса и запаха. Связь двойная, ковалентная неполярная. Молекулы Мало могут растворим в объединяводе. ться в молекулу О 3 – озон. Чуть тяжелее воздуха. 8
 Химические свойства кислород обладает высокой электроотрицательностью; l в реакциях выступает окислителем; l поддерживает процессы горения и медленного окисления, к которым относится, например, дыхание. l Подумайте … Горение – это окисление, идущее с выделением тепла и света. Каковы условия горения? 16. 02. 2018 9
Химические свойства кислород обладает высокой электроотрицательностью; l в реакциях выступает окислителем; l поддерживает процессы горения и медленного окисления, к которым относится, например, дыхание. l Подумайте … Горение – это окисление, идущее с выделением тепла и света. Каковы условия горения? 16. 02. 2018 9
 Допиши химические реакции: Ca + O 2 → Na + O 2 → Al + O 2 → S + O 2 → Cu. O → Fe 2 O 3 → 16. 02. 2018 10
Допиши химические реакции: Ca + O 2 → Na + O 2 → Al + O 2 → S + O 2 → Cu. O → Fe 2 O 3 → 16. 02. 2018 10
 l Как погасить горящую древесину? l Загоревшуюся на человеке одежду? l Горящую на поверхности воды нефть? 16. 02. 2018 11
l Как погасить горящую древесину? l Загоревшуюся на человеке одежду? l Горящую на поверхности воды нефть? 16. 02. 2018 11
 Применение кислорода: l l l 16. 02. 2018 Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом. При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек. Кислородом в баллонах снабжают подводные лодки. Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах. Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой. 12
Применение кислорода: l l l 16. 02. 2018 Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом. При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек. Кислородом в баллонах снабжают подводные лодки. Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах. Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой. 12


