 Кислород – химический элемент N = 8 Ar = 16 p – 8, e – 8, n - 8 -2 окислитель
Кислород – химический элемент N = 8 Ar = 16 p – 8, e – 8, n - 8 -2 окислитель
 Самый распространенный элемент на Земле Воздух – 21% Земная кора – 49% Гидросфера – 89% Живые организмы – 65%
Самый распространенный элемент на Земле Воздух – 21% Земная кора – 49% Гидросфера – 89% Живые организмы – 65%
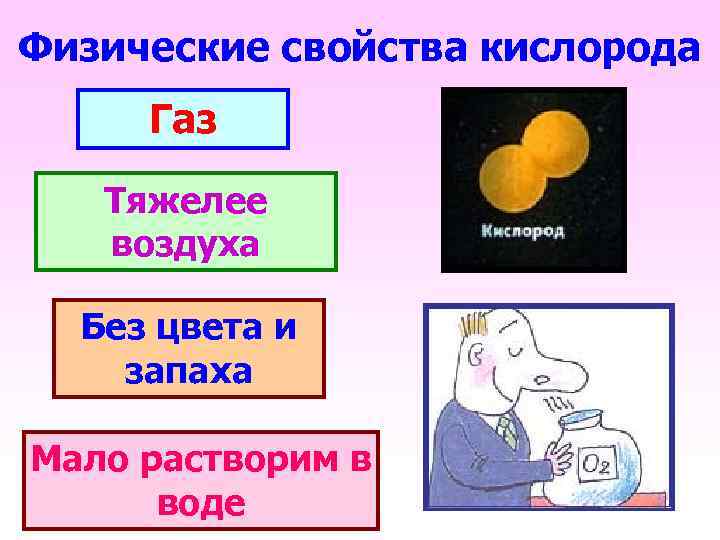 Физические свойства кислорода Газ Тяжелее воздуха Без цвета и запаха Мало растворим в воде
Физические свойства кислорода Газ Тяжелее воздуха Без цвета и запаха Мало растворим в воде
 Способы получения кислорода В промышленности – перегонка жидкого воздуха Стальной баллон, Р – 15 МПа
Способы получения кислорода В промышленности – перегонка жидкого воздуха Стальной баллон, Р – 15 МПа
 -196°С азот аргон -183°С Жидкий кислород -200°С
-196°С азот аргон -183°С Жидкий кислород -200°С
 В лаборатории 1. Разложение воды электрическим током (электролиз воды) эл. ток 2 Н 2 О → 2 Н 2 + О 2 2. Разложение сложных кислородсодержащих веществ Оксид ртути (ll) t 2 Hg. O 2 Hg + O 2
В лаборатории 1. Разложение воды электрическим током (электролиз воды) эл. ток 2 Н 2 О → 2 Н 2 + О 2 2. Разложение сложных кислородсодержащих веществ Оксид ртути (ll) t 2 Hg. O 2 Hg + O 2
 kat 2 Н 2 О 2 → 2 Н 2 О + О 2 ↑ Перекись водорода Катализатор — вещество, ускоряющее реакцию t° 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2 ↑ Перманганат калия
kat 2 Н 2 О 2 → 2 Н 2 О + О 2 ↑ Перекись водорода Катализатор — вещество, ускоряющее реакцию t° 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2 ↑ Перманганат калия
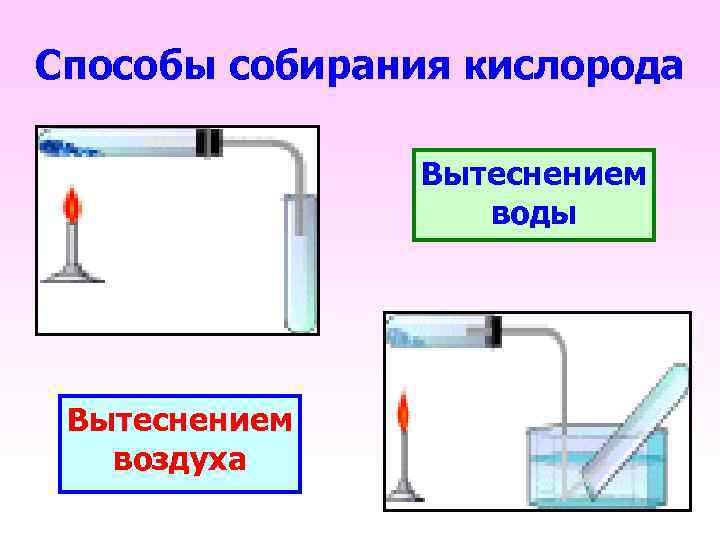 Способы собирания кислорода Вытеснением воды Вытеснением воздуха
Способы собирания кислорода Вытеснением воды Вытеснением воздуха
 Наличие кислорода доказывают тлеющей лучинкой
Наличие кислорода доказывают тлеющей лучинкой
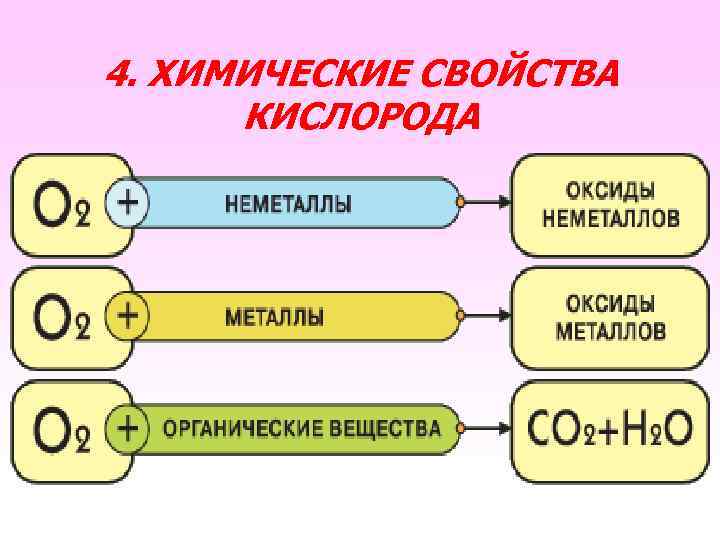 4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
 Химические свойства кислорода Горение – быстрое окисление t° +3 -2 4 Al + O 2 → Al O 3 3 2 2 оксид алюминия t° 3 Fe + 2 O 2 → Fe 3 O 4 Оксид железа (ll, lll)
Химические свойства кислорода Горение – быстрое окисление t° +3 -2 4 Al + O 2 → Al O 3 3 2 2 оксид алюминия t° 3 Fe + 2 O 2 → Fe 3 O 4 Оксид железа (ll, lll)
 t° +5 -2 4 Р + О 2 → Р О 5 2 2 5 P 4 O 10 оксид фосфора (V) t°+4 -2 С + О 2 → СО 2 оксид углерода (l. V) t° +4 -2 S + O 2 → SO 2 оксид серы (l. V) При горении элементов в кислороде образуются оксиды этих элементов
t° +5 -2 4 Р + О 2 → Р О 5 2 2 5 P 4 O 10 оксид фосфора (V) t°+4 -2 С + О 2 → СО 2 оксид углерода (l. V) t° +4 -2 S + O 2 → SO 2 оксид серы (l. V) При горении элементов в кислороде образуются оксиды этих элементов
 При горении сложных веществ образуются оксиды элементов, из которых состоит молекула сложного вещества! t°+2 -2 +4 -2 2 Cu. S + O 2 → Cu. O + SO 2 3 2 2 +2 -2 Оксид меди (ll) оксид серы (l. V) t°+4 -2 СН 4 + О 2 → СО + Н 2 О 2 2 2 оксид углерода (l. V)
При горении сложных веществ образуются оксиды элементов, из которых состоит молекула сложного вещества! t°+2 -2 +4 -2 2 Cu. S + O 2 → Cu. O + SO 2 3 2 2 +2 -2 Оксид меди (ll) оксид серы (l. V) t°+4 -2 СН 4 + О 2 → СО + Н 2 О 2 2 2 оксид углерода (l. V)
 4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2 2 H 2 S + 3 O 2 2 SO 2 + 2 H 2 O Для прекращения реакции горения необходимо перекрыть доступ кислорода
4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2 2 H 2 S + 3 O 2 2 SO 2 + 2 H 2 O Для прекращения реакции горения необходимо перекрыть доступ кислорода
 Медленное окисление 4 Fe + 3 O 2 + 2 n. H 2 O = 2 Fe 2 O 3× n. H 2 O (ржавчина – гидрат оксида железа (III) )
Медленное окисление 4 Fe + 3 O 2 + 2 n. H 2 O = 2 Fe 2 O 3× n. H 2 O (ржавчина – гидрат оксида железа (III) )
 Применение кислорода
Применение кислорода