ОБЩАЯ 2 кинетика.pptx
- Количество слайдов: 19
 Кинетика химических реакций Закономерности протекания химических реакций
Кинетика химических реакций Закономерности протекания химических реакций
 Химическая кинетика изучает закономерности протекания химических реакций во времени, с ее помощью можно оптимизировать процессы и изучать их механизм. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т. е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача). Основные различия между химической термодинамикой и кинетикой: 1. В химической термодинамике нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамические) системы. 2. Равновесные свойства определяется состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции. 3. Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства – их концентрацией.
Химическая кинетика изучает закономерности протекания химических реакций во времени, с ее помощью можно оптимизировать процессы и изучать их механизм. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т. е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача). Основные различия между химической термодинамикой и кинетикой: 1. В химической термодинамике нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамические) системы. 2. Равновесные свойства определяется состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции. 3. Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства – их концентрацией.
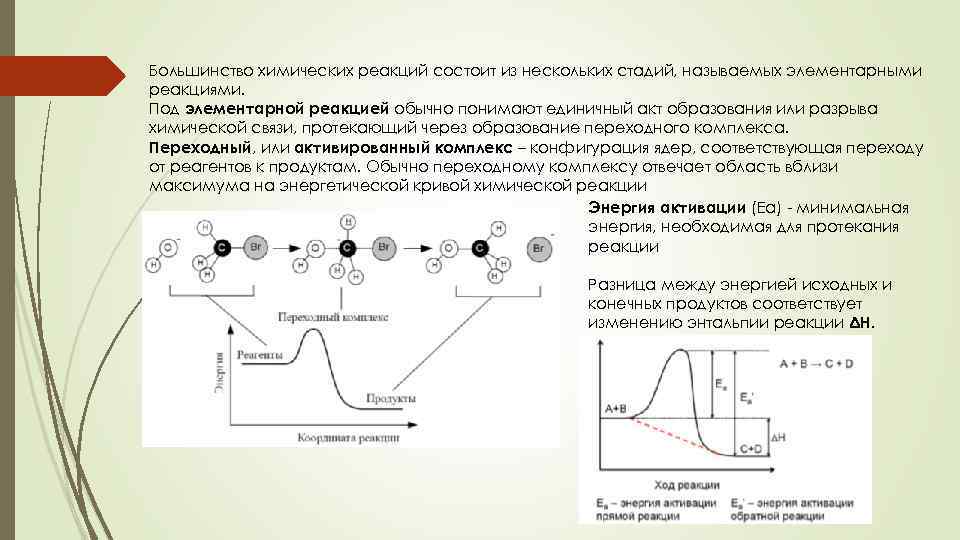 Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный, или активированный комплекс – конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции Энергия активации (Еа) - минимальная энергия, необходимая для протекания реакции Разница между энергией исходных и конечных продуктов соответствует изменению энтальпии реакции ΔН.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Переходный, или активированный комплекс – конфигурация ядер, соответствующая переходу от реагентов к продуктам. Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции Энергия активации (Еа) - минимальная энергия, необходимая для протекания реакции Разница между энергией исходных и конечных продуктов соответствует изменению энтальпии реакции ΔН.
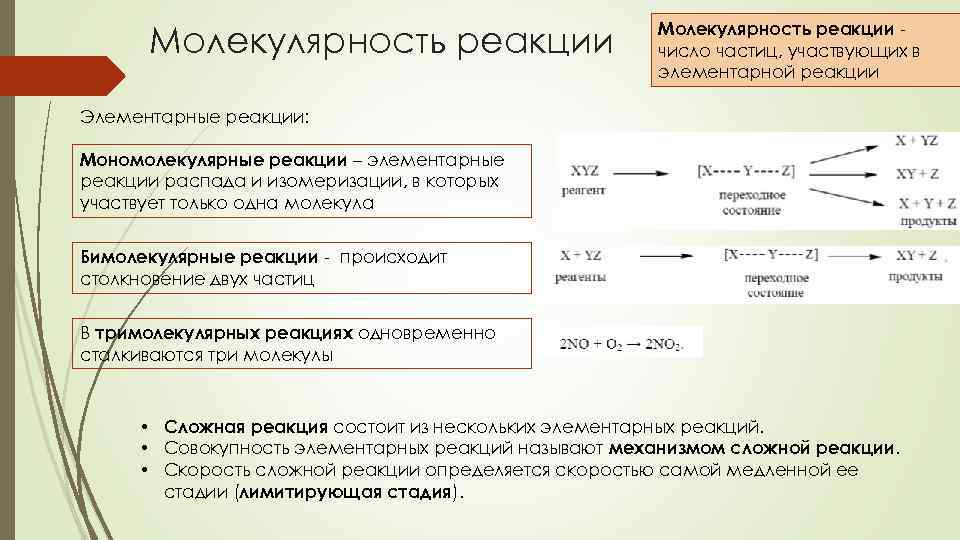 Молекулярность реакции число частиц, участвующих в элементарной реакции Элементарные реакции: Мономолекулярные реакции – элементарные реакции распада и изомеризации, в которых участвует только одна молекула Бимолекулярные реакции - происходит столкновение двух частиц В тримолекулярных реакциях одновременно сталкиваются три молекулы • Сложная реакция состоит из нескольких элементарных реакций. • Совокупность элементарных реакций называют механизмом сложной реакции. • Скорость сложной реакции определяется скоростью самой медленной ее стадии (лимитирующая стадия).
Молекулярность реакции число частиц, участвующих в элементарной реакции Элементарные реакции: Мономолекулярные реакции – элементарные реакции распада и изомеризации, в которых участвует только одна молекула Бимолекулярные реакции - происходит столкновение двух частиц В тримолекулярных реакциях одновременно сталкиваются три молекулы • Сложная реакция состоит из нескольких элементарных реакций. • Совокупность элементарных реакций называют механизмом сложной реакции. • Скорость сложной реакции определяется скоростью самой медленной ее стадии (лимитирующая стадия).
 Скорость химической реакции в газовой фазе или растворе определяется как изменениием числа молекул (или числа молей) вещества в единице объема в единицу времени. υ = ±(1/V)(dn/dτ). Знак плюс используют, если скорость определяют по продукту, а минус – по исходному веществу. Если реакция протекает при постоянном объеме, то скорость выражают через молярную концентрацию: С = n/V, которая имеет размерность моль⋅л– 1. Если в реакции участвует несколько веществ, то скорость можно выражать через концентрацию любого из них, так концентрации остальных веществ связаны с ней стехиометрическими соотношениями. Скорость в момент времени t (мгновенная) Средняя скорость Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль⋅л– 1⋅с– 1, моль⋅см– 3⋅с– 1, Па⋅с– 1 и др.
Скорость химической реакции в газовой фазе или растворе определяется как изменениием числа молекул (или числа молей) вещества в единице объема в единицу времени. υ = ±(1/V)(dn/dτ). Знак плюс используют, если скорость определяют по продукту, а минус – по исходному веществу. Если реакция протекает при постоянном объеме, то скорость выражают через молярную концентрацию: С = n/V, которая имеет размерность моль⋅л– 1. Если в реакции участвует несколько веществ, то скорость можно выражать через концентрацию любого из них, так концентрации остальных веществ связаны с ней стехиометрическими соотношениями. Скорость в момент времени t (мгновенная) Средняя скорость Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ. Скорость реакции выражают в различных единицах: моль⋅л– 1⋅с– 1, моль⋅см– 3⋅с– 1, Па⋅с– 1 и др.
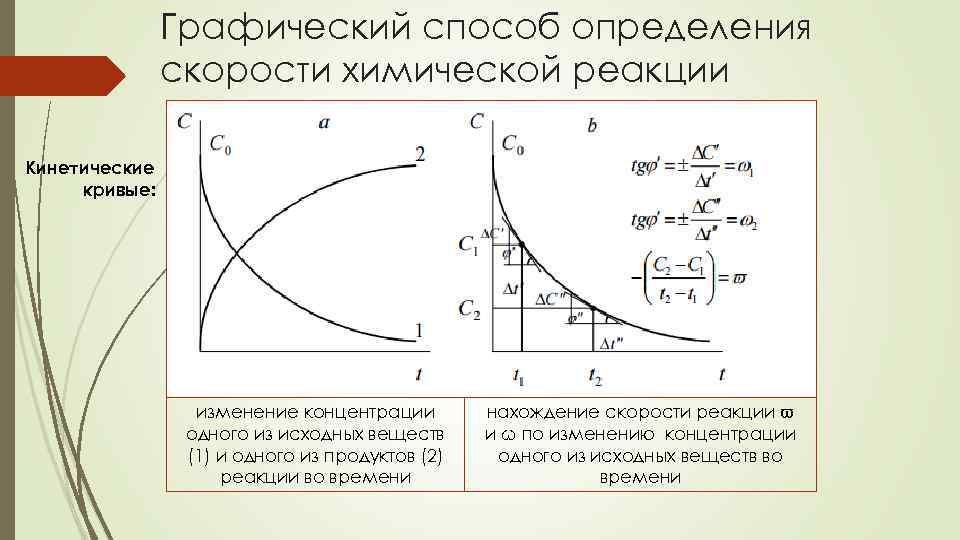 Графический способ определения скорости химической реакции Кинетические кривые: изменение концентрации одного из исходных веществ (1) и одного из продуктов (2) реакции во времени нахождение скорости реакции ϖ и ω по изменению концентрации одного из исходных веществ во времени
Графический способ определения скорости химической реакции Кинетические кривые: изменение концентрации одного из исходных веществ (1) и одного из продуктов (2) реакции во времени нахождение скорости реакции ϖ и ω по изменению концентрации одного из исходных веществ во времени
 Факторы, влияющие на скорость химической реакции природа реагирующих веществ; концентрация реагирующих веществ; температура; наличие катализатора; ЗДМ: Скорость химической реакции при постоянной температуре прямо пропорциональна произведению мольных концентраций реагирующих веществ, возведенных в определенные степени 1867 г. , К. Гульдберг и П Вааге величина поверхности раздела (для гетерогенных реакций); прочие энергетические воздействия (свет, радиация, механические деформации и т. д. ). АВ + С → А + ВС υ = k[C]m[AB]n [C], [AB] – мольные концентрации реагентов (моль/л); k – константа скорости реакции, равная скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л; величины m и n (показатели степеней) определяются экспериментально и не всегда совпадают со стехиометрическими коэффициентами уравнения химической реакции. Сумму m+n называют общим порядком реакции, m или n в отдельности – частные порядки по конкретным реагентам. • Порядок реакции может быть положительным или отрицательным, целым или дробным. • Показатели m и n равны стехиометрическим коэффициентам в уравнении реакции только в том случае, когда она является элементарной, или кинетическое уравнение записано для элементарной стадии реакции.
Факторы, влияющие на скорость химической реакции природа реагирующих веществ; концентрация реагирующих веществ; температура; наличие катализатора; ЗДМ: Скорость химической реакции при постоянной температуре прямо пропорциональна произведению мольных концентраций реагирующих веществ, возведенных в определенные степени 1867 г. , К. Гульдберг и П Вааге величина поверхности раздела (для гетерогенных реакций); прочие энергетические воздействия (свет, радиация, механические деформации и т. д. ). АВ + С → А + ВС υ = k[C]m[AB]n [C], [AB] – мольные концентрации реагентов (моль/л); k – константа скорости реакции, равная скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л; величины m и n (показатели степеней) определяются экспериментально и не всегда совпадают со стехиометрическими коэффициентами уравнения химической реакции. Сумму m+n называют общим порядком реакции, m или n в отдельности – частные порядки по конкретным реагентам. • Порядок реакции может быть положительным или отрицательным, целым или дробным. • Показатели m и n равны стехиометрическим коэффициентам в уравнении реакции только в том случае, когда она является элементарной, или кинетическое уравнение записано для элементарной стадии реакции.
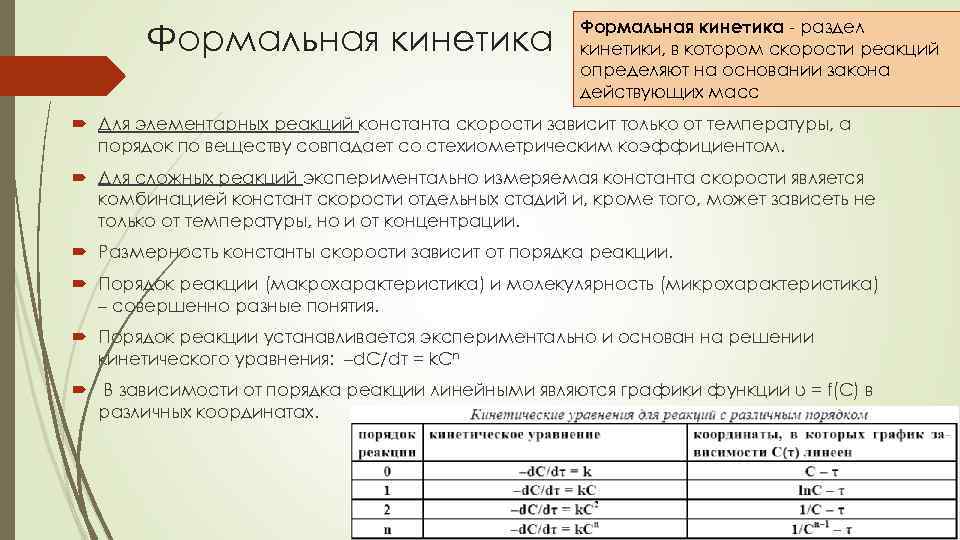 Формальная кинетика - раздел кинетики, в котором скорости реакций определяют на основании закона действующих масс Для элементарных реакций константа скорости зависит только от температуры, а порядок по веществу совпадает со стехиометрическим коэффициентом. Для сложных реакций экспериментально измеряемая константа скорости является комбинацией констант скорости отдельных стадий и, кроме того, может зависеть не только от температуры, но и от концентрации. Размерность константы скорости зависит от порядка реакции. Порядок реакции (макрохарактеристика) и молекулярность (микрохарактеристика) – совершенно разные понятия. Порядок реакции устанавливается экспериментально и основан на решении кинетического уравнения: –d. C/dτ = k. Cn В зависимости от порядка реакции линейными являются графики функции υ = f(С) в различных координатах.
Формальная кинетика - раздел кинетики, в котором скорости реакций определяют на основании закона действующих масс Для элементарных реакций константа скорости зависит только от температуры, а порядок по веществу совпадает со стехиометрическим коэффициентом. Для сложных реакций экспериментально измеряемая константа скорости является комбинацией констант скорости отдельных стадий и, кроме того, может зависеть не только от температуры, но и от концентрации. Размерность константы скорости зависит от порядка реакции. Порядок реакции (макрохарактеристика) и молекулярность (микрохарактеристика) – совершенно разные понятия. Порядок реакции устанавливается экспериментально и основан на решении кинетического уравнения: –d. C/dτ = k. Cn В зависимости от порядка реакции линейными являются графики функции υ = f(С) в различных координатах.
 Кинетика реакций целого порядка Реакции 0 -го порядка: § скорость реакции не зависит от концентрации данного компонента § при большом избытке одного из реагентов, когда он одновременно служит растворителем Период полураспада (полупревращения) - промежуток времени, в течение которого прореагирует половина исходного количества вещества.
Кинетика реакций целого порядка Реакции 0 -го порядка: § скорость реакции не зависит от концентрации данного компонента § при большом избытке одного из реагентов, когда он одновременно служит растворителем Период полураспада (полупревращения) - промежуток времени, в течение которого прореагирует половина исходного количества вещества.
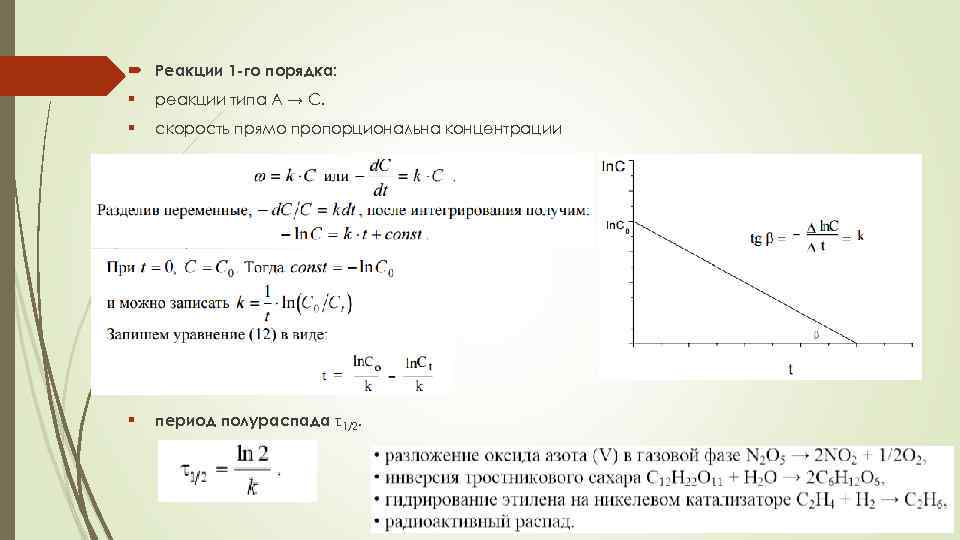 Реакции 1 -го порядка: § реакции типа A → С. § скорость прямо пропорциональна концентрации § период полураспада τ1/2.
Реакции 1 -го порядка: § реакции типа A → С. § скорость прямо пропорциональна концентрации § период полураспада τ1/2.
 Реакции 2 -го порядка: § скорость прямо пропорциональна произведению концентраций начальные концентрации веществ: [A]0 = a, [B]0 = b; текущие концентрации: [A] = a – x(τ), [B] = b – x(τ). § При решении этого уравнения различают два случая: 1. Одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид: Решение уравнения записывают в различных формах: Период полураспада A и B одинаков и равен: 2. Начальные концентрации веществ A и B различны: a ≠ b. Кинетическое уравнение имеет вид : Решение уравнения: Периоды полураспада веществ A и B различны
Реакции 2 -го порядка: § скорость прямо пропорциональна произведению концентраций начальные концентрации веществ: [A]0 = a, [B]0 = b; текущие концентрации: [A] = a – x(τ), [B] = b – x(τ). § При решении этого уравнения различают два случая: 1. Одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид: Решение уравнения записывают в различных формах: Период полураспада A и B одинаков и равен: 2. Начальные концентрации веществ A и B различны: a ≠ b. Кинетическое уравнение имеет вид : Решение уравнения: Периоды полураспада веществ A и B различны
 Реакции 3 -го порядка А+В+С → продукты или 2 А+В → продукты, 3 А → продукты и т. д.
Реакции 3 -го порядка А+В+С → продукты или 2 А+В → продукты, 3 А → продукты и т. д.
 Реакции n-го порядка А+В+С. . . → продукты реакции
Реакции n-го порядка А+В+С. . . → продукты реакции
 Метод определения порядка реакции интегральные дифференциальные используют интегральные кинетические уравнения для обработки экспериментальных данных о зависимости концентраций реагирующих веществ от времени используют дифференциальные кинетические уравнения для обработки экспериментальных данных о зависимости концентраций реагирующих веществ от времени Метод подстановки Метод Вант-Гоффа Метод Раковского метод изолирования Оствальда, (метод понижения порядка реакции)
Метод определения порядка реакции интегральные дифференциальные используют интегральные кинетические уравнения для обработки экспериментальных данных о зависимости концентраций реагирующих веществ от времени используют дифференциальные кинетические уравнения для обработки экспериментальных данных о зависимости концентраций реагирующих веществ от времени Метод подстановки Метод Вант-Гоффа Метод Раковского метод изолирования Оствальда, (метод понижения порядка реакции)
 Метод подстановки Аналитический Графический § Экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от нулевого до третьего) и рассчитывают константу скорости. § Представляют экспериментальные данные в соответствующих координатах для целых порядков. § Если для выбранного порядка рассчитанные значения k приблизительно постоянны (с учетом разброса экспериментальных данных), то изучаемая реакция имеет данный порядок. § Если рассчитанные значения константы скорости систематически возрастают или убывают, то расчет повторяют для другого порядка. § Если ни одно из кинетических уравнений не дает удовлетворительного результата, т. е. порядок реакции не является целым, это означает, что реакция описывается более сложным кинетическим уравнением § Если в координатах, соответствующих одному из порядков, получается линейная зависимость от времени, то изучаемая реакция имеет данный порядок. § Одновременно из тангенса угла наклона прямой в этом случае можно получить значение константы скорости
Метод подстановки Аналитический Графический § Экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций целых порядков (от нулевого до третьего) и рассчитывают константу скорости. § Представляют экспериментальные данные в соответствующих координатах для целых порядков. § Если для выбранного порядка рассчитанные значения k приблизительно постоянны (с учетом разброса экспериментальных данных), то изучаемая реакция имеет данный порядок. § Если рассчитанные значения константы скорости систематически возрастают или убывают, то расчет повторяют для другого порядка. § Если ни одно из кинетических уравнений не дает удовлетворительного результата, т. е. порядок реакции не является целым, это означает, что реакция описывается более сложным кинетическим уравнением § Если в координатах, соответствующих одному из порядков, получается линейная зависимость от времени, то изучаемая реакция имеет данный порядок. § Одновременно из тангенса угла наклона прямой в этом случае можно получить значение константы скорости
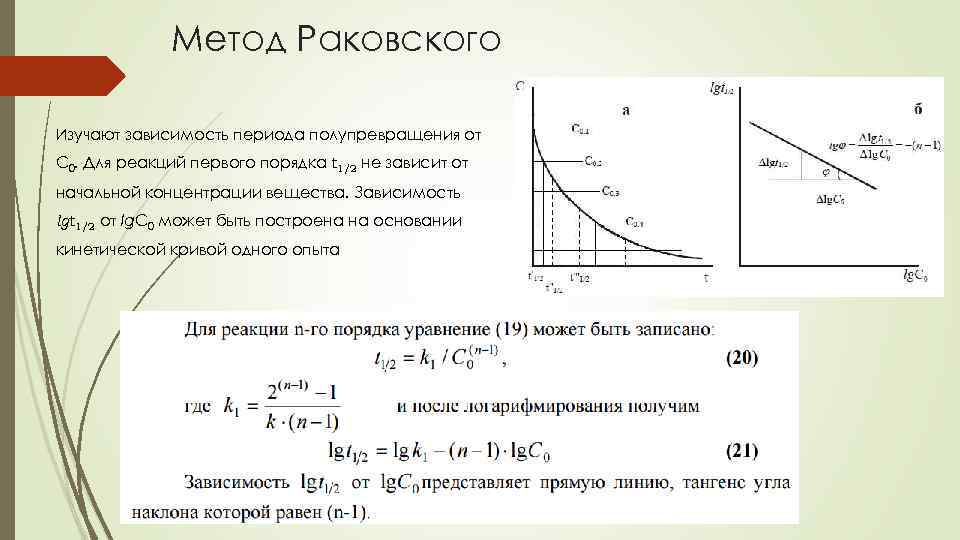 Метод Раковского Изучают зависимость периода полупревращения от С 0. Для реакций первого порядка t 1/2 не зависит от начальной концентрации вещества. Зависимость lgt 1/2 от lg. C 0 может быть построена на основании кинетической кривой одного опыта
Метод Раковского Изучают зависимость периода полупревращения от С 0. Для реакций первого порядка t 1/2 не зависит от начальной концентрации вещества. Зависимость lgt 1/2 от lg. C 0 может быть построена на основании кинетической кривой одного опыта
![Метод Вант-Гоффа Аналитический Графический § Cтроят зависимость lnυ от ln[A]. § Из тангенса угла Метод Вант-Гоффа Аналитический Графический § Cтроят зависимость lnυ от ln[A]. § Из тангенса угла](https://present5.com/presentation/1/331341122_451708361.pdf-img/331341122_451708361.pdf-17.jpg) Метод Вант-Гоффа Аналитический Графический § Cтроят зависимость lnυ от ln[A]. § Из тангенса угла наклона полученной прямой определяют порядок реакции, а из отсекаемого отрезка – константу скорости. § Различные значения υ и [A] могут быть получены из одной кинетической кривой, однако более надежные результаты (с учетом ошибок эксперимента) получают, используя значения начальных скоростей при разных начальных концентрациях реагентов. а- определение скорости реакции в различные моменты времени, б- определение порядка реакции
Метод Вант-Гоффа Аналитический Графический § Cтроят зависимость lnυ от ln[A]. § Из тангенса угла наклона полученной прямой определяют порядок реакции, а из отсекаемого отрезка – константу скорости. § Различные значения υ и [A] могут быть получены из одной кинетической кривой, однако более надежные результаты (с учетом ошибок эксперимента) получают, используя значения начальных скоростей при разных начальных концентрациях реагентов. а- определение скорости реакции в различные моменты времени, б- определение порядка реакции
 Метод изолирования Оствальда • зависимость скорости реакции от начальной концентрации одного из реагентов (например, A) изучают при большом избытке второго реагента. В таком случае концентрация реагента B в течение реакции остается практически постоянной, и уравнение приобретает вид • Порядок реакции α по веществу A находят одним из рассмотренных выше методов. Затем аналогичным образом определяют порядок реакции β по веществу B.
Метод изолирования Оствальда • зависимость скорости реакции от начальной концентрации одного из реагентов (например, A) изучают при большом избытке второго реагента. В таком случае концентрация реагента B в течение реакции остается практически постоянной, и уравнение приобретает вид • Порядок реакции α по веществу A находят одним из рассмотренных выше методов. Затем аналогичным образом определяют порядок реакции β по веществу B.
 Зависимость скорости реакции от температуры правило Вант. Гоффа: при увеличении температуры на каждые 10 градусов скорость возрастает в 2… 4 раза. § Грубо (приблизительно) описывает экспериментальные данные § применимо только в очень ограниченном интервале температур. Уравнение Аррениуса: где А = Z 0·P (предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции); Z 0 – число, пропорциональное количеству соударений, зависящее от массы и размера частиц, Р – стерический множитель, показывающий вероятность столкновений в направлении, которое благоприятно для перераспределения связей. ЕА - энергия активации. Для большинства реакций в растворе ЕА = 50… 100 к. Дж⋅моль– 1. R – универсальная газовая постоянная, R ≈ 8, 314 Дж/(моль·К) Т – температура, К
Зависимость скорости реакции от температуры правило Вант. Гоффа: при увеличении температуры на каждые 10 градусов скорость возрастает в 2… 4 раза. § Грубо (приблизительно) описывает экспериментальные данные § применимо только в очень ограниченном интервале температур. Уравнение Аррениуса: где А = Z 0·P (предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции); Z 0 – число, пропорциональное количеству соударений, зависящее от массы и размера частиц, Р – стерический множитель, показывающий вероятность столкновений в направлении, которое благоприятно для перераспределения связей. ЕА - энергия активации. Для большинства реакций в растворе ЕА = 50… 100 к. Дж⋅моль– 1. R – универсальная газовая постоянная, R ≈ 8, 314 Дж/(моль·К) Т – температура, К


