кинетика +элхимия.ppt
- Количество слайдов: 55
 Кинетика химических реакций 1
Кинетика химических реакций 1
 План лекции n n n Сущность химической кинетики. Понятие скорости, молекулярности, порядка химической реакции, периода полупревращения вещества. Кинетические уравнения реакций нулевого, первого, второго порядков. Факторы, определяющие скорость химической реакции. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса. 2
План лекции n n n Сущность химической кинетики. Понятие скорости, молекулярности, порядка химической реакции, периода полупревращения вещества. Кинетические уравнения реакций нулевого, первого, второго порядков. Факторы, определяющие скорость химической реакции. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса. 2
 Сущность химической кинетики Принципиальную возможность той или иной реакции предсказывает химическая термодинамика ( G < 0). Однако далеко не всегда термодинамически возможные реакции осуществляются в действительности. Например, все органические вещества, согласно принципам термодинамики, должны были бы достаточно быстро окисляться в углекислоту и воду молекулярным кислородом воздуха, так как этот процесс сопровождался бы значительным уменьшением энергии Гиббса. Существование растений, животных, залежей угля, нефти и т. д. обязано тем, что реакция окисления в действительности протекает исключительно медленно. 3
Сущность химической кинетики Принципиальную возможность той или иной реакции предсказывает химическая термодинамика ( G < 0). Однако далеко не всегда термодинамически возможные реакции осуществляются в действительности. Например, все органические вещества, согласно принципам термодинамики, должны были бы достаточно быстро окисляться в углекислоту и воду молекулярным кислородом воздуха, так как этот процесс сопровождался бы значительным уменьшением энергии Гиббса. Существование растений, животных, залежей угля, нефти и т. д. обязано тем, что реакция окисления в действительности протекает исключительно медленно. 3
 Сущность химической кинетики !!! Важно знать, насколько быстро протекают химические реакции, а также понимать, какими факторами определяется их скорость. Например: - Какие факторы оказывают преимущественное влияние на скорость порчи продуктов питания? - От чего зависит скорость ржавления стали? - Какими факторами определяется скорость сгорания горючего в двигателе автомобиля и как эта скорость влияет на содержание загрязняющих веществ в выхлопных газах автомобилей? 4
Сущность химической кинетики !!! Важно знать, насколько быстро протекают химические реакции, а также понимать, какими факторами определяется их скорость. Например: - Какие факторы оказывают преимущественное влияние на скорость порчи продуктов питания? - От чего зависит скорость ржавления стали? - Какими факторами определяется скорость сгорания горючего в двигателе автомобиля и как эта скорость влияет на содержание загрязняющих веществ в выхлопных газах автомобилей? 4
 Химическая кинетика Область химии, занимающаяся скоростью химических реакций, называется кинетикой. протекания Химическая кинетика устанавливает законы, определяющие скорость химических процессов, и выясняет роль различных факторов, влияющих на скорость и механизм реакций. Практическое значение ее очевидно, так как зная законы кинетики и механизм реакций можно управлять химическими процессами. От скорости химической реакции зависит выход продуктов, т. е. производительность труда и аппаратуры. 5
Химическая кинетика Область химии, занимающаяся скоростью химических реакций, называется кинетикой. протекания Химическая кинетика устанавливает законы, определяющие скорость химических процессов, и выясняет роль различных факторов, влияющих на скорость и механизм реакций. Практическое значение ее очевидно, так как зная законы кинетики и механизм реакций можно управлять химическими процессами. От скорости химической реакции зависит выход продуктов, т. е. производительность труда и аппаратуры. 5
 Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. n В общем случае скорость химической реакции определяется как производная концентрации реагирующего вещества по времени при постоянном объеме системы: n v = -dc/dt, где v – скорость, выраженная убылью концентрации (с) реагирующего вещества; t – время. 6
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. n В общем случае скорость химической реакции определяется как производная концентрации реагирующего вещества по времени при постоянном объеме системы: n v = -dc/dt, где v – скорость, выраженная убылью концентрации (с) реагирующего вещества; t – время. 6
 Основной постулат химической кинетики Согласно закону действующих масс, скорость химической реакции a. A + b. B =c. C определяется выражением v = k. CAa CBb , где CА и СB – концентрации реагирующих веществ; k – константа скорости реакции. Это выражение называется основным постулатом химической кинетики. 7
Основной постулат химической кинетики Согласно закону действующих масс, скорость химической реакции a. A + b. B =c. C определяется выражением v = k. CAa CBb , где CА и СB – концентрации реагирующих веществ; k – константа скорости реакции. Это выражение называется основным постулатом химической кинетики. 7
 Основной постулат химической кинетики Физический смысл константы скорости k можно установить, если принять концентрации всех реагирующих веществ равными единице. Тогда, n v = k, т. е. константа скорости химической реакции – это скорость реакции при концентрациях реагирующих веществ равных единице. 8
Основной постулат химической кинетики Физический смысл константы скорости k можно установить, если принять концентрации всех реагирующих веществ равными единице. Тогда, n v = k, т. е. константа скорости химической реакции – это скорость реакции при концентрациях реагирующих веществ равных единице. 8
 Факторы, влияющие на скорость реакции Скорость химической реакции зависит от: - природы реагирующих веществ, - температуры, - наличия катализатора, - концентрации и других факторов. По известным величинам k сравнивают скорости различных реакций. 9
Факторы, влияющие на скорость реакции Скорость химической реакции зависит от: - природы реагирующих веществ, - температуры, - наличия катализатора, - концентрации и других факторов. По известным величинам k сравнивают скорости различных реакций. 9
 Молекулярность химической реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции. По молекулярности различают одномолекулярные, двухмолекулярные и трехмолекулярные реакции. 10
Молекулярность химической реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции. По молекулярности различают одномолекулярные, двухмолекулярные и трехмолекулярные реакции. 10
 Молекулярность химической реакции К одномолекулярным реакциям типа А В или А В + С относятся процессы распада молекул на более простые составные части, например СН 3 СОСН 3 С 2 Н 4 + Н 2 + СО Двухмолекулярными называются реакции типа А + В С или 2 А В Н 2 + I 2 2 НI Значительно реже встречаются трехмолекулярные реакции А + 2 В С или 3 А В, например 2 NО + О 2 2 NО 2 11
Молекулярность химической реакции К одномолекулярным реакциям типа А В или А В + С относятся процессы распада молекул на более простые составные части, например СН 3 СОСН 3 С 2 Н 4 + Н 2 + СО Двухмолекулярными называются реакции типа А + В С или 2 А В Н 2 + I 2 2 НI Значительно реже встречаются трехмолекулярные реакции А + 2 В С или 3 А В, например 2 NО + О 2 2 NО 2 11
 Порядок реакции n Порядок реакции – сумма показателей степеней концентраций всех реагентов, входящих в уравнение скорости реакции. Реакции могут быть: - первого порядка (v = kс); - второго порядка (v = kс2), - третьего порядка (v = kс3), а также нулевого и дробного порядка. Дробный порядок характерен для сложных реакций, протекающих через промежуточные стадии. Нулевой порядок наблюдается в таких гетерогенных реакциях, в которых скорость подвода вещества больше скорости его расходования. В реакциях нулевого порядка скорость – постоянная величина (v = k) 12
Порядок реакции n Порядок реакции – сумма показателей степеней концентраций всех реагентов, входящих в уравнение скорости реакции. Реакции могут быть: - первого порядка (v = kс); - второго порядка (v = kс2), - третьего порядка (v = kс3), а также нулевого и дробного порядка. Дробный порядок характерен для сложных реакций, протекающих через промежуточные стадии. Нулевой порядок наблюдается в таких гетерогенных реакциях, в которых скорость подвода вещества больше скорости его расходования. В реакциях нулевого порядка скорость – постоянная величина (v = k) 12
 Период полупревращения n Период полупревращения (период полураспада) реакции – время, необходимое для того, чтобы концентрация реагента стала равна половине исходного значения. 13
Период полупревращения n Период полупревращения (период полураспада) реакции – время, необходимое для того, чтобы концентрация реагента стала равна половине исходного значения. 13
 Лимитирующая стадия реакции Если скорости отдельных стадий сильно различаются, то скорость реакции в целом и ее порядок определяются скоростью и порядком самой медленной стадии. Такая стадия называется лимитирующей. 14
Лимитирующая стадия реакции Если скорости отдельных стадий сильно различаются, то скорость реакции в целом и ее порядок определяются скоростью и порядком самой медленной стадии. Такая стадия называется лимитирующей. 14
 Кинетика реакций в статических условиях В данном разделе рассматриваются кинетические закономерности необратимых реакций. Реакции обычно характеризуют кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала, и периодом полупревращения t 1/2, который определяет момент уменьшения начальной концентрации реагирующих веществ вдвое. 15
Кинетика реакций в статических условиях В данном разделе рассматриваются кинетические закономерности необратимых реакций. Реакции обычно характеризуют кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала, и периодом полупревращения t 1/2, который определяет момент уменьшения начальной концентрации реагирующих веществ вдвое. 15
 Кинетическое уравнение выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. n Кинетическое уравнение для необратимой реакции нулевого порядка: размерность k 0 [моль/(л с)]. n Период полупревращения для необратимой реакции нулевого порядка пропорционален начальному количеству вещества: 16
Кинетическое уравнение выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. n Кинетическое уравнение для необратимой реакции нулевого порядка: размерность k 0 [моль/(л с)]. n Период полупревращения для необратимой реакции нулевого порядка пропорционален начальному количеству вещества: 16
 Реакции первого порядка Кинетическое уравнение для реакций первого порядка где k 1 – константа скорости реакции первого порядка; C 0 – концентрация исходного вещества в начальный момент; C – концентрация исходного вещества в момент времени t от начала реакции. Размерность составляет c-1 (или мин– 1). Период полупревращения для реакции первого порядка, не зависит от начальной концентрации реагирующих веществ: 17
Реакции первого порядка Кинетическое уравнение для реакций первого порядка где k 1 – константа скорости реакции первого порядка; C 0 – концентрация исходного вещества в начальный момент; C – концентрация исходного вещества в момент времени t от начала реакции. Размерность составляет c-1 (или мин– 1). Период полупревращения для реакции первого порядка, не зависит от начальной концентрации реагирующих веществ: 17
 Реакции второго порядка При t = 0; C = C 0 и const = 1/C 0. Тогда Период полупревращения для реакции второго порядка: 18
Реакции второго порядка При t = 0; C = C 0 и const = 1/C 0. Тогда Период полупревращения для реакции второго порядка: 18
 Зависимость скорости реакции от температуры Скорость (и константа скорости) химической реакции зависит от температуры. Как правило, при повышении температуры скорость растет. Исключение составляют некоторые реакции третьего порядка. Ориентировочную зависимость константы скорости от температуры выражают правилом Вант-Гоффа, согласно которому повышение температуры на 10° (10 К) увеличивает константу скорости реакции в 2– 4 раза: Это правило не выполняется при высоких температурах, когда температурный коэффициент скорости ( ) перестает быть постоянным, приближаясь к единице. 19
Зависимость скорости реакции от температуры Скорость (и константа скорости) химической реакции зависит от температуры. Как правило, при повышении температуры скорость растет. Исключение составляют некоторые реакции третьего порядка. Ориентировочную зависимость константы скорости от температуры выражают правилом Вант-Гоффа, согласно которому повышение температуры на 10° (10 К) увеличивает константу скорости реакции в 2– 4 раза: Это правило не выполняется при высоких температурах, когда температурный коэффициент скорости ( ) перестает быть постоянным, приближаясь к единице. 19
 Определения срока годности На основе правила Вант-Гоффа (26) разработан метод «ускоренного старения» для определения срока годности различных материалов (продуктов питания, лекарств и т. п. ) Повышение температуры позволяет увеличить скорость разложения в 10 раз и более по сравнению с ее значением при комнатной температуре. Это сокращает время установления срока годности материала, помогает определить оптимальную температуру его хранения. 20
Определения срока годности На основе правила Вант-Гоффа (26) разработан метод «ускоренного старения» для определения срока годности различных материалов (продуктов питания, лекарств и т. п. ) Повышение температуры позволяет увеличить скорость разложения в 10 раз и более по сравнению с ее значением при комнатной температуре. Это сокращает время установления срока годности материала, помогает определить оптимальную температуру его хранения. 20
 Зависимость скорости реакции от температуры Уравнение Аррениуса представляют в форме (32) Величину Z 0 называют предэкспоненциальным множителем; е – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура. 21
Зависимость скорости реакции от температуры Уравнение Аррениуса представляют в форме (32) Величину Z 0 называют предэкспоненциальным множителем; е – основание натурального логарифма; Еа – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура. 21
 Роль катализатора n Катализ - изменение скорости химических реакций под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. В зависимости от агрегатного состояния участвующих в реакции веществ и катализатора различают гомогенный и гетерогенный катализ. n Специфичность катализаторов заключается в том, что они проявляют активность лишь в отношении одной реакции или узкой группы реакций. Особенно специфично действие биологических катализаторов – ферментов. Ферменты катализируют превращения лишь отдельных химических соединений, даже если в реакционной смеси находится большое число сходных по строению изомеров данного вещества. 22
Роль катализатора n Катализ - изменение скорости химических реакций под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. В зависимости от агрегатного состояния участвующих в реакции веществ и катализатора различают гомогенный и гетерогенный катализ. n Специфичность катализаторов заключается в том, что они проявляют активность лишь в отношении одной реакции или узкой группы реакций. Особенно специфично действие биологических катализаторов – ферментов. Ферменты катализируют превращения лишь отдельных химических соединений, даже если в реакционной смеси находится большое число сходных по строению изомеров данного вещества. 22
 Скорость гомогенной и гетерогенной реакции n n n При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе – гомогенные реакции и в гетерогенной – гетерогенные реакции. Гомогенной называется система, состоящая из одной фазы (жидкость), гетерогенной – из двух и более. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию, или образующегося при реакции за единицу времени в единице объема системы. 23
Скорость гомогенной и гетерогенной реакции n n n При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе – гомогенные реакции и в гетерогенной – гетерогенные реакции. Гомогенной называется система, состоящая из одной фазы (жидкость), гетерогенной – из двух и более. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию, или образующегося при реакции за единицу времени в единице объема системы. 23
 Скоростью гетерогенной реакции n Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы. 24
Скоростью гетерогенной реакции n Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы. 24
 Скорость гетерогенной реакции В ходе гетерогенной реакции можно выделить, по меньшей мере, три стадии: n Подвод реагирующего вещества к поверхности n Химическая реакция на поверхности n Отвод продукта реакции от поверхности. 25
Скорость гетерогенной реакции В ходе гетерогенной реакции можно выделить, по меньшей мере, три стадии: n Подвод реагирующего вещества к поверхности n Химическая реакция на поверхности n Отвод продукта реакции от поверхности. 25
 Необратимые и обратимые реакции. Химическое равновесие Равновесным состоянием называют такое термодинамическое состояние системы, которое не изменяется во времени. Устойчивое равновесное состояние характеризуется: n - неизменностью состояния системы при сохранении внешних условий; n - подвижностью равновесия: самопроизвольным восстановлением равновесия после прекращения воздействия, вызывающего отклонение системы от положения равновесия; n - динамическим характером равновесия: сохранением его вследствие равенства скоростей прямого и обратного процессов; n - различием в достижении равновесного состояния для самопроизвольных и несамопроизвольных процессов; n - минимальным значением энергии Гиббса (или энергии Гельмгольца). 26
Необратимые и обратимые реакции. Химическое равновесие Равновесным состоянием называют такое термодинамическое состояние системы, которое не изменяется во времени. Устойчивое равновесное состояние характеризуется: n - неизменностью состояния системы при сохранении внешних условий; n - подвижностью равновесия: самопроизвольным восстановлением равновесия после прекращения воздействия, вызывающего отклонение системы от положения равновесия; n - динамическим характером равновесия: сохранением его вследствие равенства скоростей прямого и обратного процессов; n - различием в достижении равновесного состояния для самопроизвольных и несамопроизвольных процессов; n - минимальным значением энергии Гиббса (или энергии Гельмгольца). 26
 Закон действующих масс n В основе учения о химическом равновесии реакций лежит закон действующих масс. Запишем в общем виде уравнение обратимого химического процесса: а. А + в. В ↔ с. С + d. D n Химическое равновесие численно выражается константами равновесия - постоянными величинами для данной температуры. Если количества реагирующих веществ выразить через равновесные концентрации, то константа равновесия будет выглядеть следующим образом: 27
Закон действующих масс n В основе учения о химическом равновесии реакций лежит закон действующих масс. Запишем в общем виде уравнение обратимого химического процесса: а. А + в. В ↔ с. С + d. D n Химическое равновесие численно выражается константами равновесия - постоянными величинами для данной температуры. Если количества реагирующих веществ выразить через равновесные концентрации, то константа равновесия будет выглядеть следующим образом: 27
 Химическое равновесие n Если в реакции участвуют газообразные вещества, то действующие массы выражают через их парциальные давления: 28
Химическое равновесие n Если в реакции участвуют газообразные вещества, то действующие массы выражают через их парциальные давления: 28
 Химическое равновесие n Между константами Кс и Кр существует связь: Кр = Кс(RT)∆n , где ∆n = (c+d) – (a+b) – разность стехиометрических коэффициентов или изменение числа молей в результате реакции. Если же реакция идет без изменения числа молекул (∆n=0), то Кр = Кс 29
Химическое равновесие n Между константами Кс и Кр существует связь: Кр = Кс(RT)∆n , где ∆n = (c+d) – (a+b) – разность стехиометрических коэффициентов или изменение числа молей в результате реакции. Если же реакция идет без изменения числа молекул (∆n=0), то Кр = Кс 29
 Принцип смещения химического равновесия (Ле-Шателье): n Если изменить одно из условий, при которых система находится в состоянии химического равновесия, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению. 30
Принцип смещения химического равновесия (Ле-Шателье): n Если изменить одно из условий, при которых система находится в состоянии химического равновесия, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению. 30
 Смещение химического равновесия в основном определяется: n концентрацией реагирующих веществ; n давлением, если реагирующие вещества находятся в газообразном или парообразном состоянии; n температурой, при которой происходит химический процесс. 31
Смещение химического равновесия в основном определяется: n концентрацией реагирующих веществ; n давлением, если реагирующие вещества находятся в газообразном или парообразном состоянии; n температурой, при которой происходит химический процесс. 31
 Влияние концентрации n Увеличение концентрации веществ приводит к смещению равновесия в сторону увеличения расхода тех компонентов (или компонента), концентрация которых увеличивается. 32
Влияние концентрации n Увеличение концентрации веществ приводит к смещению равновесия в сторону увеличения расхода тех компонентов (или компонента), концентрация которых увеличивается. 32
 Влияние давления (для газообразных веществ): Смещение равновесия при изменении давления зависит от изменения числа молей (∆n) в процессе реакции. При ∆n = 0 смещение равновесия при увеличении или уменьшении давления не произойдет. При ∆n ≠ 0, равновесие смещается следующим образом: n а) если процесс идет с увеличением числа молей продуктов реакции - ∆n > 0, то увеличение давления приведет к смещению равновесия в сторону образования исходных веществ, а уменьшение давления – в сторону продуктов реакции; n б) если процесс идет с уменьшением числа молей продуктов реакции - ∆n < 0, то увеличение давления приведет к смещению равновесия в сторону образования продуктов реакции, а уменьшение давления – в сторону исходных веществ. 33
Влияние давления (для газообразных веществ): Смещение равновесия при изменении давления зависит от изменения числа молей (∆n) в процессе реакции. При ∆n = 0 смещение равновесия при увеличении или уменьшении давления не произойдет. При ∆n ≠ 0, равновесие смещается следующим образом: n а) если процесс идет с увеличением числа молей продуктов реакции - ∆n > 0, то увеличение давления приведет к смещению равновесия в сторону образования исходных веществ, а уменьшение давления – в сторону продуктов реакции; n б) если процесс идет с уменьшением числа молей продуктов реакции - ∆n < 0, то увеличение давления приведет к смещению равновесия в сторону образования продуктов реакции, а уменьшение давления – в сторону исходных веществ. 33
 Влияние температуры Увеличение температуры системы приведет к смещению равновесия в сторону эндотермической реакции: n если реакция экзотермическая (идет с выделением тепла), увеличение температуры системы приведет к смещению равновесия в сторону исходных веществ; уменьшение температуры (например, отвод тепла от системы) – смещение равновесия в сторону продуктов реакции. n если реакция эндотермическая (идет с поглощением тепла), увеличение температуры системы приведет к смещению равновесия в сторону продуктов реакции; уменьшение температуры – в сторону образования исходных веществ. 34
Влияние температуры Увеличение температуры системы приведет к смещению равновесия в сторону эндотермической реакции: n если реакция экзотермическая (идет с выделением тепла), увеличение температуры системы приведет к смещению равновесия в сторону исходных веществ; уменьшение температуры (например, отвод тепла от системы) – смещение равновесия в сторону продуктов реакции. n если реакция эндотермическая (идет с поглощением тепла), увеличение температуры системы приведет к смещению равновесия в сторону продуктов реакции; уменьшение температуры – в сторону образования исходных веществ. 34
 Равновесие в гетерогенных системах. Фазовые равновесия n Фаза (Ф) – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми химическими, физическими и термодинамическими свойствами во всех точках. По числу фаз системы делятся на однофазные, двухфазные, трехфазные и многофазные. n Система может состоять из одного или нескольких компонентов. Компонентом системы называют индивидуальное химическое вещество, которое может быть выделено из системы и существовать отдельно от нее. 35
Равновесие в гетерогенных системах. Фазовые равновесия n Фаза (Ф) – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми химическими, физическими и термодинамическими свойствами во всех точках. По числу фаз системы делятся на однофазные, двухфазные, трехфазные и многофазные. n Система может состоять из одного или нескольких компонентов. Компонентом системы называют индивидуальное химическое вещество, которое может быть выделено из системы и существовать отдельно от нее. 35
 Фазовые равновесия n Число степеней свободы (С) в равновесной системе – число независимых термодинамических параметров (температура, давление, концентрация), определяющих состояние системы, которые можно до известного предела изменять, не нарушая равновесия в системе (т. е. без изменения числа фаз в системе). n Если С = 1, то система моновариантна, при С = 2 система бивариантна, при С = 3 - система – трехвариантна. 36
Фазовые равновесия n Число степеней свободы (С) в равновесной системе – число независимых термодинамических параметров (температура, давление, концентрация), определяющих состояние системы, которые можно до известного предела изменять, не нарушая равновесия в системе (т. е. без изменения числа фаз в системе). n Если С = 1, то система моновариантна, при С = 2 система бивариантна, при С = 3 - система – трехвариантна. 36
 Правило фаз Гиббса n В равновесной системе сумма чисел фаз и степеней свободы равна числу компонентов, увеличенному на два: С = К – Ф + 2, где Ф – число фаз; С – число степеней свободы; К – количество компонентов. 37
Правило фаз Гиббса n В равновесной системе сумма чисел фаз и степеней свободы равна числу компонентов, увеличенному на два: С = К – Ф + 2, где Ф – число фаз; С – число степеней свободы; К – количество компонентов. 37
 Следствия из правила фаз n Каждая новая фаза уменьшает, а каждый новый компонент увеличивает число степеней свободы данной равновесной системы. n Для конденсированных систем (давление для которых мало влияет на состояние равновесия), а также в случае влияния на систему только температуры, правило фаз Гиббса выражается уравнением: С=К–Ф+1 38
Следствия из правила фаз n Каждая новая фаза уменьшает, а каждый новый компонент увеличивает число степеней свободы данной равновесной системы. n Для конденсированных систем (давление для которых мало влияет на состояние равновесия), а также в случае влияния на систему только температуры, правило фаз Гиббса выражается уравнением: С=К–Ф+1 38
 Электрохимия 1. Электрическая проводимость растворов 2. Электродные процессы. Гальванические элементы 3. Электролиз. Законы Фарадея. 39
Электрохимия 1. Электрическая проводимость растворов 2. Электродные процессы. Гальванические элементы 3. Электролиз. Законы Фарадея. 39
 Электрохимия – раздел физической химии, в котором изучаются физико-химические свойства ионных систем (растворов, расплавов или твердых электролитов), а также явления, возникающие на границе Основы электрохимии двух фаз с участием заряженных частиц (ионов и электронов). В двухфазной электрохимической системе одна из фаз – чаще всего металл или полупроводник, другая – раствор или расплав электролита. 40
Электрохимия – раздел физической химии, в котором изучаются физико-химические свойства ионных систем (растворов, расплавов или твердых электролитов), а также явления, возникающие на границе Основы электрохимии двух фаз с участием заряженных частиц (ионов и электронов). В двухфазной электрохимической системе одна из фаз – чаще всего металл или полупроводник, другая – раствор или расплав электролита. 40
 Различают две основные группы проводников электрического тока: проводники первого рода, электрическая проводимость которых обусловлена электронами, роводники второго рода, обладающие ионной проводимостью. Главную роль в электрохимии играют проводники второго рода – растворы и расплавы электролитов. 41
Различают две основные группы проводников электрического тока: проводники первого рода, электрическая проводимость которых обусловлена электронами, роводники второго рода, обладающие ионной проводимостью. Главную роль в электрохимии играют проводники второго рода – растворы и расплавы электролитов. 41
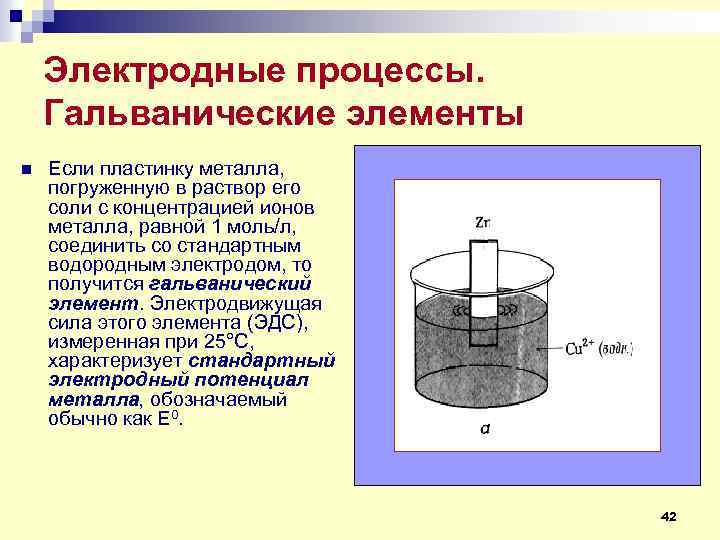 Электродные процессы. Гальванические элементы n Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25°С, характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е 0. 42
Электродные процессы. Гальванические элементы n Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25°С, характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е 0. 42
 Электрохимический ряд напряжений металлов n Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов Li Cs К Ва Са Na Mg Al Zn Fe Co Ni Sn Pb Н 2 Cu Ag Hg -3, 0 -2, 9 -2. 8 -2, 7 -2, 3 -1, 6 - 0, 7 -0, 4 -0, 2 -0, 1 0, 2 0, 3 43
Электрохимический ряд напряжений металлов n Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов Li Cs К Ва Са Na Mg Al Zn Fe Co Ni Sn Pb Н 2 Cu Ag Hg -3, 0 -2, 9 -2. 8 -2, 7 -2, 3 -1, 6 - 0, 7 -0, 4 -0, 2 -0, 1 0, 2 0, 3 43
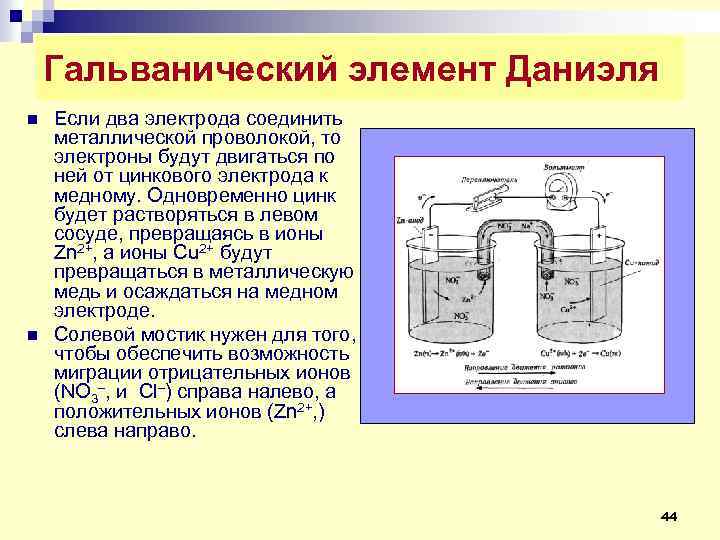 Гальванический элемент Даниэля n n Если два электрода соединить металлической проволокой, то электроны будут двигаться по ней от цинкового электрода к медному. Одновременно цинк будет растворяться в левом сосуде, превращаясь в ионы Zn 2+, a ионы Cu 2+ будут превращаться в металлическую медь и осаждаться на медном электроде. Солевой мостик нужен для того, чтобы обеспечить возможность миграции отрицательных ионов (NО 3–, и Сl–) справа налево, а положительных ионов (Zn 2+, ) слева направо. 44
Гальванический элемент Даниэля n n Если два электрода соединить металлической проволокой, то электроны будут двигаться по ней от цинкового электрода к медному. Одновременно цинк будет растворяться в левом сосуде, превращаясь в ионы Zn 2+, a ионы Cu 2+ будут превращаться в металлическую медь и осаждаться на медном электроде. Солевой мостик нужен для того, чтобы обеспечить возможность миграции отрицательных ионов (NО 3–, и Сl–) справа налево, а положительных ионов (Zn 2+, ) слева направо. 44
 Гальванический элемент Даниэля n n n Окислительно-восстановительную реакцию, протекающую в элементе Даниэля, можно представить в виде совокупности двух полуреакций: Ζn (тв. ) → Ζn 2+ + 2 е– Cu 2+ + 2 e– → Cu (тв. ) Цинковый электрод называется анодом. На нем происходит окисление (потеря электронов). Медный электрод называется катодом. На нем происходит восстановление (присоединение электронов). 45
Гальванический элемент Даниэля n n n Окислительно-восстановительную реакцию, протекающую в элементе Даниэля, можно представить в виде совокупности двух полуреакций: Ζn (тв. ) → Ζn 2+ + 2 е– Cu 2+ + 2 e– → Cu (тв. ) Цинковый электрод называется анодом. На нем происходит окисление (потеря электронов). Медный электрод называется катодом. На нем происходит восстановление (присоединение электронов). 45
 Гальванический элемент Даниэля n Состав элемента Даниэля можно записать в виде следующей диаграммы: Ζn(тв. ) | Zn(NO 3)2 aq) | | Cu(NO 3)2(aq) | Cu (тв. ) где вертикальные линии указывают на межфазные границы раздела. Анод помещен слева диаграммы, а катод — справа. 46
Гальванический элемент Даниэля n Состав элемента Даниэля можно записать в виде следующей диаграммы: Ζn(тв. ) | Zn(NO 3)2 aq) | | Cu(NO 3)2(aq) | Cu (тв. ) где вертикальные линии указывают на межфазные границы раздела. Анод помещен слева диаграммы, а катод — справа. 46
 Электролиз n При пропускании постоянного электрического тока через электролит на электродах протекают химические реакции разложения расплава электролита на составляющие его элементы: 2 Na. Cl (ж. ) 2 Na (ж. ) + Сl 2 (г. ) n Такие процессы, осуществляемые при помощи внешнего источника электрической энергии, называются реакциями электролиза и проводятся в электролитических ячейках (электролизерах). 47
Электролиз n При пропускании постоянного электрического тока через электролит на электродах протекают химические реакции разложения расплава электролита на составляющие его элементы: 2 Na. Cl (ж. ) 2 Na (ж. ) + Сl 2 (г. ) n Такие процессы, осуществляемые при помощи внешнего источника электрической энергии, называются реакциями электролиза и проводятся в электролитических ячейках (электролизерах). 47
 Ионная теория электролиза В случае электролиза расплава хлорида натрия в электролизере протекают следующие реакции: на аноде 2 Сl– (ж. ) Сl 2 (г. ) + 2 е– на катоде 2 Na+ (ж. ) + 2 е– 2 Na (ж. ) n 2 Na+ (ж. ) + 2 Cl- (ж. ) 2 Na (ж. ) + Сl 2 (г. ) 48
Ионная теория электролиза В случае электролиза расплава хлорида натрия в электролизере протекают следующие реакции: на аноде 2 Сl– (ж. ) Сl 2 (г. ) + 2 е– на катоде 2 Na+ (ж. ) + 2 е– 2 Na (ж. ) n 2 Na+ (ж. ) + 2 Cl- (ж. ) 2 Na (ж. ) + Сl 2 (г. ) 48
 Электролиз водных растворов n Состав продуктов электролиза зависит от условий проведения процесса. Так натрий нельзя получить электролизом водного раствора Na. Cl, потому что вода восстанавливается легче, чем Na+ (водн. ): 2 Н 2 О (ж. ) + 2 e– Н 2 (г. ) + 2 ОН– (водн. ) Е восст = – 0, 83 В Na+ (водн. ) + е– Na (тв. ) Е°восст = – 2, 71 В Следовательно, при электролизе водного раствора Na. Cl на катоде вместо Na должен выделяться Н 2. 49
Электролиз водных растворов n Состав продуктов электролиза зависит от условий проведения процесса. Так натрий нельзя получить электролизом водного раствора Na. Cl, потому что вода восстанавливается легче, чем Na+ (водн. ): 2 Н 2 О (ж. ) + 2 e– Н 2 (г. ) + 2 ОН– (водн. ) Е восст = – 0, 83 В Na+ (водн. ) + е– Na (тв. ) Е°восст = – 2, 71 В Следовательно, при электролизе водного раствора Na. Cl на катоде вместо Na должен выделяться Н 2. 49
 Электролиз водных растворов В этом случае на аноде возможно окисление Сl– или Н 2 О. : 2 Сl– (водн. ) Сl 2 (г. ) + 2 е– Е окисл = – 1, 36 В 2 Н 2 O(ж. ) 4 Н+ (водн. ) + O 2 (г. ) + 4 е– Е°окисл = – 1, 23 В Хотя стандартные окислительные потенциалы отличаются друг от друга не слишком сильно, но из их сравнения следует, что Н 2 О должна окисляться с большей легкостью, чем Cl–. 50
Электролиз водных растворов В этом случае на аноде возможно окисление Сl– или Н 2 О. : 2 Сl– (водн. ) Сl 2 (г. ) + 2 е– Е окисл = – 1, 36 В 2 Н 2 O(ж. ) 4 Н+ (водн. ) + O 2 (г. ) + 4 е– Е°окисл = – 1, 23 В Хотя стандартные окислительные потенциалы отличаются друг от друга не слишком сильно, но из их сравнения следует, что Н 2 О должна окисляться с большей легкостью, чем Cl–. 50
 Электролиз водных растворов Т. о. при электролизе водных растворов Na. Cl образуются Н 2 и Сl 2, если только концентрация Сl– не слишком низка; при этом протекают следующие реакции: n n на аноде 2 Сl– (водн. ) Сl 2 (г. ) + 2 е– на катоде 2 Н 2 О (ж. ) + 2 е– Н 2 (г. ) + 2 ОН– 2 Сl- (водн. ) + 2 Н 2 О (ж. ) Сl 2 (г. ) + Н 2 (г. ) + 2 ОН– 51
Электролиз водных растворов Т. о. при электролизе водных растворов Na. Cl образуются Н 2 и Сl 2, если только концентрация Сl– не слишком низка; при этом протекают следующие реакции: n n на аноде 2 Сl– (водн. ) Сl 2 (г. ) + 2 е– на катоде 2 Н 2 О (ж. ) + 2 е– Н 2 (г. ) + 2 ОН– 2 Сl- (водн. ) + 2 Н 2 О (ж. ) Сl 2 (г. ) + Н 2 (г. ) + 2 ОН– 51
 Законы Фарадея n Законы Фарадея определяют соотношение между массой продукта, образующегося на электроде, и количеством электричества (электрическим зарядом), пропущенным через электролит. 52
Законы Фарадея n Законы Фарадея определяют соотношение между массой продукта, образующегося на электроде, и количеством электричества (электрическим зарядом), пропущенным через электролит. 52
 Первый закон Фарадея n Масса вещества, образующегося на электроде, пропорциональна количеству пропущенного электричества. m = k Q = k I t , где m – масса выделившегося вещества, кг; Q – количество прошедшего электричества, Кл; I – сила тока, A; t – время, с; к – коэффициент пропорциональности – масса вещества, выделившегося из раствора на электродах при пропускании через него количества электричества 1 Кл. 53
Первый закон Фарадея n Масса вещества, образующегося на электроде, пропорциональна количеству пропущенного электричества. m = k Q = k I t , где m – масса выделившегося вещества, кг; Q – количество прошедшего электричества, Кл; I – сила тока, A; t – время, с; к – коэффициент пропорциональности – масса вещества, выделившегося из раствора на электродах при пропускании через него количества электричества 1 Кл. 53
 Второй закон Фарадея n Для разряда одного моля какого-либо иона на электроде необходимо пропустить через электролит такое число фарадеев заряда, которое равно числу элементарных зарядов на этом ионе. где; F – постоянная Фарадея, М – молекулярная масса иона, z – заряд иона. 54
Второй закон Фарадея n Для разряда одного моля какого-либо иона на электроде необходимо пропустить через электролит такое число фарадеев заряда, которое равно числу элементарных зарядов на этом ионе. где; F – постоянная Фарадея, М – молекулярная масса иона, z – заряд иона. 54
 Объединенный закон Фарадея n Математическое выражение, объединяющее оба закона Фарадея, будет иметь вид: 55
Объединенный закон Фарадея n Математическое выражение, объединяющее оба закона Фарадея, будет иметь вид: 55


