КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ.pptx
- Количество слайдов: 38
 КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ l l l Основные понятия Михаэлис-Ментен Типы ингибирования
КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ l l l Основные понятия Михаэлис-Ментен Типы ингибирования
 Биохимическая кинетика Задачей кинетики является определение сродства фермента к субстрату или ингибитору, а также скоростей биохимических реакций и их максимальных значений. Это необходимо для решения задач фармакологии, основными из которых являются разработка новых лекарств, подбор их дозировки и определение индивидуальной чувствительности.
Биохимическая кинетика Задачей кинетики является определение сродства фермента к субстрату или ингибитору, а также скоростей биохимических реакций и их максимальных значений. Это необходимо для решения задач фармакологии, основными из которых являются разработка новых лекарств, подбор их дозировки и определение индивидуальной чувствительности.
 Скорость реакции - количество продукта (или субстрата), образовавшегося (или распавшегося) в единицу времени А молекулярность реакции порядок реакции P A+А или А v = k[А] P P [A], % начальная скорость время (количество вступающ реакци v = k[А]2 v = k 1[А]-k-1[P]
Скорость реакции - количество продукта (или субстрата), образовавшегося (или распавшегося) в единицу времени А молекулярность реакции порядок реакции P A+А или А v = k[А] P P [A], % начальная скорость время (количество вступающ реакци v = k[А]2 v = k 1[А]-k-1[P]
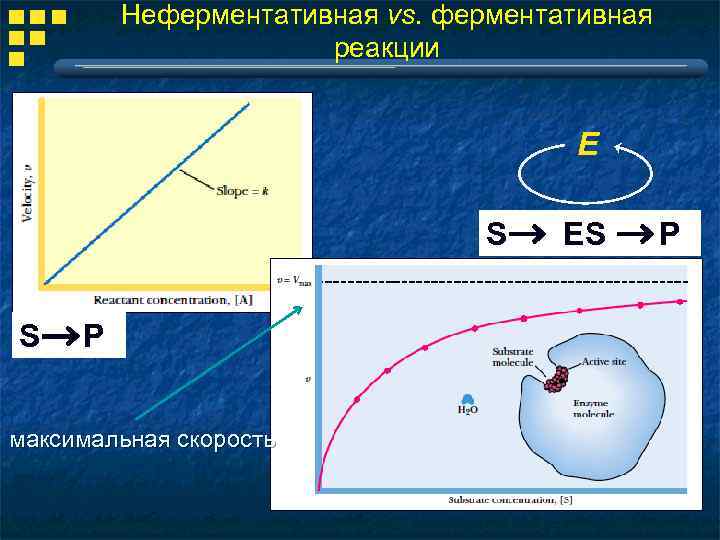 Неферментативная vs. ферментативная реакции E S S P максимальная скорость ES P
Неферментативная vs. ферментативная реакции E S S P максимальная скорость ES P
 Кинетика Михаэлиса-Ментен (модель Бригса. Холдейна) S+E k+1 k-1 ES k+2 P+E УСЛОВИЯ : 1. Избыток субстрата (S >> E) 2. Начальное состояние (нет k-2 и [P]=0 ) 3. Фермент-субстратный комплекс (ES) 4. Равновесное состояние (ES=const)
Кинетика Михаэлиса-Ментен (модель Бригса. Холдейна) S+E k+1 k-1 ES k+2 P+E УСЛОВИЯ : 1. Избыток субстрата (S >> E) 2. Начальное состояние (нет k-2 и [P]=0 ) 3. Фермент-субстратный комплекс (ES) 4. Равновесное состояние (ES=const)
 Уравнение Михаэлиса-Ментен S+E k+1 k-1 ES k+2 P+E ES = constant Скорость образования ES = Скорость распада ES = Km Скорость суммарной реакции в которой [S] [ET] Vmax
Уравнение Михаэлиса-Ментен S+E k+1 k-1 ES k+2 P+E ES = constant Скорость образования ES = Скорость распада ES = Km Скорость суммарной реакции в которой [S] [ET] Vmax
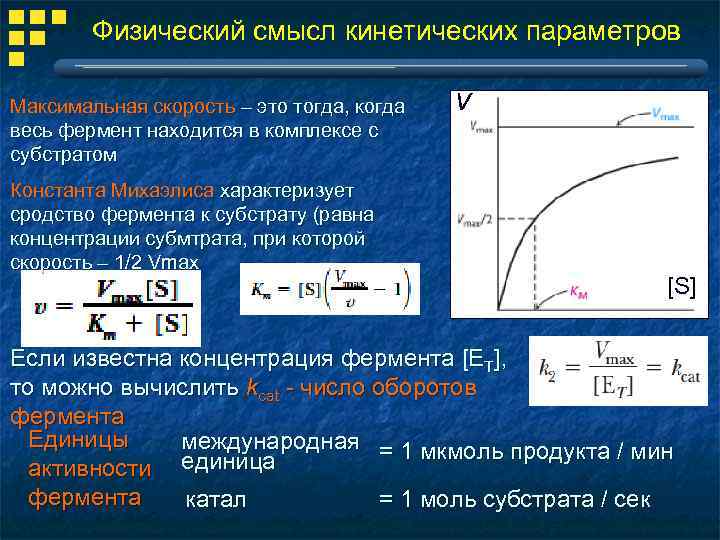 Физический смысл кинетических параметров Максимальная скорость – это тогда, когда весь фермент находится в комплексе с субстратом Константа Михаэлиса характеризует сродство фермента к субстрату (равна концентрации субмтрата, при которой скорость – 1/2 Vmax v [S] Если известна концентрация фермента [ET], то можно вычислить kcat - число оборотов фермента Единицы международная = 1 мкмоль продукта / мин активности единица фермента = 1 моль субстрата / сек катал
Физический смысл кинетических параметров Максимальная скорость – это тогда, когда весь фермент находится в комплексе с субстратом Константа Михаэлиса характеризует сродство фермента к субстрату (равна концентрации субмтрата, при которой скорость – 1/2 Vmax v [S] Если известна концентрация фермента [ET], то можно вычислить kcat - число оборотов фермента Единицы международная = 1 мкмоль продукта / мин активности единица фермента = 1 моль субстрата / сек катал
 Эффективность фермента Соотношение kcat/Кm можно рассматривать как показатель эффективности данного фермента
Эффективность фермента Соотношение kcat/Кm можно рассматривать как показатель эффективности данного фермента
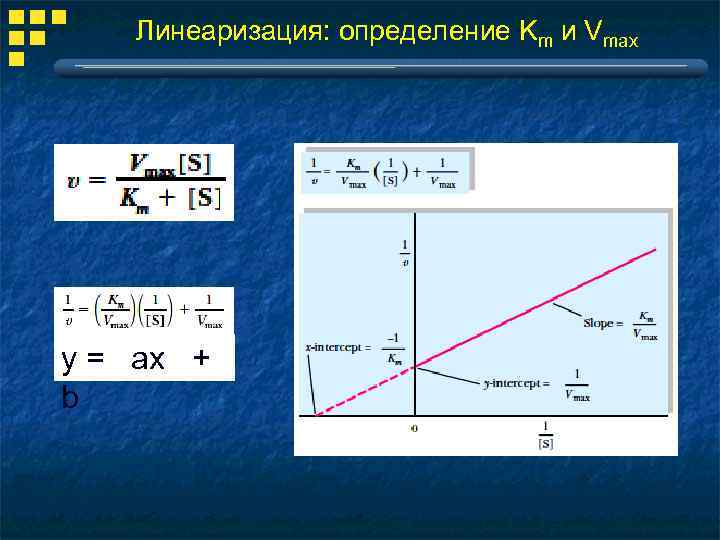 Линеаризация: определение Km и Vmax y = ax + b
Линеаризация: определение Km и Vmax y = ax + b
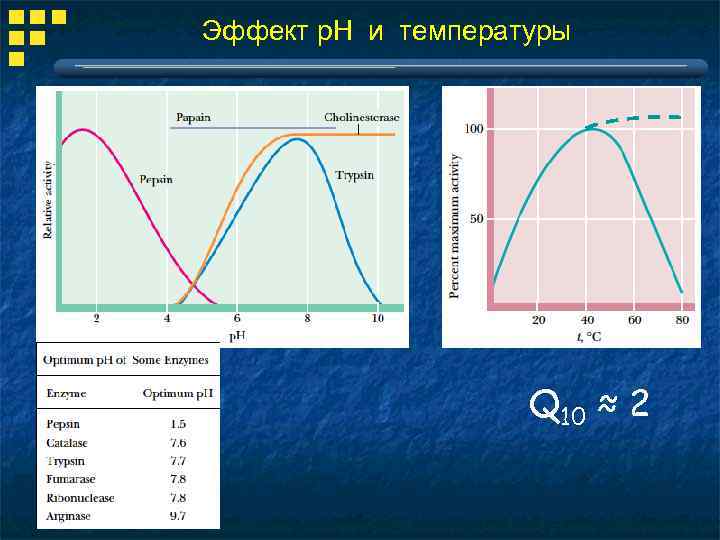 Эффект р. Н и температуры Q 10 ≈ 2
Эффект р. Н и температуры Q 10 ≈ 2
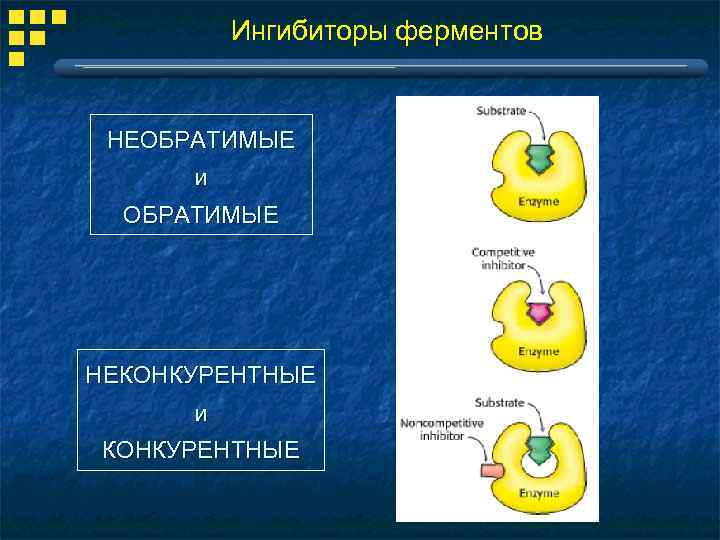 Ингибиторы ферментов НЕОБРАТИМЫЕ и ОБРАТИМЫЕ НЕКОНКУРЕНТНЫЕ и КОНКУРЕНТНЫЕ
Ингибиторы ферментов НЕОБРАТИМЫЕ и ОБРАТИМЫЕ НЕКОНКУРЕНТНЫЕ и КОНКУРЕНТНЫЕ
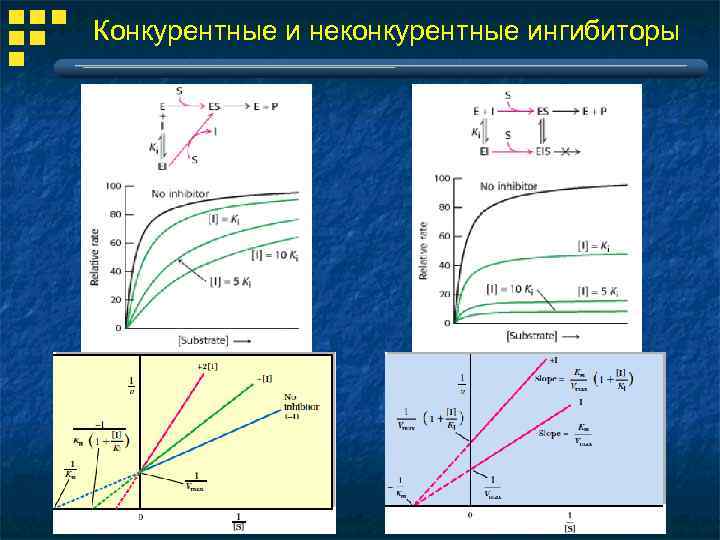 Конкурентные и неконкурентные ингибиторы
Конкурентные и неконкурентные ингибиторы
 РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ Концентрационная Метаболитами Генетический контроль Посттрансляционные модификации Аллостерическая
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ Концентрационная Метаболитами Генетический контроль Посттрансляционные модификации Аллостерическая
 Стратегии регуляции активности ферментов 1. За счет концентраций субстрата/продукта 2. Под действием метаболитов 3. При помощи ковалентной модификации 4. Белок-белковыми взаимодействиями 5. Аллостерически 6. Ограниченным протеолизом 7. Изменением уровня экспрессии 8. Изменением изоформного состава
Стратегии регуляции активности ферментов 1. За счет концентраций субстрата/продукта 2. Под действием метаболитов 3. При помощи ковалентной модификации 4. Белок-белковыми взаимодействиями 5. Аллостерически 6. Ограниченным протеолизом 7. Изменением уровня экспрессии 8. Изменением изоформного состава
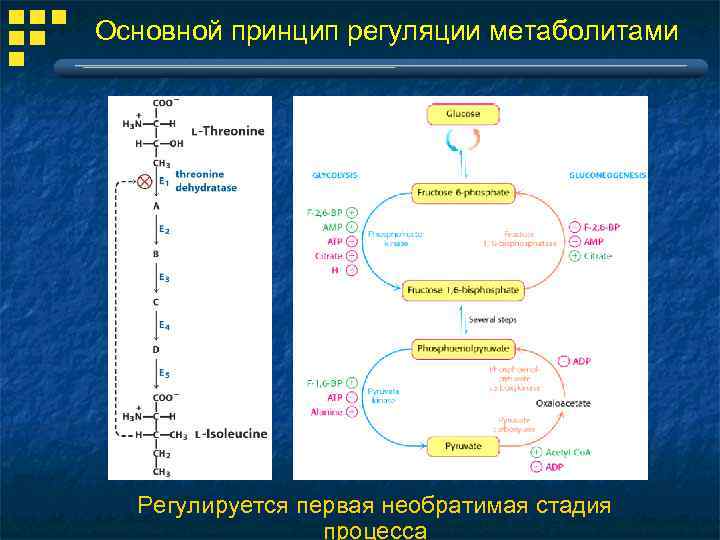 Основной принцип регуляции метаболитами Регулируется первая необратимая стадия процесса
Основной принцип регуляции метаболитами Регулируется первая необратимая стадия процесса
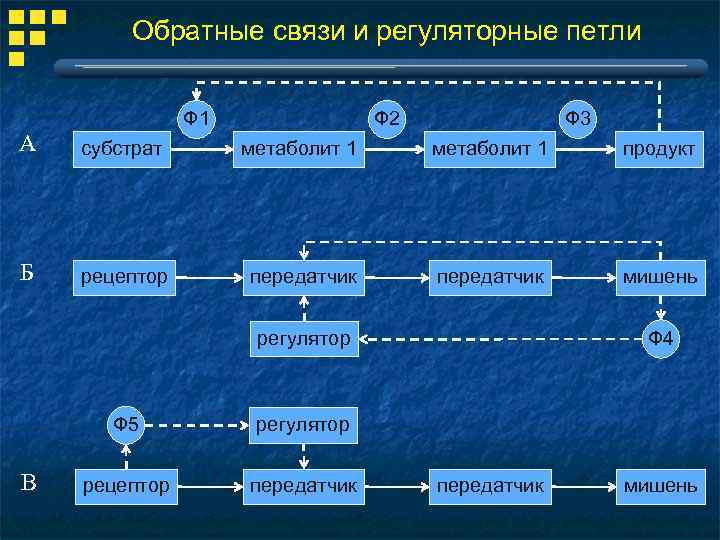 Обратные связи и регуляторные петли Ф 3 Ф 2 Ф 1 А субстрат метаболит 1 продукт Б рецептор передатчик мишень регулятор Ф 5 В регулятор рецептор передатчик Ф 4 передатчик мишень
Обратные связи и регуляторные петли Ф 3 Ф 2 Ф 1 А субстрат метаболит 1 продукт Б рецептор передатчик мишень регулятор Ф 5 В регулятор рецептор передатчик Ф 4 передатчик мишень
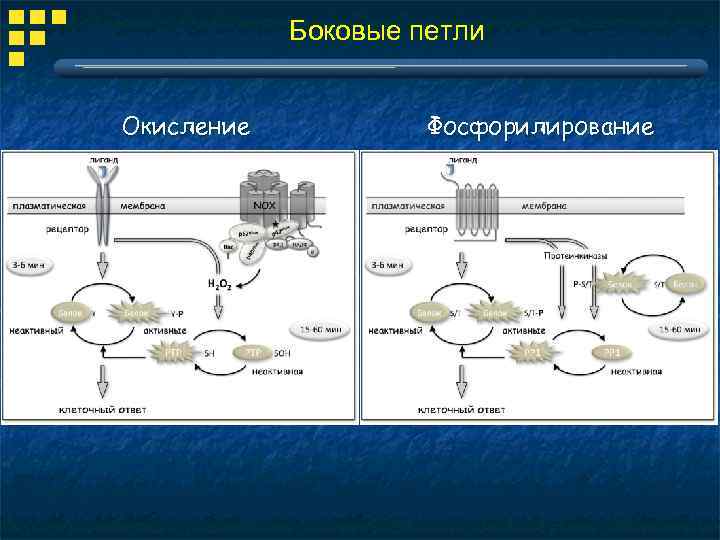 Боковые петли Окисление Фосфорилирование
Боковые петли Окисление Фосфорилирование
 Варианты ковалентной модификации Неддилирование Убиквитинирование Ацетилирование Сумоилирование Метилирование NH 3+ Фосфорилирование Гликозилирование Биотинилирование OH S/T СH 2 Гидроксилирование 6 К 11 К СH 2 К ADP-рибозилирование Метилирование OH O С D/E Фосфорилирование Сульфатирование Нитрозилирование 27 К 29 К 33 К 48 К убиквитин 63 К O Y К белок-мишень
Варианты ковалентной модификации Неддилирование Убиквитинирование Ацетилирование Сумоилирование Метилирование NH 3+ Фосфорилирование Гликозилирование Биотинилирование OH S/T СH 2 Гидроксилирование 6 К 11 К СH 2 К ADP-рибозилирование Метилирование OH O С D/E Фосфорилирование Сульфатирование Нитрозилирование 27 К 29 К 33 К 48 К убиквитин 63 К O Y К белок-мишень
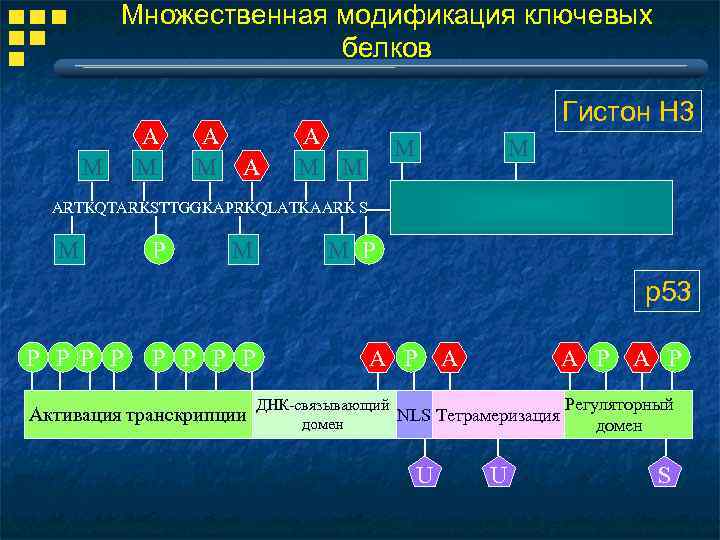 Множественная модификация ключевых белков M A M A Гистон Н 3 A M M ARTKQTARKSTTGGKAPRKQLATKAARK S M P M M P р53 P P P P Активация транскрипции A P A P Регуляторный ДНК-связывающий NLS Тетрамеризация домен U U S
Множественная модификация ключевых белков M A M A Гистон Н 3 A M M ARTKQTARKSTTGGKAPRKQLATKAARK S M P M M P р53 P P P P Активация транскрипции A P A P Регуляторный ДНК-связывающий NLS Тетрамеризация домен U U S
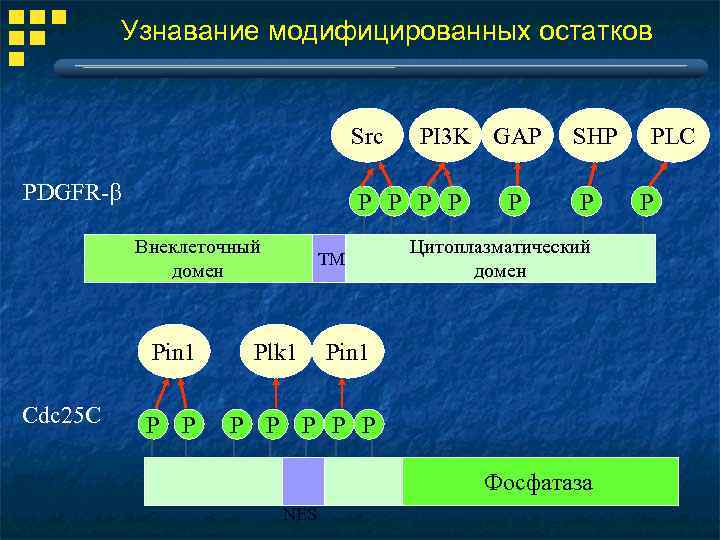 Узнавание модифицированных остатков Src PDGFR-b P P Внеклеточный домен Pin 1 Cdc 25 C PI 3 K GAP P P ТМ Plk 1 P SHP P Цитоплазматический домен Pin 1 P P P Фосфатаза NES PLC P
Узнавание модифицированных остатков Src PDGFR-b P P Внеклеточный домен Pin 1 Cdc 25 C PI 3 K GAP P P ТМ Plk 1 P SHP P Цитоплазматический домен Pin 1 P P P Фосфатаза NES PLC P
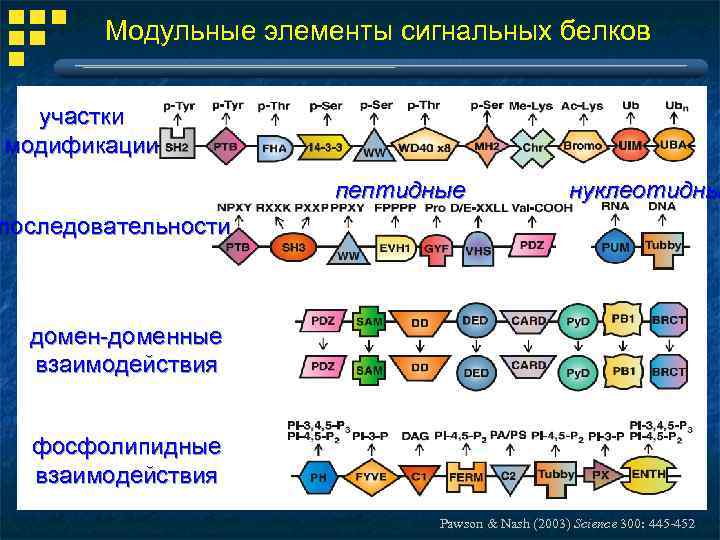 Модульные элементы сигнальных белков участки модификации пептидные нуклеотидны последовательности домен-доменные взаимодействия фосфолипидные взаимодействия Pawson & Nash (2003) Science 300: 445 -452
Модульные элементы сигнальных белков участки модификации пептидные нуклеотидны последовательности домен-доменные взаимодействия фосфолипидные взаимодействия Pawson & Nash (2003) Science 300: 445 -452
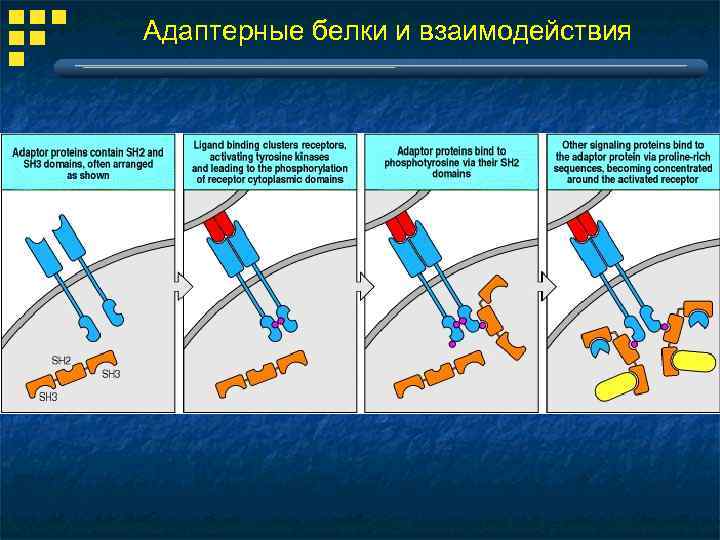 Адаптерные белки и взаимодействия
Адаптерные белки и взаимодействия
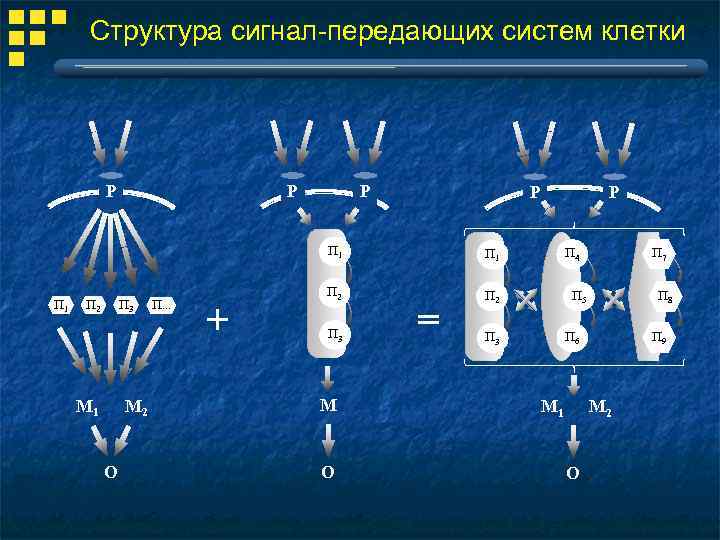 Структура сигнал-передающих систем клетки Р Р П 1 П 2 П 3 М 1 М 2 O П. . . + П 1 П 2 Р П 2 П 3 М O = П 7 П 4 П 8 П 5 П 9 П 6 П 3 М 1 М 2 O
Структура сигнал-передающих систем клетки Р Р П 1 П 2 П 3 М 1 М 2 O П. . . + П 1 П 2 Р П 2 П 3 М O = П 7 П 4 П 8 П 5 П 9 П 6 П 3 М 1 М 2 O
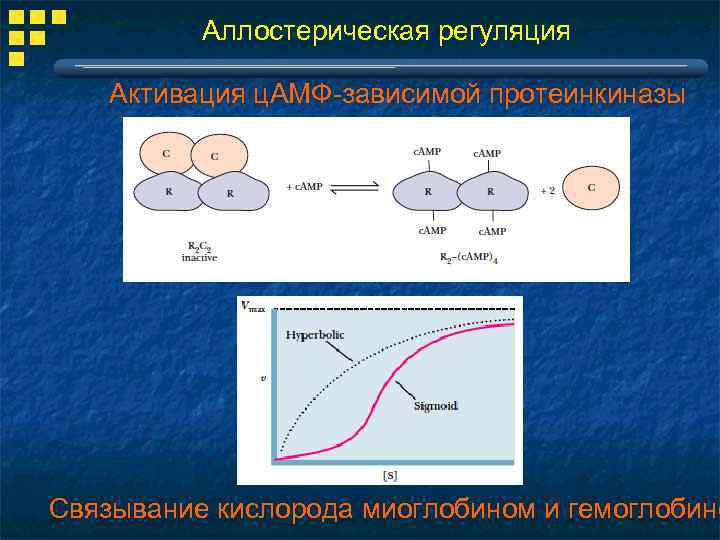 Аллостерическая регуляция Активация ц. АМФ-зависимой протеинкиназы Связывание кислорода миоглобином и гемоглобино
Аллостерическая регуляция Активация ц. АМФ-зависимой протеинкиназы Связывание кислорода миоглобином и гемоглобино
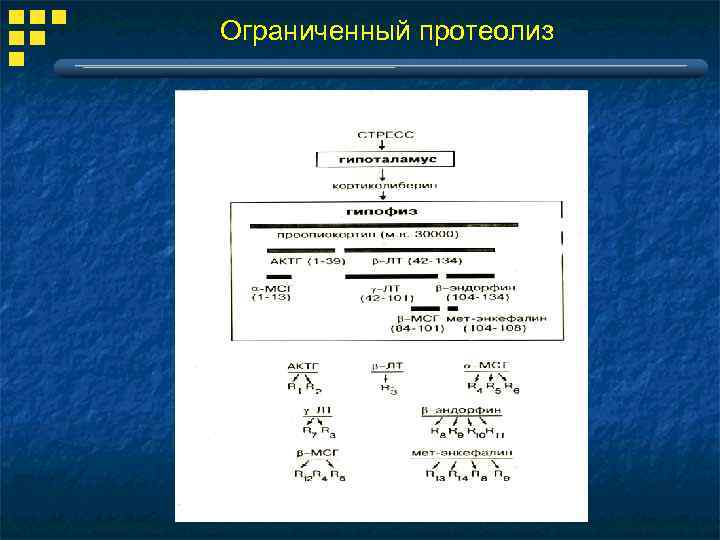 Ограниченный протеолиз
Ограниченный протеолиз
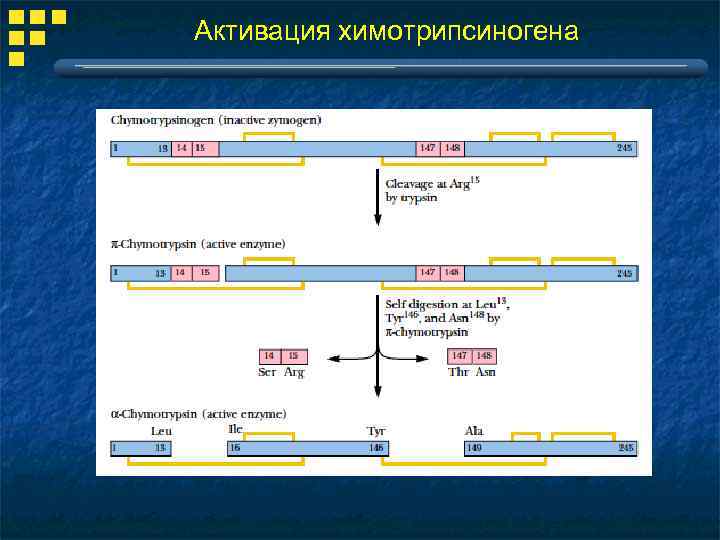 Активация химотрипсиногена
Активация химотрипсиногена
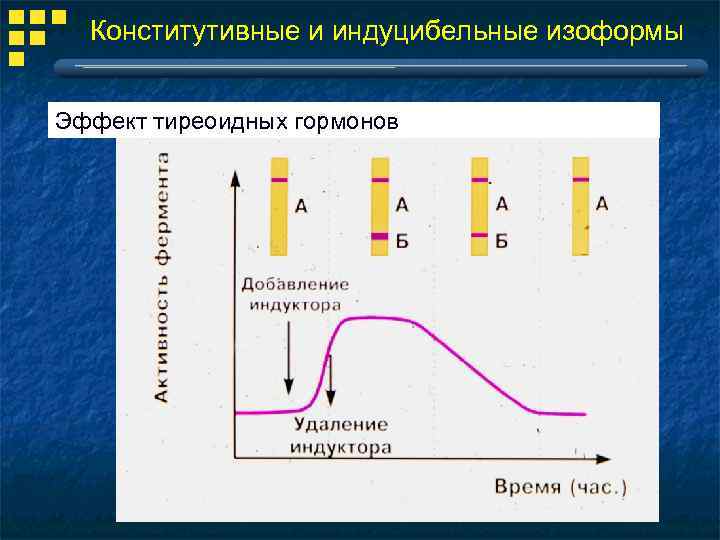 Конститутивные и индуцибельные изоформы Эффект тиреоидных гормонов
Конститутивные и индуцибельные изоформы Эффект тиреоидных гормонов
 МИОГЛОБИН И ГЕМОГЛОБИН l l Транспорт кислорода Структура, гем и связывание кислорода Регуляция и аллостерия Изоформы и патология
МИОГЛОБИН И ГЕМОГЛОБИН l l Транспорт кислорода Структура, гем и связывание кислорода Регуляция и аллостерия Изоформы и патология
 Аллостерическая регуляция Аллостерические ферменты : 1. Не подчиняются кинетике Михаэлиса-Ментен, есть кооперативность 2. Есть аллостерический центр, отличный от каталитического 3. Прямые и обратные (feedback) аллостерические регуляторы 4. Часто имеют олигомерную структуру
Аллостерическая регуляция Аллостерические ферменты : 1. Не подчиняются кинетике Михаэлиса-Ментен, есть кооперативность 2. Есть аллостерический центр, отличный от каталитического 3. Прямые и обратные (feedback) аллостерические регуляторы 4. Часто имеют олигомерную структуру
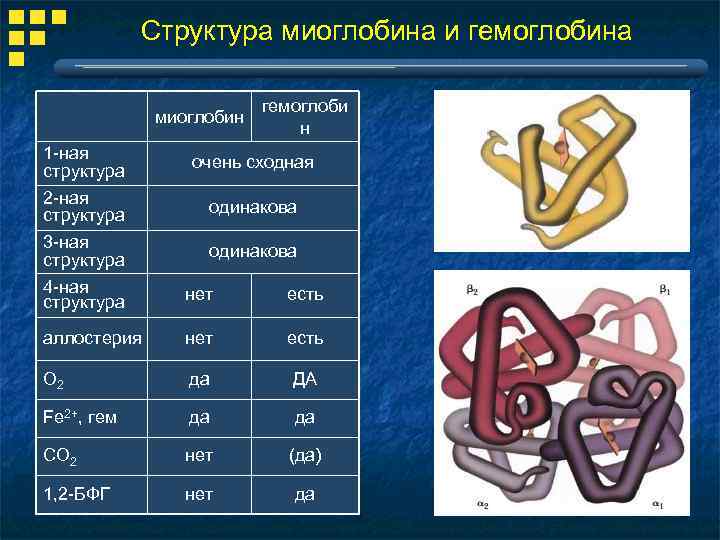 Структура миоглобина и гемоглобина миоглобин гемоглоби н 1 -ная структура очень сходная 2 -ная структура одинакова 3 -ная структура 4 -ная структура одинакова нет есть аллостерия нет есть O 2 да ДА Fe 2+, гем да да CO 2 нет (да) 1, 2 -БФГ нет да
Структура миоглобина и гемоглобина миоглобин гемоглоби н 1 -ная структура очень сходная 2 -ная структура одинакова 3 -ная структура 4 -ная структура одинакова нет есть аллостерия нет есть O 2 да ДА Fe 2+, гем да да CO 2 нет (да) 1, 2 -БФГ нет да
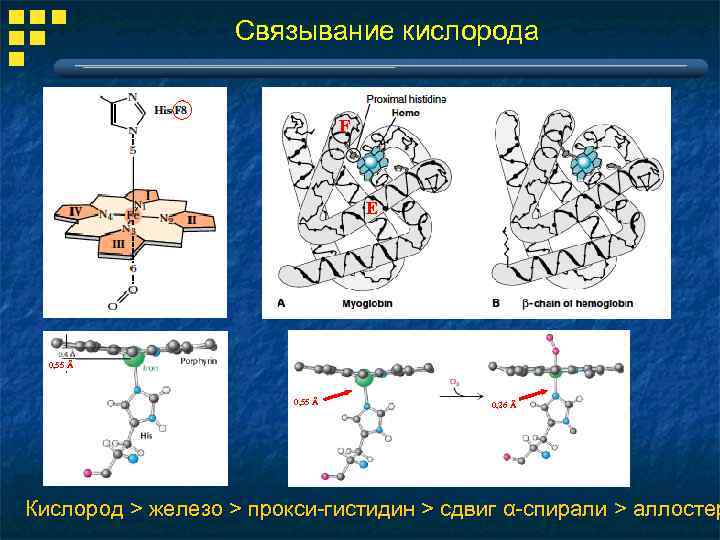 Связывание кислорода F E 0, 55 Å 0, 26 Å Кислород > железо > прокси-гистидин > сдвиг α-спирали > аллостер
Связывание кислорода F E 0, 55 Å 0, 26 Å Кислород > железо > прокси-гистидин > сдвиг α-спирали > аллостер
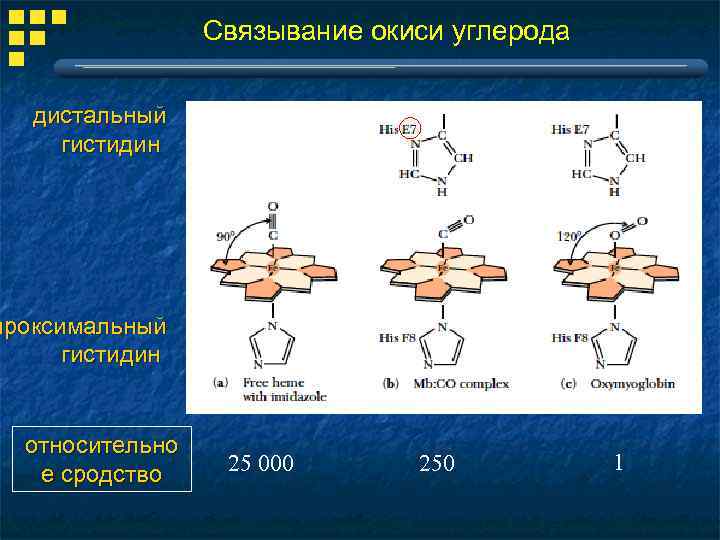 Связывание окиси углерода дистальный гистидин проксимальный гистидин относительно е сродство 25 000 250 1
Связывание окиси углерода дистальный гистидин проксимальный гистидин относительно е сродство 25 000 250 1
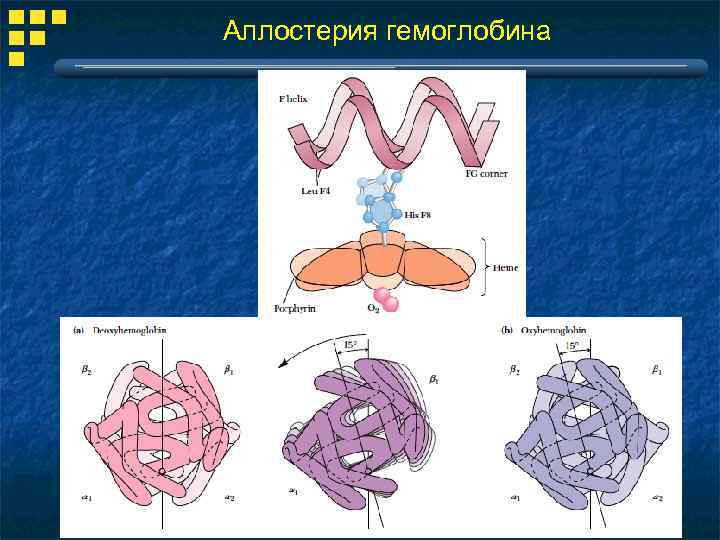 Аллостерия гемоглобина
Аллостерия гемоглобина
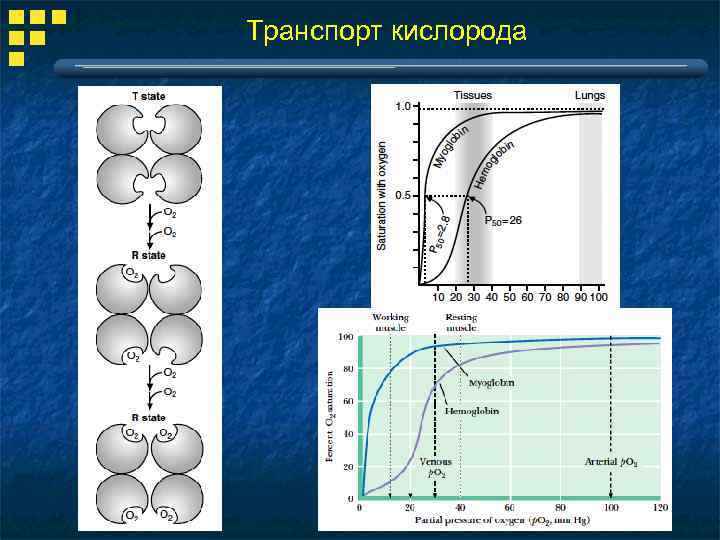 Транспорт кислорода
Транспорт кислорода
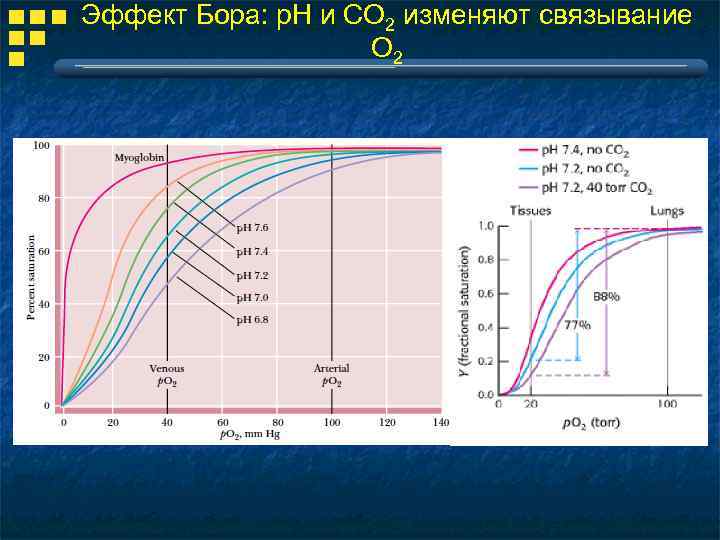 Эффект Бора: р. Н и СО 2 изменяют связывание О 2
Эффект Бора: р. Н и СО 2 изменяют связывание О 2
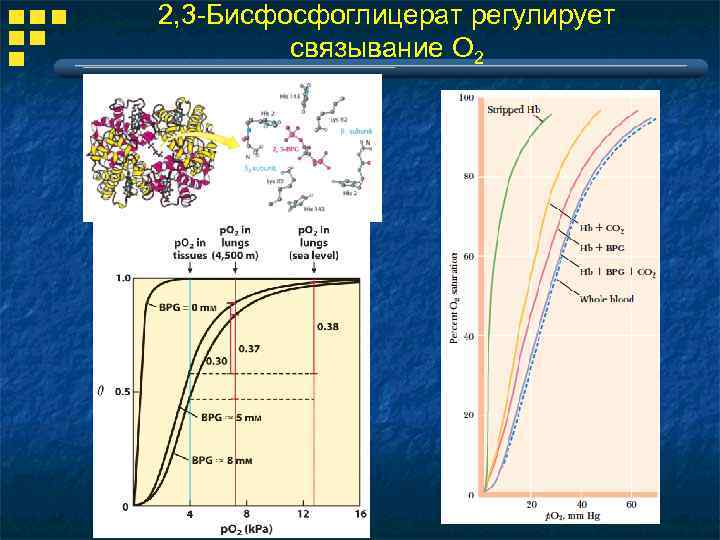 2, 3 -Бисфосфоглицерат регулирует связывание О 2
2, 3 -Бисфосфоглицерат регулирует связывание О 2
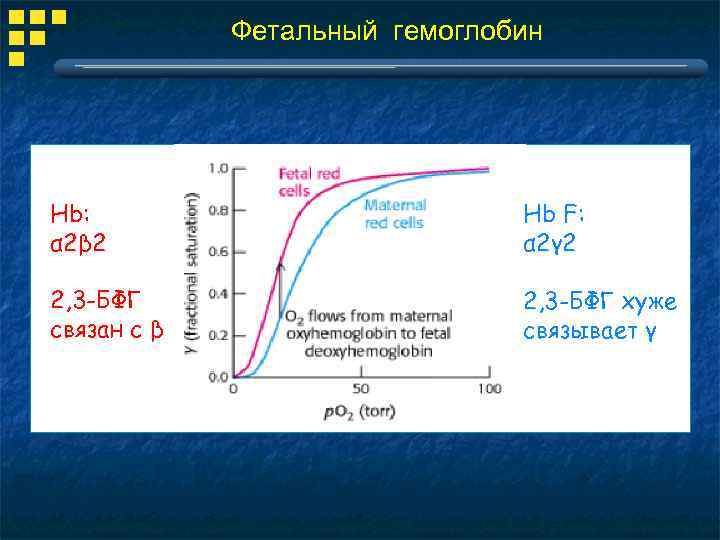 Фетальный гемоглобин Hb: α 2β 2 Hb F: α 2γ 2 2, 3 -БФГ связан с β 2, 3 -БФГ хуже связывает γ
Фетальный гемоглобин Hb: α 2β 2 Hb F: α 2γ 2 2, 3 -БФГ связан с β 2, 3 -БФГ хуже связывает γ
 Двусубстратные реакции Могут быть двух типов Последовательные, или единозамещающие (singledisplacement) Random (креатинкиназа) Ordered (НАД+-зависимые ДГ) Пинг-понг, или двузамещающие (double-displacement) (аминотрансферазы)
Двусубстратные реакции Могут быть двух типов Последовательные, или единозамещающие (singledisplacement) Random (креатинкиназа) Ordered (НАД+-зависимые ДГ) Пинг-понг, или двузамещающие (double-displacement) (аминотрансферазы)


