5. Кинетика биологических процессов.ppt
- Количество слайдов: 33
КИНЕТИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ

ØОсновные понятия химической кинетики ØЭлементарные кинетические уравнения и их решение

МОЛЕКУЛЯРНОСТЬ Химические реакции мономолекулярные тримолекулярные A P 2 A P A + B + C P A P + Q бимолекулярные A + B P A + B + C P + Q +. . . A + B P + Q А + 2 В P + Q +. . .
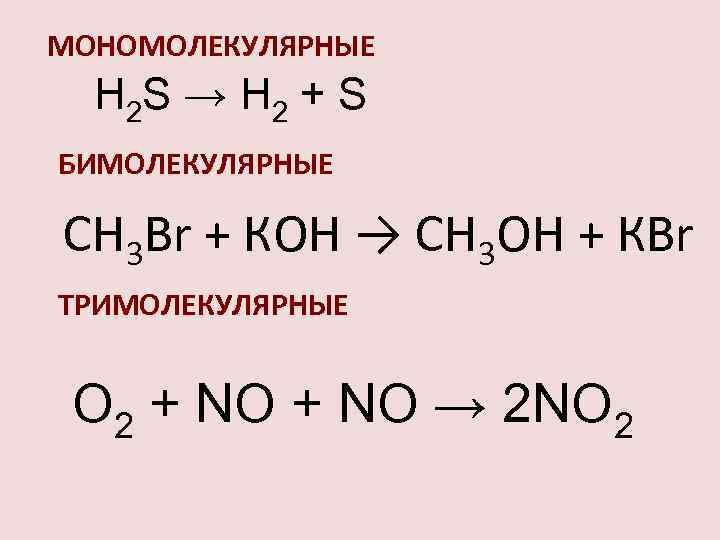
МОНОМОЛЕКУЛЯРНЫЕ H 2 S → H 2 + S БИМОЛЕКУЛЯРНЫЕ СН 3 Вr + КОН → СН 3 ОН + КВr ТРИМОЛЕКУЛЯРНЫЕ О 2 + NО → 2 NО 2
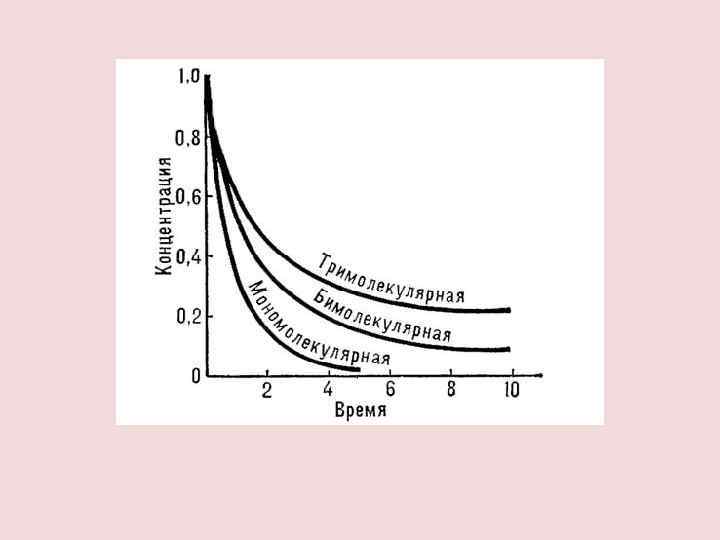

ПОРЯДОК РЕАКЦИИ Порядок реакции определяется величиной показателя степени в кинетическом уравнении a. A+b. B=c. C+d. D порядок прямой реакции η=a+b

Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени a. A+b. B=c. C+d. D

ЗАКОН ДЕЙСТВУЮЩИХ МАСС К. М. ГУЛЬДБЕРГ, П. ВААГЕ Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
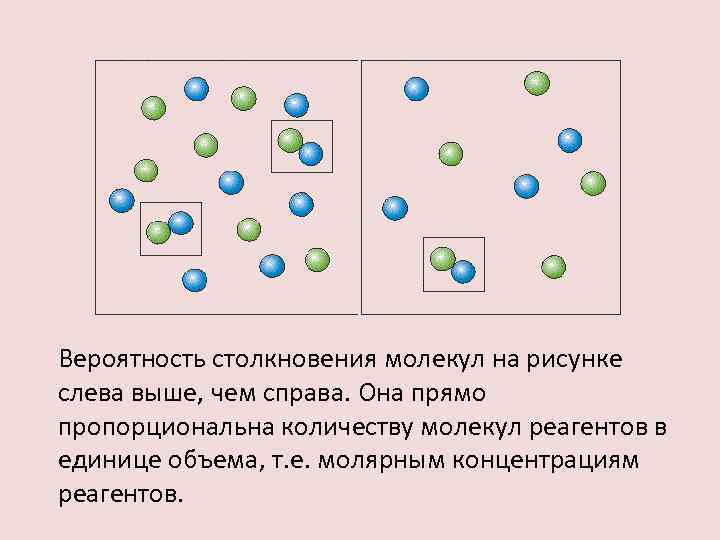
Вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т. е. молярным концентрациям реагентов.

a. A+b. B=c. C+d. D k- константа скорости реакции является мерой реакционной способности реагентов при данной температуре
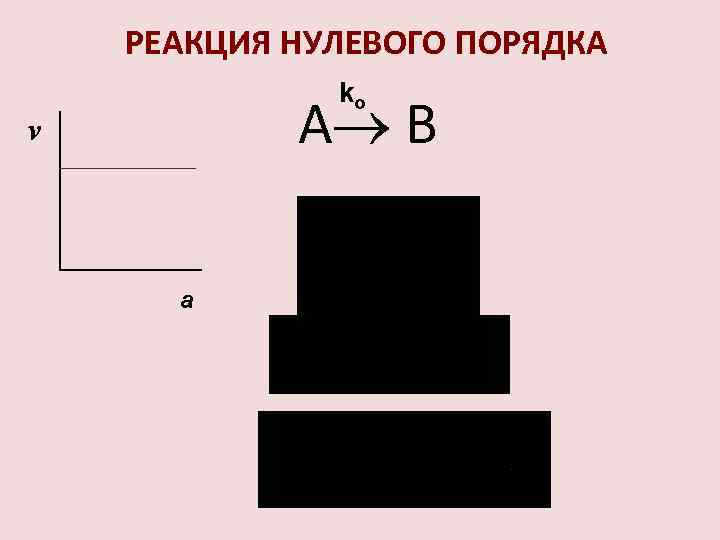
РЕАКЦИЯ НУЛЕВОГО ПОРЯДКА ko А В v a
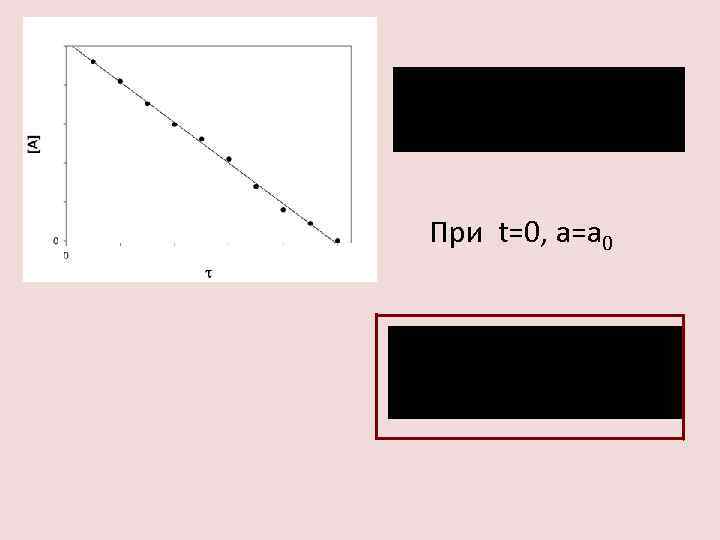
При t=0, a=a 0
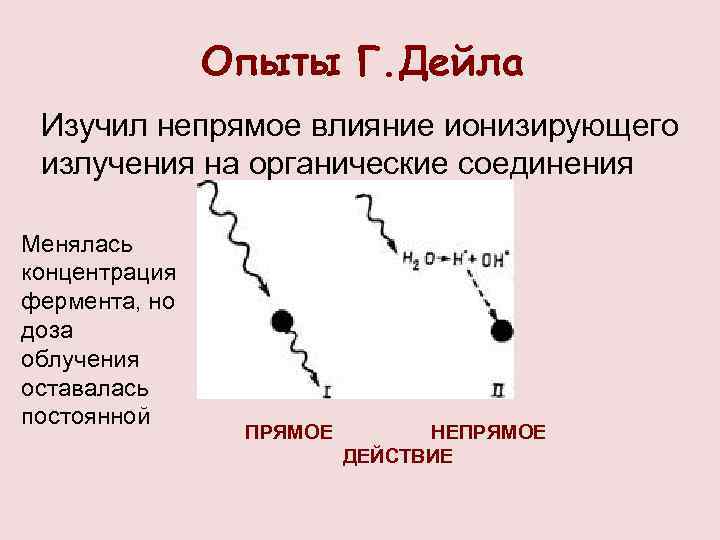
Опыты Г. Дейла Изучил непрямое влияние ионизирующего излучения на органические соединения Менялась концентрация фермента, но доза облучения оставалась постоянной ПРЯМОЕ НЕПРЯМОЕ ДЕЙСТВИЕ
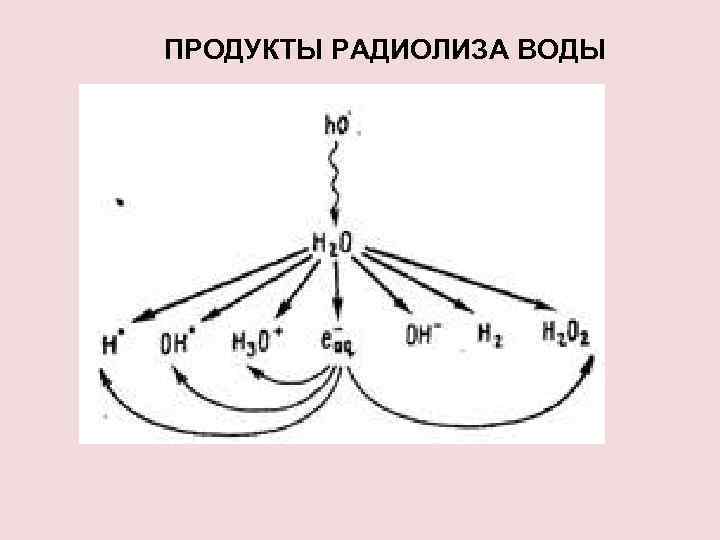
ПРОДУКТЫ РАДИОЛИЗА ВОДЫ
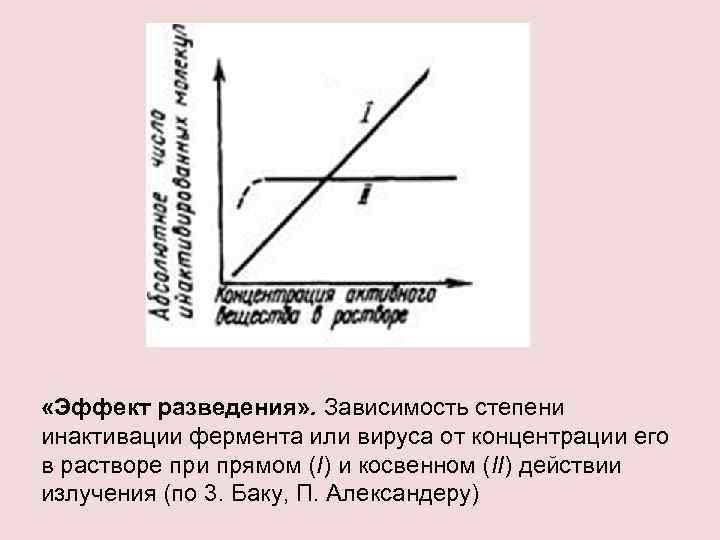
«Эффект разведения» . Зависимость степени инактивации фермента или вируса от концентрации его в растворе при прямом (I) и косвенном (II) действии излучения (по 3. Баку, П. Александеру)
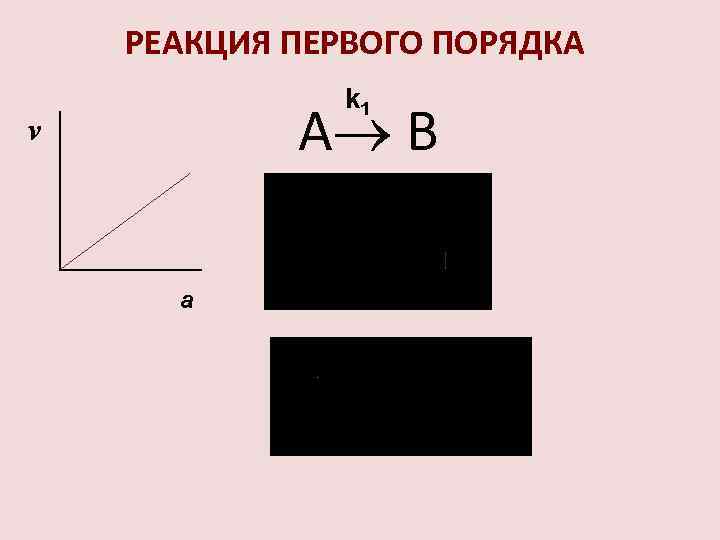
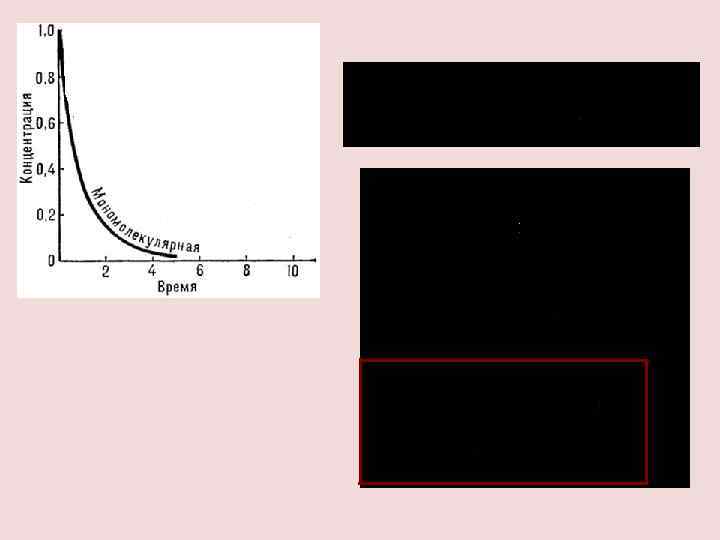
РЕАКЦИЯ ПЕРВОГО ПОРЯДКА k 1 А В v a
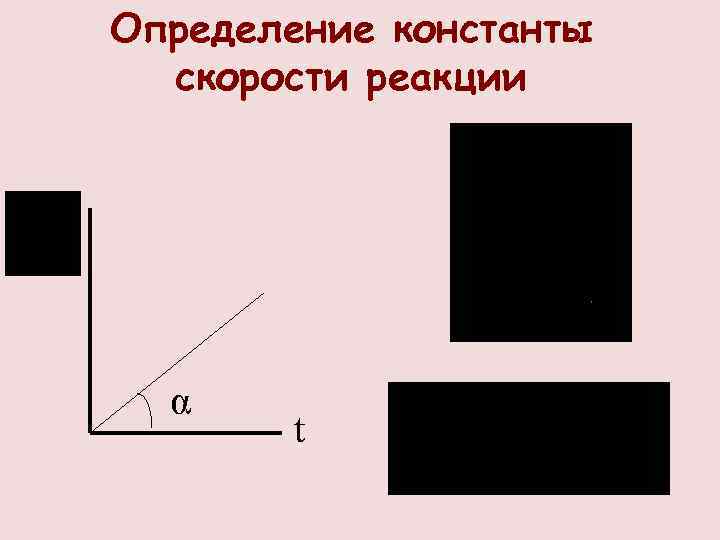
Определение константы скорости реакции α t

Выражение для b найдем из условия закрытости системы

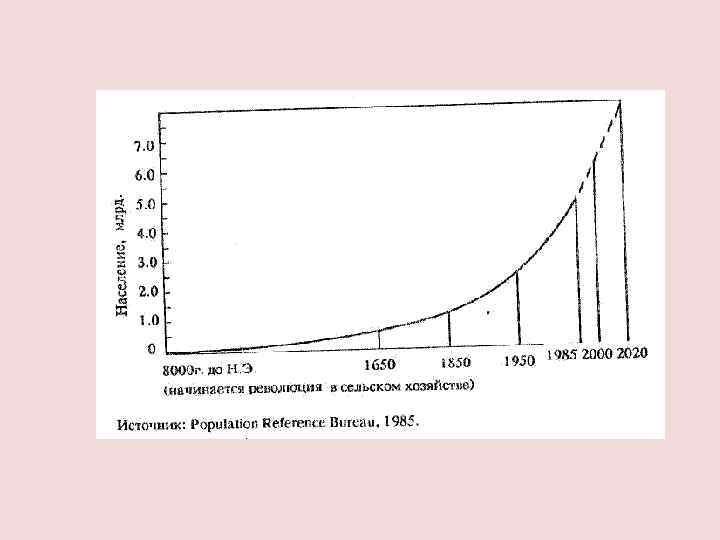
МОДЕЛЬ МАЛЬТУСА Т. Мальтус (1766– 1834) α — коэффициент прироста x 0 — численность популяции в начальный момент времени.

СКОРОСТЬ РЕАКЦИИ ВТОРОГО ПОРЯДКА
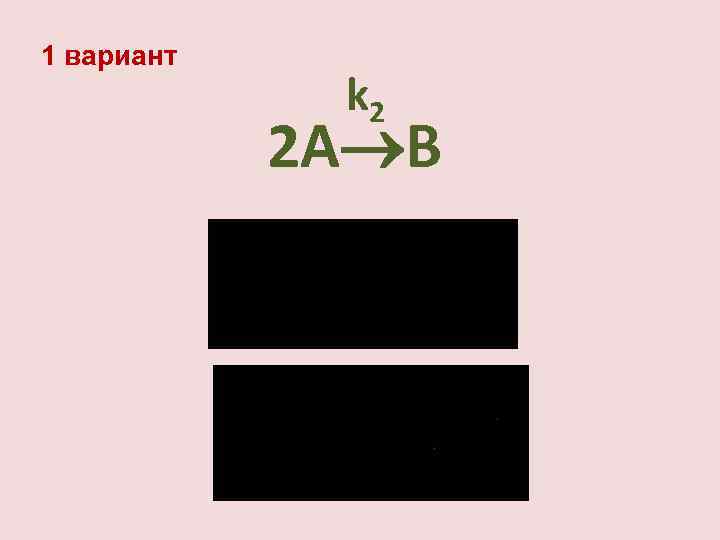
1 вариант k 2 2 А В

Определим С при t=0, a=a 0
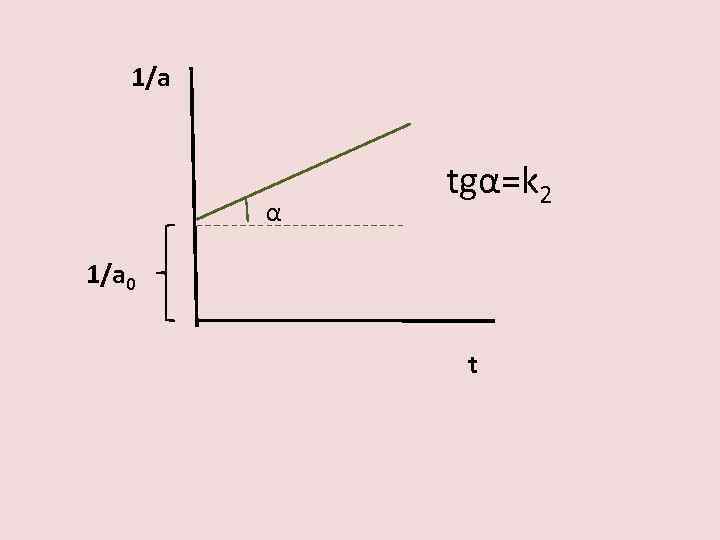
1/a α tgα=k 2 1/a 0 t

k 2 2 вариант При t=0 a=a 0 А+B C b=b 0 X – количество каждого вещества, израсходованного за время t

ИСПОЛЬЗУЕМ ТОЖДЕСТВО: ПОЛУЧИМ:


ОПРЕДЕЛИМ t=0, a=a 0 , С ПРИ УСЛОВИИ, ЧТО b=b 0 , x=0

ПРЕОБРАЗОВАНИЕ ДАЕТ:

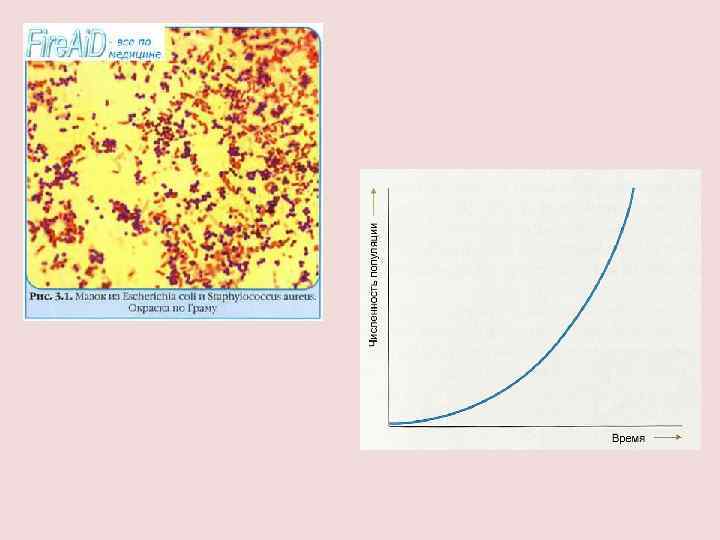
ПРИМЕР БИОЛОГИЧЕСКОЙ РЕАКЦИИ ВТОРОГО ПОРЯДКА СКОРОСТЬ РОСТА КЛЕТОК α НЕ ЯВЛЯЕТСЯ ПОСТОЯННОЙ, Т. К. КЛЕТКИ НЕ ТОЛЬКО РАЗМНОЖАЮТСЯ, НО И ГИБНУТ, ПОЭТОМУ α= -γN ( , γ - константы)
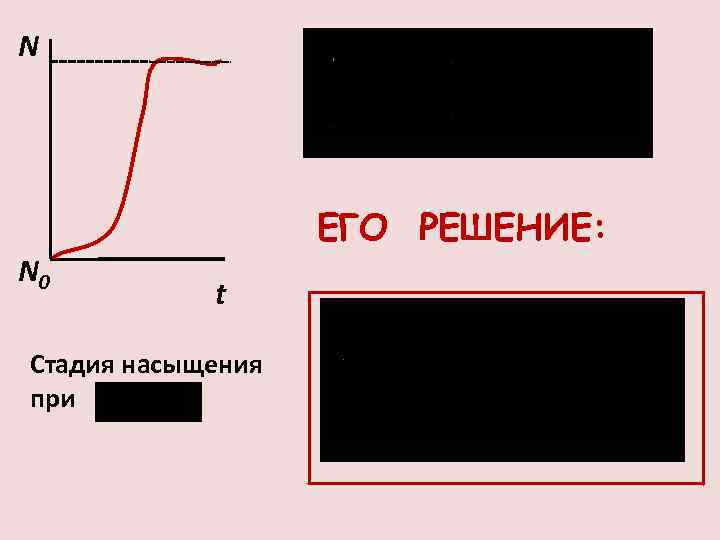
N N 0 ЕГО РЕШЕНИЕ: t Стадия насыщения при
5. Кинетика биологических процессов.ppt