2011_OKhT_Min_LK_4_kinet_i_optim_rezhim.ppt
- Количество слайдов: 50
 Кинетический и оптимальный режимы Основные закономерности химической технологии - Химическое равновесие Кинетика химических превращений - Кинетическое уравнение или кинетическая модель реакции - зависимость скорости протекания реакции от условий её протекания. Влияние концентрации на скорость реакции - Кинетические уравнения простых, сложных, гомогенных и гетерогенных реакций - Влияние температуры на скорость реакций - Влияние катализатора на скорость реакций - Влияние давления на скорость реакций - Влияние поверхности раздела фаз на скорость реакций Оптимальный температурный режим и способы его осуществления в реакторах для эндо- и экзотермических обратимых и необратимых химических процессов - Способы осуществления оптимального температурного режима - Выбор оптимальной концентрации
Кинетический и оптимальный режимы Основные закономерности химической технологии - Химическое равновесие Кинетика химических превращений - Кинетическое уравнение или кинетическая модель реакции - зависимость скорости протекания реакции от условий её протекания. Влияние концентрации на скорость реакции - Кинетические уравнения простых, сложных, гомогенных и гетерогенных реакций - Влияние температуры на скорость реакций - Влияние катализатора на скорость реакций - Влияние давления на скорость реакций - Влияние поверхности раздела фаз на скорость реакций Оптимальный температурный режим и способы его осуществления в реакторах для эндо- и экзотермических обратимых и необратимых химических процессов - Способы осуществления оптимального температурного режима - Выбор оптимальной концентрации

 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Экзотермический процесс характеризуется условием ΔН 0 Т<0, следовательно, и тогда с увеличением температуры К 0 р, Т уменьшается и вследствие этого уменьшаются концентрации продуктов реакции. Примером реакции, равновесие которой при нагревании смещается вправо, является разложение карбоната кальция: Са. СО 3 =Са. О + СO 2; ΔH° 298 = 178 к. Дж Наоборот, равновесие 2 NO = N 2 + O 2; Δ H° 298 = -181 к. Дж при повышении температуры смещается влево.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Экзотермический процесс характеризуется условием ΔН 0 Т<0, следовательно, и тогда с увеличением температуры К 0 р, Т уменьшается и вследствие этого уменьшаются концентрации продуктов реакции. Примером реакции, равновесие которой при нагревании смещается вправо, является разложение карбоната кальция: Са. СО 3 =Са. О + СO 2; ΔH° 298 = 178 к. Дж Наоборот, равновесие 2 NO = N 2 + O 2; Δ H° 298 = -181 к. Дж при повышении температуры смещается влево.
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т. е. если в реакции участвуют твердые вещества, то они в расчет не берутся. Давление на Кр не влияет, но влияет на КN. где ν∑ - суммарный стехиометрический коэффициент реакции, вычисленной по газообразным участникам реакции и равен изменению числа моль и, соответственно, объема реакционной смеси протекании реакции; Робщ – общее относительное давление в зоне реакции. Если ν∑=Δn>0 (реакция идет с увеличением числа газовых молей, т. е. объем возрастает) и, следовательно, КN уменьшается. Это означает, что повышение давления смещает равновесие данной реакции влево, в сторону реагентов. Если Δn<0, объем уменьшается и увеличивается КN.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т. е. если в реакции участвуют твердые вещества, то они в расчет не берутся. Давление на Кр не влияет, но влияет на КN. где ν∑ - суммарный стехиометрический коэффициент реакции, вычисленной по газообразным участникам реакции и равен изменению числа моль и, соответственно, объема реакционной смеси протекании реакции; Робщ – общее относительное давление в зоне реакции. Если ν∑=Δn>0 (реакция идет с увеличением числа газовых молей, т. е. объем возрастает) и, следовательно, КN уменьшается. Это означает, что повышение давления смещает равновесие данной реакции влево, в сторону реагентов. Если Δn<0, объем уменьшается и увеличивается КN.
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Для определения степени смещения равновесия необходимо знать абсолютную величину ΔV. Так, если на реакции N 2 + 3 Н 2 =2 NH 3; СО + 2 Н 2 =СН 3 ОН повышение давления влияет почти одинаково (Δ V = – 2 моль), то для реакции 2 SO 2 + O 2 =2 SO 3 его действие менее эффективно (Δ V = – 1 моль).
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие Для определения степени смещения равновесия необходимо знать абсолютную величину ΔV. Так, если на реакции N 2 + 3 Н 2 =2 NH 3; СО + 2 Н 2 =СН 3 ОН повышение давления влияет почти одинаково (Δ V = – 2 моль), то для реакции 2 SO 2 + O 2 =2 SO 3 его действие менее эффективно (Δ V = – 1 моль).
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции в сторону исходных веществ. Во многих случаях смещение химического равновесия вправо можно осуществить, удаляя продукты процесса из реакционной зоны путем связывания их в малодиссоциирующие, малорастворимые или нелетучие вещества. Так, введение в равновесную систему СН 3 ОН + СН 3 СООН = СН 3 СООСН 3 + Н 2 O водоотнимающих веществ, например H 2 SO 4, позволяет сместить реакцию вправо. При введении в равновесную систему (при р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Если течение процесса связано с уменьшением объема, то равновесие сместится влево (например, при синтезе аммиака). Наоборот, для реакций, которые сопровождаются возрастанием объема реакционной смеси, разбавление инертным газом вызывает увеличение степени протекания прямой реакции. Если же Δ V = 0, то система нечувствительна к присутствию инертного газа. Катализаторы не влияют на смещение химического равновесия!
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Химическое равновесие 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции в сторону исходных веществ. Во многих случаях смещение химического равновесия вправо можно осуществить, удаляя продукты процесса из реакционной зоны путем связывания их в малодиссоциирующие, малорастворимые или нелетучие вещества. Так, введение в равновесную систему СН 3 ОН + СН 3 СООН = СН 3 СООСН 3 + Н 2 O водоотнимающих веществ, например H 2 SO 4, позволяет сместить реакцию вправо. При введении в равновесную систему (при р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Если течение процесса связано с уменьшением объема, то равновесие сместится влево (например, при синтезе аммиака). Наоборот, для реакций, которые сопровождаются возрастанием объема реакционной смеси, разбавление инертным газом вызывает увеличение степени протекания прямой реакции. Если же Δ V = 0, то система нечувствительна к присутствию инертного газа. Катализаторы не влияют на смещение химического равновесия!
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Нельзя считать, что чем дальше реагенты находятся от состояния равновесия, т. е. чем отрицательнее энергия Гиббса реакции Δ G, тем быстрее будет достигнуто равновесие, т. е. между скоростью достижения равновесия и его положением нет однозначной зависимости. Так, для реакций 2 NO (г) + O 2 (г) = 2 NO 2 (г); ΔG° 298 = -70 к. Дж 2 Н 2 (г)+O 2 (г) = 2 Н 2 O (г); ΔG° 298 = -447 к. Дж энергия Гиббса меньше у второго процесса, однако первая реакция в отличие от второй протекает очень быстро при обычной температуре. Если термодинамические данные свидетельствуют о невозможности протекания реакции, т. е. если Δ G > 0, то, разумеется, бессмысленно пытаться реализовать ее при данных условиях. Но и в том случае, когда согласно расчету процесс принципиально осуществим (Δ G < 0), он может протекать не при всех условиях.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Нельзя считать, что чем дальше реагенты находятся от состояния равновесия, т. е. чем отрицательнее энергия Гиббса реакции Δ G, тем быстрее будет достигнуто равновесие, т. е. между скоростью достижения равновесия и его положением нет однозначной зависимости. Так, для реакций 2 NO (г) + O 2 (г) = 2 NO 2 (г); ΔG° 298 = -70 к. Дж 2 Н 2 (г)+O 2 (г) = 2 Н 2 O (г); ΔG° 298 = -447 к. Дж энергия Гиббса меньше у второго процесса, однако первая реакция в отличие от второй протекает очень быстро при обычной температуре. Если термодинамические данные свидетельствуют о невозможности протекания реакции, т. е. если Δ G > 0, то, разумеется, бессмысленно пытаться реализовать ее при данных условиях. Но и в том случае, когда согласно расчету процесс принципиально осуществим (Δ G < 0), он может протекать не при всех условиях.
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Исследованием течения реакций во времени занимается химическая кинетика. Под кинетикой в широком смысле понимают учение о скоростях различных процессов (химических реакций, растворения, кристаллизации, парообразования и т. д. ) и их механизмах, определяющих скорость процесса. Ход любой реакции можно представить схемой: Исходные реагенты → Промежуточные вещества → Продукты реакции (переходное состояние) Выявление и учет параметров переходного состояния, не требующихся для вычисления значений ΔH, Δ S, и Δ G процессов, но определяющих скорость, является чрезвычайно сложной проблемой, так как в отличие от исходных реагентов и продуктов реакции промежуточные продукты выделить и изучить зачастую затруднительно. Число актов взаимодействия, происходящих в единицу времени (для гомогенных реакций – в единице объема, для гетерогенных – на единице поверхности раздела фаз) определяет скорость реакции.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Исследованием течения реакций во времени занимается химическая кинетика. Под кинетикой в широком смысле понимают учение о скоростях различных процессов (химических реакций, растворения, кристаллизации, парообразования и т. д. ) и их механизмах, определяющих скорость процесса. Ход любой реакции можно представить схемой: Исходные реагенты → Промежуточные вещества → Продукты реакции (переходное состояние) Выявление и учет параметров переходного состояния, не требующихся для вычисления значений ΔH, Δ S, и Δ G процессов, но определяющих скорость, является чрезвычайно сложной проблемой, так как в отличие от исходных реагентов и продуктов реакции промежуточные продукты выделить и изучить зачастую затруднительно. Число актов взаимодействия, происходящих в единицу времени (для гомогенных реакций – в единице объема, для гетерогенных – на единице поверхности раздела фаз) определяет скорость реакции.
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Для выражения скорости реакции можно использовать и пропорциональные числу актов величины, например, скорость изменения во времени концентрации реагирующих веществ (концентрацию обычно выражают в моль/л, а время – в секундах). Так как в общем случае концентрации реагирующих веществ непрерывно изменяются, то следует рассматривать мгновенную скорость реакции r, т. е. скорость в данный момент времени τ. Она выражает изменение количества n реагирующих веществ в единицу времени в единице объема V реакционного пространства: (6 -1) Для гомогенных реакций скорость можно выразить как изменение во времени концентрации: (6 -2) где с = n / V – концентрация любого реагента (так как все они связаны стехиометрическими коэффициентами).
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Для выражения скорости реакции можно использовать и пропорциональные числу актов величины, например, скорость изменения во времени концентрации реагирующих веществ (концентрацию обычно выражают в моль/л, а время – в секундах). Так как в общем случае концентрации реагирующих веществ непрерывно изменяются, то следует рассматривать мгновенную скорость реакции r, т. е. скорость в данный момент времени τ. Она выражает изменение количества n реагирующих веществ в единицу времени в единице объема V реакционного пространства: (6 -1) Для гомогенных реакций скорость можно выразить как изменение во времени концентрации: (6 -2) где с = n / V – концентрация любого реагента (так как все они связаны стехиометрическими коэффициентами).
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Так концентрация исходных веществ убывает (dc<0), а продуктов реакции возрастает (dc > 0), то при расчете скорости по изменению концентрации исходных веществ эту производную надо брать с минусом rисх < 0 (dc<0, dt>0), а по изменению концентрации продуктов реакции – с плюсом rпрод >0 (dc>0, dt>0). Для необратимой реакции: a. A + b. B + c. C = l. L + d. D Процесс можно контролировать по любому компоненту: (6 -3) при V = const (6 -4)
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Так концентрация исходных веществ убывает (dc<0), а продуктов реакции возрастает (dc > 0), то при расчете скорости по изменению концентрации исходных веществ эту производную надо брать с минусом rисх < 0 (dc<0, dt>0), а по изменению концентрации продуктов реакции – с плюсом rпрод >0 (dc>0, dt>0). Для необратимой реакции: a. A + b. B + c. C = l. L + d. D Процесс можно контролировать по любому компоненту: (6 -3) при V = const (6 -4)
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Скорость реакции зависит от многих факторов. На нее влияют: • природа и концентрация реагентов, • температура, • давление (для реакций с участием газов), • катализатор, • площадь контакта фаз (для гетерогенных процессов), • наличие примесей и их концентрации, • среда (для реакций в растворах), • форма сосуда (для цепных реакций), • интенсивность света (для фотохимических реакций), • потенциал электродов (для электрохимических реакции), • мощность дозы излучения (для радиационно-химических процессов). Основными параметрами, которые приходится учитывать при изучении кинетики процессов, являются концентрации (давления) реагентов, температура и действие катализатора.
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Кинетика химических превращений Скорость реакции зависит от многих факторов. На нее влияют: • природа и концентрация реагентов, • температура, • давление (для реакций с участием газов), • катализатор, • площадь контакта фаз (для гетерогенных процессов), • наличие примесей и их концентрации, • среда (для реакций в растворах), • форма сосуда (для цепных реакций), • интенсивность света (для фотохимических реакций), • потенциал электродов (для электрохимических реакции), • мощность дозы излучения (для радиационно-химических процессов). Основными параметрами, которые приходится учитывать при изучении кинетики процессов, являются концентрации (давления) реагентов, температура и действие катализатора.
 Кинетика химических превращений Кинетическое уравнение или кинетическая модель реакции – зависимость скорости реакции от условий ее протекания ВЛИЯНИЕ КОНЦЕНТРАЦИИ НА СКОРОСТЬ РЕАКЦИЙ Закон действия масс. Основным законом химической кинетики является открытый в 18641867 гг. Гульдбергом и Вааге (Норвегия) закон действия масс (закон действующих масс), согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, вероятность их взаимодействия, пропорциональна концентрациям реагентов.
Кинетика химических превращений Кинетическое уравнение или кинетическая модель реакции – зависимость скорости реакции от условий ее протекания ВЛИЯНИЕ КОНЦЕНТРАЦИИ НА СКОРОСТЬ РЕАКЦИЙ Закон действия масс. Основным законом химической кинетики является открытый в 18641867 гг. Гульдбергом и Вааге (Норвегия) закон действия масс (закон действующих масс), согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, вероятность их взаимодействия, пропорциональна концентрациям реагентов.
 Кинетика химических превращений Влияние концентрации на скорость реакций Рассмотрим одностадийную обратимую реакцию, протекающую в гомогенной среде А + B ↔ AB Предположим, что в закрытом сосуде приведены в соприкосновение вещества А и В. Кинетическое уравнение зависимости скорости реакции от концентрации реагентов согласно закону действия масс выразится соотношением (6 -5) rпp = kпp CA CВ где kпр – константа скорости прямой реакции. Как только образуются молекулы АВ, начнется обратная реакция со скоростью, равной (6 -6) rобр = kобр CAВ ko 6 p – константа скорости обратной реакции.
Кинетика химических превращений Влияние концентрации на скорость реакций Рассмотрим одностадийную обратимую реакцию, протекающую в гомогенной среде А + B ↔ AB Предположим, что в закрытом сосуде приведены в соприкосновение вещества А и В. Кинетическое уравнение зависимости скорости реакции от концентрации реагентов согласно закону действия масс выразится соотношением (6 -5) rпp = kпp CA CВ где kпр – константа скорости прямой реакции. Как только образуются молекулы АВ, начнется обратная реакция со скоростью, равной (6 -6) rобр = kобр CAВ ko 6 p – константа скорости обратной реакции.
 Кинетика химических превращений Влияние концентрации на скорость реакций По мере протекания реакции с уменьшением концентрации реагентов A и В и с увеличением концентрации продукта реакции АВ скорость прямой реакции rпр снижается, а скорость обратной реакции rобр возрастает. Через некоторое время скорости встречных процессов сравняются rпр = rобр. т. е. в системе наступит подвижное (динамическое) равновесие. В соответствии с (6 -5) и (6 -5) (6 -7) kпp CA CВ = kобр CAВ Молекулярность и порядок реакций. В химической кинетике реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. a + b + c = молекулярность для a. A + b. B + c. C = l. L + d. D По этому параметру различают реакции мономолекулярные, бимолекулярные и т. д.
Кинетика химических превращений Влияние концентрации на скорость реакций По мере протекания реакции с уменьшением концентрации реагентов A и В и с увеличением концентрации продукта реакции АВ скорость прямой реакции rпр снижается, а скорость обратной реакции rобр возрастает. Через некоторое время скорости встречных процессов сравняются rпр = rобр. т. е. в системе наступит подвижное (динамическое) равновесие. В соответствии с (6 -5) и (6 -5) (6 -7) kпp CA CВ = kобр CAВ Молекулярность и порядок реакций. В химической кинетике реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. a + b + c = молекулярность для a. A + b. B + c. C = l. L + d. D По этому параметру различают реакции мономолекулярные, бимолекулярные и т. д.
 Кинетика химических превращений Влияние концентрации на скорость реакций α + β + γ = порядок реакции. Сумма показателей степеней в кинетических уравнениях называется общим (суммарным) порядком реакции. Таким образом, порядок реакции определяет характер зависимости скорости от концентрации реагентов. Для элементарных реакций молекулярность и порядок реакции совпадают. Пример такого несовпадения порядка реакции с ее молекулярностью можно показать на следующем процессе: 2 N 2 O 5 → 4 NO 2 + O 2 которая, вероятно, протекает в две стадии: N 2 O 5 → N 2 O 3 + O 2; N 2 O 5 + N 2 O 3 → 4 NO 2 причем скорость реакции на первой стадии значительно меньше скорости во второй стадии. В соответствии с первой стадией, лимитирующей скорость всего процесса, разложение оксида азота (V) – это реакция первого порядка, а по числу частиц, участвующих в элементарном химическом акте – это бимолекулярная реакция.
Кинетика химических превращений Влияние концентрации на скорость реакций α + β + γ = порядок реакции. Сумма показателей степеней в кинетических уравнениях называется общим (суммарным) порядком реакции. Таким образом, порядок реакции определяет характер зависимости скорости от концентрации реагентов. Для элементарных реакций молекулярность и порядок реакции совпадают. Пример такого несовпадения порядка реакции с ее молекулярностью можно показать на следующем процессе: 2 N 2 O 5 → 4 NO 2 + O 2 которая, вероятно, протекает в две стадии: N 2 O 5 → N 2 O 3 + O 2; N 2 O 5 + N 2 O 3 → 4 NO 2 причем скорость реакции на первой стадии значительно меньше скорости во второй стадии. В соответствии с первой стадией, лимитирующей скорость всего процесса, разложение оксида азота (V) – это реакция первого порядка, а по числу частиц, участвующих в элементарном химическом акте – это бимолекулярная реакция.
 Кинетика химических превращений Влияние концентрации на скорость реакций Для обратимой реакции: a. A + b. B + c. C ↔ l. L + d. D Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Реакция нулевого порядка График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетика химических превращений Влияние концентрации на скорость реакций Для обратимой реакции: a. A + b. B + c. C ↔ l. L + d. D Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Реакция нулевого порядка График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
 Кинетика химических превращений Влияние концентрации на скорость реакций Кинетическое уравнение имеет следующий вид: r 0 = k 0 Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени: k 1 = − tgα График зависимости концентрации реагента A для первого порядка реакции
Кинетика химических превращений Влияние концентрации на скорость реакций Кинетическое уравнение имеет следующий вид: r 0 = k 0 Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени: k 1 = − tgα График зависимости концентрации реагента A для первого порядка реакции
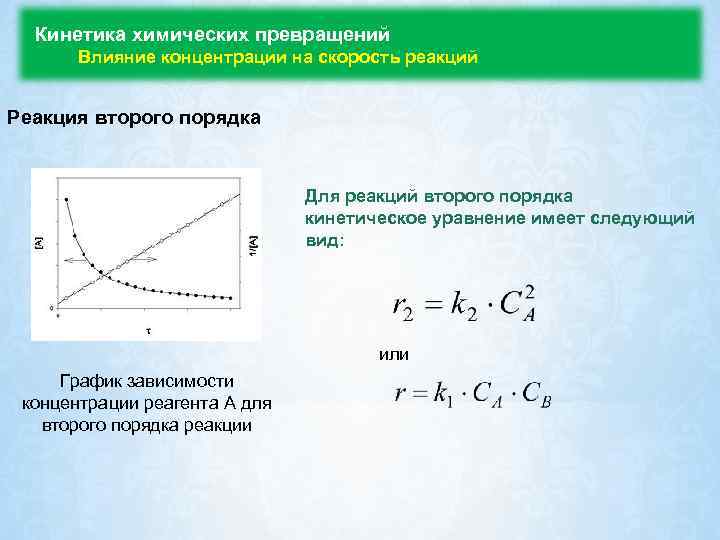 Кинетика химических превращений Влияние концентрации на скорость реакций Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид: или График зависимости концентрации реагента A для второго порядка реакции
Кинетика химических превращений Влияние концентрации на скорость реакций Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид: или График зависимости концентрации реагента A для второго порядка реакции
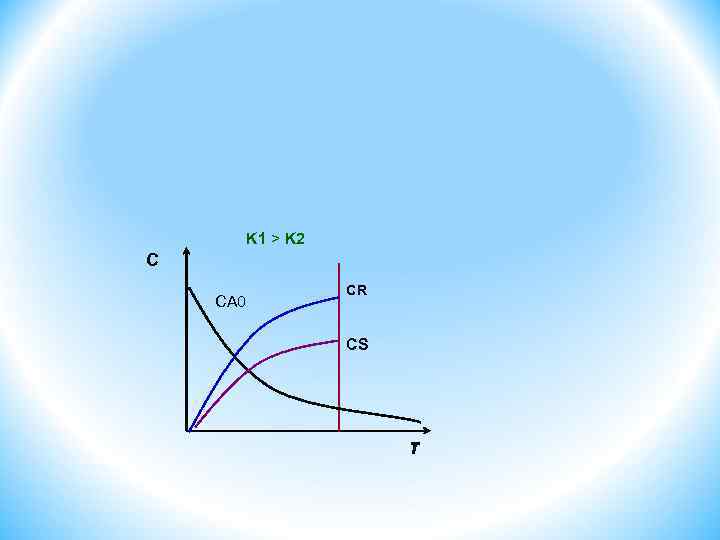
 Кинетика химических превращений Влияние концентрации на скорость реакций Кинетические уравнения простых, сложных, гомогенных и гетерогенных реакций. Рассмотрим кинетику сложной необратимой реакции. 1) взаимодействия протекают параллельно C K 1 > K 2 CA 0 K 1 A K 2 CR CS τ R S
Кинетика химических превращений Влияние концентрации на скорость реакций Кинетические уравнения простых, сложных, гомогенных и гетерогенных реакций. Рассмотрим кинетику сложной необратимой реакции. 1) взаимодействия протекают параллельно C K 1 > K 2 CA 0 K 1 A K 2 CR CS τ R S
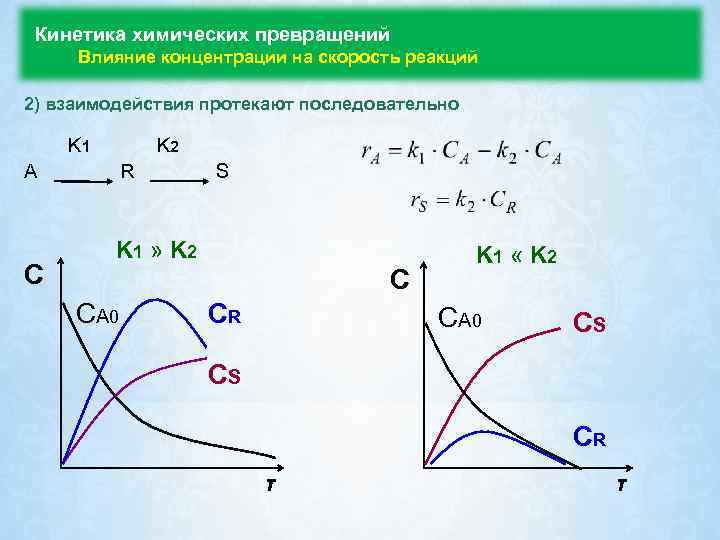 Кинетика химических превращений Влияние концентрации на скорость реакций 2) взаимодействия протекают последовательно K 1 K 2 A C R S K 1 » K 2 C CA 0 CR K 1 « K 2 CA 0 CS CS CR τ τ
Кинетика химических превращений Влияние концентрации на скорость реакций 2) взаимодействия протекают последовательно K 1 K 2 A C R S K 1 » K 2 C CA 0 CR K 1 « K 2 CA 0 CS CS CR τ τ
 Кинетика химических превращений Влияние концентрации на скорость реакций C K 1 ≈ K 2 CA 0 CS Для сложных реакций если известен механизм, то скорость превращения вещества равна алгебраической сумме скоростей тех стадий, в которых это вещество принимает участие. CR τ
Кинетика химических превращений Влияние концентрации на скорость реакций C K 1 ≈ K 2 CA 0 CS Для сложных реакций если известен механизм, то скорость превращения вещества равна алгебраической сумме скоростей тех стадий, в которых это вещество принимает участие. CR τ
 Кинетика химических превращений Влияние концентрации на скорость реакций ПРОСТАЯ ОБРАТИМАЯ РЕАКЦИЯ: А ↔ R фактически представляет собой сложную, состоящую из двух превращений: А превращается в R (прямая реакция) и R превращается в А (обратная реакция). ΔG ≈ 0; Kp = f(T); xp < 1 Скорость реакции r будет равна разности скоростей прямой r 1 и обратной r 2 реакций: r = r 1 - r 2. Для примера рассмотрим случай, когда обе реакции имеют первый порядок. Тогда Перед квадратной скобкой стоит выражение скорости прямой реакции. В условиях равновесия концентрации будут равны равновесным, а r = 0. Это возможно если выражение в скобках равно 0. Из термодинамического условия равновесия вытекает связь между константой химического равновесия, концентрациями начальных и конечных компонентов реакции и константами скорости: СА = СА 0(1 – xр) – текущая концентрация вещества А
Кинетика химических превращений Влияние концентрации на скорость реакций ПРОСТАЯ ОБРАТИМАЯ РЕАКЦИЯ: А ↔ R фактически представляет собой сложную, состоящую из двух превращений: А превращается в R (прямая реакция) и R превращается в А (обратная реакция). ΔG ≈ 0; Kp = f(T); xp < 1 Скорость реакции r будет равна разности скоростей прямой r 1 и обратной r 2 реакций: r = r 1 - r 2. Для примера рассмотрим случай, когда обе реакции имеют первый порядок. Тогда Перед квадратной скобкой стоит выражение скорости прямой реакции. В условиях равновесия концентрации будут равны равновесным, а r = 0. Это возможно если выражение в скобках равно 0. Из термодинамического условия равновесия вытекает связь между константой химического равновесия, концентрациями начальных и конечных компонентов реакции и константами скорости: СА = СА 0(1 – xр) – текущая концентрация вещества А
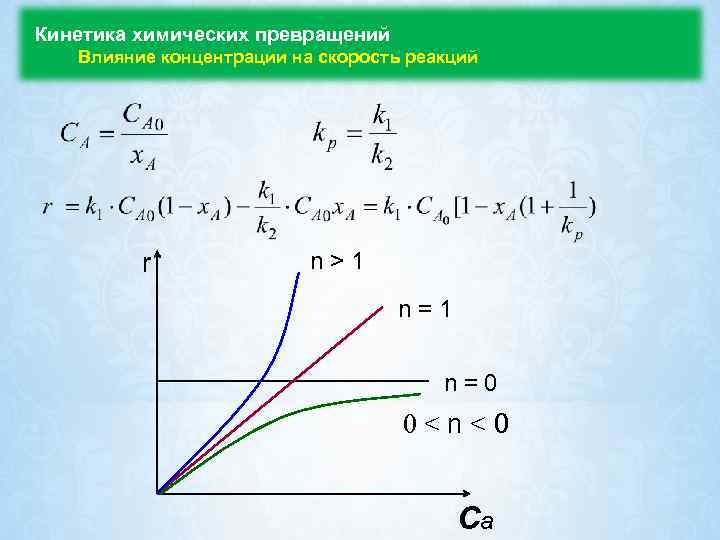 Кинетика химических превращений Влияние концентрации на скорость реакций r n > 1 n = 0 0 < n < 0 Ca
Кинетика химических превращений Влияние концентрации на скорость реакций r n > 1 n = 0 0 < n < 0 Ca
 Кинетика химических превращений Влияние температуры на скорость реакций Скорость подавляющего большинства химических реакций при повышении температуры возрастает, причем она очень чувствительна к изменению температуры. Так, осуществить синтез Н 2 O при 20°С даже с выходом продукта в 15% практически невозможно (на это потребовалось бы 54 миллиарда лет), при 500°С реакция протекает за 5 мин, а при 700°С реакция происходит мгновенно. Опытные данные свидетельствуют о справедливости приближенного правила Вант-Гоффа (1884 г. ): при повышении температуры на каждые 10°С скорость гомогенной реакции увеличивается в 2 -4 раза. Основываясь на факте огромного разрыва между числом молекул, вступающих в реакцию (их принято называть активными), и числом столкновений, а также учитывая характер зависимости скорости реакций от температуры, шведский ученый Аррениус (1889 г. ) предложил уравнение, выражающее зависимость константы скорости реакции от температуры: k = k 0 e – E / RT где k 0 предэкспоненциальный множитель; e – основание натуральных логарифмов; Е энергия активации, Дж/моль; R универсальная газовая постоянная, Дж/моль К; Т температура, К.
Кинетика химических превращений Влияние температуры на скорость реакций Скорость подавляющего большинства химических реакций при повышении температуры возрастает, причем она очень чувствительна к изменению температуры. Так, осуществить синтез Н 2 O при 20°С даже с выходом продукта в 15% практически невозможно (на это потребовалось бы 54 миллиарда лет), при 500°С реакция протекает за 5 мин, а при 700°С реакция происходит мгновенно. Опытные данные свидетельствуют о справедливости приближенного правила Вант-Гоффа (1884 г. ): при повышении температуры на каждые 10°С скорость гомогенной реакции увеличивается в 2 -4 раза. Основываясь на факте огромного разрыва между числом молекул, вступающих в реакцию (их принято называть активными), и числом столкновений, а также учитывая характер зависимости скорости реакций от температуры, шведский ученый Аррениус (1889 г. ) предложил уравнение, выражающее зависимость константы скорости реакции от температуры: k = k 0 e – E / RT где k 0 предэкспоненциальный множитель; e – основание натуральных логарифмов; Е энергия активации, Дж/моль; R универсальная газовая постоянная, Дж/моль К; Т температура, К.
 Кинетика химических превращений Влияние температуры на скорость реакций Предэкспоненциальный множитель k 0 учитывает число соударений, вероятность распада активированного комплекса на исходные реагенты, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры. Реакционноспособными являются лишь те частицы, энергия которых выше некоторой величины, ей соответствует порог скорости u. E. Согласно изложенным представлениям, энергия активации – это та минимальная избыточная (по сравнению со средней) энергия теплового движения некоторых молекул в реакционной смеси, благодаря которой при столкновении молекул возможно химическое взаимодействие. Доля активных молекул в реакционной смеси обычно очень мала. Разность между энергией активированного комплекса и средней энергией исходных молекул и есть энергия активации. Переходное состояние, т. е. образование активированного комплекса, является неустойчивым, поэтому оно не может быть отождествлено с химическим соединением в обычном понимании (к нему неприменимы в полной мере такие понятия, как валентные углы, межатомные расстояния и т. д. ).
Кинетика химических превращений Влияние температуры на скорость реакций Предэкспоненциальный множитель k 0 учитывает число соударений, вероятность распада активированного комплекса на исходные реагенты, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры. Реакционноспособными являются лишь те частицы, энергия которых выше некоторой величины, ей соответствует порог скорости u. E. Согласно изложенным представлениям, энергия активации – это та минимальная избыточная (по сравнению со средней) энергия теплового движения некоторых молекул в реакционной смеси, благодаря которой при столкновении молекул возможно химическое взаимодействие. Доля активных молекул в реакционной смеси обычно очень мала. Разность между энергией активированного комплекса и средней энергией исходных молекул и есть энергия активации. Переходное состояние, т. е. образование активированного комплекса, является неустойчивым, поэтому оно не может быть отождествлено с химическим соединением в обычном понимании (к нему неприменимы в полной мере такие понятия, как валентные углы, межатомные расстояния и т. д. ).
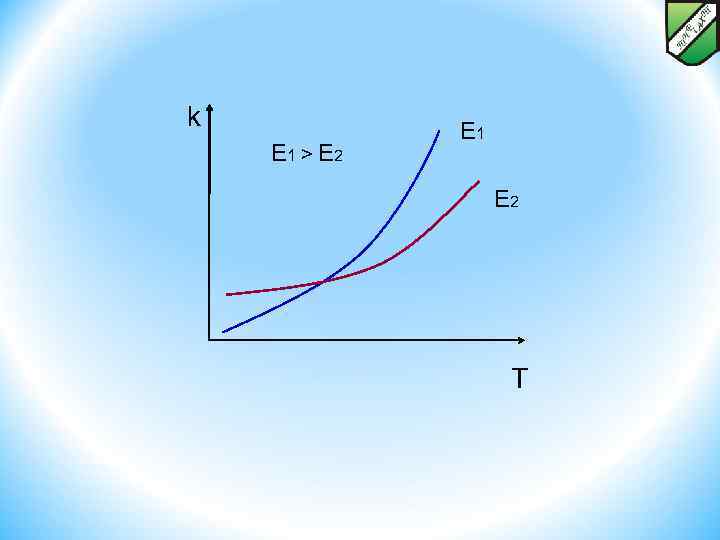
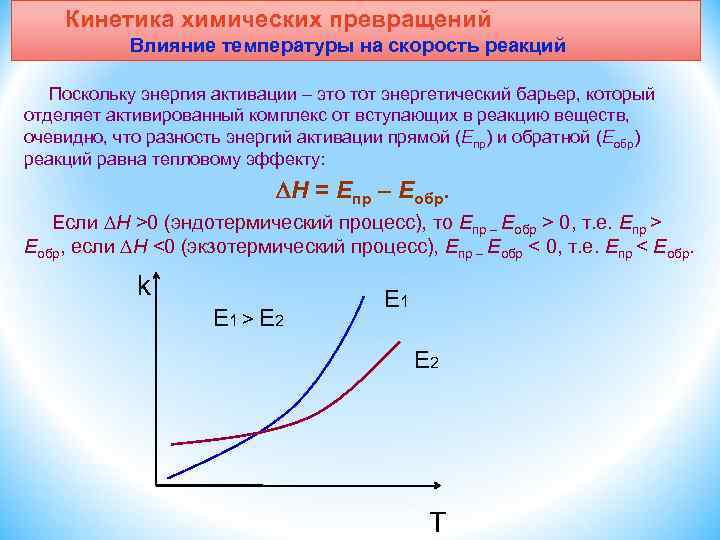 Кинетика химических превращений Влияние температуры на скорость реакций Поскольку энергия активации – это тот энергетический барьер, который отделяет активированный комплекс от вступающих в реакцию веществ, очевидно, что разность энергий активации прямой (Eпр) и обратной (Eобр) реакций равна тепловому эффекту: H = Eпр – Eобр. Если H >0 (эндотермический процесс), то Eпр – Eобр > 0, т. е. Епр > Еобр, если H <0 (экзотермический процесс), Eпр – Eобр < 0, т. е. Епр < Еобр. k E 1 > E 2 E 1 E 2 T
Кинетика химических превращений Влияние температуры на скорость реакций Поскольку энергия активации – это тот энергетический барьер, который отделяет активированный комплекс от вступающих в реакцию веществ, очевидно, что разность энергий активации прямой (Eпр) и обратной (Eобр) реакций равна тепловому эффекту: H = Eпр – Eобр. Если H >0 (эндотермический процесс), то Eпр – Eобр > 0, т. е. Епр > Еобр, если H <0 (экзотермический процесс), Eпр – Eобр < 0, т. е. Епр < Еобр. k E 1 > E 2 E 1 E 2 T
 Кинетика химических превращений Влияние температуры на скорость реакций Совокупность кинетического уравнения и уравнения Аррениуса (кинетических параметров) носит название кинетической модели процесса. Кинетическая модель для каждого процесса индивидуальна. Кинетическая модель зависит от параметров, характеризующих данную модель. Простые реакции: Сложные реакции: В сложных реакциях температура помимо скорости влияет и на селективность процесса
Кинетика химических превращений Влияние температуры на скорость реакций Совокупность кинетического уравнения и уравнения Аррениуса (кинетических параметров) носит название кинетической модели процесса. Кинетическая модель для каждого процесса индивидуальна. Кинетическая модель зависит от параметров, характеризующих данную модель. Простые реакции: Сложные реакции: В сложных реакциях температура помимо скорости влияет и на селективность процесса
 Кинетика химических превращений Влияние катализатора на скорость реакций Одновременно со снижением энергии активации в ряде случаев наблюдается уменьшение порядка реакции, так как порядок элементарных стадий каталитических реакций может быть меньше порядка некаталитической реакции. Одной из важнейших характеристик катализатора является активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется из соотношения А = kк / k = e E / RT где kк, k константы скорости реакции в присутствии катализатора и без катализатора; E снижение энергии активации под действием катализатора. E = Е – Ек, где Ек, Е энергия активации реакции в присутствии катализатора и без катализатора.
Кинетика химических превращений Влияние катализатора на скорость реакций Одновременно со снижением энергии активации в ряде случаев наблюдается уменьшение порядка реакции, так как порядок элементарных стадий каталитических реакций может быть меньше порядка некаталитической реакции. Одной из важнейших характеристик катализатора является активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется из соотношения А = kк / k = e E / RT где kк, k константы скорости реакции в присутствии катализатора и без катализатора; E снижение энергии активации под действием катализатора. E = Е – Ек, где Ек, Е энергия активации реакции в присутствии катализатора и без катализатора.
 Кинетика химических превращений Влияние давления на скорость реакций Влияние давления на скорость наблюдается только для процессов, в которых присутствует хотя бы один газовый реагент. Повышение давления равносильно повышению концентрации r n > 1 n = 1 n < 1 Р Влияние давления на скорость газовых реакций различного порядка
Кинетика химических превращений Влияние давления на скорость реакций Влияние давления на скорость наблюдается только для процессов, в которых присутствует хотя бы один газовый реагент. Повышение давления равносильно повышению концентрации r n > 1 n = 1 n < 1 Р Влияние давления на скорость газовых реакций различного порядка
 Кинетика химических превращений Влияние поверхности раздела фаз Этот фактор применим лишь к гетерогенным системам:
Кинетика химических превращений Влияние поверхности раздела фаз Этот фактор применим лишь к гетерогенным системам:
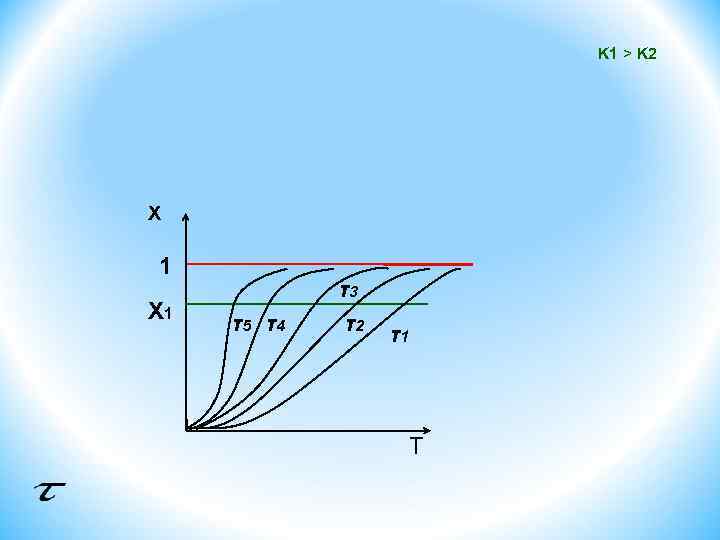
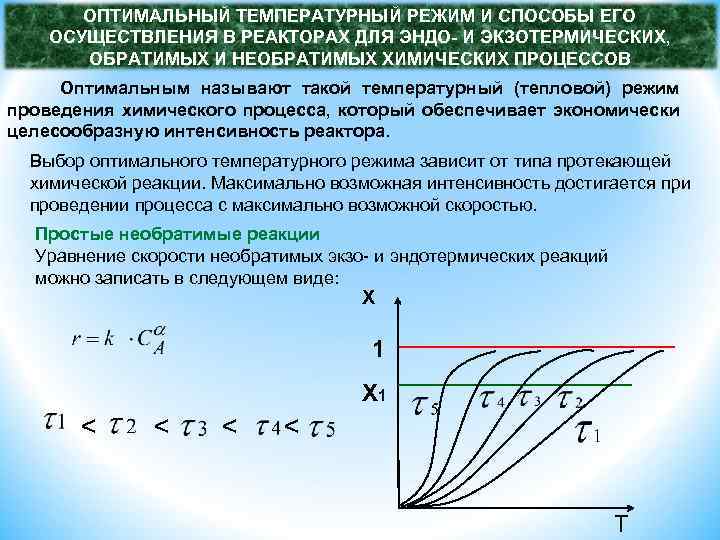 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Оптимальным называют такой температурный (тепловой) режим проведения химического процесса, который обеспечивает экономически целесообразную интенсивность реактора. Выбор оптимального температурного режима зависит от типа протекающей химической реакции. Максимально возможная интенсивность достигается при проведении процесса с максимально возможной скоростью. Простые необратимые реакции Уравнение скорости необратимых экзо- и эндотермических реакций можно записать в следующем виде: X 1 < < T
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Оптимальным называют такой температурный (тепловой) режим проведения химического процесса, который обеспечивает экономически целесообразную интенсивность реактора. Выбор оптимального температурного режима зависит от типа протекающей химической реакции. Максимально возможная интенсивность достигается при проведении процесса с максимально возможной скоростью. Простые необратимые реакции Уравнение скорости необратимых экзо- и эндотермических реакций можно записать в следующем виде: X 1 < < T
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Скорость химических реакций является функцией температуры и степеней превращения реагентов (или концентрации). С ростом температуры константа скорости химической реакции в соответствии с уравнением Аррениуса возрастает. С ростом степени превращения реагентов скорость реакции падает. Для компенсации этого уменьшения целесообразно увеличивать температуру. Эндотермические реакции. Са. СО 3 =Са. О + СO 2; ΔH° 298 = 178 к. Дж Такие процессы проводятся в реакторах с подводом теплоты (изотермических или реакторах с промежуточным тепловым режимом), поддерживая температуру максимально допустимую по конструкционным соображениям. Необходимо также учитывать экономические показатели: увеличение прибыли за счет роста производительности реактора и увеличение расходов на поддержание высокой температуры. Проведение таких процессов в адиабатических условиях нецелесообразно, так как по мере протекания реакции ее скорость будет падать как за счет увеличения степени превращения так и за счет уменьшения температуры.
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Скорость химических реакций является функцией температуры и степеней превращения реагентов (или концентрации). С ростом температуры константа скорости химической реакции в соответствии с уравнением Аррениуса возрастает. С ростом степени превращения реагентов скорость реакции падает. Для компенсации этого уменьшения целесообразно увеличивать температуру. Эндотермические реакции. Са. СО 3 =Са. О + СO 2; ΔH° 298 = 178 к. Дж Такие процессы проводятся в реакторах с подводом теплоты (изотермических или реакторах с промежуточным тепловым режимом), поддерживая температуру максимально допустимую по конструкционным соображениям. Необходимо также учитывать экономические показатели: увеличение прибыли за счет роста производительности реактора и увеличение расходов на поддержание высокой температуры. Проведение таких процессов в адиабатических условиях нецелесообразно, так как по мере протекания реакции ее скорость будет падать как за счет увеличения степени превращения так и за счет уменьшения температуры.
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Для необратимых экзотермических реакций рост степени превращения сопровождается выделением теплоты, и, следовательно, в адиабатическом режиме это приведет к росту температуры реакционной смеси. Уменьшение скорости реакции вследствие увеличения степени превращения будет частично компенсироваться увеличением константы скорости с ростом температуры. Проводя такую реакцию в адиабатическом реакторе, можно обеспечить высокую скорость химических реакций и высокую производительность реактора в автотермическом режиме без использования посторонних источников теплоты. При этом теплота реакционной смеси, выходящей из реактора, служит для нагрева исходных реагентов на входе в реактор. Повышение температуры приводит к увеличению скорости и степени превращения. При заданной степени превращения х1 время пребывания в реакционной зоне уменьшается с увеличением температуры. Следовательно, процесс необходимо проводить при максимально возможной температуре. Ограничения: • термостойкость исходных реагентов, промежуточных и конечных продуктов и катализатора; • изменение агрегатного состояния веществ; • селективность процесса; • жаропрочность конструкционных материалов
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Для необратимых экзотермических реакций рост степени превращения сопровождается выделением теплоты, и, следовательно, в адиабатическом режиме это приведет к росту температуры реакционной смеси. Уменьшение скорости реакции вследствие увеличения степени превращения будет частично компенсироваться увеличением константы скорости с ростом температуры. Проводя такую реакцию в адиабатическом реакторе, можно обеспечить высокую скорость химических реакций и высокую производительность реактора в автотермическом режиме без использования посторонних источников теплоты. При этом теплота реакционной смеси, выходящей из реактора, служит для нагрева исходных реагентов на входе в реактор. Повышение температуры приводит к увеличению скорости и степени превращения. При заданной степени превращения х1 время пребывания в реакционной зоне уменьшается с увеличением температуры. Следовательно, процесс необходимо проводить при максимально возможной температуре. Ограничения: • термостойкость исходных реагентов, промежуточных и конечных продуктов и катализатора; • изменение агрегатного состояния веществ; • селективность процесса; • жаропрочность конструкционных материалов
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Обратимые химические реакции. Проанализируем условия обеспечения оптимального температурного режима обратимых реакций на примере обратимой реакции первого порядка А↔R. Скорость такой реакции определяется уравнением: С одной стороны, как и скорость необратимой реакции, она определяется константой скорости k 1 и глубиной химического превращения х, а с другой - определяется степенью приближения реакционной системы к состоянию химического равновесия и значением предельно достижимой степени превращения в равновесных условиях х*. Изменение скорости с ростом температуры для обратимых эндо- и экзотермических реакций будет различным. Повышение температуры проведения обратимой эндотермической реакции приводит одновременно приводит и к росту k 1, и к увеличению равновесной степени превращения х*.
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ Обратимые химические реакции. Проанализируем условия обеспечения оптимального температурного режима обратимых реакций на примере обратимой реакции первого порядка А↔R. Скорость такой реакции определяется уравнением: С одной стороны, как и скорость необратимой реакции, она определяется константой скорости k 1 и глубиной химического превращения х, а с другой - определяется степенью приближения реакционной системы к состоянию химического равновесия и значением предельно достижимой степени превращения в равновесных условиях х*. Изменение скорости с ростом температуры для обратимых эндо- и экзотермических реакций будет различным. Повышение температуры проведения обратимой эндотермической реакции приводит одновременно приводит и к росту k 1, и к увеличению равновесной степени превращения х*.
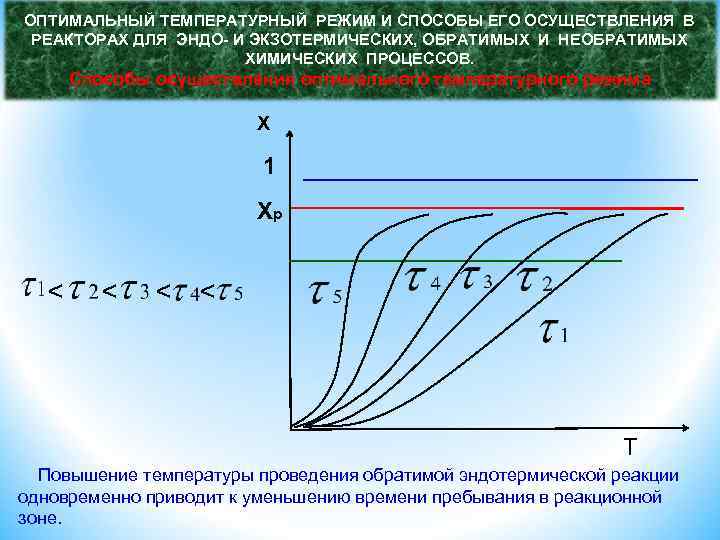 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима X 1 Xр < < T Повышение температуры проведения обратимой эндотермической реакции одновременно приводит к уменьшению времени пребывания в реакционной зоне.
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима X 1 Xр < < T Повышение температуры проведения обратимой эндотермической реакции одновременно приводит к уменьшению времени пребывания в реакционной зоне.
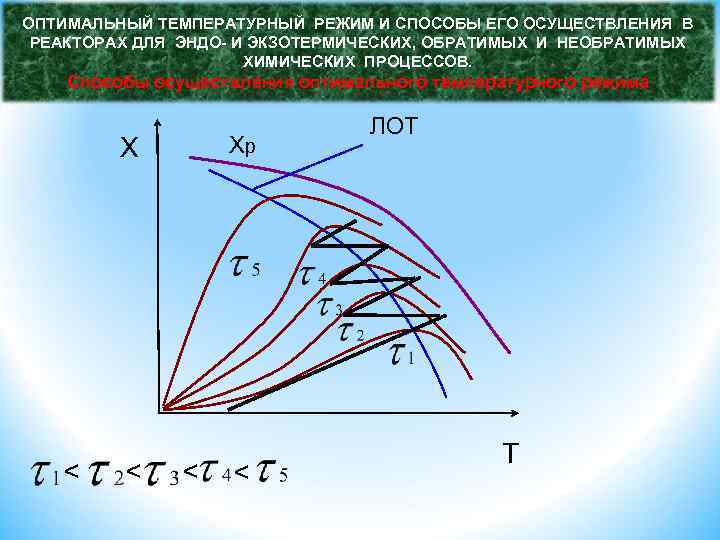
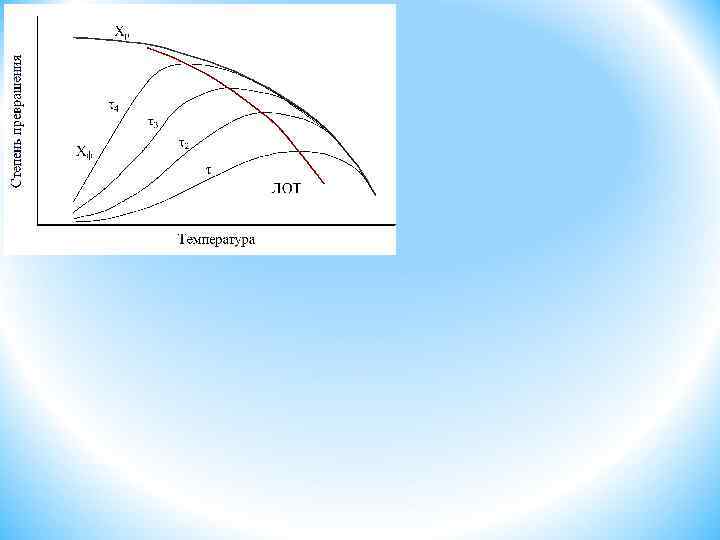
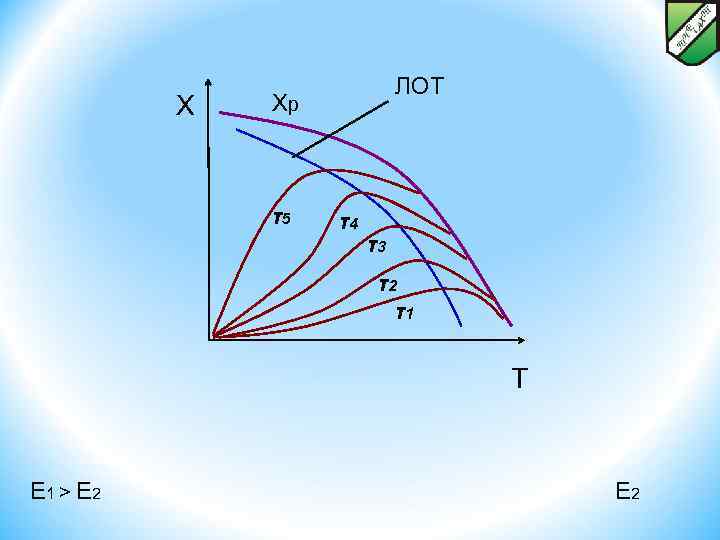
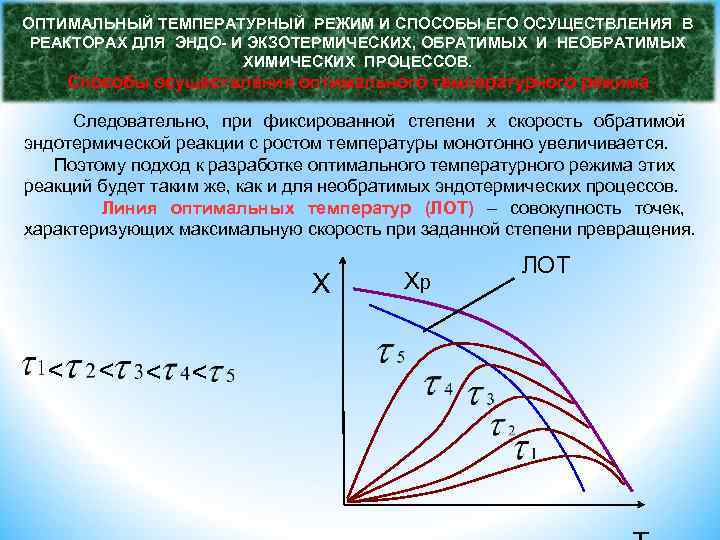 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Следовательно, при фиксированной степени х скорость обратимой эндотермической реакции с ростом температуры монотонно увеличивается. Поэтому подход к разработке оптимального температурного режима этих реакций будет таким же, как и для необратимых эндотермических процессов. Линия оптимальных температур (ЛОТ) – совокупность точек, характеризующих максимальную скорость при заданной степени превращения. X < < Хр ЛОТ
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Следовательно, при фиксированной степени х скорость обратимой эндотермической реакции с ростом температуры монотонно увеличивается. Поэтому подход к разработке оптимального температурного режима этих реакций будет таким же, как и для необратимых эндотермических процессов. Линия оптимальных температур (ЛОТ) – совокупность точек, характеризующих максимальную скорость при заданной степени превращения. X < < Хр ЛОТ
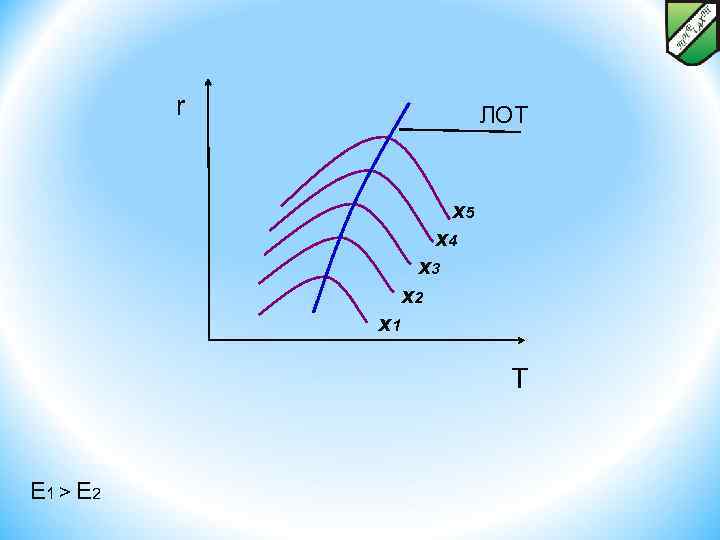
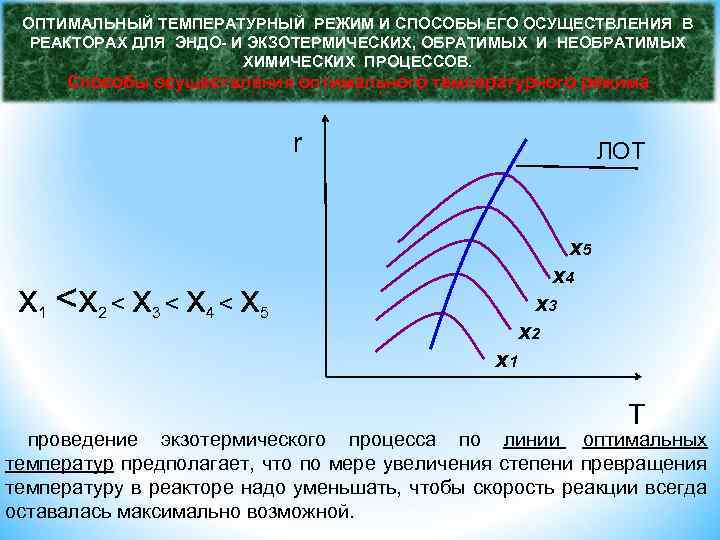 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима r ЛОТ x 5 x 4 x
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима r ЛОТ x 5 x 4 x
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Для эндотермических (обратимых и необратимых) реакций целесообразно химический процесс проводить в реакторах с подводом теплоты, причем желательно обеспечить достаточно равномерное распределение температур по объему реактора. Распространенным типом аппаратов для проведения эндотермических реакций являются трубчатые реакторы, похожие по своей конструкции на кожухотрубные теплообменники. В таких реакторах трубное пространство представляет собой собственно реактор, в котором по трубному пространству движутся реагенты, а по межтрубному пространству проходит теплоноситель, например топочные газы. (Конверсия природного газа, синтез бутадиена из этанола ретортная печь). Теплоноситель может непосредственно подаваться в реакционное пространство (получение извести, кирпича, цементного клинкера).
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Для эндотермических (обратимых и необратимых) реакций целесообразно химический процесс проводить в реакторах с подводом теплоты, причем желательно обеспечить достаточно равномерное распределение температур по объему реактора. Распространенным типом аппаратов для проведения эндотермических реакций являются трубчатые реакторы, похожие по своей конструкции на кожухотрубные теплообменники. В таких реакторах трубное пространство представляет собой собственно реактор, в котором по трубному пространству движутся реагенты, а по межтрубному пространству проходит теплоноситель, например топочные газы. (Конверсия природного газа, синтез бутадиена из этанола ретортная печь). Теплоноситель может непосредственно подаваться в реакционное пространство (получение извести, кирпича, цементного клинкера).
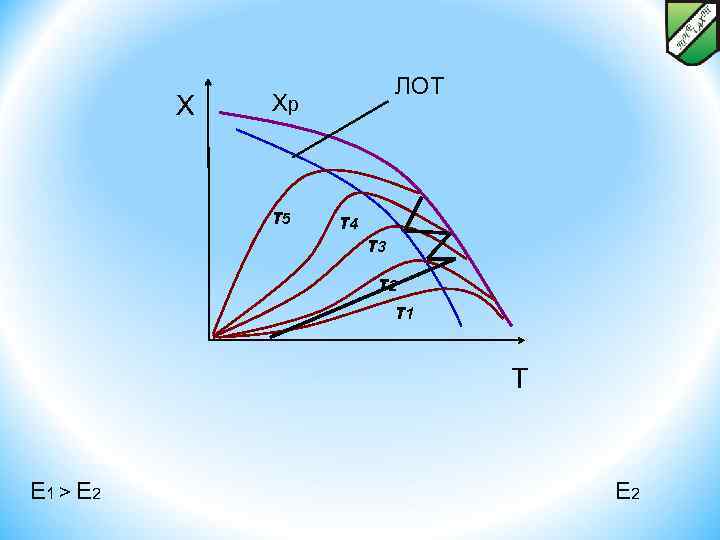
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Гомогенные эндотермические реакции можно также проводить в реакторах с интенсивным перемешиванием и поверхностью теплообмена, т. к. в этом случае будет обеспечено равномерное распределение температуры по реактору. Экзотермические реакции проводят, как правило, либо в адиабатических условиях, либо в реакторах с отводом теплоты. При проведении необратимых экзотермических реакций рост температуры приводит однозначно лишь к увеличению скорости процесса. Для снижения энергетических затрат такие реакции выгодно проводить в автотермическом режиме, когда требуемая температура обеспечивается исключительно за счет выделяющейся теплоты химической реакции без подвода энергии извне. Обратимые экзотермические реакции проводят в соответствии с линией оптимальных температур, т. е. понижая температуру в реакторе по мере роста степени превращения. Такой режим неосуществим ни в адиабатических, ни в изотермических условиях.
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Гомогенные эндотермические реакции можно также проводить в реакторах с интенсивным перемешиванием и поверхностью теплообмена, т. к. в этом случае будет обеспечено равномерное распределение температуры по реактору. Экзотермические реакции проводят, как правило, либо в адиабатических условиях, либо в реакторах с отводом теплоты. При проведении необратимых экзотермических реакций рост температуры приводит однозначно лишь к увеличению скорости процесса. Для снижения энергетических затрат такие реакции выгодно проводить в автотермическом режиме, когда требуемая температура обеспечивается исключительно за счет выделяющейся теплоты химической реакции без подвода энергии извне. Обратимые экзотермические реакции проводят в соответствии с линией оптимальных температур, т. е. понижая температуру в реакторе по мере роста степени превращения. Такой режим неосуществим ни в адиабатических, ни в изотермических условиях.
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Хр X < < ЛОТ T
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Хр X < < ЛОТ T
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Выбор оптимального давления. Ограничения при выборе оптимального давления: • при повышении давления возрастают энергозатраты на сжатие . реагентов. • повышение давления приводит к увеличению капитальных затрат на оборудование и его обслуживание.
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Способы осуществления оптимального температурного режима Выбор оптимального давления. Ограничения при выборе оптимального давления: • при повышении давления возрастают энергозатраты на сжатие . реагентов. • повышение давления приводит к увеличению капитальных затрат на оборудование и его обслуживание.
 ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Выбор оптимальной концентрации При выборе оптимальной концентрации необходимо учитывать: • экономическую целесообразность обогащения или концентрирования сырья. • предел взрывоопасности реакционной смеси. • возможность перехода реагентов в конденсированное состояние (конденсация, кристаллизация) • концентрация определяет количество выделяемого или поглощаемого тепла в зоне реакции, т. е. оказывает непосредственное влияние на температуру процесса. Поэтому при неправильном выборе концентрации может быть нарушен температурный режим
ОПТИМАЛЬНЫЙ ТЕМПЕРАТУРНЫЙ РЕЖИМ И СПОСОБЫ ЕГО ОСУЩЕСТВЛЕНИЯ В РЕАКТОРАХ ДЛЯ ЭНДО- И ЭКЗОТЕРМИЧЕСКИХ, ОБРАТИМЫХ И НЕОБРАТИМЫХ ХИМИЧЕСКИХ ПРОЦЕССОВ. Выбор оптимальной концентрации При выборе оптимальной концентрации необходимо учитывать: • экономическую целесообразность обогащения или концентрирования сырья. • предел взрывоопасности реакционной смеси. • возможность перехода реагентов в конденсированное состояние (конденсация, кристаллизация) • концентрация определяет количество выделяемого или поглощаемого тепла в зоне реакции, т. е. оказывает непосредственное влияние на температуру процесса. Поэтому при неправильном выборе концентрации может быть нарушен температурный режим

 K 1 > K 2 X 1 τ5 τ4 τ3 τ2 τ1 T
K 1 > K 2 X 1 τ5 τ4 τ3 τ2 τ1 T
 K 1 > K 2 C CA 0 CR CS τ
K 1 > K 2 C CA 0 CR CS τ
 k E 1 > E 2 E 1 E 2 T
k E 1 > E 2 E 1 E 2 T
 X ЛОТ Хр τ5 τ4 τ3 τ2 τ1 T E 1 > E 2
X ЛОТ Хр τ5 τ4 τ3 τ2 τ1 T E 1 > E 2
 r ЛОТ x 5 x 4 x 3 x 2 x 1 T E 1 > E 2
r ЛОТ x 5 x 4 x 3 x 2 x 1 T E 1 > E 2
 X ЛОТ Хр τ5 τ4 τ3 τ2 τ1 T E 1 > E 2
X ЛОТ Хр τ5 τ4 τ3 τ2 τ1 T E 1 > E 2


