Лекция КМА.ppt
- Количество слайдов: 19
 Кинетические факторы в редокс - реакциях 1. 2. 3. 4. Факторы, влияющие на скорость реакции Химическая индукция Катализ и автокатализ Кинетические методы анализа
Кинетические факторы в редокс - реакциях 1. 2. 3. 4. Факторы, влияющие на скорость реакции Химическая индукция Катализ и автокатализ Кинетические методы анализа
 Факторы, влияющие на скорость реакции Важно учитывать скорость реакции, когда решаем вопросы: 1 – возможность использования реакции в объемном анализе 2 - раздельное определение близких по свойствам веществ при их совместном присутсвии Пример Глюкоза(Гл) и фруктоза (Фр)– восстановители, скорость окисления Фр >> скорости окисления Гл Прямое титрование – только ФР, обратное – сумма Гл + Фр 3. Возможность определения вещества по скорости протекающей реакции (кинетические методы анализа) 4. Установление механизма протекания реакции
Факторы, влияющие на скорость реакции Важно учитывать скорость реакции, когда решаем вопросы: 1 – возможность использования реакции в объемном анализе 2 - раздельное определение близких по свойствам веществ при их совместном присутсвии Пример Глюкоза(Гл) и фруктоза (Фр)– восстановители, скорость окисления Фр >> скорости окисления Гл Прямое титрование – только ФР, обратное – сумма Гл + Фр 3. Возможность определения вещества по скорости протекающей реакции (кинетические методы анализа) 4. Установление механизма протекания реакции
 Скорость реакции А+В=D+E ИЛИ Скорость реакции зависит от: А) концентрации реагентов Б) температуры Для ускорения процесса растворы подогревают: -в ходе пробоподготовки - для ускорения основной реакции ( титрование р-ром КМn. О 4 органических веществ) В) присутствия катализаторов Титрование ведут в присутствии катализаторов, например, заместительное титрование Н 2 О 2 в иодометрии
Скорость реакции А+В=D+E ИЛИ Скорость реакции зависит от: А) концентрации реагентов Б) температуры Для ускорения процесса растворы подогревают: -в ходе пробоподготовки - для ускорения основной реакции ( титрование р-ром КМn. О 4 органических веществ) В) присутствия катализаторов Титрование ведут в присутствии катализаторов, например, заместительное титрование Н 2 О 2 в иодометрии
 Промежуточные продукты в ред-окс реакциях 5 Fe 2+ + Mn. O 4 - + 8 H+ = 5 Fe 3+ + Mn 2+ + 4 H 2 O Стехиометрическое уравнение является суммарным и не описывает всех промежуточных стадий процесса (они есть обязательно, т. к. вероятность одновременного столкновения 14 частиц ничтожно мала). v = k [Mn. O 4 -][Fe 2+] (условно) Закон действующих масс правильно описывает не суммарную, а только самую медленную, лимитирующую реакцию Red 1 + Ox 2 → Σ (промежуточные → Ox 1 + Red 2 продукты)
Промежуточные продукты в ред-окс реакциях 5 Fe 2+ + Mn. O 4 - + 8 H+ = 5 Fe 3+ + Mn 2+ + 4 H 2 O Стехиометрическое уравнение является суммарным и не описывает всех промежуточных стадий процесса (они есть обязательно, т. к. вероятность одновременного столкновения 14 частиц ничтожно мала). v = k [Mn. O 4 -][Fe 2+] (условно) Закон действующих масс правильно описывает не суммарную, а только самую медленную, лимитирующую реакцию Red 1 + Ox 2 → Σ (промежуточные → Ox 1 + Red 2 продукты)
 Химическая индукция - Увеличение скорости химической реакции в связи с одновременным протеканием другой реакции 5 Fe 2+ + Mn. O 4 - + 8 H+ = 5 Fe 3+ + Mn 2+ + 4 H 2 O Реакцию проводят в среде Н 2 SO 4 В среде НСl протекает побочная реакция: 10 Cl - + 2 Mn. O 4 - + 16 H+ = 5 Cl 2 + 2 Mn 2+ + 8 H 2 O (1) (2) Без Fe 2+ эта реакция не идет! Вывод: не сам Mn. O 4 - окисляет Cl-, а продукты его взаимодействия с Fe 2+ - индуктор реакции (2), т. е. вещество, которое не только ускоряет побочную реакцию, но и участвует при этом в основной реакции 1 - ая реакция – основная ( первичная) 2– ая реакция - индуцированная
Химическая индукция - Увеличение скорости химической реакции в связи с одновременным протеканием другой реакции 5 Fe 2+ + Mn. O 4 - + 8 H+ = 5 Fe 3+ + Mn 2+ + 4 H 2 O Реакцию проводят в среде Н 2 SO 4 В среде НСl протекает побочная реакция: 10 Cl - + 2 Mn. O 4 - + 16 H+ = 5 Cl 2 + 2 Mn 2+ + 8 H 2 O (1) (2) Без Fe 2+ эта реакция не идет! Вывод: не сам Mn. O 4 - окисляет Cl-, а продукты его взаимодействия с Fe 2+ - индуктор реакции (2), т. е. вещество, которое не только ускоряет побочную реакцию, но и участвует при этом в основной реакции 1 - ая реакция – основная ( первичная) 2– ая реакция - индуцированная
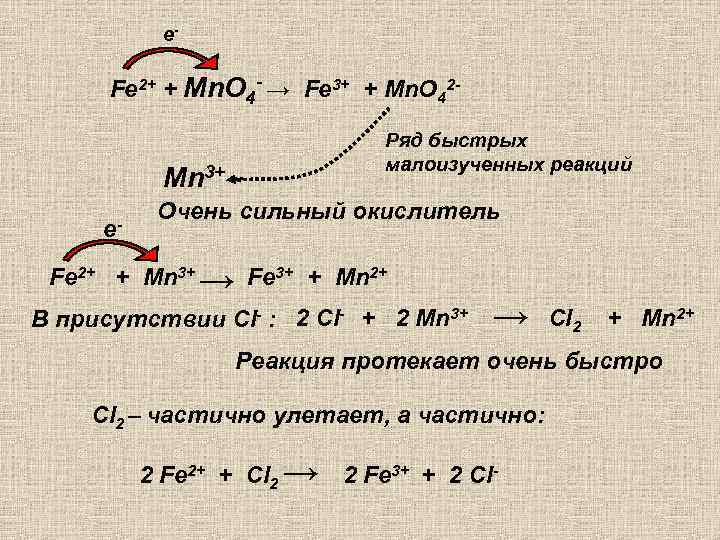 е- Fe 2+ + Mn. O 4 - → Fe 3+ + Mn. О 42 Ряд быстрых малоизученных реакций Mn 3+ е- Очень сильный окислитель Fe 2+ + Mn 3+ → Fe 3+ + Mn 2+ В присутствии Сl- : 2 Сl- + 2 Mn 3+ → Сl 2 + Mn 2+ Реакция протекает очень быстро Сl 2 – частично улетает, а частично: 2 Fe 2+ + Сl 2 → 2 Fe 3+ + 2 Сl-
е- Fe 2+ + Mn. O 4 - → Fe 3+ + Mn. О 42 Ряд быстрых малоизученных реакций Mn 3+ е- Очень сильный окислитель Fe 2+ + Mn 3+ → Fe 3+ + Mn 2+ В присутствии Сl- : 2 Сl- + 2 Mn 3+ → Сl 2 + Mn 2+ Реакция протекает очень быстро Сl 2 – частично улетает, а частично: 2 Fe 2+ + Сl 2 → 2 Fe 3+ + 2 Сl-
 Борьба с индукцией -Убирать из системы вещество, которое участвует только в индуцированной реакции, например, хлоридионы - Вводить защитные смеси Ввести в раствор Mn 2+ Потенциал уменьшится: E = E 0 (Mn 3+/Mn 2+) + 0, 0059 lg[Mn 3+] / [Mn 2+] Окисление хлорид-ионов становится невозможным Защитная смесь Циммермана – Рейнгардта: Mn. SO 4 , H 2 SO 4 , H 3 PO 4 Применяется при перманганатометрическом титровании Fe 2+ в среде НСl
Борьба с индукцией -Убирать из системы вещество, которое участвует только в индуцированной реакции, например, хлоридионы - Вводить защитные смеси Ввести в раствор Mn 2+ Потенциал уменьшится: E = E 0 (Mn 3+/Mn 2+) + 0, 0059 lg[Mn 3+] / [Mn 2+] Окисление хлорид-ионов становится невозможным Защитная смесь Циммермана – Рейнгардта: Mn. SO 4 , H 2 SO 4 , H 3 PO 4 Применяется при перманганатометрическом титровании Fe 2+ в среде НСl
 Катализ в аналитической химии От присутствия катализаторов зависят скорости многих реакций из числа тех, что используются в анализе Катализаторами редокс – реакций обычно являются: - Соединения элемента, имеющего множество с. о. - Соединения элемента, склонного к комплексообразованию Этим требованиям удовлетворяют соединения d-элементов: Os, Ir, Pt, Pd, Co, Fe, Cu, Ag В редокс-реакциях особенно заметна роль катализатора: 1 - когда в редокс- системах участвуют разное число электронов 2 - когда реакция сопровождается разрывом прочной неполярной ковалентной связи
Катализ в аналитической химии От присутствия катализаторов зависят скорости многих реакций из числа тех, что используются в анализе Катализаторами редокс – реакций обычно являются: - Соединения элемента, имеющего множество с. о. - Соединения элемента, склонного к комплексообразованию Этим требованиям удовлетворяют соединения d-элементов: Os, Ir, Pt, Pd, Co, Fe, Cu, Ag В редокс-реакциях особенно заметна роль катализатора: 1 - когда в редокс- системах участвуют разное число электронов 2 - когда реакция сопровождается разрывом прочной неполярной ковалентной связи
 Пример 1 Fe 2+ + Ce 4+ = Fe 3+ + Ce 3+ -протекает быстро, без катализатора Ох1 + n e- = Red 1 Ox 2 + m e- = Red 2 Sn 2+ + 2 Fe 3+ = Sn 4+ + 2 Fe 2+ - идет очень медленно, нужен катализатор 1 ая стадия : Sn 2+ + Fe 3+ = Sn 3+ + Fe 2+ идет очень медленно – является лимитирующей стадией 2 – ая стадия: идет быстрее Sn 3+ + Fe 3+ = Sn 4+ + 2 Fe 2+ Катализатором будет такой окислитель, который быстрее, чем Fe 3+ реагирует c Sn 2+ + Kt (ox) = Sn 3+ + Kt (red) + Fe 3+= Kt (ox) + Fe 2+ Sn 3+ + Kt (ox) = Sn 4+ + Kt (red) Катализатор – хлорид рутения
Пример 1 Fe 2+ + Ce 4+ = Fe 3+ + Ce 3+ -протекает быстро, без катализатора Ох1 + n e- = Red 1 Ox 2 + m e- = Red 2 Sn 2+ + 2 Fe 3+ = Sn 4+ + 2 Fe 2+ - идет очень медленно, нужен катализатор 1 ая стадия : Sn 2+ + Fe 3+ = Sn 3+ + Fe 2+ идет очень медленно – является лимитирующей стадией 2 – ая стадия: идет быстрее Sn 3+ + Fe 3+ = Sn 4+ + 2 Fe 2+ Катализатором будет такой окислитель, который быстрее, чем Fe 3+ реагирует c Sn 2+ + Kt (ox) = Sn 3+ + Kt (red) + Fe 3+= Kt (ox) + Fe 2+ Sn 3+ + Kt (ox) = Sn 4+ + Kt (red) Катализатор – хлорид рутения
 Пример 2 Н-О-О-Н Н 2 N-NH 2 - гидразин Механизм катализа связан с образованием тройного комплекса: Ох - - - Каt - - - Red e- Н-О-О-Н + 2 I- +2 H+ Mo. O 42 - → e- 2 H 2 O + I 2 Автокатализ – катализатором является один из продуктов реакции Пример Mn 2+ - катализатор в реакциях с участием Mn. O 4 - v Идет накопление Mn 2+ ИНДУКЦИОННЫЙ ПЕРИОД время
Пример 2 Н-О-О-Н Н 2 N-NH 2 - гидразин Механизм катализа связан с образованием тройного комплекса: Ох - - - Каt - - - Red e- Н-О-О-Н + 2 I- +2 H+ Mo. O 42 - → e- 2 H 2 O + I 2 Автокатализ – катализатором является один из продуктов реакции Пример Mn 2+ - катализатор в реакциях с участием Mn. O 4 - v Идет накопление Mn 2+ ИНДУКЦИОННЫЙ ПЕРИОД время
 Кинетические методы анализа (КМА) Необходимость определения очень малых количеств веществ: от 10 -6 г до 10 -12 г (полупроводники, биология, медицина, экологиясупертоксиканты) КМА появились в 30 -е годы 20 -го в. КМА – используют связь между концентрацией иона в растворе и скоростью реакции, которая катализируется эти ионом Кat А+В = D+E v = k. CA. CB. CKat Реакция, скорость которой зависит от концентрации определяемого вещества, называется индикаторной Вещество, концентрацию которого контролируют в ходе реакции, называют индикаторным
Кинетические методы анализа (КМА) Необходимость определения очень малых количеств веществ: от 10 -6 г до 10 -12 г (полупроводники, биология, медицина, экологиясупертоксиканты) КМА появились в 30 -е годы 20 -го в. КМА – используют связь между концентрацией иона в растворе и скоростью реакции, которая катализируется эти ионом Кat А+В = D+E v = k. CA. CB. CKat Реакция, скорость которой зависит от концентрации определяемого вещества, называется индикаторной Вещество, концентрацию которого контролируют в ходе реакции, называют индикаторным
 Требования к индикаторной реакции 1. Концентрация определяемого компонента должна быть примерно постоянной Концентрации реагентов берут достаточно большие. Концентрация катализатора остается постоянной 2. Должен существовать простой, быстрый и доступный метод наблюдения за скоростью реакции, т. е. за концентрацией индикаторного вещества Измерение объема выделившегося газа ( индикаторное вещество – газ); измерение окраски раствора (А- оптическая плотность) 3. Скорость реакции должна быть такой, чтобы время наблюдения составляло от 5 до 15 мин.
Требования к индикаторной реакции 1. Концентрация определяемого компонента должна быть примерно постоянной Концентрации реагентов берут достаточно большие. Концентрация катализатора остается постоянной 2. Должен существовать простой, быстрый и доступный метод наблюдения за скоростью реакции, т. е. за концентрацией индикаторного вещества Измерение объема выделившегося газа ( индикаторное вещество – газ); измерение окраски раствора (А- оптическая плотность) 3. Скорость реакции должна быть такой, чтобы время наблюдения составляло от 5 до 15 мин.
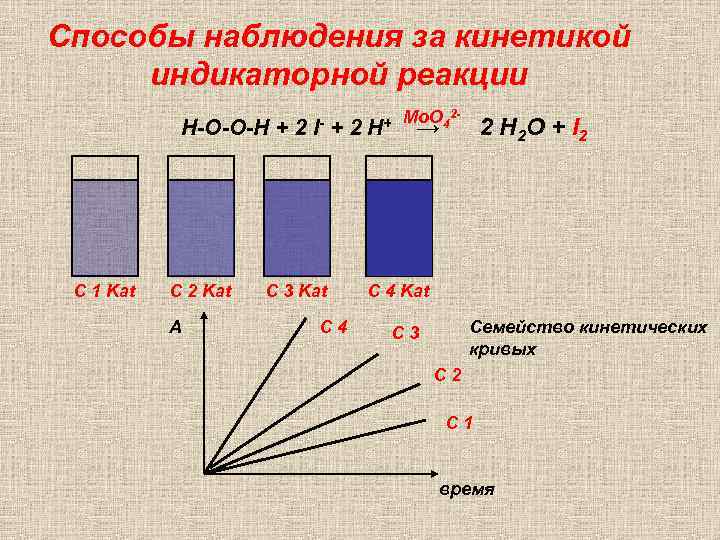 Способы наблюдения за кинетикой индикаторной реакции Н-О-О-Н + 2 С 1 Kat С 2 Kat А I- +2 С 3 Kat С 4 H+ Mo. O 42 - → 2 H 2 O + I 2 С 4 Kat Семейство кинетических кривых С 3 С 2 С 1 время
Способы наблюдения за кинетикой индикаторной реакции Н-О-О-Н + 2 С 1 Kat С 2 Kat А I- +2 С 3 Kat С 4 H+ Mo. O 42 - → 2 H 2 O + I 2 С 4 Kat Семейство кинетических кривых С 3 С 2 С 1 время
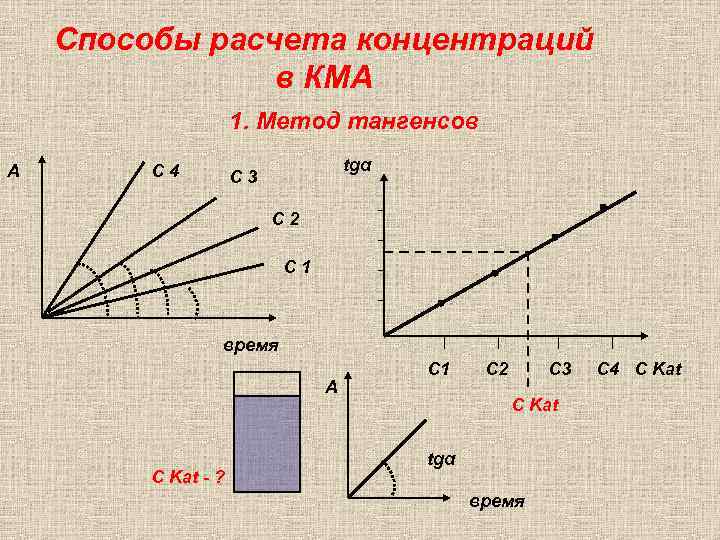 Способы расчета концентраций в КМА 1. Метод тангенсов А С 4 tgα С 3 С 2 С 1 время А C Kat - ? С 1 C 2 C 3 С Kat tgα время C 4 С Kat
Способы расчета концентраций в КМА 1. Метод тангенсов А С 4 tgα С 3 С 2 С 1 время А C Kat - ? С 1 C 2 C 3 С Kat tgα время C 4 С Kat
 2. Метод фиксированного времени А С 4 А С 3 С 2 С 1 время С 1 C 2 C 3 C 4 С Kat А таймер C Kat - ?
2. Метод фиксированного времени А С 4 А С 3 С 2 С 1 время С 1 C 2 C 3 C 4 С Kat А таймер C Kat - ?
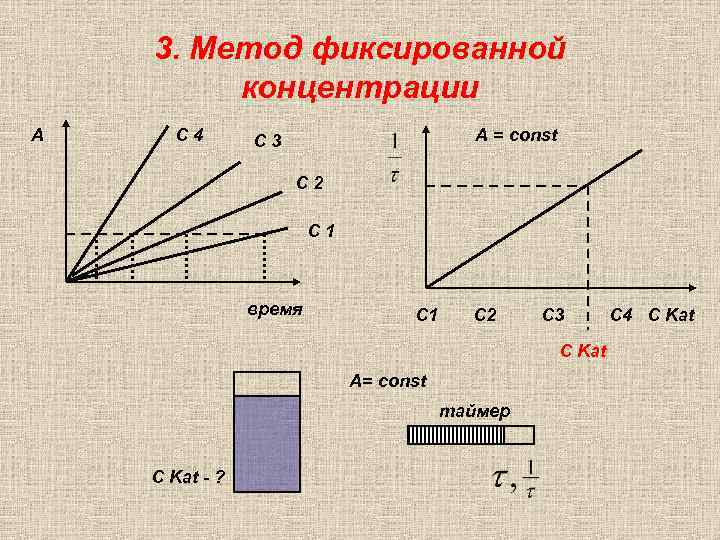 3. Метод фиксированной концентрации А С 4 А = const С 3 С 2 С 1 время С 1 C 2 C 3 C Kat А= const таймер C Kat - ? C 4 С Kat
3. Метод фиксированной концентрации А С 4 А = const С 3 С 2 С 1 время С 1 C 2 C 3 C Kat А= const таймер C Kat - ? C 4 С Kat
 Характеристика КМА 1. Высокая чувствительность. Теоретически не ограничена. На практике чувствительность ограничена чистотой реактивов, посуды и пр. Можно определять до 10 -10 М. 2. Высокая селективность. 3. Низкая сходимость. На скорость реакции влияет много факторов. Поэтому требуется строжайшая стандартизация условий и обязательная статистическая обработка результатов.
Характеристика КМА 1. Высокая чувствительность. Теоретически не ограничена. На практике чувствительность ограничена чистотой реактивов, посуды и пр. Можно определять до 10 -10 М. 2. Высокая селективность. 3. Низкая сходимость. На скорость реакции влияет много факторов. Поэтому требуется строжайшая стандартизация условий и обязательная статистическая обработка результатов.
 Ферментативные методы * Методы основаны на использовании реакций, где катализаторами являются ферментыбиологические катализатры. * Определяют: - ферменты; - субстраты (вещества, чьи превращения катализируют ферменты); - эффекторы (вещества, меняющие каталитическую активность ферментов). * Методы отличаются особо высокой чувствительностью и селективностью
Ферментативные методы * Методы основаны на использовании реакций, где катализаторами являются ферментыбиологические катализатры. * Определяют: - ферменты; - субстраты (вещества, чьи превращения катализируют ферменты); - эффекторы (вещества, меняющие каталитическую активность ферментов). * Методы отличаются особо высокой чувствительностью и селективностью
 Ферменты – белковые молекулы, состоящие из альфа-аминокислот Активный центр, определяющий каталитическую активность фермента субстрат Для измерения скорости реакции с участием ферментов чаще всего применяют фотометрические методы
Ферменты – белковые молекулы, состоящие из альфа-аминокислот Активный центр, определяющий каталитическую активность фермента субстрат Для измерения скорости реакции с участием ферментов чаще всего применяют фотометрические методы


