Лекция 10 МКТ1.pptx
- Количество слайдов: 41
 КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА Преподаватель: Пушилина Наталья Сергеевна
КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА Преподаватель: Пушилина Наталья Сергеевна
 СОДЕРЖАНИЕ ЛЕКЦИИ: 1. КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА 1. 3 Барометр 1. 4 Закон Архимеда 1. 5 Температура 1. 6 Термометры 1. 7 Уравнение состояния идеального газа. Число Авогадро 1. 8 Кинетическая теория тепла 1. 9 Тепловая энергия 1. 20 Механический эквивалент тепла 2
СОДЕРЖАНИЕ ЛЕКЦИИ: 1. КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА 1. 3 Барометр 1. 4 Закон Архимеда 1. 5 Температура 1. 6 Термометры 1. 7 Уравнение состояния идеального газа. Число Авогадро 1. 8 Кинетическая теория тепла 1. 9 Тепловая энергия 1. 20 Механический эквивалент тепла 2
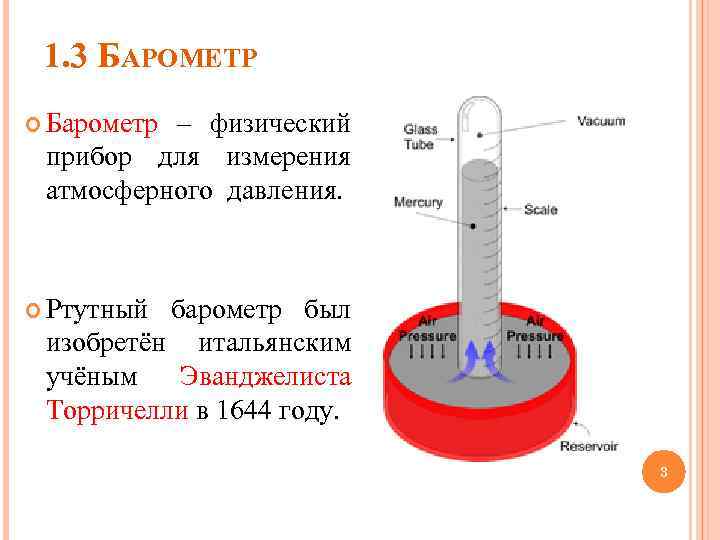 1. 3 БАРОМЕТР Барометр – физический прибор для измерения атмосферного давления. Ртутный барометр был изобретён итальянским учёным Эванджелиста Торричелли в 1644 году. 3
1. 3 БАРОМЕТР Барометр – физический прибор для измерения атмосферного давления. Ртутный барометр был изобретён итальянским учёным Эванджелиста Торричелли в 1644 году. 3
 1. 3 РТУТНЫЙ БАРОМЕТР Пусть запаянная с одного конца трубка наполнена ртутью (плотность ртути = 13, 6 103 кг/м 3) и помещена вертикально открытым концом в широкий сосуд с ртутью (рис. 1). Давление в точках А и В одинаковые, поскольку обе точки расположены на одной и той же высоте. Определим ысоту в ртутного столба трубки. 4
1. 3 РТУТНЫЙ БАРОМЕТР Пусть запаянная с одного конца трубка наполнена ртутью (плотность ртути = 13, 6 103 кг/м 3) и помещена вертикально открытым концом в широкий сосуд с ртутью (рис. 1). Давление в точках А и В одинаковые, поскольку обе точки расположены на одной и той же высоте. Определим ысоту в ртутного столба трубки. 4
 1. 3 БАРОМЕТР В соответствии с законом Паскаля PА = pgh (h – высота ртутного столба), а давление на поверхности ртуть воздух равна атмосферному: gh = Ратм, h = (1/ g)Pатм = [1, 01 105]/[13, 6 103 9, 8] м = 0, 76 м. Отсюда мы видим, что высота ртутного столба пропорциональна атмосферному давлению. Поэтому это устройство используют для измерения атмосферного давления. Единицей измерения давления в системе СИ 5 является Паскаль: 1 Па = 1 Н/ м 2.
1. 3 БАРОМЕТР В соответствии с законом Паскаля PА = pgh (h – высота ртутного столба), а давление на поверхности ртуть воздух равна атмосферному: gh = Ратм, h = (1/ g)Pатм = [1, 01 105]/[13, 6 103 9, 8] м = 0, 76 м. Отсюда мы видим, что высота ртутного столба пропорциональна атмосферному давлению. Поэтому это устройство используют для измерения атмосферного давления. Единицей измерения давления в системе СИ 5 является Паскаль: 1 Па = 1 Н/ м 2.
 1. 3 БАРОМЕТР Нормальным атмосферным давлением называют такое давление, которое уравновешивается столбом ртути высотой 760 мм при температуре 0 °С. По мере подъема над поверхностью Земли атмосферное давление понижается на 1 мм рт. ст. на каждые 12 м подъема. Понижение давления сопровождается уменьшением плотности атмосферы. На высоте 6 км давление воздуха примерно вдвое меньше, чем на поверхности Земли. 6
1. 3 БАРОМЕТР Нормальным атмосферным давлением называют такое давление, которое уравновешивается столбом ртути высотой 760 мм при температуре 0 °С. По мере подъема над поверхностью Земли атмосферное давление понижается на 1 мм рт. ст. на каждые 12 м подъема. Понижение давления сопровождается уменьшением плотности атмосферы. На высоте 6 км давление воздуха примерно вдвое меньше, чем на поверхности Земли. 6
 1. 3 БАРОМЕТР Для измерения атмосферного давления можно использовать любую жидкость. Ртуть удобна своей большой плотностью – она примерно в 13, 6 раза плотнее воды. Поэтому высота столба воды, уравновешивающего давление воздуха, будет в 13, 6 раза больше, т. е. около 10 м. Прибор таких размеров был бы слишком велик для практического применения; кроме того, у ртути есть еще одно преимущество – она не замерзает до – 39 °С и, следовательно, может использоваться при отрицательных температурах. 7
1. 3 БАРОМЕТР Для измерения атмосферного давления можно использовать любую жидкость. Ртуть удобна своей большой плотностью – она примерно в 13, 6 раза плотнее воды. Поэтому высота столба воды, уравновешивающего давление воздуха, будет в 13, 6 раза больше, т. е. около 10 м. Прибор таких размеров был бы слишком велик для практического применения; кроме того, у ртути есть еще одно преимущество – она не замерзает до – 39 °С и, следовательно, может использоваться при отрицательных температурах. 7
 ТЕМА РЕФЕРАТА БАРОМЕТРЫ. УСТРОЙСТВО. ПРИНЦИП РАБОТЫ
ТЕМА РЕФЕРАТА БАРОМЕТРЫ. УСТРОЙСТВО. ПРИНЦИП РАБОТЫ
 1. 4 ЗАКОН АРХИМЕДА Из обобщённого закона Паскаля следует закон Архимеда. ДЕМОНСТРАЦИЯ ОПЫТА Рассмотрим, брусок высотой l и площадью основания S погруженный на глубину h в жидкость с плотностью (рис. 2). 9
1. 4 ЗАКОН АРХИМЕДА Из обобщённого закона Паскаля следует закон Архимеда. ДЕМОНСТРАЦИЯ ОПЫТА Рассмотрим, брусок высотой l и площадью основания S погруженный на глубину h в жидкость с плотностью (рис. 2). 9
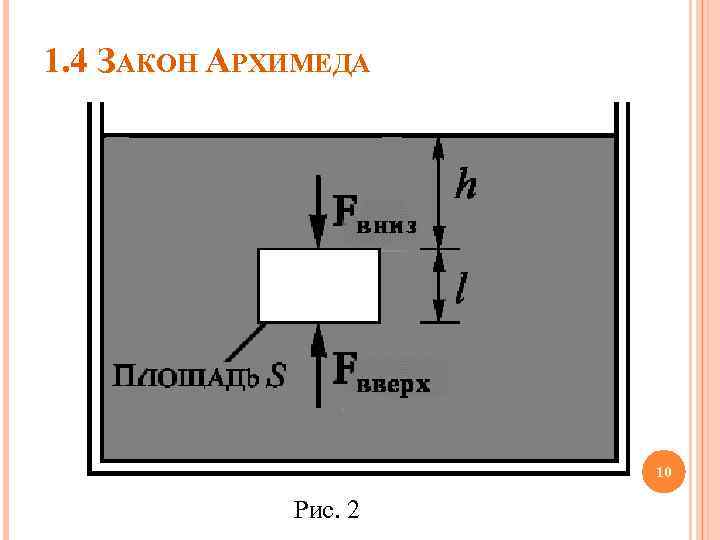 1. 4 ЗАКОН АРХИМЕДА 10 Рис. 2
1. 4 ЗАКОН АРХИМЕДА 10 Рис. 2
 На нижнюю поверхность бруска будет действовать сила: Fвверх = PS = g(h + l)S, а на верхнюю – сила: Fвниз = ( gh)S Результирующая сила запишется в виде: Fвверх Fвниз = gl. S = mжидк g, где mжидк = l. S – масса жидкости, вытесненной из объема, занятого бруском. 11
На нижнюю поверхность бруска будет действовать сила: Fвверх = PS = g(h + l)S, а на верхнюю – сила: Fвниз = ( gh)S Результирующая сила запишется в виде: Fвверх Fвниз = gl. S = mжидк g, где mжидк = l. S – масса жидкости, вытесненной из объема, занятого бруском. 11
 1. 4 ЗАКОН АРХИМЕДА Закон Архимеда гласит: любое погруженное в газ или жидкость тело выталкивается из нее с силой, равной весу вытесненного газа или жидкости. Fb = mжидк g Для тела, плавающего на поверхности воды, этот закон гласит: вес вытесненной этим телом воды равен весу тела. 12
1. 4 ЗАКОН АРХИМЕДА Закон Архимеда гласит: любое погруженное в газ или жидкость тело выталкивается из нее с силой, равной весу вытесненного газа или жидкости. Fb = mжидк g Для тела, плавающего на поверхности воды, этот закон гласит: вес вытесненной этим телом воды равен весу тела. 12
 1. 4 ЗАКОН АРХИМЕДА Вопрос: Как изменится уровень воды в стакане с плавающим льдом после того, как лед в нем растает? Повысится он или понизится? Уровень не изменится при условии, что первоначально лед плавал. Плавающий кубик льда вытесняет количество воды, равное своему весу, при таянии он превращается в воду и целиком заполняет свой собственный объем. 13
1. 4 ЗАКОН АРХИМЕДА Вопрос: Как изменится уровень воды в стакане с плавающим льдом после того, как лед в нем растает? Повысится он или понизится? Уровень не изменится при условии, что первоначально лед плавал. Плавающий кубик льда вытесняет количество воды, равное своему весу, при таянии он превращается в воду и целиком заполняет свой собственный объем. 13
 1. 4 ЗАКОН АРХИМЕДА Рассмотрим воздушный шар диаметром 10 м, наполненный горячим воздухом. Плотность воздуха внутри шара составляет 75 % плотности окружающего воздуха - 1, 3 кг/м 3. Найдем количество возможных пассажиров, перевозимых шаром. 14
1. 4 ЗАКОН АРХИМЕДА Рассмотрим воздушный шар диаметром 10 м, наполненный горячим воздухом. Плотность воздуха внутри шара составляет 75 % плотности окружающего воздуха - 1, 3 кг/м 3. Найдем количество возможных пассажиров, перевозимых шаром. 14
 Масса вытесненного газа: Мгаз = возд(4 R 3/3) = (1, 3)(4 /3)(5)3 кг = 680 кг. В соответствии с законом выталкивающая сила равна: Fb = Mгазg = 680(9, 8) Н = 6664 Н. Чтобы уравновесить эту силу, шар вместе с нагрузкой должен иметь массу 680 кг. Поскольку масса воздуха внутри баллона равна 510 кг, масса дополнительной нагрузки равна 170 кг. 15
Масса вытесненного газа: Мгаз = возд(4 R 3/3) = (1, 3)(4 /3)(5)3 кг = 680 кг. В соответствии с законом выталкивающая сила равна: Fb = Mгазg = 680(9, 8) Н = 6664 Н. Чтобы уравновесить эту силу, шар вместе с нагрузкой должен иметь массу 680 кг. Поскольку масса воздуха внутри баллона равна 510 кг, масса дополнительной нагрузки равна 170 кг. 15
 1. 5 ТЕМПЕРАТУРА Давление P определяется выражением При неизменной концентрации молекул п, т. е. при неизменном объеме V и числе молекул давление определяется средней кинетической энергией молекул. 16
1. 5 ТЕМПЕРАТУРА Давление P определяется выражением При неизменной концентрации молекул п, т. е. при неизменном объеме V и числе молекул давление определяется средней кинетической энергией молекул. 16
 Опытные данные свидетельствуют: при V = const давление растет пропорционально температуре Т. Следовательно, температура определяется средней кинетической энергией молекул. В энергетических единицах: В градусах где k - постоянная Больцмана. В системе СИ k = 1, 38 10~23 Дж/К. Отсюда следует: Р = nk. T. 17
Опытные данные свидетельствуют: при V = const давление растет пропорционально температуре Т. Следовательно, температура определяется средней кинетической энергией молекул. В энергетических единицах: В градусах где k - постоянная Больцмана. В системе СИ k = 1, 38 10~23 Дж/К. Отсюда следует: Р = nk. T. 17
 1. 6 ТЕРМОМЕТРЫ Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какоголибо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). 18
1. 6 ТЕРМОМЕТРЫ Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какоголибо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). 18
 1. 6 ТЕРМОМЕТРЫ 1723 г. – Даниель Габриель Фаренгейт (24 мая 1686 – 16 сентября 1736) – немецкий физик. 1742 г. – Андерс Цельсий (27 ноября 1701 – 25 апреля 1744) – шведский астроном, геолог и метеоролог. Широкое распространение получила шкала Цельсия, согласно которой температура замерзания воды tq = О °С, кипения - 100 °С. 19
1. 6 ТЕРМОМЕТРЫ 1723 г. – Даниель Габриель Фаренгейт (24 мая 1686 – 16 сентября 1736) – немецкий физик. 1742 г. – Андерс Цельсий (27 ноября 1701 – 25 апреля 1744) – шведский астроном, геолог и метеоролог. Широкое распространение получила шкала Цельсия, согласно которой температура замерзания воды tq = О °С, кипения - 100 °С. 19
 1. 6 ТЕРМОМЕТРЫ 1848 г. – Уильям Томсон, лорд Кельвин (26 июня 1824 года – 17 декабря 1907 года) — британский физик. Шкала Кельвина, температура замерзания воды соответствует 273, 1 °К, кипения - 373, 1 °К. Эта шкала принята за основную в системе СИ. 20
1. 6 ТЕРМОМЕТРЫ 1848 г. – Уильям Томсон, лорд Кельвин (26 июня 1824 года – 17 декабря 1907 года) — британский физик. Шкала Кельвина, температура замерзания воды соответствует 273, 1 °К, кипения - 373, 1 °К. Эта шкала принята за основную в системе СИ. 20
 ТЕМА РЕФЕРАТА ТЕРМОМЕТРЫ. ПРИНЦИП РАБОТЫ. ИХ ВИДЫ И ХАРАКТЕРИСТИКИ.
ТЕМА РЕФЕРАТА ТЕРМОМЕТРЫ. ПРИНЦИП РАБОТЫ. ИХ ВИДЫ И ХАРАКТЕРИСТИКИ.
 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Величинами, определяющими состояние идеального газа, являются р, V, Т. Согласно основному уравнению идеального газа: C учетом выражения Отсюда РV=Nk. Т, Уравнение Менделеева- Клайперона 22
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Величинами, определяющими состояние идеального газа, являются р, V, Т. Согласно основному уравнению идеального газа: C учетом выражения Отсюда РV=Nk. Т, Уравнение Менделеева- Клайперона 22
 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО В молекулярной физике широко используют понятия киломоль (моль) и число Авогадро. Дадим определения этих величин. 1 моль = количество грамм вещества, равное его молекулярной массе (определение моля). 1 киломоль = количество килограмм вещества, равное его молекулярной массе (определение киломоля). 23
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО В молекулярной физике широко используют понятия киломоль (моль) и число Авогадро. Дадим определения этих величин. 1 моль = количество грамм вещества, равное его молекулярной массе (определение моля). 1 киломоль = количество килограмм вещества, равное его молекулярной массе (определение киломоля). 23
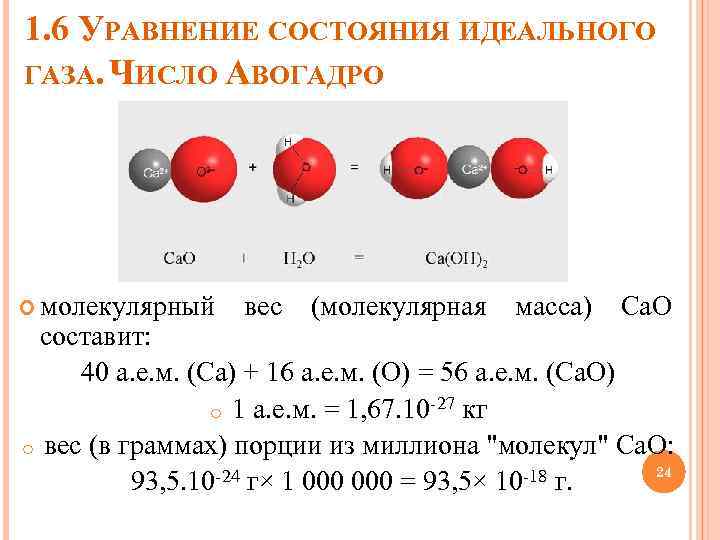 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО молекулярный вес (молекулярная масса) Са. О составит: 40 а. е. м. (Ca) + 16 а. е. м. (O) = 56 а. е. м. (Ca. O) o 1 а. е. м. = 1, 67. 10 -27 кг o вес (в граммах) порции из миллиона "молекул" Са. О: 24 93, 5. 10 -24 г× 1 000 = 93, 5× 10 -18 г.
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО молекулярный вес (молекулярная масса) Са. О составит: 40 а. е. м. (Ca) + 16 а. е. м. (O) = 56 а. е. м. (Ca. O) o 1 а. е. м. = 1, 67. 10 -27 кг o вес (в граммах) порции из миллиона "молекул" Са. О: 24 93, 5. 10 -24 г× 1 000 = 93, 5× 10 -18 г.
 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Существуют методы измерения массы частиц, как, например, протон и электрон. В частности, масса атома водорода т. Н = 1, 673 -10 г. Пусть N 0 – число атомов водорода в одном моле атомарного водорода ( = 1, 008 г). Тогда 25
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Существуют методы измерения массы частиц, как, например, протон и электрон. В частности, масса атома водорода т. Н = 1, 673 -10 г. Пусть N 0 – число атомов водорода в одном моле атомарного водорода ( = 1, 008 г). Тогда 25
 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Это число называется числом Авогадро и представляет собой число молекул любого химического соединения в одном моле соединения. Один моль любого идеального газа при атмосферном давлении и температуре Т = 273 К (О °С) занимает объем 22, 4 л. 26
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Это число называется числом Авогадро и представляет собой число молекул любого химического соединения в одном моле соединения. Один моль любого идеального газа при атмосферном давлении и температуре Т = 273 К (О °С) занимает объем 22, 4 л. 26
 1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Для одного моля газа уравнение состояния идеального газа записывается в виде PV= N 0 k. T= RT Произведение N 0 k общепринято называть газовой постоянной R: R = N 0 k = (6, 02 1023)( 1, 38 10 -23) = 8, 31 = 8, 3 14 103 Уравнение состояния идеального газа для произвольного количества газа М (уравнение Менделеева - Клайперона): 27
1. 6 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ЧИСЛО АВОГАДРО Для одного моля газа уравнение состояния идеального газа записывается в виде PV= N 0 k. T= RT Произведение N 0 k общепринято называть газовой постоянной R: R = N 0 k = (6, 02 1023)( 1, 38 10 -23) = 8, 31 = 8, 3 14 103 Уравнение состояния идеального газа для произвольного количества газа М (уравнение Менделеева - Клайперона): 27
 Связь м/д количеством вещества, постоянной Авогадро, молярной массой и массой молекулы 28
Связь м/д количеством вещества, постоянной Авогадро, молярной массой и массой молекулы 28
 ЗАКОН ДАЛЬТОНА: Давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений. p = p 1 + p 2 + … = (n 1 + n 2 + …)k. T n 1, n 2, … – концентрации молекул различных газов в смеси. 29
ЗАКОН ДАЛЬТОНА: Давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений. p = p 1 + p 2 + … = (n 1 + n 2 + …)k. T n 1, n 2, … – концентрации молекул различных газов в смеси. 29
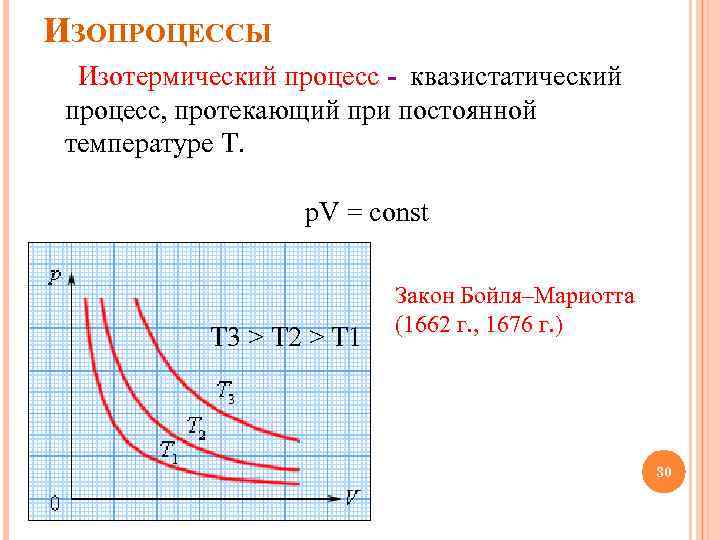 ИЗОПРОЦЕССЫ Изотермический процесс - квазистатический процесс, протекающий при постоянной температуре T. p. V = const T 3 > T 2 > T 1 Закон Бойля–Мариотта (1662 г. , 1676 г. ) 30
ИЗОПРОЦЕССЫ Изотермический процесс - квазистатический процесс, протекающий при постоянной температуре T. p. V = const T 3 > T 2 > T 1 Закон Бойля–Мариотта (1662 г. , 1676 г. ) 30
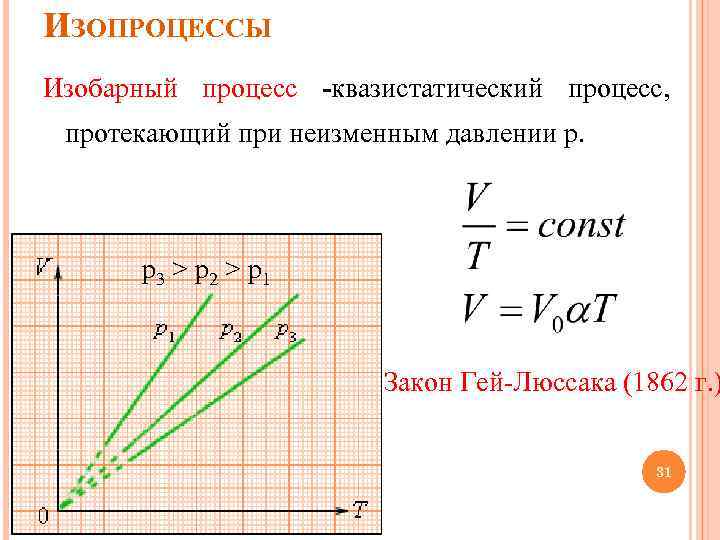 ИЗОПРОЦЕССЫ Изобарный процесс -квазистатический процесс, протекающий при неизменным давлении p. p 3 > p 2 > p 1 Закон Гей-Люссака (1862 г. ) 31
ИЗОПРОЦЕССЫ Изобарный процесс -квазистатический процесс, протекающий при неизменным давлении p. p 3 > p 2 > p 1 Закон Гей-Люссака (1862 г. ) 31
 ИЗОПРОЦЕССЫ Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. V 3 > V 2 > V 1 Закон Шарля (1787 г. ) 32
ИЗОПРОЦЕССЫ Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным. V 3 > V 2 > V 1 Закон Шарля (1787 г. ) 32
 1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. Внутренняя энергия представляет собой дополнительную энергию движения отдельных частиц, не учитываемую при макроскопическом рассмотрении системы. 33
1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. Внутренняя энергия представляет собой дополнительную энергию движения отдельных частиц, не учитываемую при макроскопическом рассмотрении системы. 33
 1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА МКТ приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др. ), молекулы которого совершают только поступательное движение: Внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное 34 состояние.
1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА МКТ приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др. ), молекулы которого совершают только поступательное движение: Внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное 34 состояние.
 1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА Если система состоит из частиц типа молекул H 2 O, которые могут вращаться во всех трех направлениях, то U = Кпост + Квр, Предполагают, что вращательная энергия двухатомных молекул равна 35
1. 8 КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛА Если система состоит из частиц типа молекул H 2 O, которые могут вращаться во всех трех направлениях, то U = Кпост + Квр, Предполагают, что вращательная энергия двухатомных молекул равна 35
 1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Тепловая энергия – форма энергии, связанная с движением атомов, молекул или других частиц, из которых состоит тело. По сути, тепловая энергия – это суммарная кинетическая энергия структурных элементов вещества (будь то атомы, молекулы или заряженные частицы). Тепловая энергия системы плюс потенциальная энергия межатомных взаимодействий называется внутренней энергией системы. Тепловая энергия может выделяться благодаря химическим реакциям (горение), ядерным реакциям (деление ядра, ядерный синтез), механическим 36 взаимодействиям (трение).
1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Тепловая энергия – форма энергии, связанная с движением атомов, молекул или других частиц, из которых состоит тело. По сути, тепловая энергия – это суммарная кинетическая энергия структурных элементов вещества (будь то атомы, молекулы или заряженные частицы). Тепловая энергия системы плюс потенциальная энергия межатомных взаимодействий называется внутренней энергией системы. Тепловая энергия может выделяться благодаря химическим реакциям (горение), ядерным реакциям (деление ядра, ядерный синтез), механическим 36 взаимодействиям (трение).
 1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Если натирать стенки сосуда с водой, то при этом будет совершаться работа против силы трения. При натирании производится тепловая энергия, которая передается воде. Температура (или внутренняя энергия) воды будет возрастать. Наряду с джоулем существует единица тепловой энергии, именуемая калорией (кал). Калория – внесистемная единица количества работы и энергии, равная количеству тепла, необходимого для нагревания 1 грамма воды на 1 кельвин при стандартном атмосферном давлении 101 37 325 Па.
1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Если натирать стенки сосуда с водой, то при этом будет совершаться работа против силы трения. При натирании производится тепловая энергия, которая передается воде. Температура (или внутренняя энергия) воды будет возрастать. Наряду с джоулем существует единица тепловой энергии, именуемая калорией (кал). Калория – внесистемная единица количества работы и энергии, равная количеству тепла, необходимого для нагревания 1 грамма воды на 1 кельвин при стандартном атмосферном давлении 101 37 325 Па.
 1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Известно, что для поддержания жизни человеку необходимо расходовать мощность в среднем 120 Вт. Определим: Сколько килокалорий должен ежедневно потреблять человек, чтобы не умереть? 38
1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ Известно, что для поддержания жизни человеку необходимо расходовать мощность в среднем 120 Вт. Определим: Сколько килокалорий должен ежедневно потреблять человек, чтобы не умереть? 38
 1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ За сутки человек тратит энергию, равную (120 Вт)(86400 с) = 1, 04 107 Дж. 1 кал = 4, 185 Дж Следовательно, эквивалентное количество калорий, расходуемых человеком за сутки, равно 39
1. 9 ТЕПЛОВАЯ ЭНЕРГИЯ За сутки человек тратит энергию, равную (120 Вт)(86400 с) = 1, 04 107 Дж. 1 кал = 4, 185 Дж Следовательно, эквивалентное количество калорий, расходуемых человеком за сутки, равно 39
 ТЕМА СЛЕДУЮЩЕЙ ЛЕКЦИИ: РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА И БОЛЬЦМАНА
ТЕМА СЛЕДУЮЩЕЙ ЛЕКЦИИ: РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА И БОЛЬЦМАНА
 СПАСИБО ЗА ВНИМАНИЕ
СПАСИБО ЗА ВНИМАНИЕ


