 КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА “Попередні дослідження системи Ni(II) - етилендиамін” -2012 - Литвин Уляна Харченко Вікторія
КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА “Попередні дослідження системи Ni(II) - етилендиамін” -2012 - Литвин Уляна Харченко Вікторія
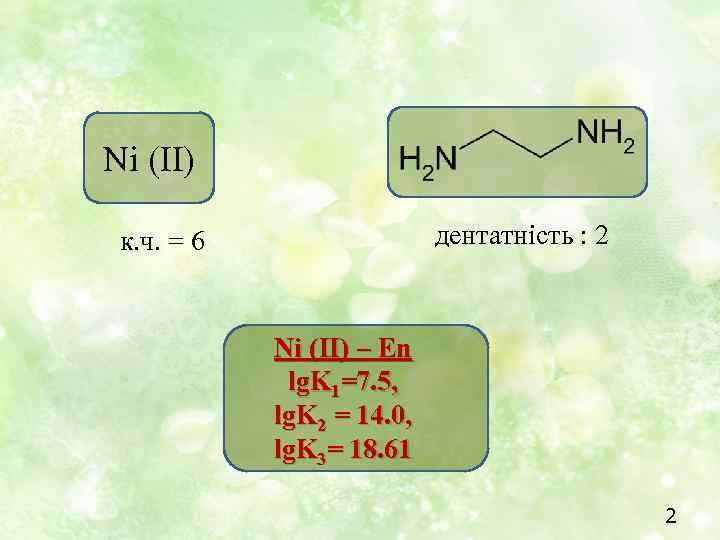 Ni (II) дентатність : 2 к. ч. = 6 Ni (II) – En lg. K 1=7. 5, lg. K 2 = 14. 0, lg. K 3= 18. 61 2
Ni (II) дентатність : 2 к. ч. = 6 Ni (II) – En lg. K 1=7. 5, lg. K 2 = 14. 0, lg. K 3= 18. 61 2
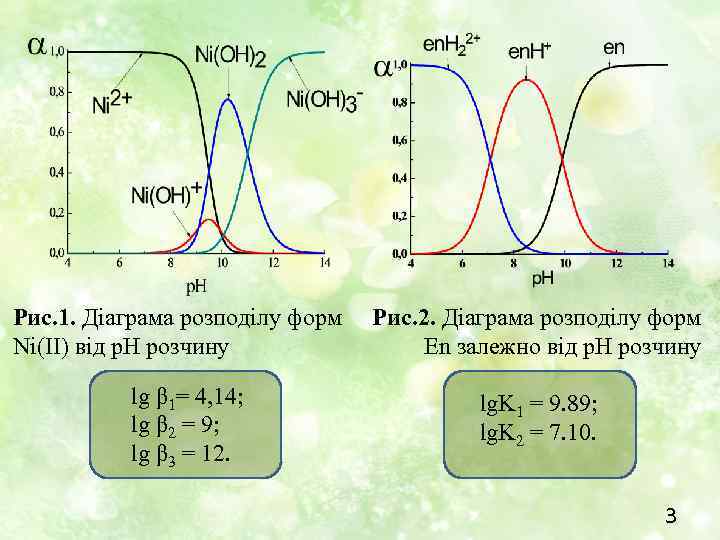 Рис. 1. Діаграма розподілу форм Ni(II) від р. Н розчину lg β 1= 4, 14; lg β 2 = 9; lg β 3 = 12. Рис. 2. Діаграма розподілу форм En залежно від р. Н розчину lg. K 1 = 9. 89; lg. K 2 = 7. 10. 3
Рис. 1. Діаграма розподілу форм Ni(II) від р. Н розчину lg β 1= 4, 14; lg β 2 = 9; lg β 3 = 12. Рис. 2. Діаграма розподілу форм En залежно від р. Н розчину lg. K 1 = 9. 89; lg. K 2 = 7. 10. 3
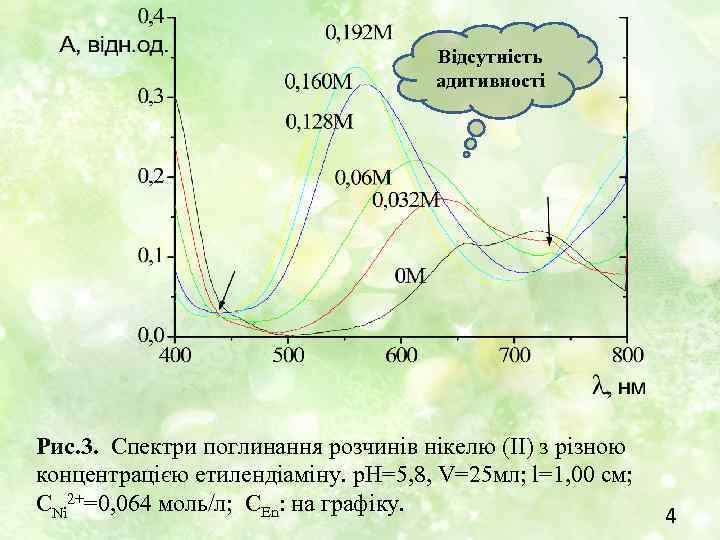 Відсутність адитивності Рис. 3. Спектри поглинання розчинів нікелю (ІІ) з різною концентрацією етилендіаміну. р. Н=5, 8, V=25 мл; l=1, 00 см; СNi 2+=0, 064 моль/л; СEn: на графіку. 4
Відсутність адитивності Рис. 3. Спектри поглинання розчинів нікелю (ІІ) з різною концентрацією етилендіаміну. р. Н=5, 8, V=25 мл; l=1, 00 см; СNi 2+=0, 064 моль/л; СEn: на графіку. 4
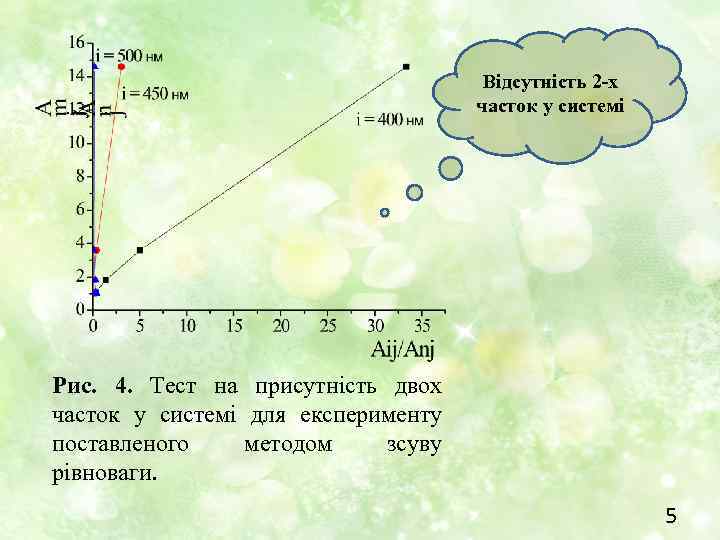 Відсутність 2 -х часток у системі Рис. 4. Тест на присутність двох часток у системі для експерименту поставленого методом зсуву рівноваги. 5
Відсутність 2 -х часток у системі Рис. 4. Тест на присутність двох часток у системі для експерименту поставленого методом зсуву рівноваги. 5
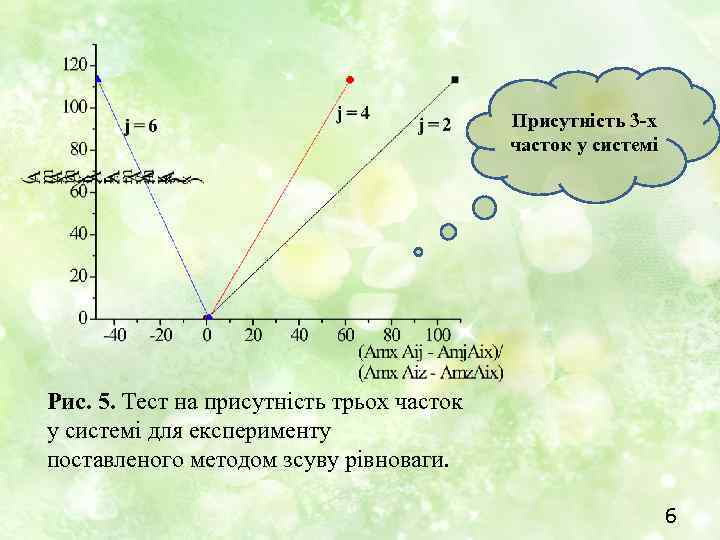 Присутність 3 -х часток у системі Рис. 5. Тест на присутність трьох часток у системі для експерименту поставленого методом зсуву рівноваги. 6
Присутність 3 -х часток у системі Рис. 5. Тест на присутність трьох часток у системі для експерименту поставленого методом зсуву рівноваги. 6
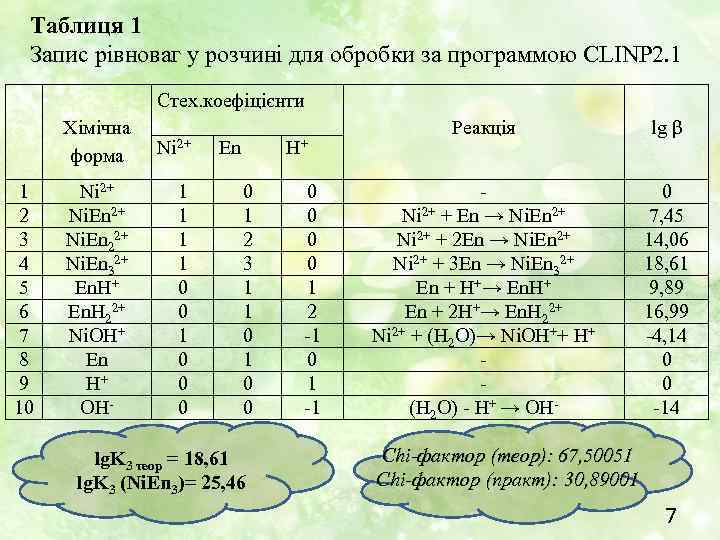 Таблиця 1 Запис рівноваг у розчині для обробки за программою CLINP 2. 1 Стех. коефіцієнти Хімічна форма 1 2 3 4 5 6 7 8 9 10 Ni 2+ Ni. En 22+ Ni. En 32+ En. H 22+ Ni. OH+ En H+ OH- Ni 2+ 1 1 0 0 0 En H+ 0 1 2 3 1 1 0 0 lg. K 3 теор = 18, 61 lg. K 3 (Ni. En 3)= 25, 46 0 0 1 2 -1 0 1 -1 Реакція lg β Ni 2+ + En → Ni. En 2+ Ni 2+ + 2 En → Ni. En 2+ Ni 2+ + 3 En → Ni. En 32+ En + H+→ En. H+ En + 2 H+→ En. H 22+ Ni 2+ + (H 2 O)→ Ni. OH++ H+ (H 2 O) - H+ → OH- 0 7, 45 14, 06 18, 61 9, 89 16, 99 -4, 14 0 0 -14 Chi-фактор (теор): 67, 50051 Chi-фактор (практ): 30, 89001 7
Таблиця 1 Запис рівноваг у розчині для обробки за программою CLINP 2. 1 Стех. коефіцієнти Хімічна форма 1 2 3 4 5 6 7 8 9 10 Ni 2+ Ni. En 22+ Ni. En 32+ En. H 22+ Ni. OH+ En H+ OH- Ni 2+ 1 1 0 0 0 En H+ 0 1 2 3 1 1 0 0 lg. K 3 теор = 18, 61 lg. K 3 (Ni. En 3)= 25, 46 0 0 1 2 -1 0 1 -1 Реакція lg β Ni 2+ + En → Ni. En 2+ Ni 2+ + 2 En → Ni. En 2+ Ni 2+ + 3 En → Ni. En 32+ En + H+→ En. H+ En + 2 H+→ En. H 22+ Ni 2+ + (H 2 O)→ Ni. OH++ H+ (H 2 O) - H+ → OH- 0 7, 45 14, 06 18, 61 9, 89 16, 99 -4, 14 0 0 -14 Chi-фактор (теор): 67, 50051 Chi-фактор (практ): 30, 89001 7
![2+ Ni + 3 En → 2+ [Ni. En 3] 8 2+ Ni + 3 En → 2+ [Ni. En 3] 8](https://present5.com/presentation/118263154_133089623/image-8.jpg) 2+ Ni + 3 En → 2+ [Ni. En 3] 8
2+ Ni + 3 En → 2+ [Ni. En 3] 8
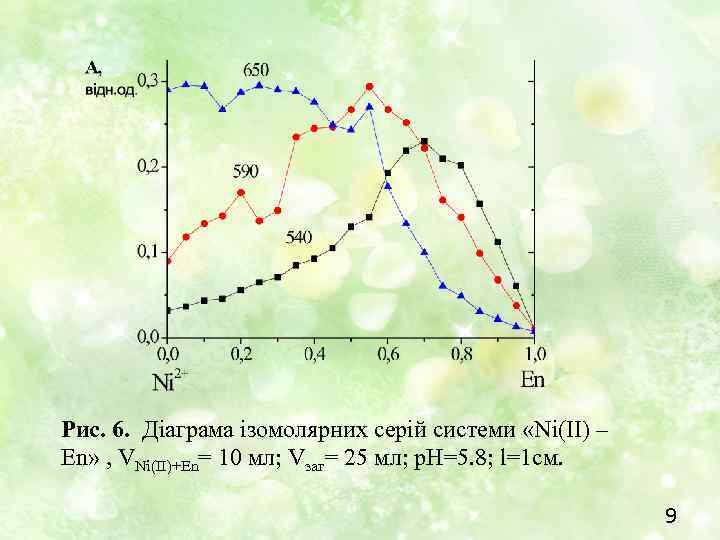 Рис. 6. Діаграма ізомолярних серій системи «Ni(II) – En» , VNi(II)+En= 10 мл; Vзаг= 25 мл; p. H=5. 8; l=1 см. 9
Рис. 6. Діаграма ізомолярних серій системи «Ni(II) – En» , VNi(II)+En= 10 мл; Vзаг= 25 мл; p. H=5. 8; l=1 см. 9
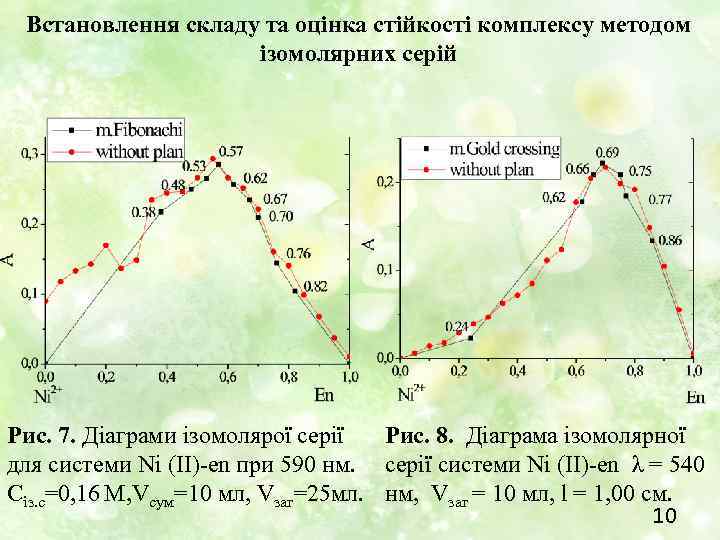 Встановлення складу та оцінка стійкості комплексу методом ізомолярних серій Рис. 7. Діаграми ізомолярої серії Рис. 8. Діаграма ізомолярної для системи Ni (II)-еn при 590 нм. серії системи Ni (II)-еn λ = 540 Cіз. с=0, 16 М, Vсум=10 мл, Vзаг=25 мл. нм, Vзаг = 10 мл, l = 1, 00 см. 10
Встановлення складу та оцінка стійкості комплексу методом ізомолярних серій Рис. 7. Діаграми ізомолярої серії Рис. 8. Діаграма ізомолярної для системи Ni (II)-еn при 590 нм. серії системи Ni (II)-еn λ = 540 Cіз. с=0, 16 М, Vсум=10 мл, Vзаг=25 мл. нм, Vзаг = 10 мл, l = 1, 00 см. 10
 Висновки: 1. За наявністю ізобестичних точок на спектрах поглинання можна зробити висновок про наявність трьох комплексних частинок у розчині. 2. Перевірено, що при використанні планування експерименту за методоми золотого перетину та чисел Фібоначчі можна отримати близькі дані до тих, що отримані без планування експерименту та зменшує трудомісткості процесу. 3. Для системи "Ni – en" характерне ступінчасте комплексоутворення. Але склад комплексу даними методами ми встановити не можемо, бо при наявності ступінчастого комплексоутворення одержана інформація про склад не достовірна. 11
Висновки: 1. За наявністю ізобестичних точок на спектрах поглинання можна зробити висновок про наявність трьох комплексних частинок у розчині. 2. Перевірено, що при використанні планування експерименту за методоми золотого перетину та чисел Фібоначчі можна отримати близькі дані до тих, що отримані без планування експерименту та зменшує трудомісткості процесу. 3. Для системи "Ni – en" характерне ступінчасте комплексоутворення. Але склад комплексу даними методами ми встановити не можемо, бо при наявності ступінчастого комплексоутворення одержана інформація про склад не достовірна. 11
 Дякуємо за увагу! 12
Дякуємо за увагу! 12