ген регул.Паша.ppt
- Количество слайдов: 41
 Київський Національний університет імені Тараса Шевченка Навчально-науковий центр «Інститут біології» Кафедра фізіології та екології рослин РЕГУЛЯЦІЯ ГЕНОМУ РОСЛИН У СТРЕСОВИХ УМОВАХ Швидуна Павловича студента I курсу МАГІСТРАТУРИ
Київський Національний університет імені Тараса Шевченка Навчально-науковий центр «Інститут біології» Кафедра фізіології та екології рослин РЕГУЛЯЦІЯ ГЕНОМУ РОСЛИН У СТРЕСОВИХ УМОВАХ Швидуна Павловича студента I курсу МАГІСТРАТУРИ
 Генетична регуляція. Сприйнятий клітиною сигналу в кінцевому підсумку передається в ядро. Виділяють кілька рівнів регуляції клітинної відповіді: 1) рівень транскрипції, коли регулюється як власне транскрипція, так і подальший процесинг (дозрівання) попередника і-РНК, а також деградація попередника і-РНК; 2) рівень трансляції, коли регуляції може піддаватися синтезу білка, його подальший процесинг, або деградація попередника або самого білка після завершення процесингу; 3) рівень зрілих білків, коли регуляція може реалізовуватися в процесах фосфорилювання-дефосфорилирования білків, а значить, і в зміні їх властивостей, в зрушеннях каталітичної активності під дією вторинних месенджерів, модуляції властивостей білків в результаті білок-білкових взаємодій.
Генетична регуляція. Сприйнятий клітиною сигналу в кінцевому підсумку передається в ядро. Виділяють кілька рівнів регуляції клітинної відповіді: 1) рівень транскрипції, коли регулюється як власне транскрипція, так і подальший процесинг (дозрівання) попередника і-РНК, а також деградація попередника і-РНК; 2) рівень трансляції, коли регуляції може піддаватися синтезу білка, його подальший процесинг, або деградація попередника або самого білка після завершення процесингу; 3) рівень зрілих білків, коли регуляція може реалізовуватися в процесах фосфорилювання-дефосфорилирования білків, а значить, і в зміні їх властивостей, в зрушеннях каталітичної активності під дією вторинних месенджерів, модуляції властивостей білків в результаті білок-білкових взаємодій.
 Одним із захисних механізмів рослин є регуляція експресії генів на основі специфічного впізнавання і деградації РНК (RNA silencin або RNA interference) - «умолкание генов» , або – епігенетичний сайленсінг. Епігенетичний сайленсінг – це форма репресії генетичної активності, яка встановлюється строго в певний час онтогенезу і потім успадковується в багатьох клітинних поколіннях. У дослідах з трансгенними рослинами, в геном яких вбудовували вірусні гени вірусостійкість: - корелювала з руйнуванням трансгенної м. РНК в цитоплазмі, - супроводжувалася накопиченням коротких (приблизно 25 нуклеотидів) дволанцюгових РНК (ds. РНК) і - була сиквенс - специфічною.
Одним із захисних механізмів рослин є регуляція експресії генів на основі специфічного впізнавання і деградації РНК (RNA silencin або RNA interference) - «умолкание генов» , або – епігенетичний сайленсінг. Епігенетичний сайленсінг – це форма репресії генетичної активності, яка встановлюється строго в певний час онтогенезу і потім успадковується в багатьох клітинних поколіннях. У дослідах з трансгенними рослинами, в геном яких вбудовували вірусні гени вірусостійкість: - корелювала з руйнуванням трансгенної м. РНК в цитоплазмі, - супроводжувалася накопиченням коротких (приблизно 25 нуклеотидів) дволанцюгових РНК (ds. РНК) і - була сиквенс - специфічною.
 Сиквенс-специфічна стійкість, або посттранскрипційне «умолкание генов» (post--transcriptional gene silencin, PTGS), виявлялася у трансгенних рослин не тільки до того вірусу, вплив якого досліджувався, а й до інших вірусів, які мають гомологічні послідовності. Короткі РНК (short, s. RNA) запускають регуляторні реакції організму • відіграють ключову роль в регуляції активності значної частини транскриптому рослин при дії стресів абіотичної і біотичної природи; • ініціюють реакцію на патогени, освітлення, водний стрес, мінеральне живлення, сольовий стрес, гіпоксію, механічний стрес і зміни температури; • активність системи утворення s. RNA також контролюється через s. RNA.
Сиквенс-специфічна стійкість, або посттранскрипційне «умолкание генов» (post--transcriptional gene silencin, PTGS), виявлялася у трансгенних рослин не тільки до того вірусу, вплив якого досліджувався, а й до інших вірусів, які мають гомологічні послідовності. Короткі РНК (short, s. RNA) запускають регуляторні реакції організму • відіграють ключову роль в регуляції активності значної частини транскриптому рослин при дії стресів абіотичної і біотичної природи; • ініціюють реакцію на патогени, освітлення, водний стрес, мінеральне живлення, сольовий стрес, гіпоксію, механічний стрес і зміни температури; • активність системи утворення s. RNA також контролюється через s. RNA.
 В рослині функціонує регуляторна мережа стрес- чутливих s. RNA, що активно перебудовує метаболізм клітини до дії стресів. Відповідно до сучасних уявлень, виявлено три механізми епігенетичного сайленсінгу у рослин: • цитоплазматичний сайленсінг трансгенних і вірусних РНК, • сайленсінг ендогенних м. РНК, • транскрипційний сайленсінг генів.
В рослині функціонує регуляторна мережа стрес- чутливих s. RNA, що активно перебудовує метаболізм клітини до дії стресів. Відповідно до сучасних уявлень, виявлено три механізми епігенетичного сайленсінгу у рослин: • цитоплазматичний сайленсінг трансгенних і вірусних РНК, • сайленсінг ендогенних м. РНК, • транскрипційний сайленсінг генів.
 Ефекти АБК на клітинному рівні. Абсцизова кислота з'являється в клітині у відповідь на зміну стану води. У звичайних умовах ця зміна викликається трьома чинниками: 1. Підсушуванням. 2. Підвищенням концентрації речовин в клітині. 3. Охолодженням. У усіх трьох випадках вода стає для клітини менш доступною, спостерігається водний дефіцит.
Ефекти АБК на клітинному рівні. Абсцизова кислота з'являється в клітині у відповідь на зміну стану води. У звичайних умовах ця зміна викликається трьома чинниками: 1. Підсушуванням. 2. Підвищенням концентрації речовин в клітині. 3. Охолодженням. У усіх трьох випадках вода стає для клітини менш доступною, спостерігається водний дефіцит.
 Закривання продихів у відповідь на АБК - дуже швидка реакція, при якій механізми геномної регуляції не встигають увімкнутися. Для формування геномної відповіді реакції розгортаються далі в такій послідовності: 1. Високий рівень р. Н активує протеїнфосфатази – білки ABI 1 и ABI 2, які дефосфорелюють білок-репресор АБК-сигналу (розташований на внутрішній поверхні мембрани ядра – таким чином відбувається передача сигналу АБК в ядро). Поки репресор фосфорильований, він не дає проявлятися подальшим відповідям на АБК. Дефосфорилювання інактивує (вимикає) репресор, і відбувається подальша передача сигналу АБК. Якщо протеїнфосфатази не активні, репресор постійно пригнічує відповідь на АБК і рослина стає нечутливою до цього гормону. Мутації Arabidopsis по протеїнфосфатазам були спочатку ідентифіковані як нечутливі до АБК, саме тому відповідні гени були названі ABI 1 і ABI 2. 2. Для процесів активізації/інактивації генів в ядрі важливим регулятором є залежний від стану білка-репресора білок ABI 3 у Arabidopsis (чи його гомолог у кукурудзи - VP 1). ABI 3 є активатором транскрипції, що запускає експресію АБКзалежних генів. ; 3. Відбувається синтез речовин-протекторів, які захищають клітину від стресу (антоціани, поліаміни, осмотин, ЕМ-білки); 4. Синтез запасних білків при переході до стану спокою.
Закривання продихів у відповідь на АБК - дуже швидка реакція, при якій механізми геномної регуляції не встигають увімкнутися. Для формування геномної відповіді реакції розгортаються далі в такій послідовності: 1. Високий рівень р. Н активує протеїнфосфатази – білки ABI 1 и ABI 2, які дефосфорелюють білок-репресор АБК-сигналу (розташований на внутрішній поверхні мембрани ядра – таким чином відбувається передача сигналу АБК в ядро). Поки репресор фосфорильований, він не дає проявлятися подальшим відповідям на АБК. Дефосфорилювання інактивує (вимикає) репресор, і відбувається подальша передача сигналу АБК. Якщо протеїнфосфатази не активні, репресор постійно пригнічує відповідь на АБК і рослина стає нечутливою до цього гормону. Мутації Arabidopsis по протеїнфосфатазам були спочатку ідентифіковані як нечутливі до АБК, саме тому відповідні гени були названі ABI 1 і ABI 2. 2. Для процесів активізації/інактивації генів в ядрі важливим регулятором є залежний від стану білка-репресора білок ABI 3 у Arabidopsis (чи його гомолог у кукурудзи - VP 1). ABI 3 є активатором транскрипції, що запускає експресію АБКзалежних генів. ; 3. Відбувається синтез речовин-протекторів, які захищають клітину від стресу (антоціани, поліаміни, осмотин, ЕМ-білки); 4. Синтез запасних білків при переході до стану спокою.
 Без ABI 3 або VP 1: • не може ініціюватися експресія генів дозрівання ембріона (EM-гени від embryo maturation), • не запускається біосинтез антоцианів, • не накопичуються запасні білки в насінні і так далі. Одного білку ABI 3 або VP 1 недостатньо для активації транскрипції через ABRC- мотив. Для цього потрібний досить складний комплекс транскрипції, EMB- білки (димерні чинники транскрипції типу "лейцинової застібки"). Ушкодження білків ABI 3 або VP 1 в результаті мутації веде до порушення процесів формування зрілого насіння і передчасного проростання. лейцинова блискавка (leucine zipper), яка забезпечуюэ можливість зв'язування з ДНК.
Без ABI 3 або VP 1: • не може ініціюватися експресія генів дозрівання ембріона (EM-гени від embryo maturation), • не запускається біосинтез антоцианів, • не накопичуються запасні білки в насінні і так далі. Одного білку ABI 3 або VP 1 недостатньо для активації транскрипції через ABRC- мотив. Для цього потрібний досить складний комплекс транскрипції, EMB- білки (димерні чинники транскрипції типу "лейцинової застібки"). Ушкодження білків ABI 3 або VP 1 в результаті мутації веде до порушення процесів формування зрілого насіння і передчасного проростання. лейцинова блискавка (leucine zipper), яка забезпечуюэ можливість зв'язування з ДНК.
 Індукція синтезу стресових білків при засоленні аналогічна визувати посухою • Одночасне участь декількох генів в адаптації до одного стресового впливу свідчить про те, що різні гени, що відповідають за стійкість рослин до стресу, повинні мати загальні регуляторні елементи. Дійсно, виявивлено ген RD 29, який активується при осмотичному шоці, охолодженні, водному дефіциті, обробці АБК. У промоторній області гена RD 29 виявлені нуклеотидні послідовності, які дозволяють відповідати на АБК (АБК-відповідальний елемент, АВRЕ) і осмотичний шок (елемент, що відповідає на дегідратацію, DRЕ).
Індукція синтезу стресових білків при засоленні аналогічна визувати посухою • Одночасне участь декількох генів в адаптації до одного стресового впливу свідчить про те, що різні гени, що відповідають за стійкість рослин до стресу, повинні мати загальні регуляторні елементи. Дійсно, виявивлено ген RD 29, який активується при осмотичному шоці, охолодженні, водному дефіциті, обробці АБК. У промоторній області гена RD 29 виявлені нуклеотидні послідовності, які дозволяють відповідати на АБК (АБК-відповідальний елемент, АВRЕ) і осмотичний шок (елемент, що відповідає на дегідратацію, DRЕ).
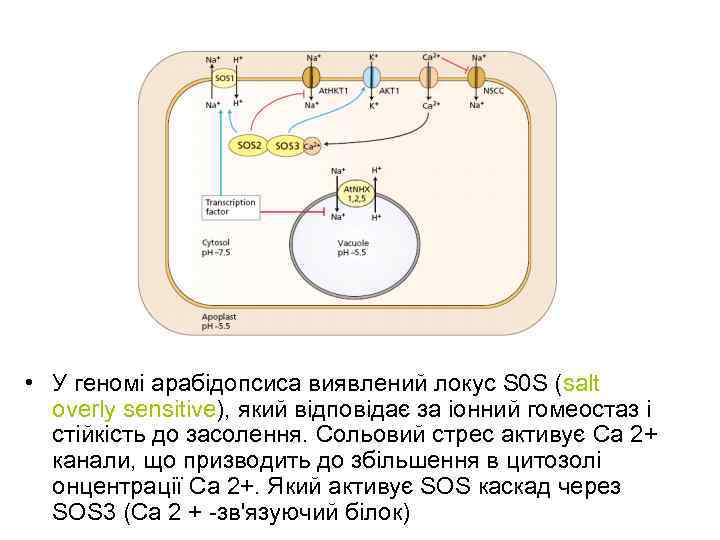 • У геномі арабідопсиса виявлений локус S 0 S (salt overly sensitive), який відповідає за іонний гомеостаз і стійкість до засолення. Сольовий стрес активує Са 2+ канали, що призводить до збільшення в цитозолі онцентрації Са 2+. Який активує SOS каскад через SOS 3 (Са 2 + -зв'язуючий білок)
• У геномі арабідопсиса виявлений локус S 0 S (salt overly sensitive), який відповідає за іонний гомеостаз і стійкість до засолення. Сольовий стрес активує Са 2+ канали, що призводить до збільшення в цитозолі онцентрації Са 2+. Який активує SOS каскад через SOS 3 (Са 2 + -зв'язуючий білок)
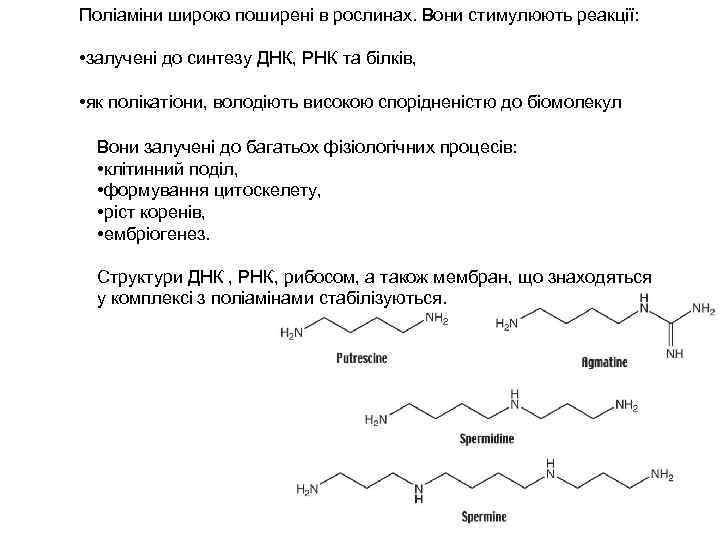 Поліаміни широко поширені в рослинах. Вони стимулюють реакції: • залучені до синтезу ДНК, РНК та білків, • як полікатіони, володіють високою спорідненістю до біомолекул Вони залучені до багатьох фізіологічних процесів: • клітинний поділ, • формування цитоскелету, • ріст коренів, • ембріогенез. Структури ДНК , РНК, рибосом, а також мембран, що знаходяться у комплексі з поліамінами стабілізуються.
Поліаміни широко поширені в рослинах. Вони стимулюють реакції: • залучені до синтезу ДНК, РНК та білків, • як полікатіони, володіють високою спорідненістю до біомолекул Вони залучені до багатьох фізіологічних процесів: • клітинний поділ, • формування цитоскелету, • ріст коренів, • ембріогенез. Структури ДНК , РНК, рибосом, а також мембран, що знаходяться у комплексі з поліамінами стабілізуються.
 До специфічних механізмів боротьби з сильним абіотичним стресом і утворенням великих кристалів льоду поза клітинами, відноситься накопичення рослиною антизаморожуючих білків (AFPs). Гриби, бактерії, рослини, здатні накопичувати AFPs, що зв’язуються з поверхнею кристалів льоду та інгібують їх ріст. Для рослин роль AFPs повністью не з’ясована, але відомо, що вони синтезуються в апопласті і підвищують точку замерзання тканин. Було запропоновано, що AFPs знижують швидкість поширення льоду по тканинам.
До специфічних механізмів боротьби з сильним абіотичним стресом і утворенням великих кристалів льоду поза клітинами, відноситься накопичення рослиною антизаморожуючих білків (AFPs). Гриби, бактерії, рослини, здатні накопичувати AFPs, що зв’язуються з поверхнею кристалів льоду та інгібують їх ріст. Для рослин роль AFPs повністью не з’ясована, але відомо, що вони синтезуються в апопласті і підвищують точку замерзання тканин. Було запропоновано, що AFPs знижують швидкість поширення льоду по тканинам.
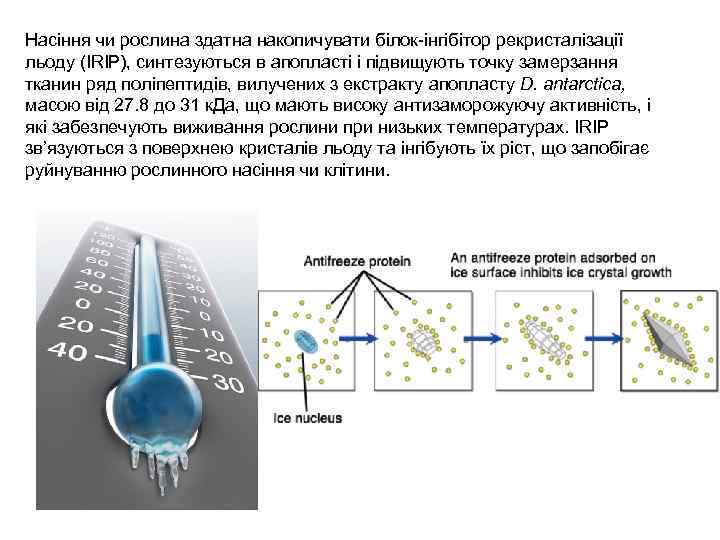 Насіння чи рослина здатна накопичувати білок-інгібітор рекристалізації льоду (IRIP), синтезуються в апопласті і підвищують точку замерзання тканин ряд поліпептидів, вилучених з екстракту апопласту D. antarctica, масою від 27. 8 до 31 к. Да, що мають високу антизаморожуючу активність, і які забезпечують виживання рослини при низьких температурах. IRIP зв’язуються з поверхнею кристалів льоду та інгібують їх ріст, що запобігає руйнуванню рослинного насіння чи клітини.
Насіння чи рослина здатна накопичувати білок-інгібітор рекристалізації льоду (IRIP), синтезуються в апопласті і підвищують точку замерзання тканин ряд поліпептидів, вилучених з екстракту апопласту D. antarctica, масою від 27. 8 до 31 к. Да, що мають високу антизаморожуючу активність, і які забезпечують виживання рослини при низьких температурах. IRIP зв’язуються з поверхнею кристалів льоду та інгібують їх ріст, що запобігає руйнуванню рослинного насіння чи клітини.
 Гени рослин, індуковані низькими температурами У рослинах ідентифіковано велику кількість генів індукованих низькими температурами: гени десатураз, жирних кислот що підтверджує важливу роль десатурації мембранних ліпідів у регуляції плинності мембран та акліматизації рослин до низьких температур. Аналіз експресії 8, 000 генів у Arabidopsis thaliana за допомогою ДНК-мікрочіпів показав, що експресія 218 генів активується у відповідь на низькотемпературний стрес, гени кодують транскрипційні фактори, передавачі сигналів, переносники іонів і молекул, ферменти, залучені в синтез клітинної стінки і в відповіді на окислювальний стрес. Аналіз транскрипційного контролю двох генів (rd 29 A and cor 15 a), індукованих низькими температурами у A. thaliana, призвів до відкриття холодозалежного цис-елемента CRT / DRE [від англ. (C-repeat) / (dehydration responsive element)], локалізованого в промоторних областях цих генів. Білки сімейства AP 2 -доменних транскрипційних факторів, DREB 1 (від англ. DRE-binding protein) і CBF (від англ. CRT-binding factor), зв'язуються з цис-елементом CRT / DRE і активують транскрипцію
Гени рослин, індуковані низькими температурами У рослинах ідентифіковано велику кількість генів індукованих низькими температурами: гени десатураз, жирних кислот що підтверджує важливу роль десатурації мембранних ліпідів у регуляції плинності мембран та акліматизації рослин до низьких температур. Аналіз експресії 8, 000 генів у Arabidopsis thaliana за допомогою ДНК-мікрочіпів показав, що експресія 218 генів активується у відповідь на низькотемпературний стрес, гени кодують транскрипційні фактори, передавачі сигналів, переносники іонів і молекул, ферменти, залучені в синтез клітинної стінки і в відповіді на окислювальний стрес. Аналіз транскрипційного контролю двох генів (rd 29 A and cor 15 a), індукованих низькими температурами у A. thaliana, призвів до відкриття холодозалежного цис-елемента CRT / DRE [від англ. (C-repeat) / (dehydration responsive element)], локалізованого в промоторних областях цих генів. Білки сімейства AP 2 -доменних транскрипційних факторів, DREB 1 (від англ. DRE-binding protein) і CBF (від англ. CRT-binding factor), зв'язуються з цис-елементом CRT / DRE і активують транскрипцію
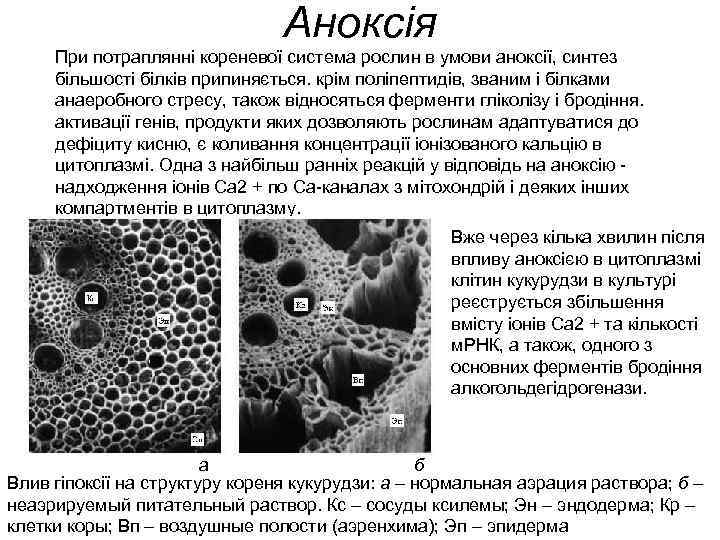 Аноксія При потраплянні кореневої система рослин в умови аноксії, синтез більшості білків припиняється. крім поліпептидів, званим і білками анаеробного стресу, також відносяться ферменти гліколізу і бродіння. активації генів, продукти яких дозволяють рослинам адаптуватися до дефіциту кисню, є коливання концентрації іонізованого кальцію в цитоплазмі. Одна з найбільш ранніх реакцій у відповідь на аноксію - надходження іонів Са 2 + по Са-каналах з мітохондрій і деяких інших компартментів в цитоплазму. Вже через кілька хвилин після впливу аноксією в цитоплазмі клітин кукурудзи в культурі реєструється збільшення вмісту іонів Са 2 + та кількості м. РНК, а також, одного з основних ферментів бродіння алкогольдегідрогенази. а б Влив гіпоксії на структуру кореня кукурудзи: а – нормальная аэрация раствора; б – неаэрируемый питательный раствор. Кс – сосуды ксилемы; Эн – эндодерма; Кр – клетки коры; Вп – воздушные полости (аэренхима); Эп – эпидерма
Аноксія При потраплянні кореневої система рослин в умови аноксії, синтез більшості білків припиняється. крім поліпептидів, званим і білками анаеробного стресу, також відносяться ферменти гліколізу і бродіння. активації генів, продукти яких дозволяють рослинам адаптуватися до дефіциту кисню, є коливання концентрації іонізованого кальцію в цитоплазмі. Одна з найбільш ранніх реакцій у відповідь на аноксію - надходження іонів Са 2 + по Са-каналах з мітохондрій і деяких інших компартментів в цитоплазму. Вже через кілька хвилин після впливу аноксією в цитоплазмі клітин кукурудзи в культурі реєструється збільшення вмісту іонів Са 2 + та кількості м. РНК, а також, одного з основних ферментів бродіння алкогольдегідрогенази. а б Влив гіпоксії на структуру кореня кукурудзи: а – нормальная аэрация раствора; б – неаэрируемый питательный раствор. Кс – сосуды ксилемы; Эн – эндодерма; Кр – клетки коры; Вп – воздушные полости (аэренхима); Эп – эпидерма
 Запуск анаеробної транскрипції у вищих рослинах через гемоглобін Умови аноксии через 1, 5 год призводять до синтезу 15 -20 нових білків анаеробного стресу (білків аноксии). Це головним чином ферменти гліколізу і бродіння. Рецепторами кисневого сигналу в клітині є Fe / S-кластери ЕТЛ мітохондрій або редокс-система в плазмалемі; з'являється всебільше даних про запуск анаеробної транскрипції у вищих рослинах безпосередньо через такий сенсор кисню, як гемоглобін
Запуск анаеробної транскрипції у вищих рослинах через гемоглобін Умови аноксии через 1, 5 год призводять до синтезу 15 -20 нових білків анаеробного стресу (білків аноксии). Це головним чином ферменти гліколізу і бродіння. Рецепторами кисневого сигналу в клітині є Fe / S-кластери ЕТЛ мітохондрій або редокс-система в плазмалемі; з'являється всебільше даних про запуск анаеробної транскрипції у вищих рослинах безпосередньо через такий сенсор кисню, як гемоглобін
 Аклімації рослин до аноксії може бути здійснена слідуючим чином рецептори передають кисневий сигналу елементам сигнальної трансдукції. Відбувається зміна в цитоплазмі концентрації іонів Са 2+ за рахунок його надходження по Са 2+ - канали з клітинної стінки, вакуолей, мітохондрій, ЕПР. Через кілька хвилин після впливу аноксією в цитоплазмі клітин кукурудзи в культурі реєструється збільшення іонів Са 2+ та кількості м. РНК і одного з основних ферментів бродіння - Індукція синтезу аноксичних білків. алкогольдегідрогенази. GBF - G-box binding factor - білкові фактори транскрипції, що відповідають на аноксію; ARE - регуляторні елементи анаеробного відповіді генів (5'-ГТГГ-3 '- ½ G-box)
Аклімації рослин до аноксії може бути здійснена слідуючим чином рецептори передають кисневий сигналу елементам сигнальної трансдукції. Відбувається зміна в цитоплазмі концентрації іонів Са 2+ за рахунок його надходження по Са 2+ - канали з клітинної стінки, вакуолей, мітохондрій, ЕПР. Через кілька хвилин після впливу аноксією в цитоплазмі клітин кукурудзи в культурі реєструється збільшення іонів Са 2+ та кількості м. РНК і одного з основних ферментів бродіння - Індукція синтезу аноксичних білків. алкогольдегідрогенази. GBF - G-box binding factor - білкові фактори транскрипції, що відповідають на аноксію; ARE - регуляторні елементи анаеробного відповіді генів (5'-ГТГГ-3 '- ½ G-box)
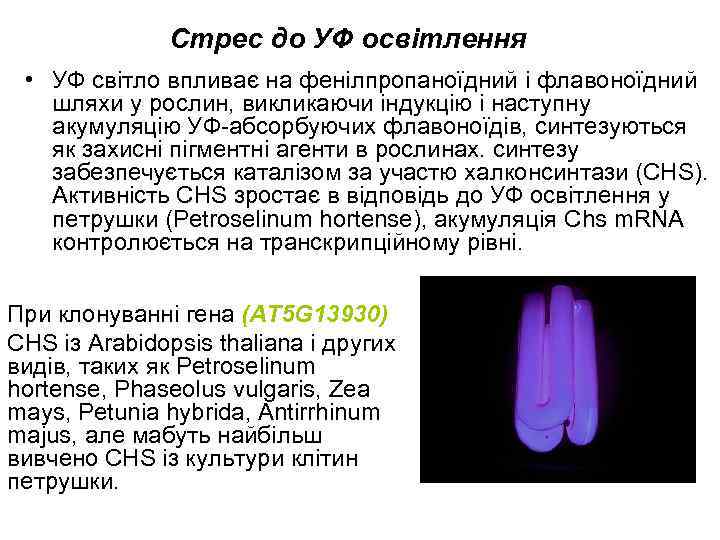 Стрес до УФ освітлення • УФ світло впливає на фенілпропаноїдний і флавоноїдний шляхи у рослин, викликаючи індукцію і наступну акумуляцію УФ-абсорбуючих флавоноїдів, синтезуються як захисні пігментні агенти в рослинах. синтезу забезпечується каталізом за участю халконсинтази (CHS). Активність CHS зростає в відповідь до УФ освітлення у петрушки (Petroselinum hortense), акумуляція Chs m. RNA контролюється на транскрипційному рівні. При клонуванні гена (AT 5 G 13930) CHS із Arabidopsis thaliana і других видів, таких як Petroselinum hortense, Phaseolus vulgaris, Zea mays, Petunia hybrida, Antirrhinum majus, але мабуть найбільш вивчено CHS із культури клітин петрушки.
Стрес до УФ освітлення • УФ світло впливає на фенілпропаноїдний і флавоноїдний шляхи у рослин, викликаючи індукцію і наступну акумуляцію УФ-абсорбуючих флавоноїдів, синтезуються як захисні пігментні агенти в рослинах. синтезу забезпечується каталізом за участю халконсинтази (CHS). Активність CHS зростає в відповідь до УФ освітлення у петрушки (Petroselinum hortense), акумуляція Chs m. RNA контролюється на транскрипційному рівні. При клонуванні гена (AT 5 G 13930) CHS із Arabidopsis thaliana і других видів, таких як Petroselinum hortense, Phaseolus vulgaris, Zea mays, Petunia hybrida, Antirrhinum majus, але мабуть найбільш вивчено CHS із культури клітин петрушки.
 Стрес до УФ освітлення • В першу чергу ефект спектрального складу світла діє на індукцію CHS при опроміненні Arabidopsis thaliana різними довжинами світла білим, голубим, червоним і УФ. У рослин, опромінених білим, голубим або УФ світлом виявлено підвищений рівень Chs m. RNA, тоді як червоне світло мало незначний вплив на концентрацію m. RNA. • Довжина хвилі відіграє роль в індукції експресії 4 флавоноїдних генів, фенілаланін амоній-ліази (Pall), халконсинтази (Chs) халконізомерази (Chi) і дігідрофла-вонол редуктази (Dfr). Вирощені в темноті проростки Arabidopsis thaliana опромінювали УФ-В (310 нм) і голубим світлом. Рівні експресії були вищими при УФ-В дії, ніж при опроміненні голубим світлом • Стресові навантаження призводять часто до виникнення флавоноїдних мутацій. У багатьох рослин ідентифіковані флавоноїдні мутації.
Стрес до УФ освітлення • В першу чергу ефект спектрального складу світла діє на індукцію CHS при опроміненні Arabidopsis thaliana різними довжинами світла білим, голубим, червоним і УФ. У рослин, опромінених білим, голубим або УФ світлом виявлено підвищений рівень Chs m. RNA, тоді як червоне світло мало незначний вплив на концентрацію m. RNA. • Довжина хвилі відіграє роль в індукції експресії 4 флавоноїдних генів, фенілаланін амоній-ліази (Pall), халконсинтази (Chs) халконізомерази (Chi) і дігідрофла-вонол редуктази (Dfr). Вирощені в темноті проростки Arabidopsis thaliana опромінювали УФ-В (310 нм) і голубим світлом. Рівні експресії були вищими при УФ-В дії, ніж при опроміненні голубим світлом • Стресові навантаження призводять часто до виникнення флавоноїдних мутацій. У багатьох рослин ідентифіковані флавоноїдні мутації.
 Синтез протеїнів при гамма-опроміненні рослин Після опромінення відбувається синтез групи низькомолекулярних білків, і що вони не є продуктами розкладу білків з більшою молекулярною масою, про що свідчить їх висока питома радіоактивність. При цьому відбувається значне пошкодження транскрипційно-трансляційної системи, деградація полісомного матеріалу або дефектна зборка полісом внаслідок пошкодження РНК. При опроміненні проростків Pisum sativum в дозі 100 Гр в меристемних клітинах кореня на фоні істотного гальмування включення мітки в майже всі білки спостерігалось інтенсивне включення 35 S-метіоніну в білки з відносною молекулярною масою 70, 82, 99 (100), 104 к. Д, а також в низькомолекулярні білки з молекулярною масою 47 і 50 к. Д. З’явились нові фракції (смуги) — 1524 к. Д. Pisum sativum
Синтез протеїнів при гамма-опроміненні рослин Після опромінення відбувається синтез групи низькомолекулярних білків, і що вони не є продуктами розкладу білків з більшою молекулярною масою, про що свідчить їх висока питома радіоактивність. При цьому відбувається значне пошкодження транскрипційно-трансляційної системи, деградація полісомного матеріалу або дефектна зборка полісом внаслідок пошкодження РНК. При опроміненні проростків Pisum sativum в дозі 100 Гр в меристемних клітинах кореня на фоні істотного гальмування включення мітки в майже всі білки спостерігалось інтенсивне включення 35 S-метіоніну в білки з відносною молекулярною масою 70, 82, 99 (100), 104 к. Д, а також в низькомолекулярні білки з молекулярною масою 47 і 50 к. Д. З’явились нові фракції (смуги) — 1524 к. Д. Pisum sativum
 Відомо, що рання стадія розвитку рослин характеризується проліферативної активністю меристеми кореня і, можливо, що механізм стійкості ДНК пов'язаний саме з активністю меристеми. Це припущення підтверджує підвищена експресія гена Cyc. B 1 в A. Thaliana, Підвищується експресія Сус. В 1 при розривах ДНК що сприяє арешту клітин у фазі G 2 перед переходом в мітоз і, таким чином, блокує проліферацію клітин з ушкодженою ДНК. Активності меристеми свідчить і підвищення експресії іншого маркерного гена, а саме BRCA, необхідний для ефективтивного відновлення подвійних розривів ДНК в процесі, відомому як гомологічна рекомбінація (HR). BRCA 1 здатний розщеплювати γ-тубулін та впливати на нуклеацію мікротрубочок в центрах їх організації, що сприяє росту і проліферації клітин меристеми. Можливо, цим також пояснюється участь BRCA 1 в цитокінезі і клітинної проліферації. Дослідження вперше показали, що після 25 -річного впливу хронічної радіації в природних умовах зони ЧАЕС у проростків A. thaliana на ранних етапах розвитку формується механізм стійкості генома до дії радіації. Механізм стійкості відбувається під час інтенсивної проліферації клітин меристеми і здійснюється за рахунок активації репаративних процесів ДНК. Даний механізм має адаптивне значення і спрямований на збереження цілісності геному рослин і обмеження потенційно шкідливих перебудов в умовах хронічної радіації
Відомо, що рання стадія розвитку рослин характеризується проліферативної активністю меристеми кореня і, можливо, що механізм стійкості ДНК пов'язаний саме з активністю меристеми. Це припущення підтверджує підвищена експресія гена Cyc. B 1 в A. Thaliana, Підвищується експресія Сус. В 1 при розривах ДНК що сприяє арешту клітин у фазі G 2 перед переходом в мітоз і, таким чином, блокує проліферацію клітин з ушкодженою ДНК. Активності меристеми свідчить і підвищення експресії іншого маркерного гена, а саме BRCA, необхідний для ефективтивного відновлення подвійних розривів ДНК в процесі, відомому як гомологічна рекомбінація (HR). BRCA 1 здатний розщеплювати γ-тубулін та впливати на нуклеацію мікротрубочок в центрах їх організації, що сприяє росту і проліферації клітин меристеми. Можливо, цим також пояснюється участь BRCA 1 в цитокінезі і клітинної проліферації. Дослідження вперше показали, що після 25 -річного впливу хронічної радіації в природних умовах зони ЧАЕС у проростків A. thaliana на ранних етапах розвитку формується механізм стійкості генома до дії радіації. Механізм стійкості відбувається під час інтенсивної проліферації клітин меристеми і здійснюється за рахунок активації репаративних процесів ДНК. Даний механізм має адаптивне значення і спрямований на збереження цілісності геному рослин і обмеження потенційно шкідливих перебудов в умовах хронічної радіації
 Гени-регулятори розвитку рослин генами-регуляторами (перемикачами) розвитку детермінують процеси росту та диференціювання, кодують білки транскрипційні фактори, які контролюють формування органів і тканин рослин. Також називають гомеозисними У вищих рослин добре вивчено функціонування двох типів генів-регуляторів розвитку: гомеобоксвмісних і генів з MADS-боксом
Гени-регулятори розвитку рослин генами-регуляторами (перемикачами) розвитку детермінують процеси росту та диференціювання, кодують білки транскрипційні фактори, які контролюють формування органів і тканин рослин. Також називають гомеозисними У вищих рослин добре вивчено функціонування двох типів генів-регуляторів розвитку: гомеобоксвмісних і генів з MADS-боксом
 Гомеобоксвмісні гени • Визначаються за наявності характерної послідовності ДНК близько з 180 пар нуклеотидів (гомеобокса), кодуючого гомеодомен – консервативну ділянку ряду транскрипційних факторів. • Першим клонованим геном рослин, кодуючим гомеодоменвмісний білок, був KNOTTED 1 (KN 1) кукурудзи. • Пізніше було знайдено ціле сімейство генів, подібних KN 1, назване KNOX (KNOTTED 1 -like HOMEOBOX)
Гомеобоксвмісні гени • Визначаються за наявності характерної послідовності ДНК близько з 180 пар нуклеотидів (гомеобокса), кодуючого гомеодомен – консервативну ділянку ряду транскрипційних факторів. • Першим клонованим геном рослин, кодуючим гомеодоменвмісний білок, був KNOTTED 1 (KN 1) кукурудзи. • Пізніше було знайдено ціле сімейство генів, подібних KN 1, назване KNOX (KNOTTED 1 -like HOMEOBOX)
 • • • KNOTTED 1 (KN 1) -як гомеобокс (KNOX) транскрипційні фактори беруть KNOX участь у створенні і підтримці рослин меристем; Однак, кілька прямих цілей KNOX білків були визнані. Використовуючи комбінацію подвійного KNOX мутанта аналізу та біохімії, ми виявили, що в кукурудзі (Zea Mays), KN 1 негативно модулює накопичення гібереліну (GA) через контроль, який кодує фермент, який інактивує GA. Рівень м. РНК підвищений в незрілих листя домінуючих мутантів KNOX і KNOX пригнічується в репродуктивних меристем нульового-алеля Kn 1 -e 1. KN 1 пов'язує в природних умовах на інтрони через цис-регуляторних елементів, що містять два мотиви TGAC. VP 16 -KN 1 активує транскрипцію в рослині з химерного промотора, що містить цей сайт зв'язування. Домени експресії KN 1 м. РНК перекриваються на базі апікальної меристеми пагона і підставою вперше почали листя, що свідчить KN 1 опосередкованої активації підтримує кордон між ідентичності меристеми клітин і швидко подовжуючи клітин зйомки. Сайт зв'язування KN 1 зберігається в генах ga 2 ox 1 різних трав, припускаючи, що місцеві регулювання біологічно активних рівнів GA через KNOX білків в травах.
• • • KNOTTED 1 (KN 1) -як гомеобокс (KNOX) транскрипційні фактори беруть KNOX участь у створенні і підтримці рослин меристем; Однак, кілька прямих цілей KNOX білків були визнані. Використовуючи комбінацію подвійного KNOX мутанта аналізу та біохімії, ми виявили, що в кукурудзі (Zea Mays), KN 1 негативно модулює накопичення гібереліну (GA) через контроль, який кодує фермент, який інактивує GA. Рівень м. РНК підвищений в незрілих листя домінуючих мутантів KNOX і KNOX пригнічується в репродуктивних меристем нульового-алеля Kn 1 -e 1. KN 1 пов'язує в природних умовах на інтрони через цис-регуляторних елементів, що містять два мотиви TGAC. VP 16 -KN 1 активує транскрипцію в рослині з химерного промотора, що містить цей сайт зв'язування. Домени експресії KN 1 м. РНК перекриваються на базі апікальної меристеми пагона і підставою вперше почали листя, що свідчить KN 1 опосередкованої активації підтримує кордон між ідентичності меристеми клітин і швидко подовжуючи клітин зйомки. Сайт зв'язування KN 1 зберігається в генах ga 2 ox 1 різних трав, припускаючи, що місцеві регулювання біологічно активних рівнів GA через KNOX білків в травах.
 Гени, що містять MADS-бокс • Термін «MADS-бокс» утворений бокс» початковими літерами чотирьох генів: MCM 1 дріжджів AG арабідопсиса SRF ссавців DEF левового ротика
Гени, що містять MADS-бокс • Термін «MADS-бокс» утворений бокс» початковими літерами чотирьох генів: MCM 1 дріжджів AG арабідопсиса SRF ссавців DEF левового ротика
 До генів, що містить, МАDS-бокс, відносяться, зокрема, AG (AGAMOUS), DEF (DEFICIENCE), AP 1 (APETALA 1) і AP 3 (APETALA 3), TFL 1 (TERMINAL FLOWER), PI (PISTILLATA). Гени цього типу регулюють флоригенез і визначають долю клітин у сім'ядолі; їх експресія виявлена у зародку, коренях і листках. Члени сімейства генів МАDS-боксвідіграють важливу роль у розвитку квітки з раннього етапу визначення ідентичності квіткових меристем завданням особистість квіткових зачатків органів пізніше у розвитку квітки. Зареєстрованих для Arabidopsis МАDS-бокс генів до 17. Всі 11 членів, заявлених до цього дослідження виражається в кольорах, і більшість з них є квіткові специфічні.
До генів, що містить, МАDS-бокс, відносяться, зокрема, AG (AGAMOUS), DEF (DEFICIENCE), AP 1 (APETALA 1) і AP 3 (APETALA 3), TFL 1 (TERMINAL FLOWER), PI (PISTILLATA). Гени цього типу регулюють флоригенез і визначають долю клітин у сім'ядолі; їх експресія виявлена у зародку, коренях і листках. Члени сімейства генів МАDS-боксвідіграють важливу роль у розвитку квітки з раннього етапу визначення ідентичності квіткових меристем завданням особистість квіткових зачатків органів пізніше у розвитку квітки. Зареєстрованих для Arabidopsis МАDS-бокс генів до 17. Всі 11 членів, заявлених до цього дослідження виражається в кольорах, і більшість з них є квіткові специфічні.
 Два гени, AGL 11 і AGL 13 (AGL для безстатевих-як), переважно виражається в яйцеклітинах, але кожен має яскраво виражений характер експресії. AGL 15 переважно експресується у ембріонів, з настанням на або до стадії октанта на початку розвитку ембріона. AGL 12, AGL 14 і AGL 17 все переважно виражені в тканинах корінні. Філогенетичні аналізи показали, що ці два гени, виражені в яйцеклітин тісно пов'язані з раніше ізольованих генів МАDS-бокс , в той час як чотири гени, що показують без квітковий вираз більш віддалено пов'язаний. Дані з цього і попередніх досліджень показують, що на додаток до їх перевіреної ролі в розвитку квітки, гени МАDS-бокс , швидше за все, відіграють роль у багатьох інших аспектах розвитку рослин.
Два гени, AGL 11 і AGL 13 (AGL для безстатевих-як), переважно виражається в яйцеклітинах, але кожен має яскраво виражений характер експресії. AGL 15 переважно експресується у ембріонів, з настанням на або до стадії октанта на початку розвитку ембріона. AGL 12, AGL 14 і AGL 17 все переважно виражені в тканинах корінні. Філогенетичні аналізи показали, що ці два гени, виражені в яйцеклітин тісно пов'язані з раніше ізольованих генів МАDS-бокс , в той час як чотири гени, що показують без квітковий вираз більш віддалено пов'язаний. Дані з цього і попередніх досліджень показують, що на додаток до їх перевіреної ролі в розвитку квітки, гени МАDS-бокс , швидше за все, відіграють роль у багатьох інших аспектах розвитку рослин.
 MADS- білки здатні формувати гетеродимери, які розрізняються по здатності зв'язуватися з ДНК і по активності транскрипції. Більш ніж у половини MADS- білків є К-домен (keratin - like), який забезпечує білок-білкові взаємодії і можливість для димеризації. MADS- білки регулюють формування квітів і плодів, беруть участь у регуляції розвитку кореня і насіння, деякі з них здатні контролювати гомеозисні процеси.
MADS- білки здатні формувати гетеродимери, які розрізняються по здатності зв'язуватися з ДНК і по активності транскрипції. Більш ніж у половини MADS- білків є К-домен (keratin - like), який забезпечує білок-білкові взаємодії і можливість для димеризації. MADS- білки регулюють формування квітів і плодів, беруть участь у регуляції розвитку кореня і насіння, деякі з них здатні контролювати гомеозисні процеси.
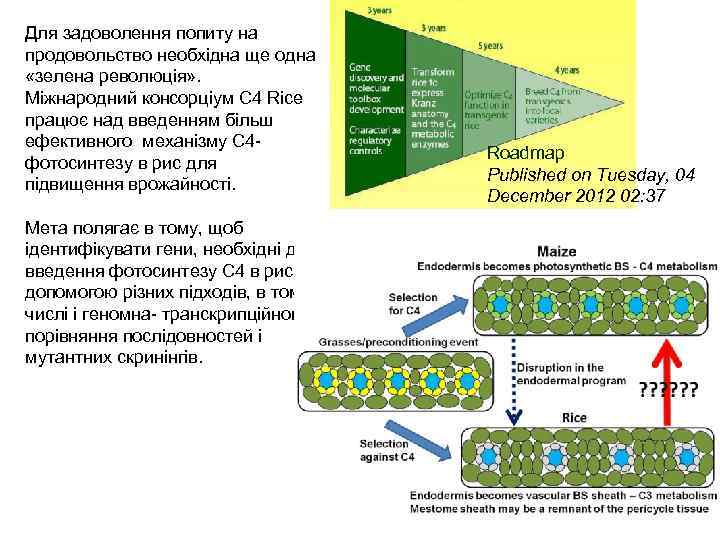 Для задоволення попиту на продовольство необхідна ще одна «зелена революція» . Міжнародний консорціум C 4 Rice працює над введенням більш ефективного механізму C 4 фотосинтезу в рис для підвищення врожайності. Мета полягає в тому, щоб ідентифікувати гени, необхідні для введення фотосинтезу С 4 в рис за допомогою різних підходів, в тому числі і геномна- транскрипційного порівняння послідовностей і мутантних скринінгів. Roadmap Published on Tuesday, 04 December 2012 02: 37
Для задоволення попиту на продовольство необхідна ще одна «зелена революція» . Міжнародний консорціум C 4 Rice працює над введенням більш ефективного механізму C 4 фотосинтезу в рис для підвищення врожайності. Мета полягає в тому, щоб ідентифікувати гени, необхідні для введення фотосинтезу С 4 в рис за допомогою різних підходів, в тому числі і геномна- транскрипційного порівняння послідовностей і мутантних скринінгів. Roadmap Published on Tuesday, 04 December 2012 02: 37
 Норман Борлоуг американський агроном, фахівець із патології рослин. Відомий, як батько Зеленої революції . • Суть «зеленої революції» полягала у виведенні нових високопродуктивних і загартованих сортів пшениці (потім і рису), які дозволяли вже в перший рік домогтися подвоєння її врожаю. Шість латиноамериканських, вісім близькосхідних і дві азійські країни одержали вигоду від застосування програми Борлоуга. • Лауреат Нобелевської премії миру 1970 року за його внесок у рішення продовольчої проблеми. Завдяки зеленій революції виробництво їжі у всьому світі збільшилося удвічі з 1960 по 1990 роки. У Пакистані і Індії, двох країнах, де інновації землеробства упроваджувалися масштабніше за інших, урожай зерна збільшився в чотири рази за аналогічний період.
Норман Борлоуг американський агроном, фахівець із патології рослин. Відомий, як батько Зеленої революції . • Суть «зеленої революції» полягала у виведенні нових високопродуктивних і загартованих сортів пшениці (потім і рису), які дозволяли вже в перший рік домогтися подвоєння її врожаю. Шість латиноамериканських, вісім близькосхідних і дві азійські країни одержали вигоду від застосування програми Борлоуга. • Лауреат Нобелевської премії миру 1970 року за його внесок у рішення продовольчої проблеми. Завдяки зеленій революції виробництво їжі у всьому світі збільшилося удвічі з 1960 по 1990 роки. У Пакистані і Індії, двох країнах, де інновації землеробства упроваджувалися масштабніше за інших, урожай зерна збільшився в чотири рази за аналогічний період.
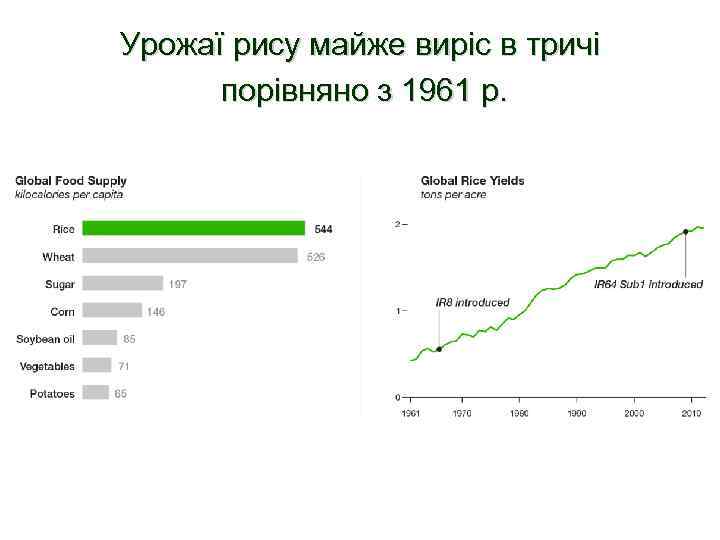 Урожаї рису майже виріс в тричі порівняно з 1961 р.
Урожаї рису майже виріс в тричі порівняно з 1961 р.
 The Development of C 4 Rice: Current Progress and Future Challenges • Невеликий розмір клітин, поєднаних з хлоропластами оболонки, забезпечує велику провідність мезофілу. Крім цього, рис має більший стромальний вміст CO 2, нижчу точку компенсації по CO 2 при теплій температурі і меншу чутливість фотосинтезу до кисню ніж трави помірного клімату. Довжина пучків в листі, товщина мезофілу і міжклітинних просторів є проміжними порівняно з більшістю C 3 і C 4 трав, що дозволяє сподиватися на те, що введення Kranz анатомії в клітинах рису може не вимагати радикальних змін в анатомії листа, проте глибоко розсічені клітини хлоренхіми є певною проблемою в інженерії С 4 фотосинтезу в рисі.
The Development of C 4 Rice: Current Progress and Future Challenges • Невеликий розмір клітин, поєднаних з хлоропластами оболонки, забезпечує велику провідність мезофілу. Крім цього, рис має більший стромальний вміст CO 2, нижчу точку компенсації по CO 2 при теплій температурі і меншу чутливість фотосинтезу до кисню ніж трави помірного клімату. Довжина пучків в листі, товщина мезофілу і міжклітинних просторів є проміжними порівняно з більшістю C 3 і C 4 трав, що дозволяє сподиватися на те, що введення Kranz анатомії в клітинах рису може не вимагати радикальних змін в анатомії листа, проте глибоко розсічені клітини хлоренхіми є певною проблемою в інженерії С 4 фотосинтезу в рисі.
 Гени стійкості рослин проти патогенів Гени які кодують НС-токсинредуктаз • гени Hm 1 и Нт2 кукурузы, стійкість до гриба Cochliobolus carbonum, • Гени RPP 5, RPP 1 -Ws. A, -Ws. B. –Ws. C Arabidopsis проти гриба Peronospora parasitica • Gpa 2/Rxl в картоплі проти нематоди Globodera pallida, вирус картофеля Х. • Hs 1 pro- в буряка проти нематоди Heterodera schachtii • Xa-2 в рисі проти бактерії Xanthomonas oryzae pv. oryzae
Гени стійкості рослин проти патогенів Гени які кодують НС-токсинредуктаз • гени Hm 1 и Нт2 кукурузы, стійкість до гриба Cochliobolus carbonum, • Гени RPP 5, RPP 1 -Ws. A, -Ws. B. –Ws. C Arabidopsis проти гриба Peronospora parasitica • Gpa 2/Rxl в картоплі проти нематоди Globodera pallida, вирус картофеля Х. • Hs 1 pro- в буряка проти нематоди Heterodera schachtii • Xa-2 в рисі проти бактерії Xanthomonas oryzae pv. oryzae
 Гени стійкості, що кодують білки з сайтом зв'язування нуклеотидів і регіоном збагачених лейцином повторів (NBS-LRR) ген RPMI Arabidopsis забезпечує стійкість до штамів P. syringae pv. maculicola, гена Mi-1. 2 томату стійкість до галової нематоди Meloidogyne incognita и картопляної тлі Macrosiphum euphorbiae, ген картоплі Сра 2, стійкість до ізолянтам цистової картопляної нематоди Globodera pallida
Гени стійкості, що кодують білки з сайтом зв'язування нуклеотидів і регіоном збагачених лейцином повторів (NBS-LRR) ген RPMI Arabidopsis забезпечує стійкість до штамів P. syringae pv. maculicola, гена Mi-1. 2 томату стійкість до галової нематоди Meloidogyne incognita и картопляної тлі Macrosiphum euphorbiae, ген картоплі Сра 2, стійкість до ізолянтам цистової картопляної нематоди Globodera pallida
 Гени стійкості, що кодують внутрішньоклітинні серин / треонінспеціфічні протеінкінази ген Pto томата, який обумовлює стійкість до штамів фітоопатогенної бактерії Pseudomonas syringae pv. tomato, експресуючих ген avr. Pto, ген Pto кодує серин / треонінспеціфічну протеінкіназу, здатну до автофосфорилюванню. Нещодавно був клонований ще один ген цього класу, Lhir. Pto, з дикого виду томату Lycopersicon hirsutum var. glabratum, який також обумовлює avr. Ptoзалежну стійкість до Pseudomonas syringae pv. tomato. Цей ген має 97% -ву гомологію з Pto.
Гени стійкості, що кодують внутрішньоклітинні серин / треонінспеціфічні протеінкінази ген Pto томата, який обумовлює стійкість до штамів фітоопатогенної бактерії Pseudomonas syringae pv. tomato, експресуючих ген avr. Pto, ген Pto кодує серин / треонінспеціфічну протеінкіназу, здатну до автофосфорилюванню. Нещодавно був клонований ще один ген цього класу, Lhir. Pto, з дикого виду томату Lycopersicon hirsutum var. glabratum, який також обумовлює avr. Ptoзалежну стійкість до Pseudomonas syringae pv. tomato. Цей ген має 97% -ву гомологію з Pto.
 Гени стійкості, що кодують білки з суперспіральним і трансмембранним доменами (СС-ТМ) локус RPW 8 Arabidopsis, широкий спектр стійкості до борошнистої роси (збудники Erysiphe cichoracearum, E. cruciferarum, E. orontii і Oidium lycopersici). Цей локус містить два домінантивих гена, RPW 8. 1 і RPW 8. 2, що мають 50% -ву ідентичність амінокислот. Кожен з них має широкий спектр стійкості і кодує невеликий, заякоренних в мембрані білок з передбачуваними суперспіральним і трансмембранним доменами.
Гени стійкості, що кодують білки з суперспіральним і трансмембранним доменами (СС-ТМ) локус RPW 8 Arabidopsis, широкий спектр стійкості до борошнистої роси (збудники Erysiphe cichoracearum, E. cruciferarum, E. orontii і Oidium lycopersici). Цей локус містить два домінантивих гена, RPW 8. 1 і RPW 8. 2, що мають 50% -ву ідентичність амінокислот. Кожен з них має широкий спектр стійкості і кодує невеликий, заякоренних в мембрані білок з передбачуваними суперспіральним і трансмембранним доменами.
 Ген буряка Hs 1 pro-1 ген Hs 1 pro-1 обумовлює стійкість буряка до цистової нематоди Heterodera schachtii. Як вважали спочатку, цей ген кодує білок з трансмембранним доменом і позаклітинним регіоном, що включає збагачення лейцином повтори, хоча і дуже звичайні за складом амінокислот. Однак подальший аналіз поставив під сумнів такий висновок, і цей ген пропонується розглядати як перший член нового класу генів R, що кодує цито- плазматичні білки
Ген буряка Hs 1 pro-1 ген Hs 1 pro-1 обумовлює стійкість буряка до цистової нематоди Heterodera schachtii. Як вважали спочатку, цей ген кодує білок з трансмембранним доменом і позаклітинним регіоном, що включає збагачення лейцином повтори, хоча і дуже звичайні за складом амінокислот. Однак подальший аналіз поставив під сумнів такий висновок, і цей ген пропонується розглядати як перший член нового класу генів R, що кодує цито- плазматичні білки
 Гени стійкості, що кодують білки з збагачених лейцином повторів і трансмембранним доменом (LRR-ТМ) До цього класу належать гени томату Сf, зумовлюють стійкість до фітопатогеному грибу Cladosporium fulvum. Всі гени Сf огранзовуються в два незв'язаних мультигенних локусах, Сf-4 / Сf-9 і Сf-2 / Сf-5. Кодуються білки містять поза клітинних збагачених лейцином повторів зі середньою довжиною 24 амінокислоти, які виявивляють гарне відповідність вне цитоплазматичене LRR -консенсусу, і трансмембранному домені.
Гени стійкості, що кодують білки з збагачених лейцином повторів і трансмембранним доменом (LRR-ТМ) До цього класу належать гени томату Сf, зумовлюють стійкість до фітопатогеному грибу Cladosporium fulvum. Всі гени Сf огранзовуються в два незв'язаних мультигенних локусах, Сf-4 / Сf-9 і Сf-2 / Сf-5. Кодуються білки містять поза клітинних збагачених лейцином повторів зі середньою довжиною 24 амінокислоти, які виявивляють гарне відповідність вне цитоплазматичене LRR -консенсусу, і трансмембранному домені.
 Гени стійкості, що кодують білки з збагачених лейцином повторів, трансмембранним і протеінкіназними доменами (LRR-TM-PK) Єдиним відомим геном стійкості в цьому класі є ген рису Ха 21, що обумовлює стійкість до штамів бактерії Xanthomonas oryzae pv. oryzae. Ха 21 кодує білок, що має не цитоплазматичні LRR, трансмембранний регіон і внутрішньоклітинні домен серин / треонінспеціфіченою протеїнкінази, Ха 21 є членом мультигенних родин, до складу якого входить ще один функциональний ген стійкості, Xa 21 D. На відміну від гена Ха 21 ген Ха 21 D обумовлює тільки частково стійкість до Xanthomonas oryzae pv. oryzae. в результаті цей ген кодує усічений білок, має сигнальний пептид і домен LRR, але лишенний трансмембранного і кіназного домену.
Гени стійкості, що кодують білки з збагачених лейцином повторів, трансмембранним і протеінкіназними доменами (LRR-TM-PK) Єдиним відомим геном стійкості в цьому класі є ген рису Ха 21, що обумовлює стійкість до штамів бактерії Xanthomonas oryzae pv. oryzae. Ха 21 кодує білок, що має не цитоплазматичні LRR, трансмембранний регіон і внутрішньоклітинні домен серин / треонінспеціфіченою протеїнкінази, Ха 21 є членом мультигенних родин, до складу якого входить ще один функциональний ген стійкості, Xa 21 D. На відміну від гена Ха 21 ген Ха 21 D обумовлює тільки частково стійкість до Xanthomonas oryzae pv. oryzae. в результаті цей ген кодує усічений білок, має сигнальний пептид і домен LRR, але лишенний трансмембранного і кіназного домену.
 Гімалайська стійкість для сільськогосподарських рослин Учені почали роботу над проектом, що здійснюється спільно з індійським Інститутом біоресурсних технологій у західних Гімалаях. Індійські вчені виявили у рослини Рotentilla гени, що відповідають за стійкість до посухи. Цей спадковий матеріал уже було перенесено лабораторній рослині Arabidopsis Thaliana. На теперішньому етапі досліджень ретельно аналізують процес росту генетично змінених рослин. Вони мають намір у подальшому застосовувати результати досліджень на практиці – у процесі вирощування бавовни та рапсу. «Посуха призводить до різкого скорочення врожаю. Глобальні зміни клімату ще більше ускладнять ситуацію. Наша мета – зробити рослини більш стійкими до стресових умов» Рotentilla fruticosa
Гімалайська стійкість для сільськогосподарських рослин Учені почали роботу над проектом, що здійснюється спільно з індійським Інститутом біоресурсних технологій у західних Гімалаях. Індійські вчені виявили у рослини Рotentilla гени, що відповідають за стійкість до посухи. Цей спадковий матеріал уже було перенесено лабораторній рослині Arabidopsis Thaliana. На теперішньому етапі досліджень ретельно аналізують процес росту генетично змінених рослин. Вони мають намір у подальшому застосовувати результати досліджень на практиці – у процесі вирощування бавовни та рапсу. «Посуха призводить до різкого скорочення врожаю. Глобальні зміни клімату ще більше ускладнять ситуацію. Наша мета – зробити рослини більш стійкими до стресових умов» Рotentilla fruticosa



