Лекция 1 ВВЕДЕНИЕ,СТРОЕНИЕ АТОМОВ.ppt
- Количество слайдов: 22
 Казанский государственный архитектурно строительный университет преподаватель доцент, канд. хим. наук Николай Семёнович Громаков дисциплина Химия Литература 1) Н. В. Коровин Общая химия: Учеб. для технических направ. и спец. вузов. – М. : Высш. шк. , 1998. – 559 с. , ил. 2) Глинка Н. Л. Задачи и упражнения по общей химии. «Химия» 1982 г. http: //www. kgasu. ru/sved/structure/stf/kh/
Казанский государственный архитектурно строительный университет преподаватель доцент, канд. хим. наук Николай Семёнович Громаков дисциплина Химия Литература 1) Н. В. Коровин Общая химия: Учеб. для технических направ. и спец. вузов. – М. : Высш. шк. , 1998. – 559 с. , ил. 2) Глинка Н. Л. Задачи и упражнения по общей химии. «Химия» 1982 г. http: //www. kgasu. ru/sved/structure/stf/kh/
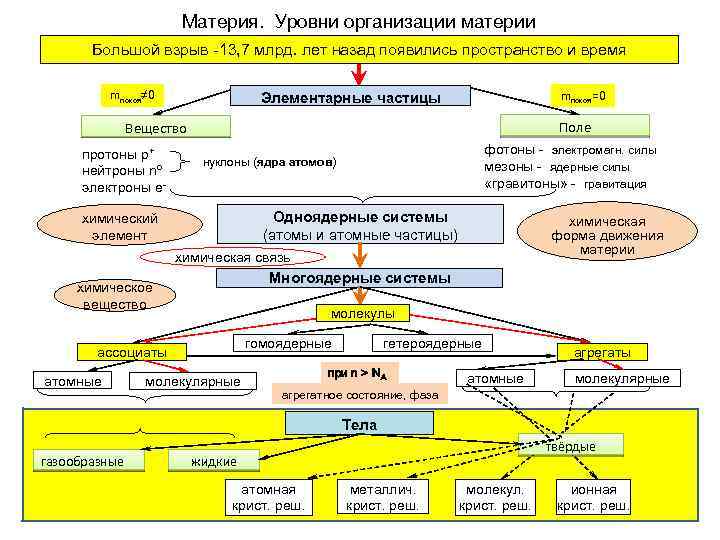 Материя. Уровни организации материи Большой взрыв 13, 7 млрд. лет назад появились пространство и время mпокоя≠ 0 mпокоя=0 Элементарные частицы Поле Вещество протоны р+ нейтроны nº электроны е фотоны электромагн. силы мезоны ядерные силы «гравитоны» гравитация нуклоны (ядра атомов) Одноядерные системы (атомы и атомные частицы) химический элемент химическая форма движения материи химическая связь Многоядерные системы химическое вещество молекулы атомные гетероядерные гомоядерные ассоциаты молекулярные при n > NА атомные агрегаты молекулярные агрегатное состояние, фаза Тела газообразные твёрдые жидкие атомная крист. реш. металлич. крист. реш. молекул. крист. реш. ионная крист. реш.
Материя. Уровни организации материи Большой взрыв 13, 7 млрд. лет назад появились пространство и время mпокоя≠ 0 mпокоя=0 Элементарные частицы Поле Вещество протоны р+ нейтроны nº электроны е фотоны электромагн. силы мезоны ядерные силы «гравитоны» гравитация нуклоны (ядра атомов) Одноядерные системы (атомы и атомные частицы) химический элемент химическая форма движения материи химическая связь Многоядерные системы химическое вещество молекулы атомные гетероядерные гомоядерные ассоциаты молекулярные при n > NА атомные агрегаты молекулярные агрегатное состояние, фаза Тела газообразные твёрдые жидкие атомная крист. реш. металлич. крист. реш. молекул. крист. реш. ионная крист. реш.

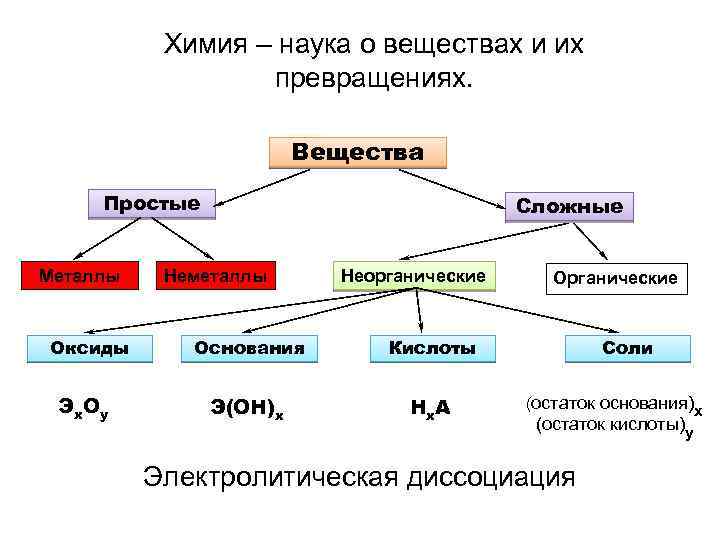 Химия – наука о веществах и их превращениях. Вещества Простые Металлы Оксиды Эх. Оу Сложные Неметаллы Неорганические Основания Кислоты Э(ОН)х Нх. А Органические Соли (остаток основания)х (остаток кислоты)у Электролитическая диссоциация
Химия – наука о веществах и их превращениях. Вещества Простые Металлы Оксиды Эх. Оу Сложные Неметаллы Неорганические Основания Кислоты Э(ОН)х Нх. А Органические Соли (остаток основания)х (остаток кислоты)у Электролитическая диссоциация
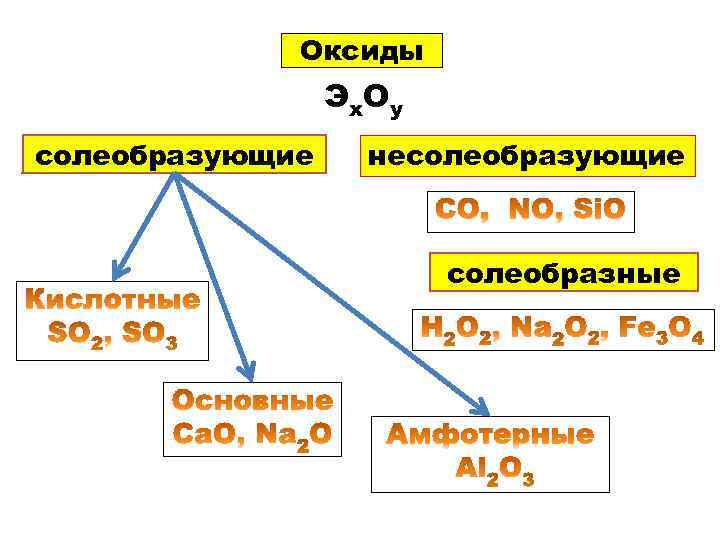 Оксиды Э х Оу солеобразующие несолеобразующие солеобразные
Оксиды Э х Оу солеобразующие несолеобразующие солеобразные
![Основания Э(ОН)х ОН‾ + [Э(ОН)х 1]+ Кислоты Н х. А Н+ + [Нх 1 Основания Э(ОН)х ОН‾ + [Э(ОН)х 1]+ Кислоты Н х. А Н+ + [Нх 1](https://present5.com/presentation/194078607_451265254/image-6.jpg) Основания Э(ОН)х ОН‾ + [Э(ОН)х 1]+ Кислоты Н х. А Н+ + [Нх 1 А] ‾ остаток основания ü сильные растворимые – щелочи; остаток кислоты ü бескислородные (НСl, Н 2 S и др. ) ü слабые; ü кислородсодержащие ü амфотерные (НСl. О 2, Н 2 SО 4 Н 3 РО 4 и др. ) реакция нейтрализации Н+ + ОН‾ = Н 2 О кислота + основание = соль + вода
Основания Э(ОН)х ОН‾ + [Э(ОН)х 1]+ Кислоты Н х. А Н+ + [Нх 1 А] ‾ остаток основания ü сильные растворимые – щелочи; остаток кислоты ü бескислородные (НСl, Н 2 S и др. ) ü слабые; ü кислородсодержащие ü амфотерные (НСl. О 2, Н 2 SО 4 Н 3 РО 4 и др. ) реакция нейтрализации Н+ + ОН‾ = Н 2 О кислота + основание = соль + вода
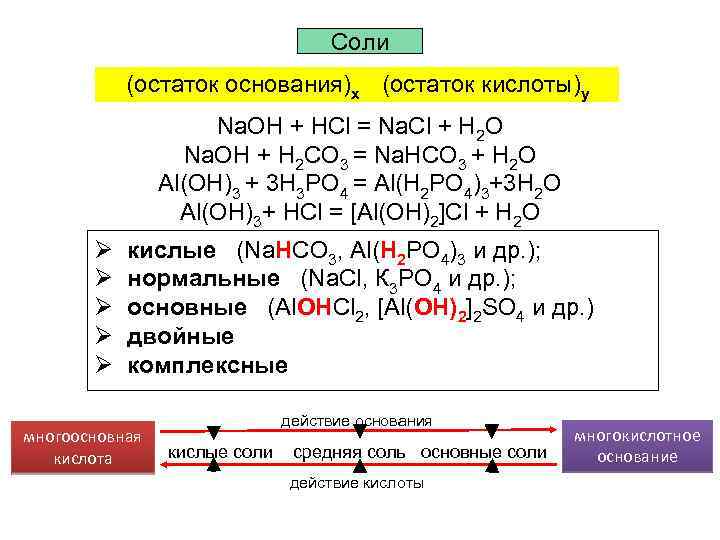 Соли (остаток основания)х (остаток кислоты)у Na. OH + HCl = Na. Cl + H 2 O Na. OH + H 2 CO 3 = Na. HCO 3 + H 2 O Al(OH)3 + 3 Н 3 РО 4 = Al(H 2 PO 4)3+3 Н 2 О Al(OH)3+ HCl = [Al(ОН)2]Cl + H 2 O Ø Ø Ø кислые (Na. HCO 3, Al(H 2 PO 4)3 и др. ); нормальные (Na. Cl, К 3 РО 4 и др. ); основные (Al. ОНСl 2, [Al(ОН)2]2 SO 4 и др. ) двойные комплексные многоосновная кислота действие основания кислые соли средняя соль основные соли действие кислоты многокислотное основание
Соли (остаток основания)х (остаток кислоты)у Na. OH + HCl = Na. Cl + H 2 O Na. OH + H 2 CO 3 = Na. HCO 3 + H 2 O Al(OH)3 + 3 Н 3 РО 4 = Al(H 2 PO 4)3+3 Н 2 О Al(OH)3+ HCl = [Al(ОН)2]Cl + H 2 O Ø Ø Ø кислые (Na. HCO 3, Al(H 2 PO 4)3 и др. ); нормальные (Na. Cl, К 3 РО 4 и др. ); основные (Al. ОНСl 2, [Al(ОН)2]2 SO 4 и др. ) двойные комплексные многоосновная кислота действие основания кислые соли средняя соль основные соли действие кислоты многокислотное основание
 Строение атомов Квантовая теория Уравнение Шредингера Квантовые числа
Строение атомов Квантовая теория Уравнение Шредингера Квантовые числа
 1900 г. М. Планк, квантовая теория света. Квант энергии Е = hν. Постоянная Планка h = 6, 625· 10 34 Дж·с. 1905 г. А. Эйнштейн. Корпускулярно- волновая природа света, фотоны. Е = mc 2. ü Объединённое ур ние Планка Эйнштейна h т. к. ν = с/λ, то ν = mc 2, λ = h/(mc). 1924 г. Де Бройль для электрона λ = h/(mv). Электрон – это и корпускула и волна. Принцип неопределённостей Гейзенберга (1927) Δx·Δpx ≥ ħ или Δх·Δv ≥ h/2πmе – у атома нет чётких границ, электронное облако. Атомная орбиталь (АО) – граничная поверхность, внутри которой вероятность нахождения электрона составляет не менее 90 95%.
1900 г. М. Планк, квантовая теория света. Квант энергии Е = hν. Постоянная Планка h = 6, 625· 10 34 Дж·с. 1905 г. А. Эйнштейн. Корпускулярно- волновая природа света, фотоны. Е = mc 2. ü Объединённое ур ние Планка Эйнштейна h т. к. ν = с/λ, то ν = mc 2, λ = h/(mc). 1924 г. Де Бройль для электрона λ = h/(mv). Электрон – это и корпускула и волна. Принцип неопределённостей Гейзенберга (1927) Δx·Δpx ≥ ħ или Δх·Δv ≥ h/2πmе – у атома нет чётких границ, электронное облако. Атомная орбиталь (АО) – граничная поверхность, внутри которой вероятность нахождения электрона составляет не менее 90 95%.
 Уравнение Шредингера: Ĥψ = ψ (энергия – это у электрона всё). Волновая функция Ψ характеризует амплитуду электронной волны, а её квадрат Ψ 2 – плотность вероятности нахождения электрона в определённой области пространства.
Уравнение Шредингера: Ĥψ = ψ (энергия – это у электрона всё). Волновая функция Ψ характеризует амплитуду электронной волны, а её квадрат Ψ 2 – плотность вероятности нахождения электрона в определённой области пространства.
 КВАНТОВЫЕ ЧИСЛА Волновая функция ψ – это функция четырёх квантовых чисел (n, ℓ, ms). ψ(n, ℓ, ms) = ψ(x, y, z, t) – главное квантовое число, – побочное (орбитальное) квантовое число, – магнитное (азимутальное) квантовое число, – магнитное спиновое квантовое число.
КВАНТОВЫЕ ЧИСЛА Волновая функция ψ – это функция четырёх квантовых чисел (n, ℓ, ms). ψ(n, ℓ, ms) = ψ(x, y, z, t) – главное квантовое число, – побочное (орбитальное) квантовое число, – магнитное (азимутальное) квантовое число, – магнитное спиновое квантовое число.
 Главное квантовое число n определяет энергию электрона и может принимать только целочисленные значения: 1, 2, 3. . . и т. д. Каждому значению n соответствует определённый уровень энергии электрона: Е 1 < Е 2 < Е 3<. . . и т. д. Обычно представляется в виде: 1 К 2 3 4 L М N
Главное квантовое число n определяет энергию электрона и может принимать только целочисленные значения: 1, 2, 3. . . и т. д. Каждому значению n соответствует определённый уровень энергии электрона: Е 1 < Е 2 < Е 3<. . . и т. д. Обычно представляется в виде: 1 К 2 3 4 L М N
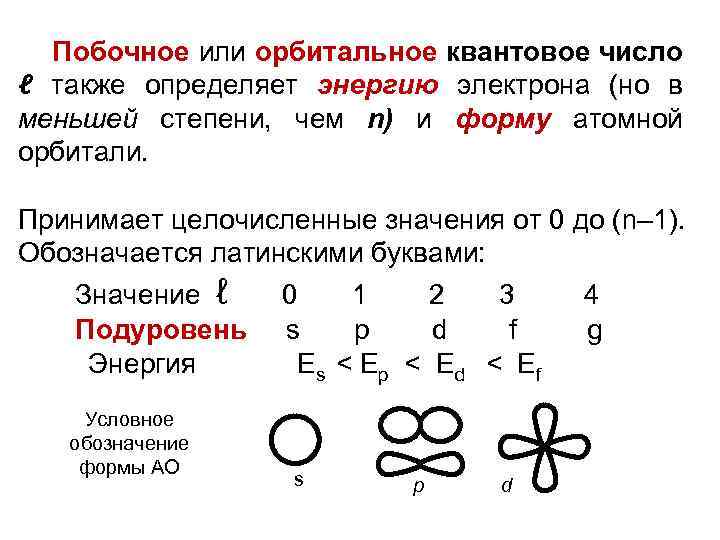 Побочное или орбитальное квантовое число ℓ также определяет энергию электрона (но в меньшей степени, чем n) и форму атомной орбитали. Принимает целочисленные значения от 0 до (n– 1). Обозначается латинскими буквами: Значение ℓ 0 1 2 3 4 Подуровень s р d f g Энергия Еs < Е р < Е d < Е f Условное обозначение формы АО s р d
Побочное или орбитальное квантовое число ℓ также определяет энергию электрона (но в меньшей степени, чем n) и форму атомной орбитали. Принимает целочисленные значения от 0 до (n– 1). Обозначается латинскими буквами: Значение ℓ 0 1 2 3 4 Подуровень s р d f g Энергия Еs < Е р < Е d < Е f Условное обозначение формы АО s р d
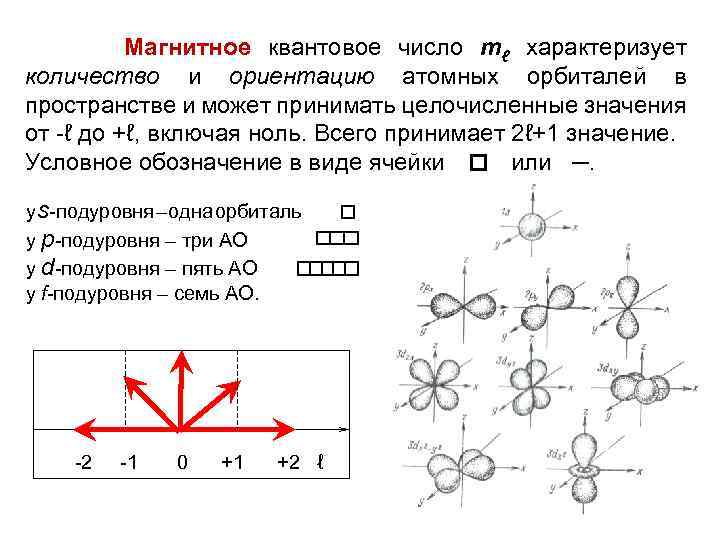 Магнитное квантовое число mℓ характеризует количество и ориентацию атомных орбиталей в пространстве и может принимать целочисленные значения от ℓ до +ℓ, включая ноль. Всего принимает 2ℓ+1 значение. Условное обозначение в виде ячейки или ─. у s подуровня – одна орбиталь у р подуровня – три АО у d подуровня – пять АО у f подуровня – семь АО. 2 1 0 +1 +2 ℓ
Магнитное квантовое число mℓ характеризует количество и ориентацию атомных орбиталей в пространстве и может принимать целочисленные значения от ℓ до +ℓ, включая ноль. Всего принимает 2ℓ+1 значение. Условное обозначение в виде ячейки или ─. у s подуровня – одна орбиталь у р подуровня – три АО у d подуровня – пять АО у f подуровня – семь АО. 2 1 0 +1 +2 ℓ
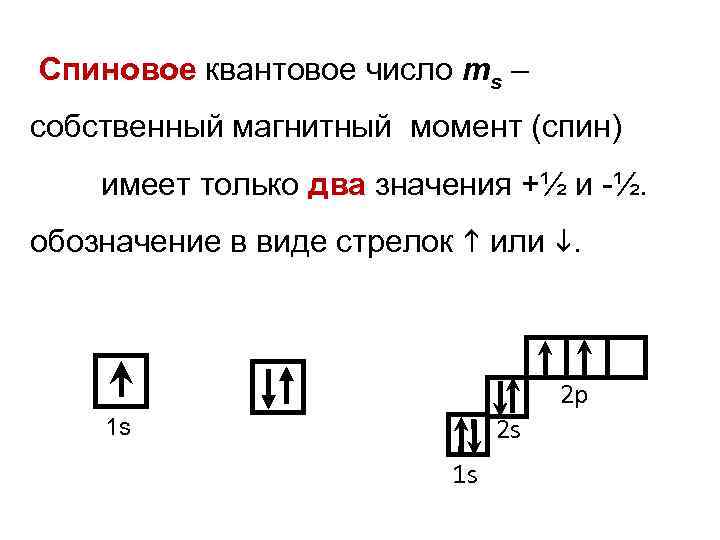 Спиновое квантовое число ms – собственный магнитный момент (спин) имеет только два значения +½ и ½. обозначение в виде стрелок или . 2 р 2 s 1 s 1 s
Спиновое квантовое число ms – собственный магнитный момент (спин) имеет только два значения +½ и ½. обозначение в виде стрелок или . 2 р 2 s 1 s 1 s
 ПРАВИЛА ЗАПОЛНЕНИЯ АО И ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ ØПринцип минимума энергии 1 s<2 s<2 р<3 s<3 р<4 s≈3 d<4 р<5 s≈4 d<5 р<6 s≈5 d≈4 f<6 р<7 s ØПринцип Паули ØПравило Гунда ØПравила Клечковского 2 s 1 s 2 р 3 s 3 р 4 s 3 d Различают электронные (сокращённые) и электронно-графические (полные) формулы атомов. Электронная формула атома водорода: Н 1 s 1 1 и электронно графическая 1 Н 1 s
ПРАВИЛА ЗАПОЛНЕНИЯ АО И ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ ØПринцип минимума энергии 1 s<2 s<2 р<3 s<3 р<4 s≈3 d<4 р<5 s≈4 d<5 р<6 s≈5 d≈4 f<6 р<7 s ØПринцип Паули ØПравило Гунда ØПравила Клечковского 2 s 1 s 2 р 3 s 3 р 4 s 3 d Различают электронные (сокращённые) и электронно-графические (полные) формулы атомов. Электронная формула атома водорода: Н 1 s 1 1 и электронно графическая 1 Н 1 s
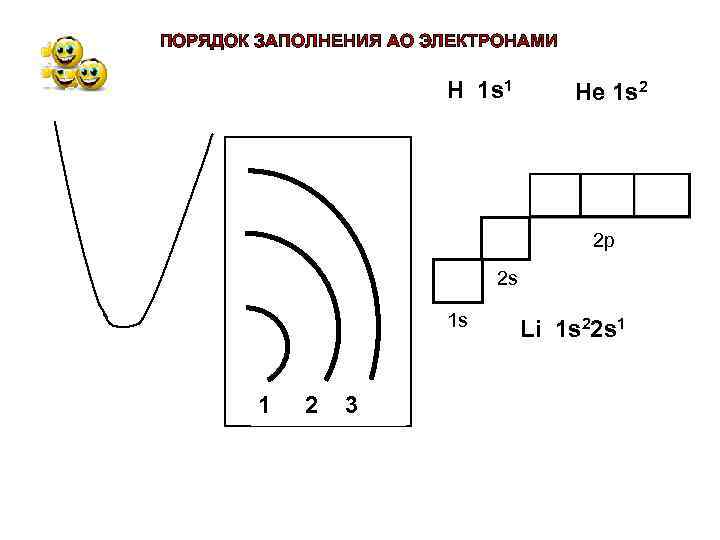 ПОРЯДОК ЗАПОЛНЕНИЯ АО ЭЛЕКТРОНАМИ Н 1 s 1 Не 1 s 2 2 р 2 s 1 s 1 2 3 Li 1 s 22 s 1
ПОРЯДОК ЗАПОЛНЕНИЯ АО ЭЛЕКТРОНАМИ Н 1 s 1 Не 1 s 2 2 р 2 s 1 s 1 2 3 Li 1 s 22 s 1
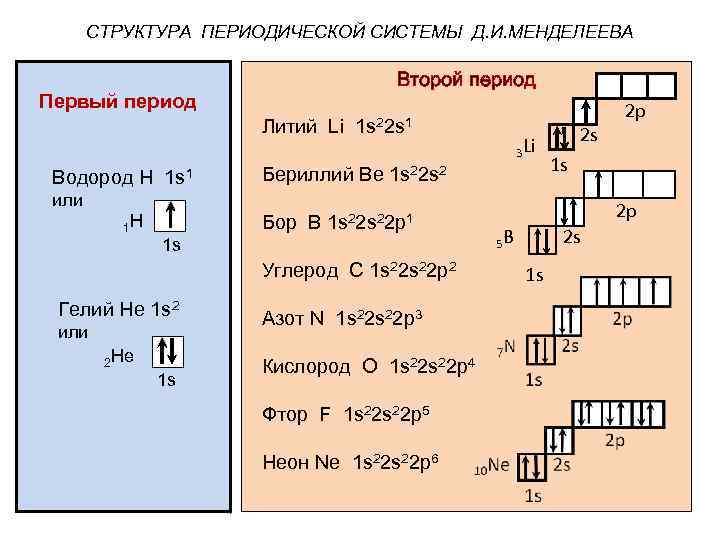 СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д. И. МЕНДЕЛЕЕВА Второй период Первый период Литий Li Водород Н 1 s 1 1 s 22 s 1 3 Li Бериллий Ве 1 s 22 s 2 2 s 1 s или 1 Н Бор В 1 s 22 р1 1 s Углерод С 1 s 22 р2 Гелий Не 1 s 2 или 2 Не 1 s Азот N 1 s 22 р3 Кислород О 1 s 22 р4 Фтор F 1 s 22 р5 Неон Nе 1 s 22 р6 2 р 2 р 2 s 5 В 1 s
СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д. И. МЕНДЕЛЕЕВА Второй период Первый период Литий Li Водород Н 1 s 1 1 s 22 s 1 3 Li Бериллий Ве 1 s 22 s 2 2 s 1 s или 1 Н Бор В 1 s 22 р1 1 s Углерод С 1 s 22 р2 Гелий Не 1 s 2 или 2 Не 1 s Азот N 1 s 22 р3 Кислород О 1 s 22 р4 Фтор F 1 s 22 р5 Неон Nе 1 s 22 р6 2 р 2 р 2 s 5 В 1 s
 Важнейшие периодические свойства атома: 1. атомный и ионный радиусы (r); 2. энергия ионизации, (Еи); 3. сродство к электрону, (Eе); 4. электроотрицательность, 5. окислительно-восстановительная активность; 6. степень окисления, 7. составы высших водородных соединений, 8. составы высших кислородных соединений, 9. термодинамические, 10. электролитические свойства и многие другие.
Важнейшие периодические свойства атома: 1. атомный и ионный радиусы (r); 2. энергия ионизации, (Еи); 3. сродство к электрону, (Eе); 4. электроотрицательность, 5. окислительно-восстановительная активность; 6. степень окисления, 7. составы высших водородных соединений, 8. составы высших кислородных соединений, 9. термодинамические, 10. электролитические свойства и многие другие.


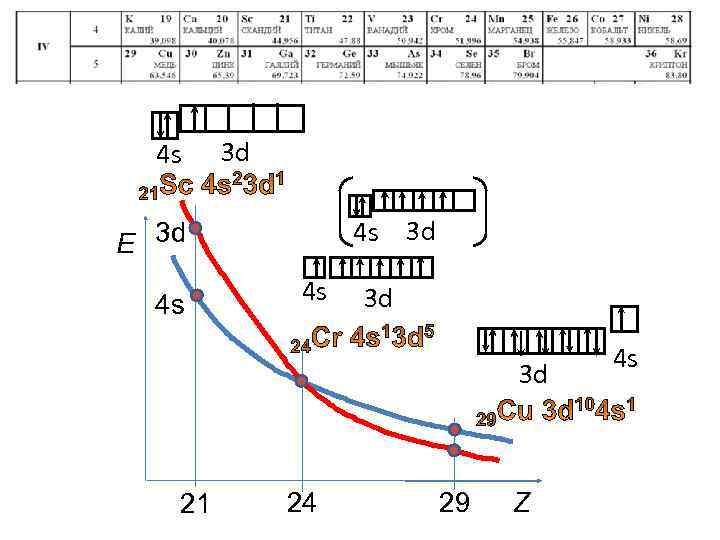 4 s 3 d E 3 d 4 s 4 s 3 d 3 d 21 24 29 Z 4 s
4 s 3 d E 3 d 4 s 4 s 3 d 3 d 21 24 29 Z 4 s


