 Катионы V 2+, Fe 3+, Mg 2+, Mn 2+, Fe 3+ Sb (III), Sb (V), Bi аналитической группы
Катионы V 2+, Fe 3+, Mg 2+, Mn 2+, Fe 3+ Sb (III), Sb (V), Bi аналитической группы
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Групповой реагент концентрированный раствор аммиака (NH 3 H 2 O), который осаждает их в виде гидроксидов, нерастворимых в избытке реагента: Fe. Cl 2 + 2 NH 3 H 2 O → Fe(OH)2 + 2 NH 4 Cl Fe. Cl 3 + 3 NH 3 H 2 O → Fe(OH)3 + 3 NH 4 Cl Mg. Cl 2 + 2 NH 3 H 2 O → Mg(OH)2 + 2 NH 4 Cl Mn. Cl 2 + 2 NH 3 H 2 O → Mn(OH)2 + 2 NH 4 Cl
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Групповой реагент концентрированный раствор аммиака (NH 3 H 2 O), который осаждает их в виде гидроксидов, нерастворимых в избытке реагента: Fe. Cl 2 + 2 NH 3 H 2 O → Fe(OH)2 + 2 NH 4 Cl Fe. Cl 3 + 3 NH 3 H 2 O → Fe(OH)3 + 3 NH 4 Cl Mg. Cl 2 + 2 NH 3 H 2 O → Mg(OH)2 + 2 NH 4 Cl Mn. Cl 2 + 2 NH 3 H 2 O → Mn(OH)2 + 2 NH 4 Cl
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Na[Sb. Cl 6] + 5 NH 3 H 2 O HSb. O 3↓ + Na. Cl + 5 NH 4 Cl + 2 H 2 O Na 3[Sb. Cl 6] + 3 NH 3 H 2 O Sb(OH)3 + 3 Na. Cl + 3 NH 4 Cl Катионы висмута при действии раствора аммиака образуют белый осадок основной соли, состав которой изменяется в зависимости от концентрации раствора, температуры: 2 NH 3 H 2 O Bi(OH)2 Cl + 2 NH 4 Cl Bi(OH)2 Cl Bi. OCl + H 2 O Bi. Cl 3 +
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Na[Sb. Cl 6] + 5 NH 3 H 2 O HSb. O 3↓ + Na. Cl + 5 NH 4 Cl + 2 H 2 O Na 3[Sb. Cl 6] + 3 NH 3 H 2 O Sb(OH)3 + 3 Na. Cl + 3 NH 4 Cl Катионы висмута при действии раствора аммиака образуют белый осадок основной соли, состав которой изменяется в зависимости от концентрации раствора, температуры: 2 NH 3 H 2 O Bi(OH)2 Cl + 2 NH 4 Cl Bi(OH)2 Cl Bi. OCl + H 2 O Bi. Cl 3 +
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида С растворами Na. OH или KOH катионы магния, марганца, висмута и сурьмы образуют белые аморфные осадки гидроксидов, зеленые – гидроксидов железа (II) и красно-бурые – гидроксидов железа (III): Mg. Cl 2 + 2 Nа. OH Mg(OH)2 2 Nа. Cl Mn. Cl 2 + 2 Nа. OH Mn(OH)2 2 Nа. Cl Fe. Cl 2 + 2 Nа. OH Fe(OH)2 2 Nа. Cl Fe. Cl 3 + 3 Nа. OH Fe(OH)3 Nа. Cl Bi. Cl 3 + 3 Nа. OН Bi(OH)3 + 3 Nа. Cl
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида С растворами Na. OH или KOH катионы магния, марганца, висмута и сурьмы образуют белые аморфные осадки гидроксидов, зеленые – гидроксидов железа (II) и красно-бурые – гидроксидов железа (III): Mg. Cl 2 + 2 Nа. OH Mg(OH)2 2 Nа. Cl Mn. Cl 2 + 2 Nа. OH Mn(OH)2 2 Nа. Cl Fe. Cl 2 + 2 Nа. OH Fe(OH)2 2 Nа. Cl Fe. Cl 3 + 3 Nа. OH Fe(OH)3 Nа. Cl Bi. Cl 3 + 3 Nа. OН Bi(OH)3 + 3 Nа. Cl
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида + 5 Nа. OН Sb(OН)5 + 6 Na. Cl Sb(OH)5 HSb. O 3 +2 H 2 O Na 3[Sb. Cl 6] + 3 Nа. OН Sb(OH)3 + 6 Na. Cl Na[Sb. Cl 6] Все гидроксиды катионов V растворяются в кислотах, например: аналитической группы Fe(OH)3 + 3 HCl Fe. Cl 3 + 3 H 2 O
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида + 5 Nа. OН Sb(OН)5 + 6 Na. Cl Sb(OH)5 HSb. O 3 +2 H 2 O Na 3[Sb. Cl 6] + 3 Nа. OН Sb(OH)3 + 6 Na. Cl Na[Sb. Cl 6] Все гидроксиды катионов V растворяются в кислотах, например: аналитической группы Fe(OH)3 + 3 HCl Fe. Cl 3 + 3 H 2 O
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида Гидроксиды Sb (III) и Sb (V) за счет амфотерных свойств растворяются в избытке щелочей: Sb(OH)3 + 3 Nа. OH Nа 3[Sb(OH)6] Sb(OH)5 + Nа. OH Nа[Sb(OH)6] Гидроксиды магния, марганца (II) и железа (II) растворимы также в насыщенном растворе NH 4 Cl, например: Mg(OH)2 +2 NH 4 Cl Mg. Cl 2 + 2 NH 3 H 2 O
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Действие растворов натрия гидроксида или калия гидроксида Гидроксиды Sb (III) и Sb (V) за счет амфотерных свойств растворяются в избытке щелочей: Sb(OH)3 + 3 Nа. OH Nа 3[Sb(OH)6] Sb(OH)5 + Nа. OH Nа[Sb(OH)6] Гидроксиды магния, марганца (II) и железа (II) растворимы также в насыщенном растворе NH 4 Cl, например: Mg(OH)2 +2 NH 4 Cl Mg. Cl 2 + 2 NH 3 H 2 O
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакция ионов магния Действие раствора натрия гидрофосфата Na 2 HPO 4 Катионы магния образуют с раствором натрия гидрофосфата в присутствии аммиачного буферного раствора белый кристаллический осадок: Mg. Cl 2 + Nа 2 HPO 4 + NH 3 H 2 O Mg. NH 4 PO 4 +2 Nа. Cl + H 2 O Эту реакцию можно выполнять как микрокристаллоскопическую.
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакция ионов магния Действие раствора натрия гидрофосфата Na 2 HPO 4 Катионы магния образуют с раствором натрия гидрофосфата в присутствии аммиачного буферного раствора белый кристаллический осадок: Mg. Cl 2 + Nа 2 HPO 4 + NH 3 H 2 O Mg. NH 4 PO 4 +2 Nа. Cl + H 2 O Эту реакцию можно выполнять как микрокристаллоскопическую.
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакция ионов железа (II) Действие раствора калия гексацианоферрата (III) K 3[Fe(CN)6] Катионы железа (II) образуют с раствором калия гексацианоферрата (III) осадок “турнбулевой сини” синего цвета: 3 Fe. Cl 2+2 К 3[Fe(CN)6] Fe 3[Fe(CN 6)]2 КCl Осадок разлагается в щелочах: Fe 3[Fe(CN)6]2 + 6 КOH 3 Fe(OH)2 + 2 К 3[Fe(CN)6]
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакция ионов железа (II) Действие раствора калия гексацианоферрата (III) K 3[Fe(CN)6] Катионы железа (II) образуют с раствором калия гексацианоферрата (III) осадок “турнбулевой сини” синего цвета: 3 Fe. Cl 2+2 К 3[Fe(CN)6] Fe 3[Fe(CN 6)]2 КCl Осадок разлагается в щелочах: Fe 3[Fe(CN)6]2 + 6 КOH 3 Fe(OH)2 + 2 К 3[Fe(CN)6]
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (III) Действие растворов калия гексацианоферрата (II) K 4[Fe(CN)6] Катионы железа (III) образуют с раствором калия гексацианоферрата (II) темно-синий осадок “берлинской лазури”: 4 Fe. Cl 3 + 3 К 4[Fe(CN)6] Fe 4[Fe(CN 6)]3 КCl В щелочах осадок разлагается: Fe 4[Fe(CN)6]3 + 12 КOH 4 Fe(OH)3 + 3 К 4[Fe(CN)6]
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (III) Действие растворов калия гексацианоферрата (II) K 4[Fe(CN)6] Катионы железа (III) образуют с раствором калия гексацианоферрата (II) темно-синий осадок “берлинской лазури”: 4 Fe. Cl 3 + 3 К 4[Fe(CN)6] Fe 4[Fe(CN 6)]3 КCl В щелочах осадок разлагается: Fe 4[Fe(CN)6]3 + 12 КOH 4 Fe(OH)3 + 3 К 4[Fe(CN)6]
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (III) Действие тиоционат-ионов Катионы железа (III) образуют с тиоцианат-ионами комплексные соединения железа (III), которые окрашивают раствор в красный цвет: Fe. Cl 3 + 3 NH 4 NCS [Fe(NCS)3] + 3 NH 4 Cl
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (III) Действие тиоционат-ионов Катионы железа (III) образуют с тиоцианат-ионами комплексные соединения железа (III), которые окрашивают раствор в красный цвет: Fe. Cl 3 + 3 NH 4 NCS [Fe(NCS)3] + 3 NH 4 Cl
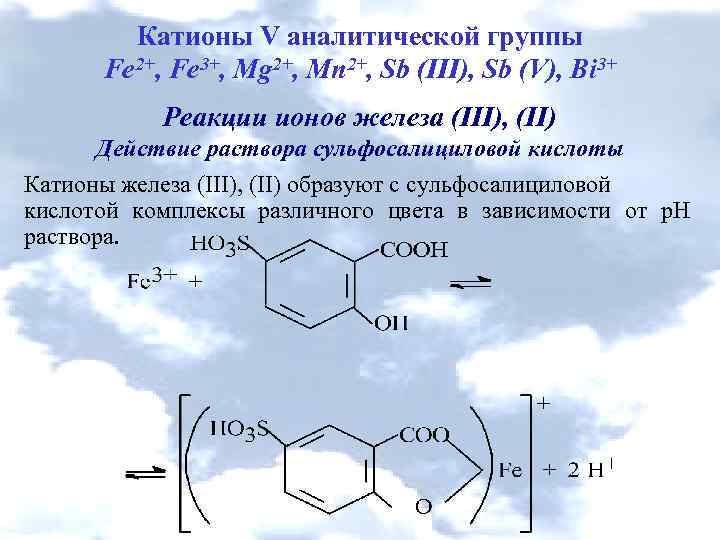 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты Катионы железа (III), (ІІ) образуют с сульфосалициловой кислотой комплексы различного цвета в зависимости от р. Н раствора.
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты Катионы железа (III), (ІІ) образуют с сульфосалициловой кислотой комплексы различного цвета в зависимости от р. Н раствора.
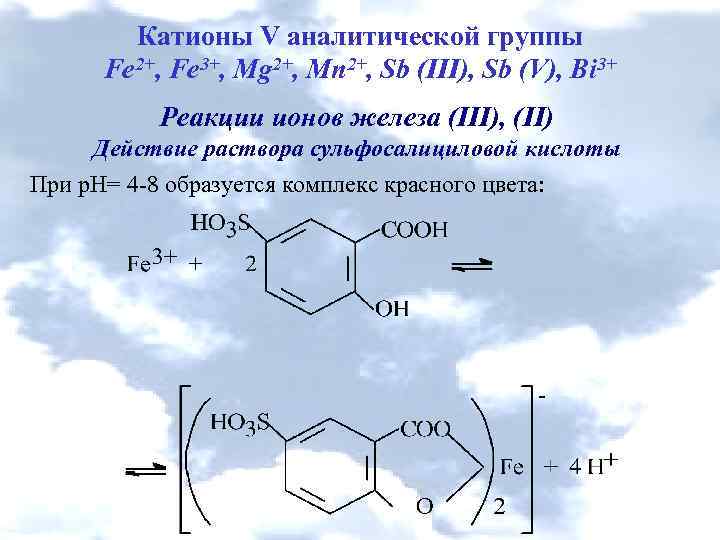 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты При р. Н= 4 -8 образуется комплекс красного цвета:
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты При р. Н= 4 -8 образуется комплекс красного цвета:
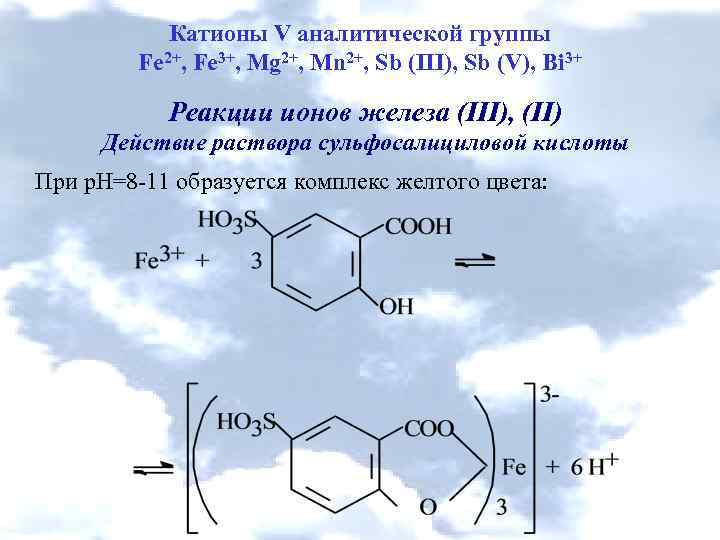 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты При р. Н=8 -11 образуется комплекс желтого цвета:
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов железа (ІІІ), (ІІ) Действие раствора сульфосалициловой кислоты При р. Н=8 -11 образуется комплекс желтого цвета:
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов марганца Действие персульфата аммония (NH 4)2 S 2 O 8 Сильные окислители, например, персульфат аммония (NH 4)2 S 2 O 8, окисляют Mn (II) до ионов Mn. O 4 -, которые окрашивают раствор в красный цвет: 2 Mn. SO 4 + 5(NH 4)2 S 2 O 8 + 8 H 2 O 2 НMn. O 4 + 5(NH 4)2 SO 4 + 7 H 2 SO 4
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов марганца Действие персульфата аммония (NH 4)2 S 2 O 8 Сильные окислители, например, персульфат аммония (NH 4)2 S 2 O 8, окисляют Mn (II) до ионов Mn. O 4 -, которые окрашивают раствор в красный цвет: 2 Mn. SO 4 + 5(NH 4)2 S 2 O 8 + 8 H 2 O 2 НMn. O 4 + 5(NH 4)2 SO 4 + 7 H 2 SO 4
 Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов висмута Действие натрия гексагидроксостанита (ІІ) Na 2[Sn(OH)4] Гексагидроксостанит (ІІ)-ионы восстанавливают ионы Bi 3+ до металлического висмута черного цвета: Sn. Cl 2 + 4 Na. OH Na 2[Sn(OH)4] + 2 Na. Cl Bi(NO 3)3 + 3 Na. OH Bi(OH)3 Na. NO 3 2 Bi(OH)3 + 3 Na 2[Sn(OH)4] 2 Bi + 3 Na 2[Sn(OH)6]
Катионы V аналитической группы Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ Реакции ионов висмута Действие натрия гексагидроксостанита (ІІ) Na 2[Sn(OH)4] Гексагидроксостанит (ІІ)-ионы восстанавливают ионы Bi 3+ до металлического висмута черного цвета: Sn. Cl 2 + 4 Na. OH Na 2[Sn(OH)4] + 2 Na. Cl Bi(NO 3)3 + 3 Na. OH Bi(OH)3 Na. NO 3 2 Bi(OH)3 + 3 Na 2[Sn(OH)4] 2 Bi + 3 Na 2[Sn(OH)6]
![K 3[Fe(CN)6] ↓Fe 3[(Fe(CN)6]2 Fe 2+, Fe 3+, Mn 2+, Mg 2+, Bi 3+, K 3[Fe(CN)6] ↓Fe 3[(Fe(CN)6]2 Fe 2+, Fe 3+, Mn 2+, Mg 2+, Bi 3+,](https://present5.com/presentation/3/58084556_444056522.pdf-img/58084556_444056522.pdf-16.jpg) K 3[Fe(CN)6] ↓Fe 3[(Fe(CN)6]2 Fe 2+, Fe 3+, Mn 2+, Mg 2+, Bi 3+, Sb (III), Sb (V) 1 K 4[Fe(CN)6] ↓Fe 4[(Fe(CN)6]3 HNO 3 (2 M), H 2 O 2 (3%) 2 1 Fe 3+, Mn 2+, Mg 2+, Bi 3+ 5 ↓HSb. O 3 NH 3 ∙ H 2 О (конц. ), H 2 O 2 3 ↓Fe(OH)3, Mn. O 2∙n. H 2 O, ↓Mg(OH)2, ↓Bi(OH)3 6 7 NH 4 Cl Na 2 HPO 4, NH 3∙H 2 O, NH 4 Cl ↓Mg. NH 4 PO 4 [Sb. Cl 6]4 ↓Fe(OH)3, Mn. O 2∙n. H 2 O, ↓Bi(OH)3 Mg 2+, NH 4+ 8 Mn. O 2∙n. H 2 O HNO 3 (2 M), H 2 O 2 (2%) 9 Mn 2+ HNO 3 (2 M), Ag. NO 3, (NH 4)2 S 2 O 8 10 Mn. O 4 - HСl (конц. ) Zn ↓Sb HNO 3 (3 M) Fe 3+, Bi 3+ 11 ↓Bi Na 2[Sn(OН)4]
K 3[Fe(CN)6] ↓Fe 3[(Fe(CN)6]2 Fe 2+, Fe 3+, Mn 2+, Mg 2+, Bi 3+, Sb (III), Sb (V) 1 K 4[Fe(CN)6] ↓Fe 4[(Fe(CN)6]3 HNO 3 (2 M), H 2 O 2 (3%) 2 1 Fe 3+, Mn 2+, Mg 2+, Bi 3+ 5 ↓HSb. O 3 NH 3 ∙ H 2 О (конц. ), H 2 O 2 3 ↓Fe(OH)3, Mn. O 2∙n. H 2 O, ↓Mg(OH)2, ↓Bi(OH)3 6 7 NH 4 Cl Na 2 HPO 4, NH 3∙H 2 O, NH 4 Cl ↓Mg. NH 4 PO 4 [Sb. Cl 6]4 ↓Fe(OH)3, Mn. O 2∙n. H 2 O, ↓Bi(OH)3 Mg 2+, NH 4+ 8 Mn. O 2∙n. H 2 O HNO 3 (2 M), H 2 O 2 (2%) 9 Mn 2+ HNO 3 (2 M), Ag. NO 3, (NH 4)2 S 2 O 8 10 Mn. O 4 - HСl (конц. ) Zn ↓Sb HNO 3 (3 M) Fe 3+, Bi 3+ 11 ↓Bi Na 2[Sn(OН)4]


