Гомогенный катализ_2012.ppt
- Количество слайдов: 7

КАТАЛИЗ Термин «катализ» был введён в 1835 году шведским учёным Берцелиусом. КАТАЛИЗ (от греч. katalysis - разрушение), изменение скорости химической реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Различают положительный и отрицательный катализ, в зависимости от того, ускоряет катализатор реакцию или замедляет ее. Как правило, термин "катализ" относят к ускорению реакции; вещества, замедляющие реакцию, называются ингибиторами. Большая часть всех промышленных реакций — это каталитические процессы. Явление катализа распространено и в природе - большинство процессов, происходящих в живых организмах, являются каталитическими.

Важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций. Шариковый алюмопалладиевый катализатор Катализатор алюмоплатиновый селективного гидрирования
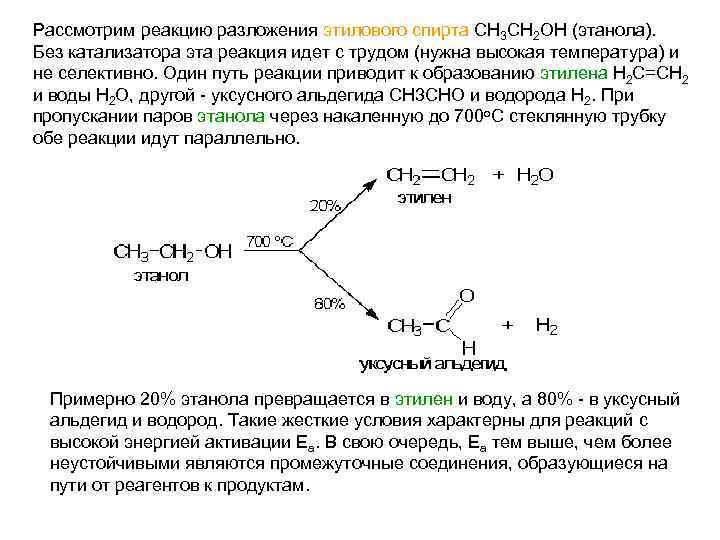
Рассмотрим реакцию разложения этилового спирта СН 3 СН 2 ОН (этанола). Без катализатора эта реакция идет с трудом (нужна высокая температура) и не селективно. Один путь реакции приводит к образованию этилена Н 2 С=СН 2 и воды Н 2 О, другой - уксусного альдегида СН 3 СНО и водорода Н 2. При пропускании паров этанола через накаленную до 700 о. С стеклянную трубку обе реакции идут параллельно. Примерно 20% этанола превращается в этилен и воду, а 80% - в уксусный альдегид и водород. Такие жесткие условия характерны для реакций с высокой энергией активации Еа. В свою очередь, Еа тем выше, чем более неустойчивыми являются промежуточные соединения, образующиеся на пути от реагентов к продуктам.
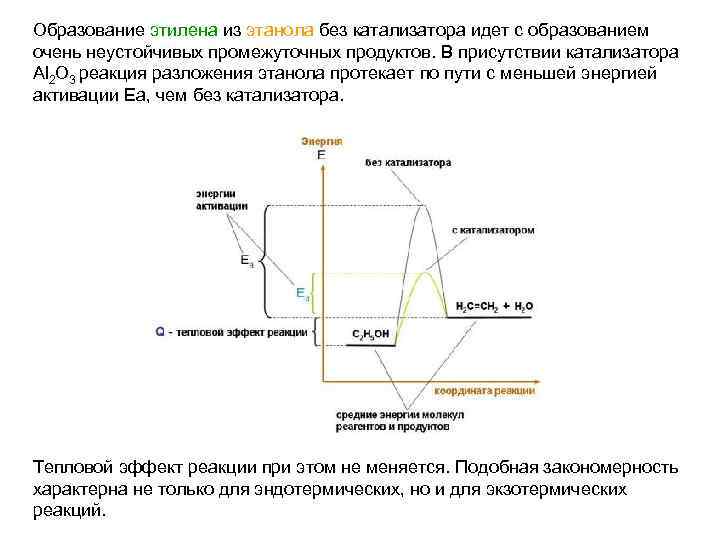
Образование этилена из этанола без катализатора идет с образованием очень неустойчивых промежуточных продуктов. В присутствии катализатора Al 2 O 3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.

В присутствии Al 2 O 3 реакция идет с хорошей скоростью уже при 300 о. С. Таким образом, катализатор позволяет проводить реакцию разложения этанола селективно - реакция теперь идет с образованием этилена и воды, а уксусный альдегид и водород в этом случае не образуются: При использовании в качестве катализатора металлической меди превращение этанола удается селективно направить по другому пути с образованием уксусного альдегида и водорода. В приведенном примере реагент (этанол) и катализатор (порошкообразный оксид Al 2 O 3 или медь) находятся в разных фазах газообразной и твердой. В этом случае мы имеем дело с гетерогенным катализом. Если же реагенты и катализатор находятся в одной фазе например, оба являются газами или оба растворены в каком-либо растворителе - то говорят о гомогенном катализе. Гомогенные катализаторы имеют различную химическую природу – кислоты (Н 2 SO 4 или Н 3 РО 4), основания (Na. OH), органические амины, металлы, чаще всего переходные (Fe или Rh), в форме солей.

Если катализатором выступает щелочь, то катализ называется основным катализом. Если катализатором выступает кислота, то катализ называется кислотным. Кислотный и основный катализы это примеры взаимодействия катализатора с одним из исходных компонентов реакции. Использование серной кислоты H 2 SO 4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 о. С. Это говорит о еще более значительном снижении энергии активации и ускорении реакции: Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н+.
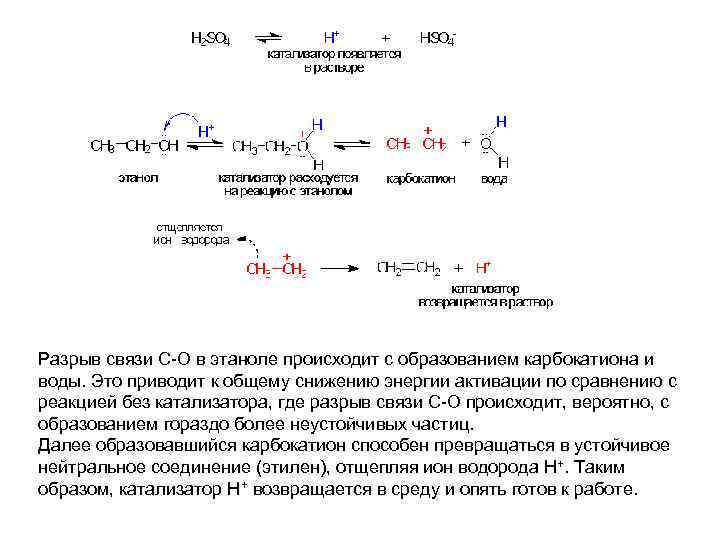
Разрыв связи С-О в этаноле происходит с образованием карбокатиона и воды. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц. Далее образовавшийся карбокатион способен превращаться в устойчивое нейтральное соединение (этилен), отщепляя ион водорода Н+. Таким образом, катализатор Н+ возвращается в среду и опять готов к работе.
Гомогенный катализ_2012.ppt