катализ-hetero.pptx
- Количество слайдов: 58
 Катализ.
Катализ.
 Определение катализа ИЮПАК Катализатор – это вещество, увеличивающее скорость реакции, но не изменяющее суммарной стандартной энергии Гиббса. Явление называется Гиббса катализом, а реакции каталитическими.
Определение катализа ИЮПАК Катализатор – это вещество, увеличивающее скорость реакции, но не изменяющее суммарной стандартной энергии Гиббса. Явление называется Гиббса катализом, а реакции каталитическими.
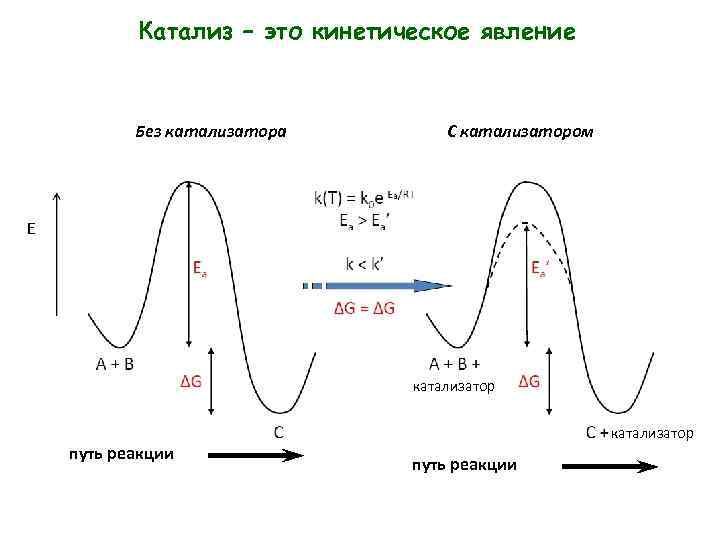 Катализ – это кинетическое явление Без катализатора С катализатором E катализатор путь реакции
Катализ – это кинетическое явление Без катализатора С катализатором E катализатор путь реакции
 Активность катализатора БОРЕСКОВ A = rk – ro (1 - ) - степень заполнения реактора скорость реакции с катализатором Гомогенный катализ скорость реакции без катализатора [Ckат] = [молькат/лреакционной среды] Гетерогенный катализ Отнесение активности к единице площади поверхности катализатора ИЮПАК Отнесение активности к единице массы катализатора Количество продукта, образующегося в единицу времени на одном активном центре
Активность катализатора БОРЕСКОВ A = rk – ro (1 - ) - степень заполнения реактора скорость реакции с катализатором Гомогенный катализ скорость реакции без катализатора [Ckат] = [молькат/лреакционной среды] Гетерогенный катализ Отнесение активности к единице площади поверхности катализатора ИЮПАК Отнесение активности к единице массы катализатора Количество продукта, образующегося в единицу времени на одном активном центре
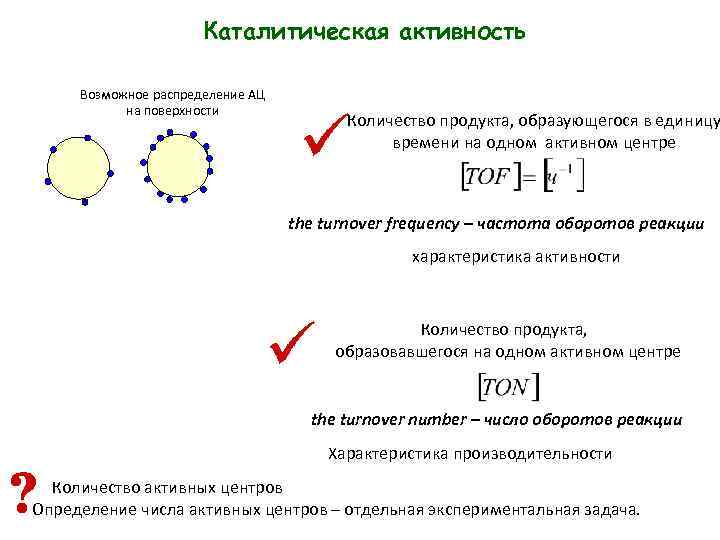 Каталитическая активность Возможное распределение АЦ на поверхности Количество продукта, образующегося в единицу времени на одном активном центре the turnover frequency – частота оборотов реакции характеристика активности Количество продукта, образовавшегося на одном активном центре the turnover number – число оборотов реакции Характеристика производительности Количество активных центров Определение числа активных центров – отдельная экспериментальная задача.
Каталитическая активность Возможное распределение АЦ на поверхности Количество продукта, образующегося в единицу времени на одном активном центре the turnover frequency – частота оборотов реакции характеристика активности Количество продукта, образовавшегося на одном активном центре the turnover number – число оборотов реакции Характеристика производительности Количество активных центров Определение числа активных центров – отдельная экспериментальная задача.
![Частота оборотов реакции (TOF) 1/rmax – определяется экспериментально, ели известно [E 0] {время-1} Число Частота оборотов реакции (TOF) 1/rmax – определяется экспериментально, ели известно [E 0] {время-1} Число](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-6.jpg) Частота оборотов реакции (TOF) 1/rmax – определяется экспериментально, ели известно [E 0] {время-1} Число молей субстрата, превращенных в продукт молем фермента за единицу времени при субстратном насыщении - число оборотов (TOF, the turnover frequency)
Частота оборотов реакции (TOF) 1/rmax – определяется экспериментально, ели известно [E 0] {время-1} Число молей субстрата, превращенных в продукт молем фермента за единицу времени при субстратном насыщении - число оборотов (TOF, the turnover frequency)
 5 стадий протекания гетерогеннокаталитического процесса: • Транспорт реагентов к поверхности катализатора • Адсорбция реагентов на поверхности катализатора. • Превращение реагентов на поверхности. • Десорбция продуктов с поверхности катализатора. • Транспорт продуктов с поверхности катализатора
5 стадий протекания гетерогеннокаталитического процесса: • Транспорт реагентов к поверхности катализатора • Адсорбция реагентов на поверхности катализатора. • Превращение реагентов на поверхности. • Десорбция продуктов с поверхности катализатора. • Транспорт продуктов с поверхности катализатора
 Адсорбция как лимитирующая стадия Скорость реакции не зависит от транспорта вещества к поверхности катализатора. Скорость диффузии на несколько порядков больше, чем скорость превращения на поверхности.
Адсорбция как лимитирующая стадия Скорость реакции не зависит от транспорта вещества к поверхности катализатора. Скорость диффузии на несколько порядков больше, чем скорость превращения на поверхности.
 Реакция на поверхности. Схема Ленгмюра-Хиншельвуда k 1 k-1 • • A- реагент в газовой фазе С- активный центр поверхности АС – адсорбционный комплекс Р - продукт Равновесная монослойная адсорбция по Ленгмюру p. A (квазиравновесие + уравнение материального баланса) - доля занятой поверхности
Реакция на поверхности. Схема Ленгмюра-Хиншельвуда k 1 k-1 • • A- реагент в газовой фазе С- активный центр поверхности АС – адсорбционный комплекс Р - продукт Равновесная монослойная адсорбция по Ленгмюру p. A (квазиравновесие + уравнение материального баланса) - доля занятой поверхности
![Схема Михаелиса-Ментен-Ленгмюра-Хиншельвуда квазистационарность r квазиравновесие [S], p. A Схема Михаелиса-Ментен-Ленгмюра-Хиншельвуда квазистационарность r квазиравновесие [S], p. A](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-10.jpg) Схема Михаелиса-Ментен-Ленгмюра-Хиншельвуда квазистационарность r квазиравновесие [S], p. A
Схема Михаелиса-Ментен-Ленгмюра-Хиншельвуда квазистационарность r квазиравновесие [S], p. A
 Реакция на поверхности. Адсорбция продукта k 1 k 2 k-1 k-2 • A, В - реагент и продукт в газовой фазе, давления p. A и p. В • С- активный центр поверхности • АС, АВ – адсорбционные комплексы реагента и продукта, доля занятой поверхности Равновесная монослойная адсорбция по Ленгмюру
Реакция на поверхности. Адсорбция продукта k 1 k 2 k-1 k-2 • A, В - реагент и продукт в газовой фазе, давления p. A и p. В • С- активный центр поверхности • АС, АВ – адсорбционные комплексы реагента и продукта, доля занятой поверхности Равновесная монослойная адсорбция по Ленгмюру
 Реакция на поверхности. Адсорбция продукта k 1 k 2 k-1 k-2 Равновесная монослойная адсорбция по Ленгмюру для А и В
Реакция на поверхности. Адсорбция продукта k 1 k 2 k-1 k-2 Равновесная монослойная адсорбция по Ленгмюру для А и В
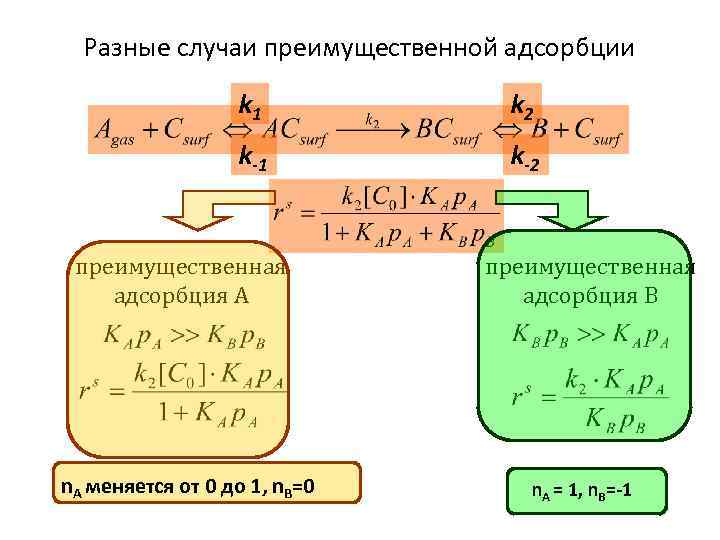 Разные случаи преимущественной адсорбции k 1 k 2 k-1 k-2 преимущественная адсорбция А n. А меняется от 0 до 1, n. В=0 преимущественная адсорбция В n. А = 1, n. В=-1
Разные случаи преимущественной адсорбции k 1 k 2 k-1 k-2 преимущественная адсорбция А n. А меняется от 0 до 1, n. В=0 преимущественная адсорбция В n. А = 1, n. В=-1
 Преимущественная адсорбция А n. А = 1, n. В=0, поверхность свободна n. А = 0, n. В=0, поверхность занята А
Преимущественная адсорбция А n. А = 1, n. В=0, поверхность свободна n. А = 0, n. В=0, поверхность занята А
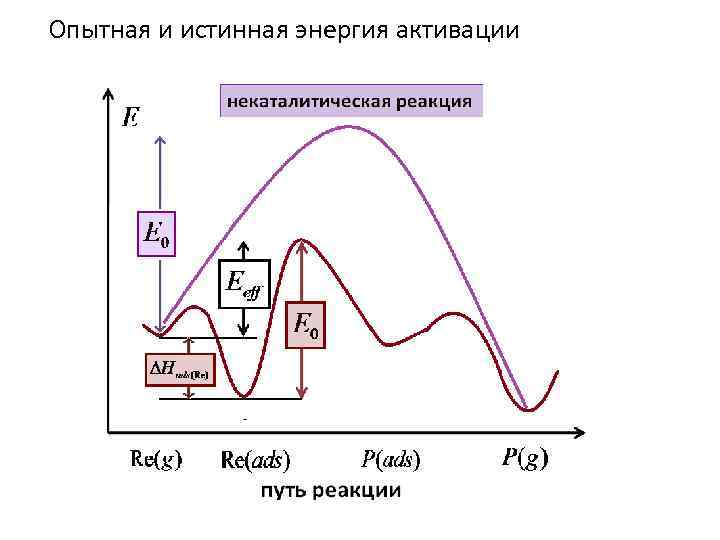 Опытная и истинная энергия активации
Опытная и истинная энергия активации
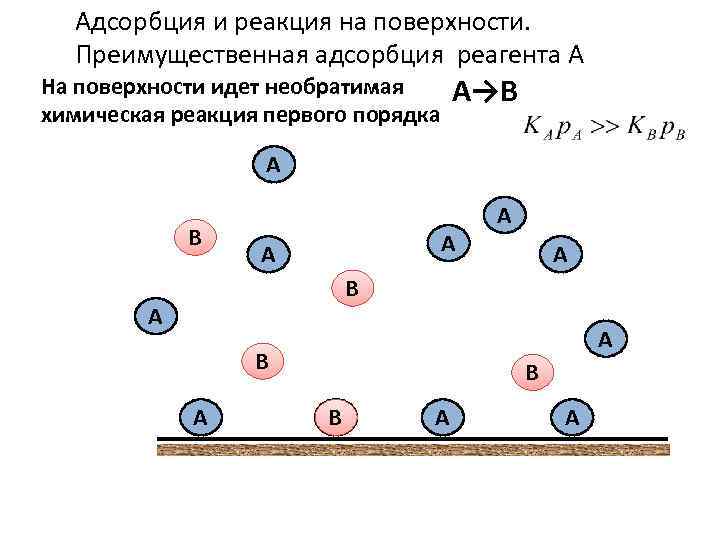 Адсорбция и реакция на поверхности. Преимущественная адсорбция реагента А На поверхности идет необратимая химическая реакция первого порядка А→В А А А А В А В В А А А
Адсорбция и реакция на поверхности. Преимущественная адсорбция реагента А На поверхности идет необратимая химическая реакция первого порядка А→В А А А А В А В В А А А
 Преимущественная адсорбция В n. А = 1, n. В=-1
Преимущественная адсорбция В n. А = 1, n. В=-1
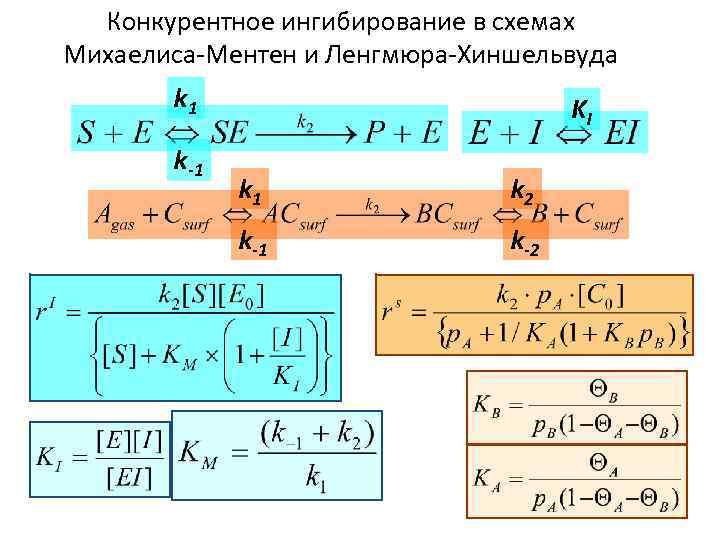 Конкурентное ингибирование в схемах Михаелиса-Ментен и Ленгмюра-Хиншельвуда k 1 k-1 KI k 1 k 2 k-1 k-2
Конкурентное ингибирование в схемах Михаелиса-Ментен и Ленгмюра-Хиншельвуда k 1 k-1 KI k 1 k 2 k-1 k-2
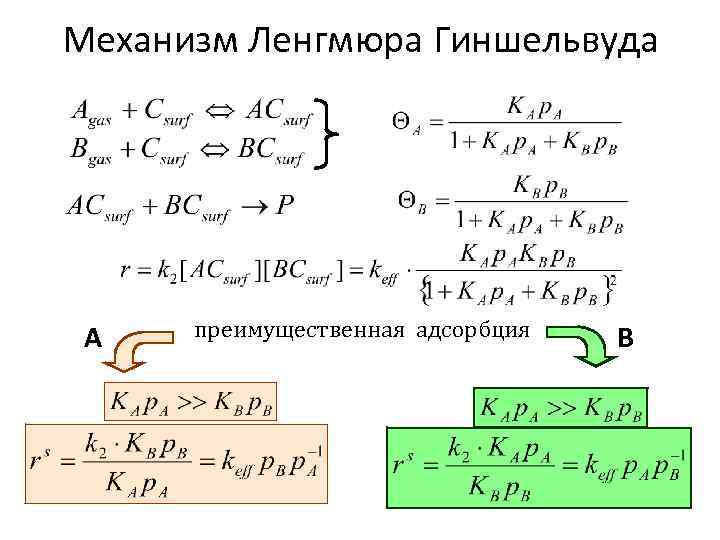 Механизм Ленгмюра Гиншельвуда А преимущественная адсорбция В
Механизм Ленгмюра Гиншельвуда А преимущественная адсорбция В
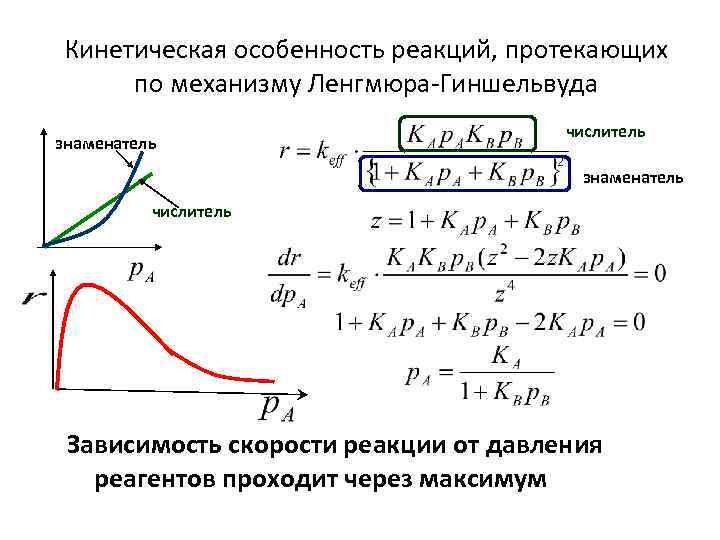 Кинетическая особенность реакций, протекающих по механизму Ленгмюра-Гиншельвуда знаменатель числитель Зависимость скорости реакции от давления реагентов проходит через максимум
Кинетическая особенность реакций, протекающих по механизму Ленгмюра-Гиншельвуда знаменатель числитель Зависимость скорости реакции от давления реагентов проходит через максимум
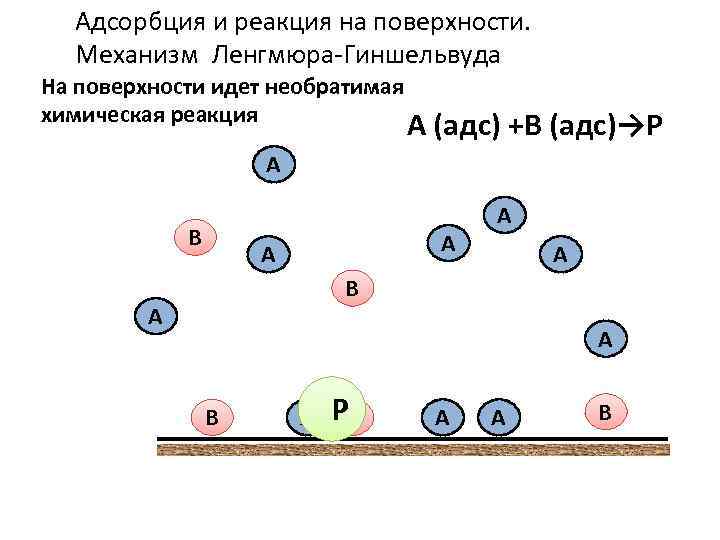 Адсорбция и реакция на поверхности. Механизм Ленгмюра-Гиншельвуда На поверхности идет необратимая химическая реакция А (адс) +В (адс)→Р А В А А В А РВ А А В
Адсорбция и реакция на поверхности. Механизм Ленгмюра-Гиншельвуда На поверхности идет необратимая химическая реакция А (адс) +В (адс)→Р А В А А В А РВ А А В
 Механизм Иле-Риделя n. А меняется от 0 до 1, n. В=1
Механизм Иле-Риделя n. А меняется от 0 до 1, n. В=1
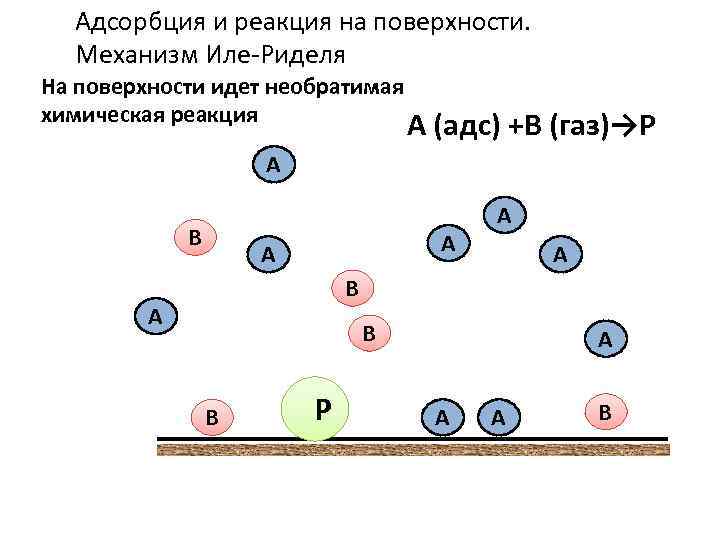 Адсорбция и реакция на поверхности. Механизм Иле-Риделя На поверхности идет необратимая химическая реакция А (адс) +В (газ)→Р А В А В В АР А А А В
Адсорбция и реакция на поверхности. Механизм Иле-Риделя На поверхности идет необратимая химическая реакция А (адс) +В (газ)→Р А В А В В АР А А А В
 Диффузия • Скорость транспорта продуктов сопоставима со скоростью химичес кой реакции
Диффузия • Скорость транспорта продуктов сопоставима со скоростью химичес кой реакции
![Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме постоянная, Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме постоянная,](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-25.jpg) Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме постоянная, не зависит от времени А А А В А В А На поверхности идет необратимая химическая реакция первого порядка А А В В на поверхности В В В А
Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме постоянная, не зависит от времени А А А В А В А На поверхности идет необратимая химическая реакция первого порядка А А В В на поверхности В В В А
![Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме отличается Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме отличается](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-26.jpg) Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме отличается от А В А поток диффузии А А В А В А
Внешняя диффузия и внешняя кинетика. Модель равнодоступной поверхности [A 0 ] в объеме отличается от А В А поток диффузии А А В А В А
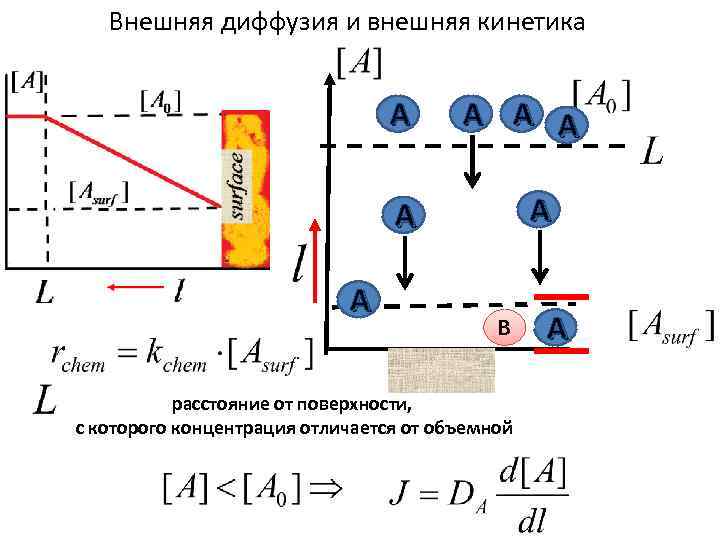 Внешняя диффузия и внешняя кинетика A A A A В расстояние от поверхности, с которого концентрация отличается от объемной A
Внешняя диффузия и внешняя кинетика A A A A В расстояние от поверхности, с которого концентрация отличается от объемной A
 Внешняя диффузия и внешняя кинетика Стационарный режим поток диффузии компенсируется химической реакцией Скорость реакции пропорциональна концентрации в газовой (жидкой) фазе, но сама реакция проходит на поверхности
Внешняя диффузия и внешняя кинетика Стационарный режим поток диффузии компенсируется химической реакцией Скорость реакции пропорциональна концентрации в газовой (жидкой) фазе, но сама реакция проходит на поверхности
 Внешняя диффузия и внешняя кинетика. Стационарный режим
Внешняя диффузия и внешняя кинетика. Стационарный режим
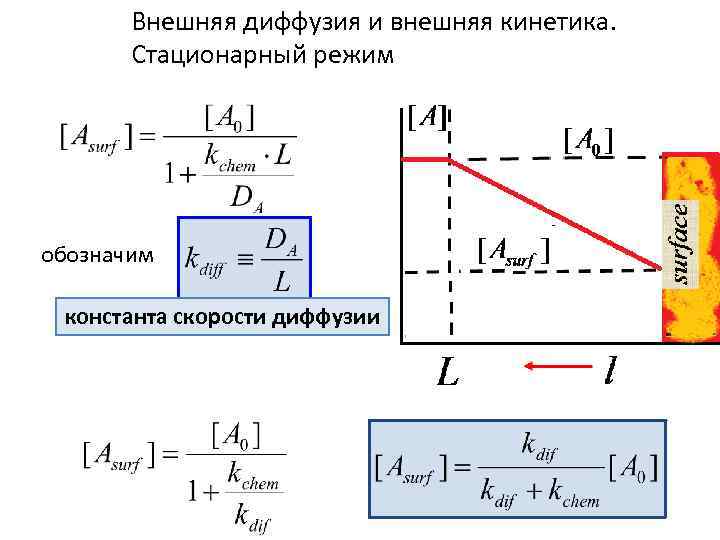 Внешняя диффузия и внешняя кинетика. Стационарный режим обозначим константа скорости диффузии
Внешняя диффузия и внешняя кинетика. Стационарный режим обозначим константа скорости диффузии
 Внешняя диффузия и внешняя кинетика. Стационарный режим
Внешняя диффузия и внешняя кинетика. Стационарный режим
 Внешняя диффузия – лимитирующая стадия Внешне диффузионный режим. Лимитирующая стадия - диффузия к поверхности катализатора. Концентрация у поверхности мала. Каталитическая реакция протекает только на поверхности.
Внешняя диффузия – лимитирующая стадия Внешне диффузионный режим. Лимитирующая стадия - диффузия к поверхности катализатора. Концентрация у поверхности мала. Каталитическая реакция протекает только на поверхности.
 Внешняя кинетика – лимитирующая стадия Внешне кинетический режим. Лимитирующая стадия - реакция на поверхности. Концентрация у поверхности близка к концентрации в объеме. Каталитическая реакция протекает только на поверхности. Макроскопическая скорость наблюдаемой химической реакции зависит от площади поверхности катализатора.
Внешняя кинетика – лимитирующая стадия Внешне кинетический режим. Лимитирующая стадия - реакция на поверхности. Концентрация у поверхности близка к концентрации в объеме. Каталитическая реакция протекает только на поверхности. Макроскопическая скорость наблюдаемой химической реакции зависит от площади поверхности катализатора.
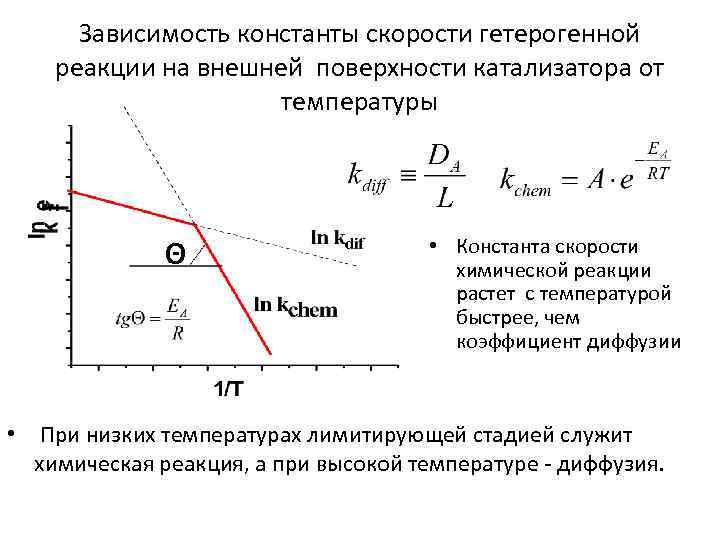 Зависимость константы скорости гетерогенной реакции на внешней поверхности катализатора от температуры Θ • Константа скорости химической реакции растет с температурой быстрее, чем коэффициент диффузии • При низких температурах лимитирующей стадией служит химическая реакция, а при высокой температуре - диффузия.
Зависимость константы скорости гетерогенной реакции на внешней поверхности катализатора от температуры Θ • Константа скорости химической реакции растет с температурой быстрее, чем коэффициент диффузии • При низких температурах лимитирующей стадией служит химическая реакция, а при высокой температуре - диффузия.
 Экспериментальные критерии внешней кинетической или диффузионной области • Низкие энергии активации – диффузионный режим. • Увеличение скорости реакции с увеличением скорости потока в проточных реакциях – диффузионный режим. • Увеличение скорости реакции с увеличением площади внешней поверхности катализатора – кинетический режим.
Экспериментальные критерии внешней кинетической или диффузионной области • Низкие энергии активации – диффузионный режим. • Увеличение скорости реакции с увеличением скорости потока в проточных реакциях – диффузионный режим. • Увеличение скорости реакции с увеличением площади внешней поверхности катализатора – кинетический режим.
 Внутренняя диффузия и внутренняя кинетика: в пористых катализаторах поры 0. 1 мм Большая площадь поверхности катализатора, но какова доступность этой поверхности для реагента?
Внутренняя диффузия и внутренняя кинетика: в пористых катализаторах поры 0. 1 мм Большая площадь поверхности катализатора, но какова доступность этой поверхности для реагента?
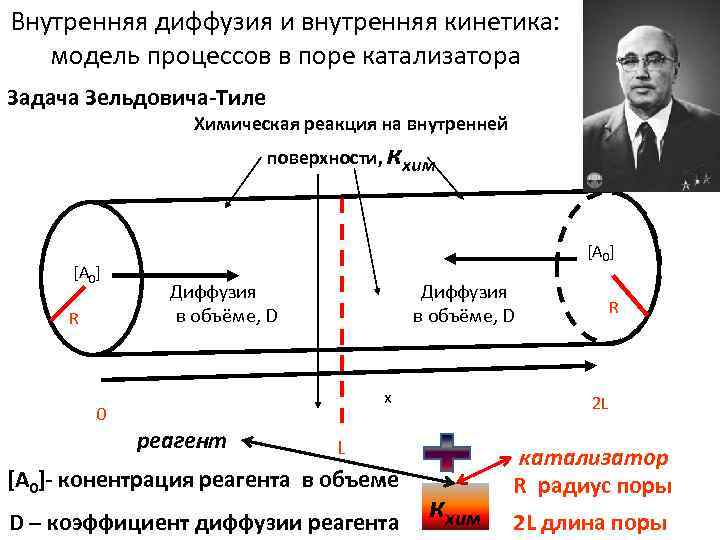 Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора Задача Зельдовича-Тиле Химическая реакция на внутренней поверхности, кхим [A 0] R [A 0] Диффузия в объёме, D x 0 реагент 2 L L [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента R кхим катализатор R радиус поры 2 L длина поры
Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора Задача Зельдовича-Тиле Химическая реакция на внутренней поверхности, кхим [A 0] R [A 0] Диффузия в объёме, D x 0 реагент 2 L L [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента R кхим катализатор R радиус поры 2 L длина поры
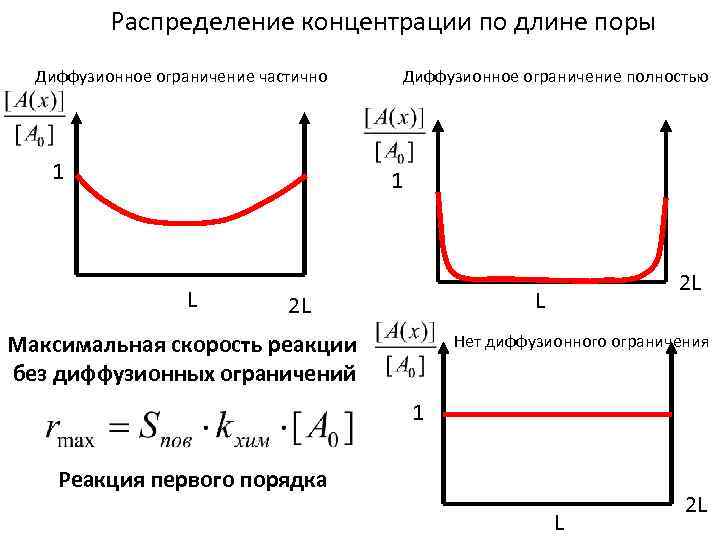 Распределение концентрации по длине поры Диффузионное ограничение частично 1 Диффузионное ограничение полностью 1 L 2 L Максимальная скорость реакции без диффузионных ограничений Нет диффузионного ограничения 1 Реакция первого порядка L 2 L
Распределение концентрации по длине поры Диффузионное ограничение частично 1 Диффузионное ограничение полностью 1 L 2 L Максимальная скорость реакции без диффузионных ограничений Нет диффузионного ограничения 1 Реакция первого порядка L 2 L
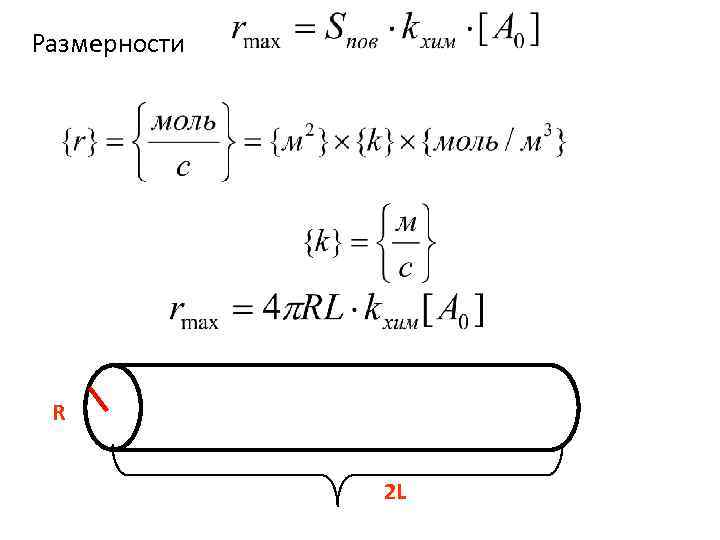 Размерности R 2 L
Размерности R 2 L
 На кольце dx Суммарная скорость реакции Фактор диффузионного торможения f
На кольце dx Суммарная скорость реакции Фактор диффузионного торможения f
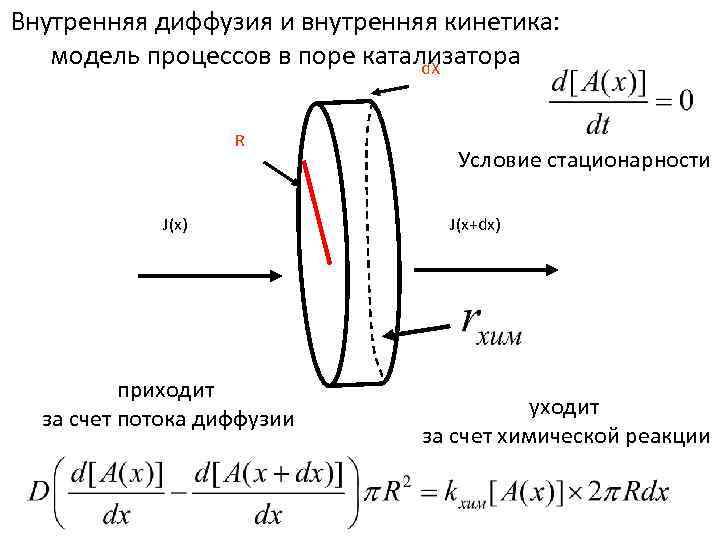 Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора d. X R J(x) приходит за счет потока диффузии Условие стационарности J(x+dx) уходит за счет химической реакции
Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора d. X R J(x) приходит за счет потока диффузии Условие стационарности J(x+dx) уходит за счет химической реакции
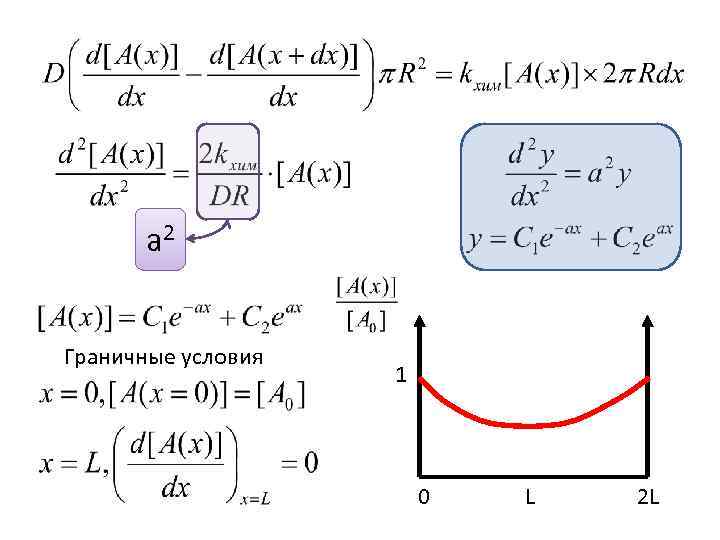 a 2 Граничные условия 1 0 L 2 L
a 2 Граничные условия 1 0 L 2 L
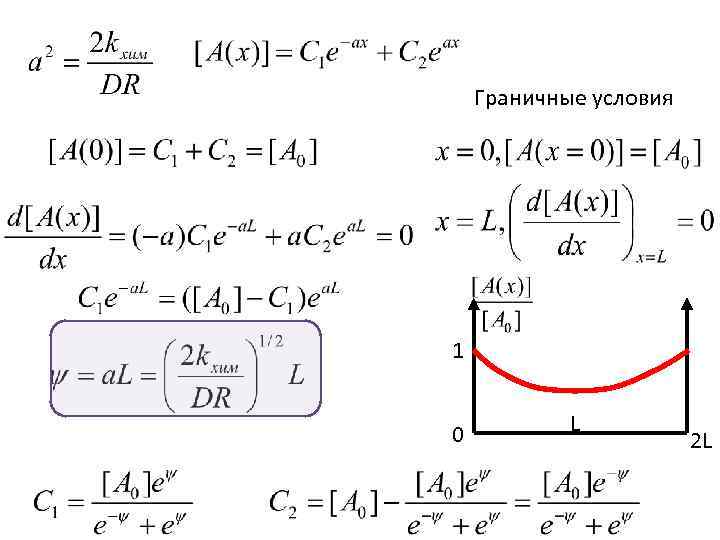 Граничные условия 1 0 L 2 L
Граничные условия 1 0 L 2 L
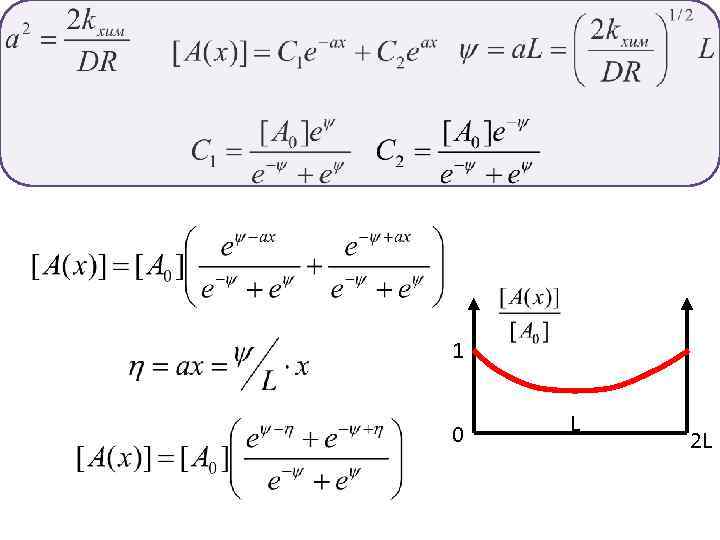 1 0 L 2 L
1 0 L 2 L
 Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора Изменение относительной концентрации реагента по длине поры Фактор Тиле Аналог расстояния в поре относительно входа в нее
Внутренняя диффузия и внутренняя кинетика: модель процессов в поре катализатора Изменение относительной концентрации реагента по длине поры Фактор Тиле Аналог расстояния в поре относительно входа в нее
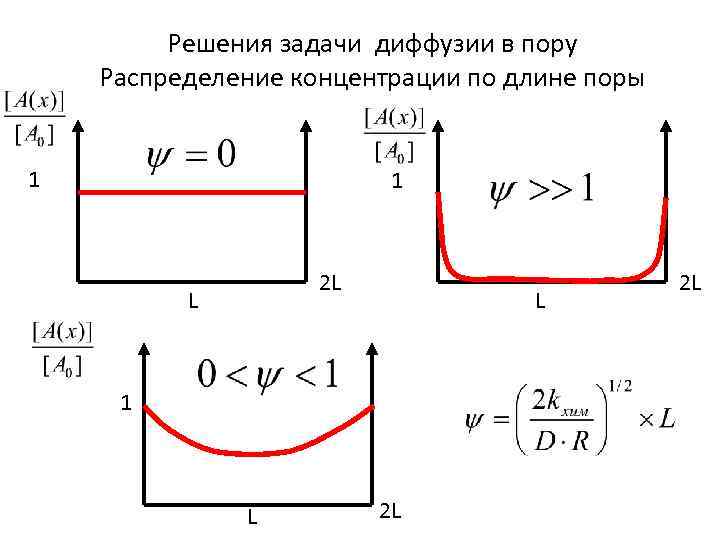 Решения задачи диффузии в пору Распределение концентрации по длине поры 1 1 2 L L L 1 L 2 L 2 L
Решения задачи диффузии в пору Распределение концентрации по длине поры 1 1 2 L L L 1 L 2 L 2 L
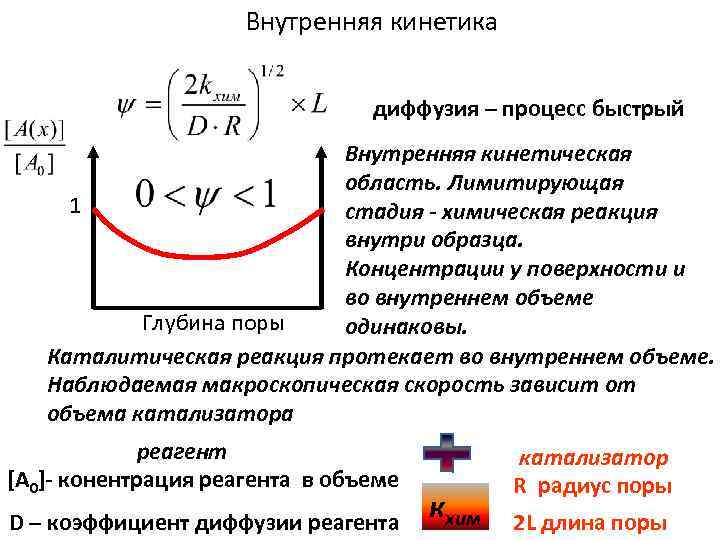 Внутренняя кинетика диффузия – процесс быстрый Внутренняя кинетическая область. Лимитирующая 1 стадия - химическая реакция внутри образца. Концентрации у поверхности и во внутреннем объеме Глубина поры одинаковы. Каталитическая реакция протекает во внутреннем объеме. Наблюдаемая макроскопическая скорость зависит от объема катализатора реагент [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента кхим катализатор R радиус поры 2 L длина поры
Внутренняя кинетика диффузия – процесс быстрый Внутренняя кинетическая область. Лимитирующая 1 стадия - химическая реакция внутри образца. Концентрации у поверхности и во внутреннем объеме Глубина поры одинаковы. Каталитическая реакция протекает во внутреннем объеме. Наблюдаемая макроскопическая скорость зависит от объема катализатора реагент [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента кхим катализатор R радиус поры 2 L длина поры
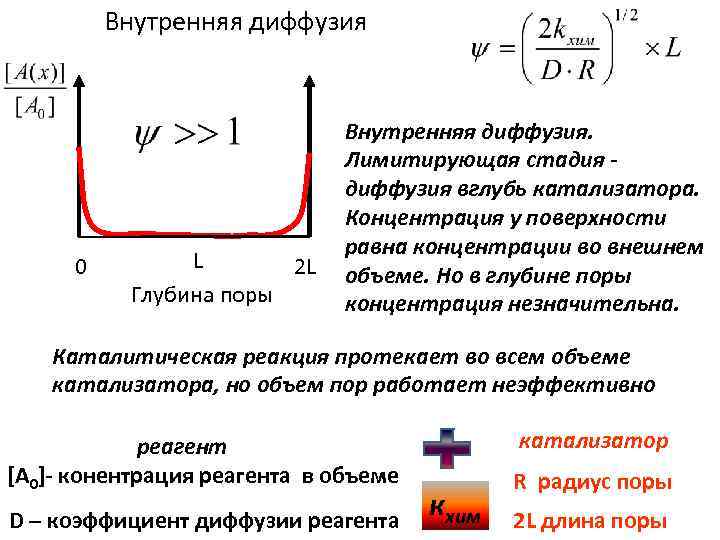 Внутренняя диффузия 0 L 2 L Глубина поры Внутренняя диффузия. Лимитирующая стадия диффузия вглубь катализатора. Концентрация у поверхности равна концентрации во внешнем объеме. Но в глубине поры концентрация незначительна. Каталитическая реакция протекает во всем объеме катализатора, но объем пор работает неэффективно реагент [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента катализатор кхим R радиус поры 2 L длина поры
Внутренняя диффузия 0 L 2 L Глубина поры Внутренняя диффузия. Лимитирующая стадия диффузия вглубь катализатора. Концентрация у поверхности равна концентрации во внешнем объеме. Но в глубине поры концентрация незначительна. Каталитическая реакция протекает во всем объеме катализатора, но объем пор работает неэффективно реагент [A 0]- конентрация реагента в объеме D – коэффициент диффузии реагента катализатор кхим R радиус поры 2 L длина поры
![Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-49.jpg) Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
![Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-50.jpg) Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
![Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-51.jpg) Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
![Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L](https://present5.com/presentation/1/9671535_135563126.pdf-img/9671535_135563126.pdf-52.jpg) Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
Решения задачи диффузии в пору [A 0] Глубина поры 0 x 2 L
 Решения задачи диффузии в пору Глубина поры Работает почти вся поверхность поры
Решения задачи диффузии в пору Глубина поры Работает почти вся поверхность поры
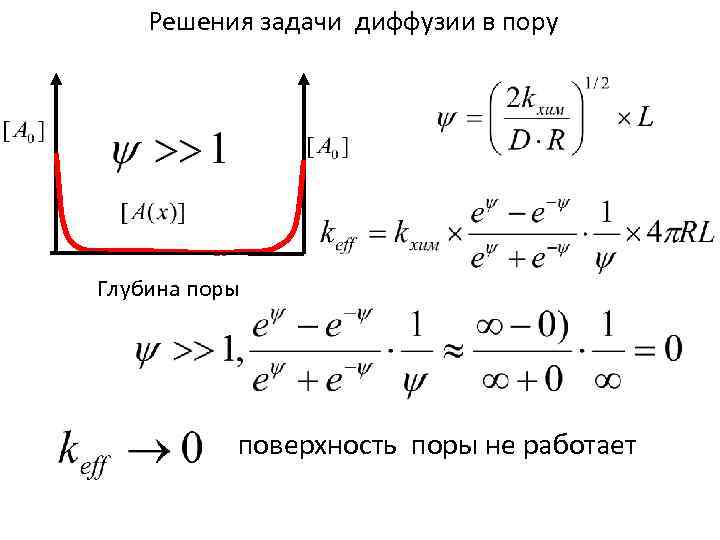 Решения задачи диффузии в пору Глубина поры поверхность поры не работает
Решения задачи диффузии в пору Глубина поры поверхность поры не работает
 Эффективная энергия активации во внутренней кинетической области катализатора
Эффективная энергия активации во внутренней кинетической области катализатора
 Эффективная энергия активации во внутренней диффузионной области катализатора
Эффективная энергия активации во внутренней диффузионной области катализатора
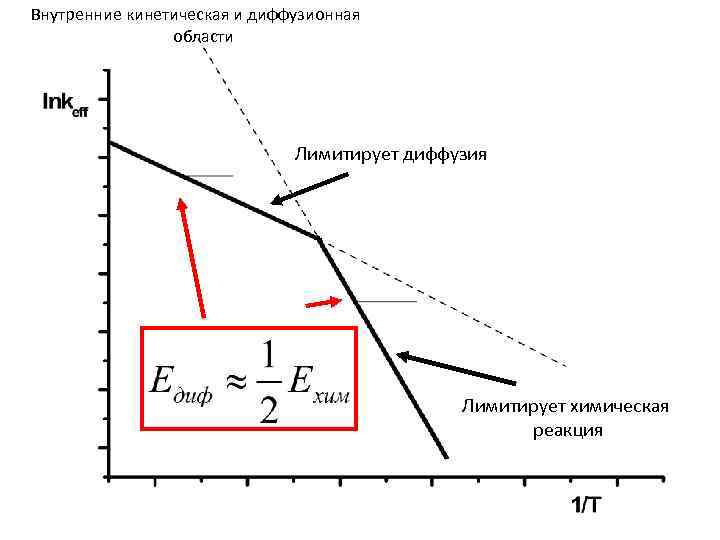 Внутренние кинетическая и диффузионная области Лимитирует диффузия Лимитирует химическая реакция
Внутренние кинетическая и диффузионная области Лимитирует диффузия Лимитирует химическая реакция
 5 возможных лимитирующих стадий протекания гетерогенно-каталитического процесса: • Адсорбция • Внешне диффузионный. Лимитирующая стадия - диффузия к поверхности катализатора. • Внешне кинетический. Лимитирующая стадия - реакция на поверхности. • Внутренняя диффузия. Лимитирующая стадия - диффузия вглубь катализатора. • Внутренняя кинетическая область. Лимитирующая стадия - химическая реакция внутри образца.
5 возможных лимитирующих стадий протекания гетерогенно-каталитического процесса: • Адсорбция • Внешне диффузионный. Лимитирующая стадия - диффузия к поверхности катализатора. • Внешне кинетический. Лимитирующая стадия - реакция на поверхности. • Внутренняя диффузия. Лимитирующая стадия - диффузия вглубь катализатора. • Внутренняя кинетическая область. Лимитирующая стадия - химическая реакция внутри образца.


