КАТАБОЛИЗМ АМИНОКИСЛОТ.ppt
- Количество слайдов: 29

КАТАБОЛИЗМ АМИНОКИСЛОТ

Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются специфическим реакциям, в результате которых синтезируются биологически активные соединения. Многие превращения аминокислот начинаются с отщепления α-аминогруппы от аминокислоты. Это происходит с помощью реакций: трансаминирования и дезаминирования.
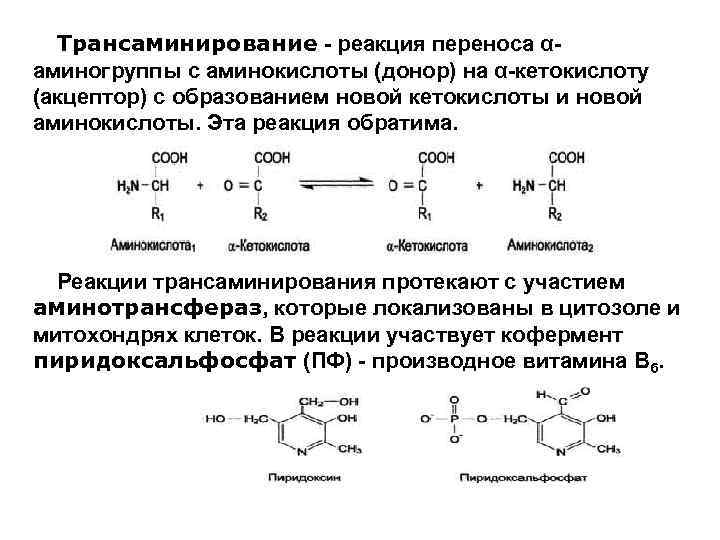
Трансаминирование - реакция переноса αаминогруппы с аминокислоты (донор) на α-кетокислоту (акцептор) с образованием новой кетокислоты и новой аминокислоты. Эта реакция обратима. Реакции трансаминирования протекают с участием аминотрансфераз, которые локализованы в цитозоле и митохондрях клеток. В реакции участвует кофермент пиридоксальфосфат (ПФ) - производное витамина В 6.

В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина. Наиболее активно идут реакции с участием глутамата, аланина, аспартата и соответствующих им кетокислот - αкетоглутарата, пирувата и оксалоацетата, причем основным донором аминогруппы является глутамат, а в качестве основного акцептора аминогруппы выступает α-кетоглутарат (α-КГ).

Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).

Реакции трансаминирования выполняют важные физиологические функции: • из α-кетокислот синтезируются аминокислоты, необходимые для существования клеток • происходит перераспределение аминного азота в тканях и органах • начинается катаболизм большинства аминокислот – первая стадия непрямого дезаминирования. Образующиеся α-кетокислоты вступают в общий путь катаболизма и используются в глюконеогенезе.

Наиболее важны с медицинской точки зрения ферменты аспартатаминотрансфераза (ACT) и аланинаминотрансфераза (АЛТ).

Фермент аспартатаминотрансфераза (ACT) катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом. Обычно второй субстрат из названия фермента исключается, если им является α-кетоглутарат – основной акцептор аминогрупп в организме. Так как реакция трансаминирования обратима, по субстратам обратной реакции этот же фермент носит название глутамат-оксалоацетатаминотрансферазы (ГОТ).

Реакцию трансаминирования между аланином и α -кетоглутаратом катализирует фермент аланинаминотрансфераза (АЛТ), причем по субстратам обратной реакции ему можно дать название глутаматпируватаминотрансферазы (ГПТ).

АЛТ обладает способностью к регуляции. Так, при длительном голодании количество АЛТ в клетках увеличивается, поскольку гормон кортизол индуцирует синтез этого фермента. Это связано с тем, что аланин продуцируется многими тканями и транспортируется кровью в печень, где используется в глюконеогенезе и поэтому считается основной гликогенной аминокислотой. Кроме того, аланин используется для переноса азота аминокислот в печень.

Аминотрансферазы АЛТ и ACT присутствуют во многих тканях, но наиболее активны в клетках печени и миокарда. АЛТ локализована в цитозоле клеток, а АСТ – в цитозоле и митохондриях. В печени наиболее активно трансаминируется аланин, а скорость трансаминирования аспартата ниже; в миокарде, наоборот, активность АСТ выше, чем АЛТ.

Оба фермента практически отсутствуют в крови здорового человека. Высокая активность ферментов в крови человека свидетельствует о воспалительных процессах, что дает возможность использовать определение активности АСТ и АЛТ для дифференциальной диагностики заболеваний печени и сердца.

Обычно определяют соотношение ACT/АЛТ в сыворотке крови (коэффициент де Ритиса). В норме этот коэффициент равен 1, 33± 0, 42. При инфаркте миокарда активность ACT в крови увеличивается в 8 -10 раз, а АЛТ - в 1, 5 -2, 0 раза. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает. При гепатитах активность АЛТ в сыворотке крови увеличивается в 8 -10 раз по сравнению с нормой, a ACT - в 2 -4 раза. Коэффициент де Ритиса снижается до 0, 6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
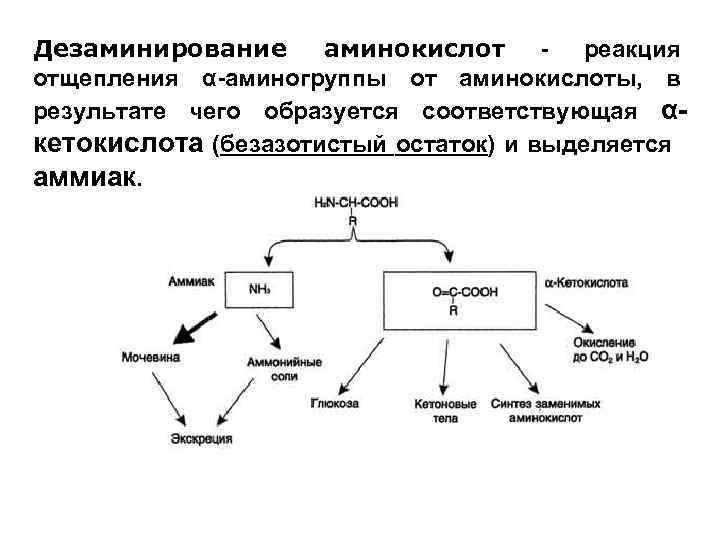
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая αкетокислота (безазотистый остаток) и выделяется аммиак.

Аммиак токсичен для ЦНС, поэтому в организме человека он превращается в хорошо растворимое соединение – мочевину и соли аммония. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кетогенеза, в реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО 2 и Н 2 О с образованием АТФ.

В отличие от трансаминирования, при дезаминировании общее количество аминокислот уменьшается, поэтому эти реакции можно рассматривать как путь катаболизма, общий для всех аминокислот. Дезаминированию подвергаются все аминокислоты, кроме лизина.

Существует несколько способов дезаминирования аминокислот: • окислительное (глутаминовая кислота); • непрямое (трансдезаминирование) для всех остальных аминокислот; • неокислительное (серин и треонин); • внутримолекулярное (гистидин).

Окислительное дезаминирование Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование αиминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется αкетоглутарат.

Окислительное дезаминирование глутамата обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, т. е. восстановительное аминирование α-кетоглутарата и образование глутамата.

Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, который в свою очередь используется в ЦТК как энергетический субстрат.

В печени и почках обнаружен фермент оксидаза Lаминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (р. Н 10, 0). В клетках, где р. Н среды близок к нейтральному, активность фермента снижена.
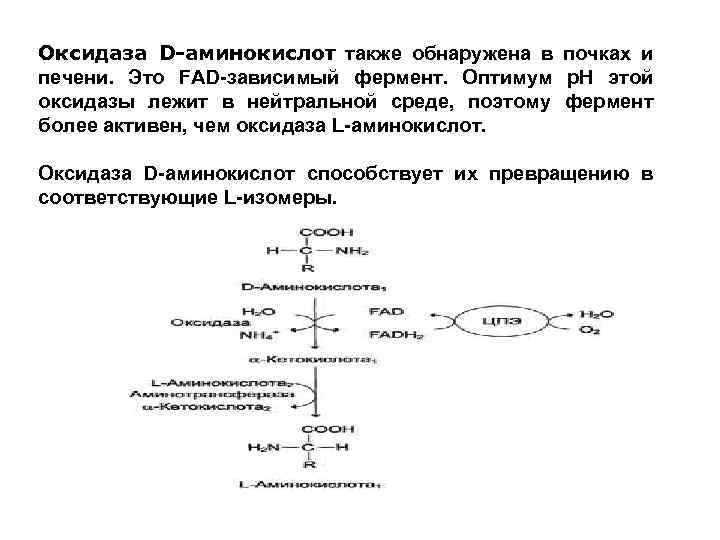
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум р. Н этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
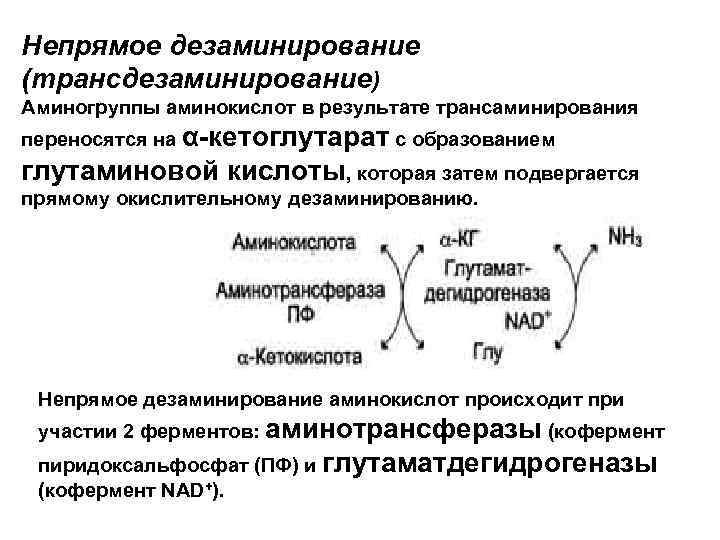
Непрямое дезаминирование (трансдезаминирование) Аминогруппы аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент пиридоксальфосфат (ПФ) и глутаматдегидрогеназы (кофермент NAD+).
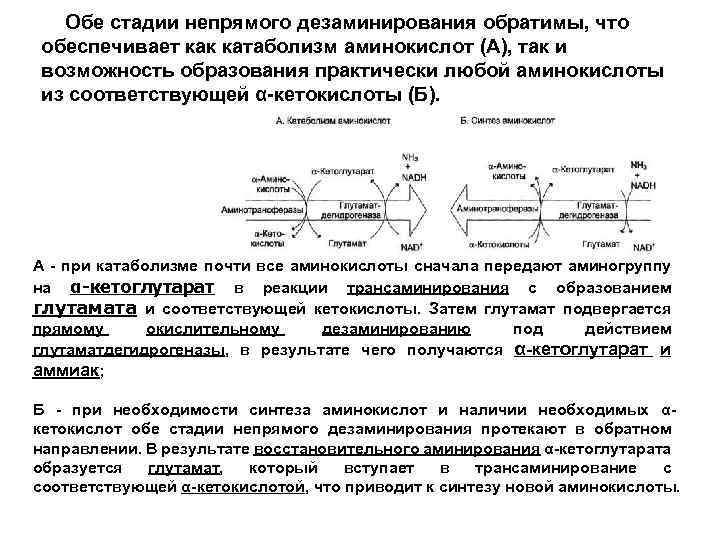
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот (А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (Б). А - при катаболизме почти все аминокислоты сначала передают аминогруппу на α-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются α-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых αкетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования α-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей α-кетокислотой, что приводит к синтезу новой аминокислоты.
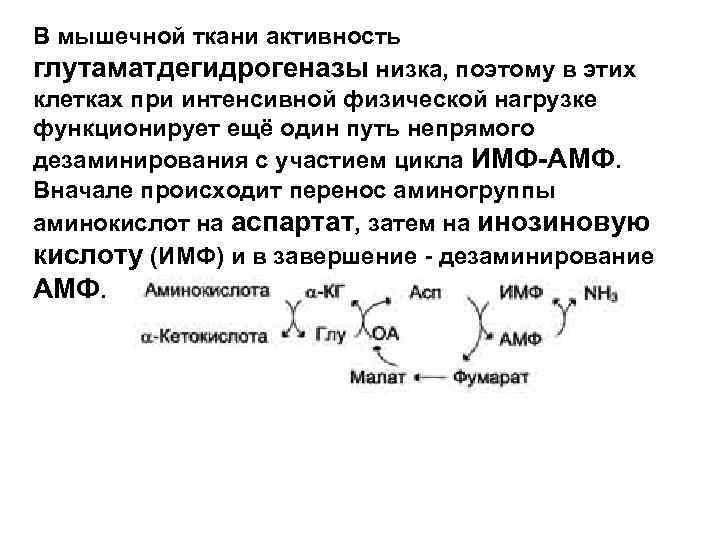
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ.

Можно выделить 4 стадии процесса: • трансаминирование с α-кетоглутаратом, образование глутамата; • трансаминирование глутамата с оксалоацетатом (фермент ACT), образование аспартата; • реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата; • гидролитическое дезаминирование АМФ.

Неокислительное дезаминировате В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём. Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с α-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
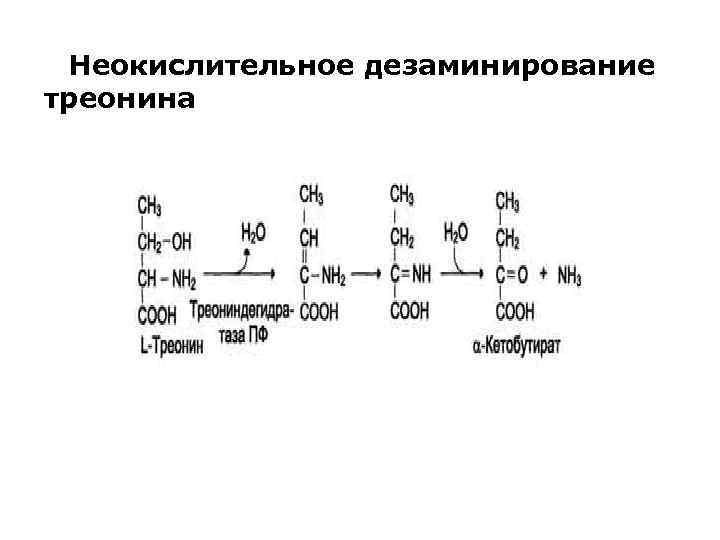
Неокислительное дезаминирование треонина
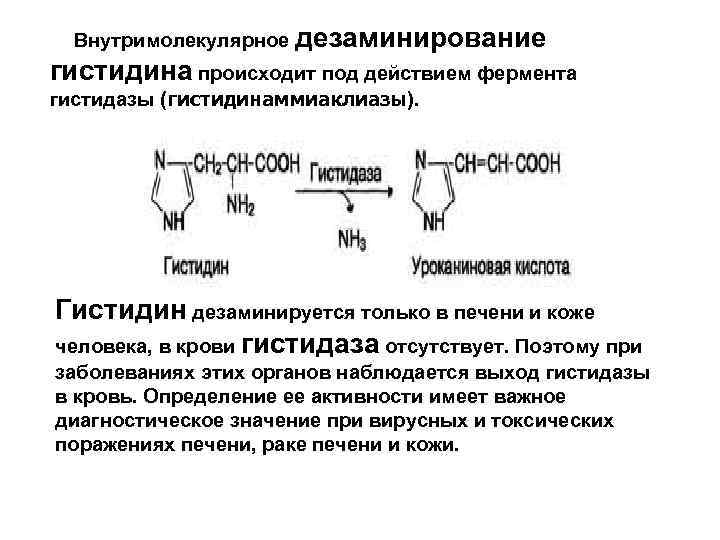
Внутримолекулярное дезаминирование гистидина происходит под действием фермента гистидазы (гистидинаммиаклиазы). Гистидин дезаминируется только в печени и коже человека, в крови гистидаза отсутствует. Поэтому при заболеваниях этих органов наблюдается выход гистидазы в кровь. Определение ее активности имеет важное диагностическое значение при вирусных и токсических поражениях печени, раке печени и кожи.
КАТАБОЛИЗМ АМИНОКИСЛОТ.ppt