Doklad_KE.ppt
- Количество слайдов: 51

Карцова А. А. , Бессонова Е. А. Санкт-Петербургский Государственный Университет 2010

1930 г. Аrne Tiselius (Нобелевская премия по химии, 1948 г. ) «за исследование электрофореза и адсорбционного анализа, особенно за открытие, связанное с комплексной природой белков сыворотки» . Arne Tiselius (1902 -1971 гг) Создал усовершенствованный метод электрофоретического анализа с различными модификациями: ü микроэлектрофорез, ü электрофорез на бумаге, ü иммуноэлектрофорез. Прибор для электрофореза Аrne Tiselius (1937 г. ) Фотографии миграционных зон: а) овальбумин, б) сыворотка крови лошади, в) альбумин 2

«…Предложенный мной метод был определенным шагом вперед, но он подвел меня к той черте, когда я , видя потенциальную возможность получения очень интересных результатов, был не в состоянии доказать что-либо определенное. Я до сих пор помню ощущение этого почти физического страдания, когда, глядя на некоторые электрофоретические фотографии, особенно сывороточных белков, я принял решение взяться за совершенно иную проблему…» А. Тизелиус «Раздумье о прошлом с разных точек зрения» 3

1930 г. А. Tiselius (Нобелевская премия по химии, 1948 г. ) 1967 г. S. Hjerten Электрофорез в кварцевых трубках (ɸ~3 мм). «Свободный зонный электрофорез» 1981 г. J. Jorgenson, K. Lukacs Теория зонного электрофореза в капиллярах (капилляры ɸ=75 мкм, 30 к. В). Hjerten, S. Chromatogr. Rev. 1967. V. 9. P. 122– 219. 4

А В 1981 г. J. Jorgenson, K. Lukacs Теория зонного электрофореза в капиллярах. (капилляры ɸ=75 мкм, 30 к. В). Электрофореграммы А) модельная система дансилпроизводных аминокислот и Б) биологическая жидкость. 30 к. В; капилляр: Ø 75 мкм; фосфатный буфер, р. Н 7, 0. В – eмеченый лизин, C – di-меченый лизин, D – лейцин, Е – серин, F – глицин, I – Цистеин, J глутаминовая кислота, К – аспарагиновая кислота, L – цистеиновая кислота А, G, H– неизвестные пики. J. W. Jorgenson, K. D. Lukacs. Free-zone electrophoresis in glass capillaries Clinical Chemistry, 1981. V. 27, 1551 -1553. 5

1930 г. А. Tiselius (Нобелевская премия по химии, 1948 г. ) 1967 г. S. Hjerten Электрофорез в кварцевых трубках (ɸ~3 мм). «свободный зонный электрофорез» 1981 г. J. Jorgenson, K. Lukacs Теория зонного электрофореза в капиллярах (капилляры ɸ=75 мкм, 30 к. В). 1984 г. S. Terabe Мицеллярная электрокинетическая хроматография (МЭКХ) 6

1984 г. S. Terabe Мицеллярная электрокинетическая хроматография (МЭКХ) Детекто р Электрофореграмма смеси фенолов. Боратный-фосфатный буфер, р. Н 7. 0, ДДСН. КЭ: 25 к. В. УФ: 270 нм. Пики: (1) вода, (2) ацетилацетат, (3) фенол, (4) о-крезол, (5) м-крезол, (6) п-крезол, (7) о-хлорфенол, (8) м-хлорфенол, (9) п-хлофенол, (10) 2, 6 -ксиленол, (11) 2, 3 -ксиленол, (12) 2, 5 ксиленол, (13) 3, 4 -ксиленол, (14) 3, 5 ксиленол, (15) 2, 4 -ксиленол, (16) п-этилфенол. Terabe, S. , Oksuka, K. , Ichikawa, K. , Tsuchiya, A. , Ando, T. Anal. Chem. 1984. V. 56. P. 111– 113. 7

1930 г. А. Tiselius (Нобелевская премия по химии, 1948 г. ) 1967 г. S. Hjerten Электрофорез в кварцевых трубках (ɸ~3 мм). «свободный зонный электрофорез» 1981 г. J. Jorgenson, K. Lukacs Теория зонного электрофореза в капиллярах (капилляры ɸ=75 мкм, 30 к. В). 1984 г. S. Terabe Мицеллярная электрокинетическая хроматография (МЭКХ) 1985 г. Gassman Первое хиральное разделение 8

1985 г Gassman Разделение дансилпроизводных энантиомеров аминокислот 1985 г. «Cu(II) – L-гистидин» 1987 г. «Cu(II) – L-аспартам» Комплекс L-L Комплекс L-D 9

1930 г. А. Tiselius (Нобелевская премия по химии, 1948 г. ) 1967 г. S. Hjerten Электрофорез в кварцевых трубках (ɸ~3 мм). «свободный зонный электрофорез» 1981 г. J. Jorgenson, K. Lukacs Теория зонного электрофореза в капиллярах (капилляры ɸ=75 мкм, 30 к. В). 1984 г. S. Terabe Мицеллярная электрокинетическая хроматография (МЭКХ) 1985 г. Gassman Первое хиральное разделение 1988 г. серийный выпуск приборов КЭ (P/ACE 2000) Beckman Coulter 1988 г. A. Guttman первое использование циклодекстрина в КЭ. 10

1990 -е гг. – на пути к КЭХ 1974 г. Pretorius Капиллярная электрокинетическая хроматография (КЭХ). Показал возможность использования ЭОП в качестве движущей силы элюента через хроматографическую колонку *. 1980 -1983 гг. J. Jorgenson, K. Lukacs - впервые продемонстрировали возможности КЭХ на примере разделения неионных соединений * Pretorius, V. , Hopkins, B. J. , Schieke, J. D. // J. Chromatogr. 1974, V. 99, P. 23– 30. 11

1990 -ые г. г. - μ-chip СЕ (MCE). 1991 г. Watarai Микроэмульсионная электрокинетическая хроматография (МЭЭКХ) 1996 г. Отечественные системы КЭ «Люмэкс» 12

Методы капиллярного электрофореза КЗЭ (CZE) МЭКХ (MEKC) МЭЭКХ (MEEKC) • Капиллярный зонный электрофорез • (Capillary Zone Electrophoresis) • Мицеллярная электрокинетическая хроматография • (Micelle Electrokinetic Cromatography) • Микроэмульсионная электрокинетическая хроматография • (Micelle Microemultion Electrokinetic Chromatography КГЭ (CGE) • Капиллярный гель-электрофорез • (Capillary Gel Electrophoresis) КИЭФ (с. IEF) • Капиллярное изоэлектрофокусирование • (Capillary Isoelectric Focusing) КИТФ (CITF) • Капиллярный изотахофорез • (Capillary Isotachphoresis) ХКЭ • Хиральный капиллярный электрофорез • (Chiral Capillary Electrophoresis) Неводный (NACE) • Неводный капиллярный электрофорез • (Nonaqueous Capillary Electrophoresis) АКЭ (ACE) • Афинный капиллярный электрофорез КЭХ (CEC) • Капиллярная электрохроматография • (Capillary Electrochromatography) 13

14

Методы капиллярного электрофореза Капиллярный зонный электрофорез (CZE) Определение заряженных аналитов Органические и неорганические ионы, аминокислоты, белки, пептиды Мицеллярная электрокинетическая хроматография (MEKC) Определение нейтральных аналитов, изменение селективности разделения заряженных аналитов. Витамины, стероиды, аминокислоты, лекарства Капиллярный гель электрофорез (CGE) Разделение биополимеров с одинаковым соотношением и разной Белки, олигонуклеотиды, фрагменты ДНК, полисахариды 15

Методы капиллярного электрофореза Капиллярное изоэлектрофокусирование (СIEF) Капиллярный изотахофорез (CITP) Определение амфотерных соединений Гемоглобин, белки, изоформы гликопротеина, иммуноглобулины Определение катионов и анионов. Используется для on-line концентрирования Белки, пептиды Хиральный электрофорез Разделение энантиомеров (Сhiral Electrophoreses) Лекарственные препараты, природные вещества. 16

Методы капиллярного электрофореза Неводный электрофорез (Nonaqueous Electrophoresis) Разделение веществ гидрофобных или не разделяемых в водной среде Лекарства, консерванты, ПАВ, неорганические ионы. Капиллярная электрохроматография (CEC) Определение нейтральных и ионогенных аналитов. Сочетание возможностей КЭ и ВЭЖХ Белки, пептиды, стероидные гормоны. 17

Мицеллярная электрокинетическая хроматография МЭКХ, норм. полярность (МЭКХ) р. Н 7, 5 Детектор МЭКХ, обращ. полярность (ОП МЭКХ) p. H 2, 0 Детектор 18

ПАВ катионной и анионной природы • Ионные Додецилсульфат натрия (ДДСН) • Неионные, ЦТАБ • Цвиттерионные, • Смешанные Микроэмульсии МЭЭКХ – 1991 г. Х. Ватараи Детект ор Образование микроэмульсии Капля углеводорода Капля микроэмульсии 19

Сравнение методов МЭКХ с нормальной и обращенной полярностью и МЭЭКХ при определении полифенолов и кофеина МЭКХ с обращенной полярностью 40 m. AU МЭЭКХ с обращенной полярностью ГКГ ЭК ЭГКГ 75 m. AU Коф Т=25 °С. 2 ЭКГ 1 – ЭКГ 2 – ГКГ 3 – ЭГКГ 4 – ЭК 5 - ЭГК 1 Capel 7 8 9 10 11 12 13 14 15 16 3 мин 4 5 Рабочий электролит: 10 м. М ацетат натрия, 50 м. М лимонная кислота, 120 м. М ДДСН, р. Н 2, 0 Ввод пробы: 600 мбар*с; 25 к. В; λ=200 нм Capel 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 мин Рабочий электролит: микроэмульсия в 10 м. М ацетата аммония и 150 м. М муравьиной кислоты, р. Н 2, 0. Ввод пробы: 600 мбар*с; 25 к. В; λ=200 нм 1. Карцова Л. А. , Ганжа О. В. Журнал Аналит. Химии. 2009. Т. 64. № 5. С. 534 – 539. 2. Карцова Л. А. , Ганжа О. В. , Хмельницкий И. К. Сорбционные и хроматографические процессы. 20 2009. Т. 9. Вып. 1. С. 33 -42.

Микроэмульсионная ЭКХ стероидов 1 -МЭЭКХ (норма. полярность) р. Н 9, 2 2 -МЭЭКХ (обращ. полярность) р. Н 2, 0 2 200 1 N*104, т. т. /м 160 120 80 40 0 Doc Ганжа О. В. Кандидатская диссертация 2007 г, СПб F E 21
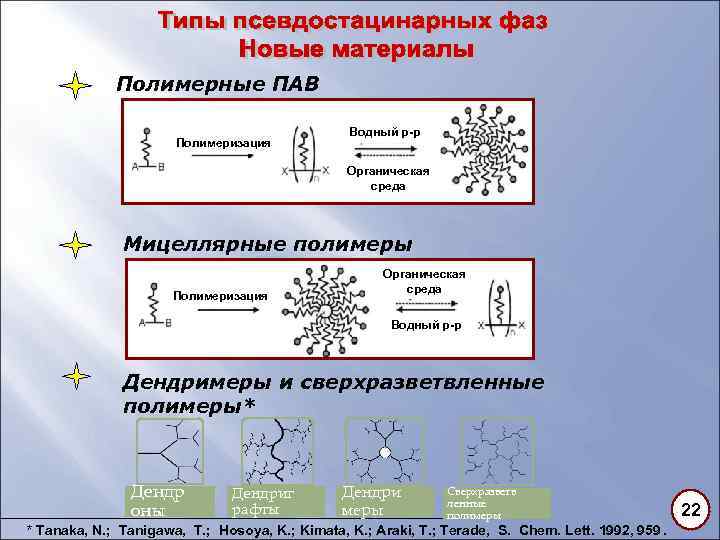
Полимерные ПАВ Полимеризация Водный р-р Органическая среда Мицеллярные полимеры Полимеризация Органическая среда Водный р-р Дендримеры и сверхразветвленные полимеры* Дендр оны Дендриг рафты Дендри меры Сверхразветв ленные полимеры * Tanaka, N. ; Tanigawa, T. ; Hosoya, K. ; Kimata, K. ; Araki, T. ; Terade, S. Chem. Lett. 1992, 959. 22

Мицеллярные полимеры Использование в качестве псевдостационарной фазы для разделения β-блокаторов Структура мицеллярных полимеров 1, 1' = атенолол, 2, 2' = метопролол, 3, 3' = пиндолол, 4, 4' = окспренолол, 5, 5' = талинолол, 6, 6' = алпренолол, 7, 7' = пропранолол. Условия: p. H 8. 8, 25 м. М NH 4 OAc/25 м. М TEA, 25 °C. n=8 Poly-L-SOc. CL n=9 Poly-L-SNo. CL n=10 Poly-L-SDe. CL n=11 Poly-L-SUCL 23
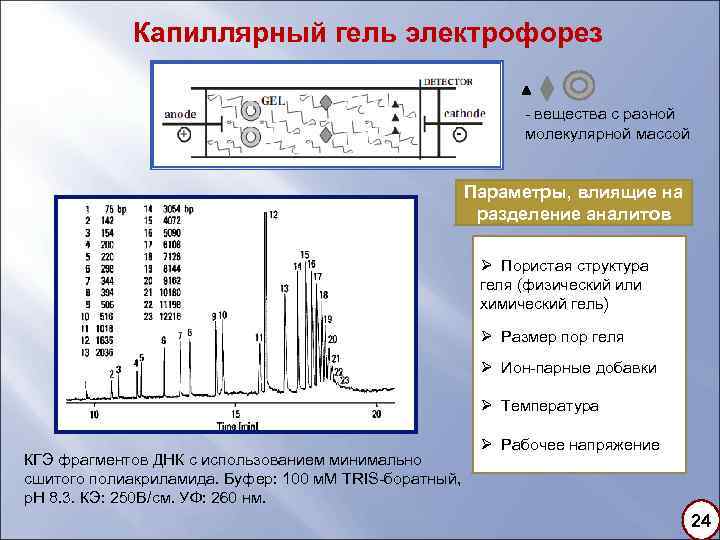
Капиллярный гель электрофорез - вещества с разной молекулярной массой Параметры, влиящие на разделение аналитов Ø Пористая структура геля (физический или химический гель) Ø Размер пор геля Ø Ион-парные добавки Ø Температура КГЭ фрагментов ДНК с использованием минимально сшитого полиакриламида. Буфер: 100 м. М TRIS-боратный, р. Н 8. 3. КЭ: 250 В/см. УФ: 260 нм. Ø Рабочее напряжение 24

Стратегия выбора метода АНАЛИТ да Поглощение УФ-области нет р. Ка Ионный Mr Низкомолекулярный КЗЭ ЛОКЭ Неводный КЭ МЭКХ МЭЭКХ NACE да ЛОКЭ с УФдетектированием Высокомолекулярный КЗЭ Ионный Нейтральный СITF CGE CIEF Комплексообразование Нейтральный нет КЗЭ с косвенным детектированием МЭКХ МЭЭКХ NACE 25

Медицина Биохимия Определение Физико-химических констант Фармацевтика КЭ Хиральное разделение Пищевая промышленность ? Экологический мониторинг 26

Публикации КЭ в клинической диагностике г. г. – нуклеозиды, нуклеотиды, РНК, ДНК – метаболиты, лекарства – полипептиды 27

Капиллярный электрофорез Достоинства Высокая эффективность ( ~105 т. т. /м. ) и разрешение Небольшой вводимый объем пробы (2– 10 нл) Экспрессность Совместимость с МС Ограничения Недостаточная селективность Недостаточная воспроизводимость, Низкая селективность и энантиоселективность, Низкая УФ-концентрационная чувствительность 28

Проблемы анализа биополимеров Необратимая адсорбция биополимеров на стенках кварцевого капилляра и силикагеля Ухудшение эффективности, разрешения пиков, воспроизводимости анализа Электростатические взаимодействия белков с активными центрами сорбента Решение Ковалентное покрытие Полиакриламид, поливиниловый спирт, полиэтиленгликоль, поливинпирролидон, дендримеры Динамическое покрытие Полиамины, катионные ПАВ (ЦТАБ), сверхразветвленные полимеры (дендримеры) 29

КЗЭ Ковалентное покрытие сульфопропилметакрилатом Схема реакций, протекающих при ковалентном Зависимость подвижности ЭОП от р. Н 1, 2 - модифицированный капилляр покрытии сульфопропилметакрилатом 3, 4 - непокрытый капилляр Bessonova E. A. , Kartsova L. A. , Shmukov A. U. Electrophoretic determination of albumin in urine using on 30 line concentration techniques. // J. Chromatogr. A. 2007. V. 1150. № 1 -2. P. 332 -338.

Сверхразветвленные полимеры в КЭХ Структура покрытия 31 Электрофореграмма смеси основных белков на: (a) немодифицированном капилляре; капилляре с сверх-разветвленным покрытием (b) 5 генерации; (c) 6 генерации; (d) 7 генерации. 1 – цитохром Ц; 2 – лизоцим; 3– α-химотрипсиноген A Электрофореграммы эпинефрина Электрофореграммы пирролопиридина G 1 C 18 Пиридил Без покрытия Пиридил C 18 Без покрытия

Поглощение (m. AU) Разделение полифенолов с использованием ионных жидкостей на основе 1 -алкил-3 метилимидазолиевых солей (BF 4−, NO 3−, PF 6−, CF 3 SO 3−) Определение полифенолов в различных сортах винограда (А – С); D – стандартные растворы полифенолов Время (мин) 32

Влияние 18 -краун-6 на разделение биогенных аминов (КЗЭ) 1 Рабочий электролит: 1% -ный раствор Ac. OH, 30 м. M ТЭА 210 нм 2 Рабочий электролит: 1% -ный раствор Ac. OH, 30 м. M ТЭА, 10 м. М 18 -к-6 210 нм 1. Карцова Л. А. , Сидорова А. А. , Иванова А. С. Электрофоретическое определение биогенных аминов в биологических жидкостях. // Журнал аналит. Хим. 2007. Т. 62. № 10. С. 1066 – 1072. 2. Карцова Л. А. , Сидорова А. А. , Ганжа О. В. Определение катехоламинов и их метаболитов в различных режимах капиллярного электрофореза с использованием макроциклических и ион-парных реагентов. 33 Сорбционные и хроматографические процессы. 2008. Т. 8. Вып. 1. С. 75 -82.

Определение ВМА и ГВА в моче (КЗЭ; в составе рабочего буфера 1 м. М Cu 2+ ) ВМА Cu 2+ Y Y Rs (X/ВМА) = 0, 44 Rs (ВМА/ГВА) = 1, 42 Rs (ГВА/Y) = 1, 55 ГВА Маркова О. И. Кандидатская диссертация. 2007. Rs (X/ВМА) = 1, 41 Rs (ВМА/ГВА) = 2, 23 Rs (ГВА/Y) = 2, 56 34
![Обнаружение глюкозы в режиме ЛОКЭ с УФ-детектированием [Cu(NH 3)4]2+ + S- [Cu(NH 3)2 S]+ Обнаружение глюкозы в режиме ЛОКЭ с УФ-детектированием [Cu(NH 3)4]2+ + S- [Cu(NH 3)2 S]+](https://present5.com/presentation/25191043_137903938/image-35.jpg)
Обнаружение глюкозы в режиме ЛОКЭ с УФ-детектированием [Cu(NH 3)4]2+ + S- [Cu(NH 3)2 S]+ + 2 NH 3 λmax = 245 нм «Agilent» ; детектор на диодной матрице: 200 – 600 нм рабочий электролит: 1 м. М Cu 2+, 175 м. М NH 3; проба: 200 мг/л глюкозы в воде 35

Одновременное определение сахаров и неорганических катионов методом ЛОКЭ-УФ сыворотка крови до диализа диализирующий раствор 36 сыворотка крови после диализа 5 5 5 1 1 4 4 4 2 2 2 3 3 3 1 – K+; 2 – Na+; 3 – системный пик; 4 – ЭОП; 5 – глюкоза Определение глюкозы и неорганических катионов в сыворотке крови Концентрация, г/л глюкоза норма Na+ K+ 0, 8 – 1, 2 2, 5 – 4, 1 0, 6 – 2, 7 до диализа после диализа Образец 1 0, 56 ± 0, 02 1, 02 ± 0, 02 3, 62 ± 0, 07 6, 65 ± 0, 12 0, 73 ± 0, 02 0, 66 ± 0, 02 Образец 2 0, 32 ± 0, 02 0, 89 ± 0, 02 3, 87 ± 0, 08 4, 50 ± 0, 10 0, 82 ± 0, 02 0, 88 ± 0, 03 Карцова Л. А. , Алексеева А. В. Журн. аналит. . хим. 2008. Т. 63. № 11 С. 1126 -1136.

Методы on-line концентрирования в КЭ Варьирование электрофоретических подвижностей аналитов Использование дополнительно (псевдостационарной) фазы -Поверхностно-активные вещества - р. Н буфера - ЦД, - органические растворители - различные добавки в буферный электролит -микроэмульсия (мицеллы, ЦД, ион-парные реагенты) 37

Основные методы on-line концентрирования в КЭ Стэкинг Изотахофоретические методы Динамический р. Н скачок Свипинг Свойства электролитов, которые используются в процессе концентрирования аналитов Проводимость (ионная сила) Подвижность ко-иона электролита р. Н буфера Концентрация мицелл Селективность концентрирования Ионные аналиты (заряд, подвижность) Слабые электролиты (кислоты или основания) или цвиттер-ионные (p. Ka) Ионные и нейтральных аналиты 38

Стэкинг с усилением поля 1950 г. - S. Haglund, A. Tiselius. Zone electrophoresis in a glass powder column. // Acta chemical Scandinavica. 1950. V. 4. P. 957. КЗЭ УФ µЭОП А FASS (field amplified sample stacking) Б + µЭФ + + Буферный Раствор ++ + + электролит пробы + Буферный электролит + + + + - Область низкой проводимости, Область высокой Высокое электрическое поле проводимости МЭКХ NSM (normal stacking mode) + µЭФ Буферный электролит µЭОП Буферный электролит - Е Сила электрического поля 39

Схема свипинга в кислой среде с добавкой β-ЦД в состав раствора пробы Карцова Л. А. , Бессонова Е. А. Определение стероидов в биологических объектах методом мицеллярной электрокинетической хроматографии// Журн. Аналит. химии 2007. Т. 62. № 1. С. 76 – 84. Карцова Л. А. , Стрельникова Е. Г. Определение эндо- и экзогенных кортикостероидов циклодекстринмодифицированной мицеллярной электрокинетической хроматографией с использованием on-line 40 концентрирования. // Журн. Аналит. химии 2007. Т. 62. № 8. С. 797 – 802.

Оптимизация метода свипинга для смеси стероидных гормонов A B Электрофореграмма смеси, содержащей 2, 5 g/ml (1) прогестерон, (2) 11 дезоксипрогестерон, (3) 17 -гидроксипрогестерон, (4) 11 -дезоксикортикостерон, (5) кортикостерон, (6) 11 -дегидрокортикостерон, (7) кортизон, (8) кортизол. Матрица образца, буферный раствор (без SDS) с той же проводимостью, что и BGS и с добавлением 5 m. M -CD. Буфер для электрофореза: 25 m. M H 3 PO 4 (p. H = 2, 5), 10 m. M SDS, 4, 5 M мочевина. Ввод: (A) 60 mbar s, (B) 3000 mbar Карцова Л. А. , Бессонова Е. А. Методы концентрирования в капиллярном электрофорезе. Журнал Аналит. Химии. 2009. Т. 64. № 4. С. 340 – 351. 41

Хиральные селекторы Циклодекстрины (ЦД) ЦД + краун-эфир ЦД (Chira. Dex–βциклодекстрин) Хиральные краун-эфиры Макроциклические антибиотики (тейкопланин, ванкомицин, Hepta-Tyr) Полисахариды [Chiralcel OD – целлюлоза трис(3, 5 диметилфенилкарбамат), целлюлоза триацетат] 42

Хиральные селекторы Белки (альбумин, овидин) Каликсарены Соли желчных кислот Нанотрубки Полимеры с молекулярным отпечатком Хиральные ПАВ (мицеллы, микроэмульсии) 43

Анионные ЦД Катионные ЦД Monoderivatives R 6 = 6 R 6 Bis Derivatives R 3 R 2 A = R 2 B= Perderivatives R 6 = R 2 = 3 3 Perderivatives R 6 = R 2, R 3 = R 2 , R 3 = 44
![Структуры комплексов для хирального лигандообменного КЭ [Cu(CDmh)(L-Trp)] [Cu(CDhm)(D-Trp)] [Cu(CDmh) (D-Trp)] [Cu(CDhm)(L-Trp)] 45 Структуры комплексов для хирального лигандообменного КЭ [Cu(CDmh)(L-Trp)] [Cu(CDhm)(D-Trp)] [Cu(CDmh) (D-Trp)] [Cu(CDhm)(L-Trp)] 45](https://present5.com/presentation/25191043_137903938/image-45.jpg)
Структуры комплексов для хирального лигандообменного КЭ [Cu(CDmh)(L-Trp)] [Cu(CDhm)(D-Trp)] [Cu(CDmh) (D-Trp)] [Cu(CDhm)(L-Trp)] 45

Новые тенденции в КЭ

Схема синтеза комплекса SWNTs-BSA Очистка Разрезание HNO 3 (конц) Однослойные нанотрубки (SWNT) Перемешивание (4 часа) Очищенные SWNT HNO 3 (конц) /H 2 SO 4 (конц) ультразвук (8 час. ) Укороченные SWNT Активация амидированием (EDAC) ультразвук перемешивание Модифицированные SWNT-BSA X. Weng, H. Bi, B. Liu, J. K. Electrophoresis, 2006. V. 27. , P. 3129 -3135 47

Ток (м. А) Хиральное разделение D, L-триптофана с использованием BSASWNT, иммобилизованных в полиметилметакрилатном микрочипе Время (с) a) В отсутствие SWNT-BSA b) 0, 025 мг/мл SWNT -BSA Время (с) с) 0, 075 мг/мл SWNT -BSA Фосфатный буфер р. Н 7, 4 Длина разделительного канала 32 мм Амперометрическое детектирование 0. 6 V 34

Времяпролётный масс-спектрометр Капиллярный Электрофорез Ионизация Заболевания Биологические жидкости Диабетическая нефропатия Моча Почечные заболевания Моча Почечная трансплантация Моча Рак мочевого пузыря Моча Рак простаты Моча Пересадка ткани Моча Сепсис Кровь Получение данных Образец База данных Вероятность положительной биопсии Схема КЭ−МС анализа биологических жидкостей для поиска биомаркеров различных заболеваний Болезнь Альцгеймера Кровь, Спиномозговая ж-ть 48

Примеры приготовления образцов и стратегии анализа Биологическая жидкость Схема А Пример подготовки пробы к анализу на основе афинного взаимодействия: Иммуноконцентрирование и иммуноочистка, используется для разделения сложных биологических смесей. - белки, - сыворотка, промывка Иммуноконцентри рование Иммуноочистка введение образца элюирование Схема B Прямой и конкурентный иммуноафинный анализ, используемый в АКЭ. - сорбент или монолит, функционализированный афинным реагентом, специфичным к белку. Прямая иммунообработка Конкурентная иммунообработка Аффинный реагент Антиген Флуоресцирующая проба 49

Doklad_KE.ppt