КАРБОНОВЫЕ КИСЛОТЫ (КК) Функц.

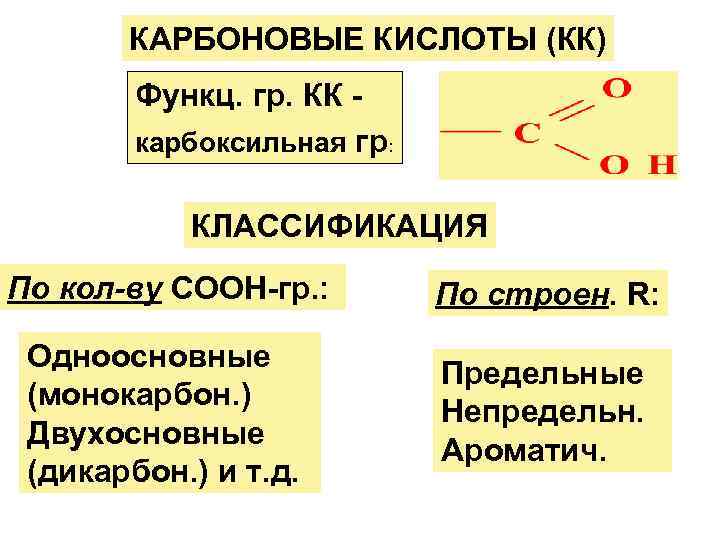
КАРБОНОВЫЕ КИСЛОТЫ (КК) Функц. гр. КК - карбоксильная гр: КЛАССИФИКАЦИЯ По кол-ву СООН-гр. : По строен. R: Одноосновные Предельные (монокарбон. ) Непредельн. Двухосновные Ароматич. (дикарбон. ) и т. д.
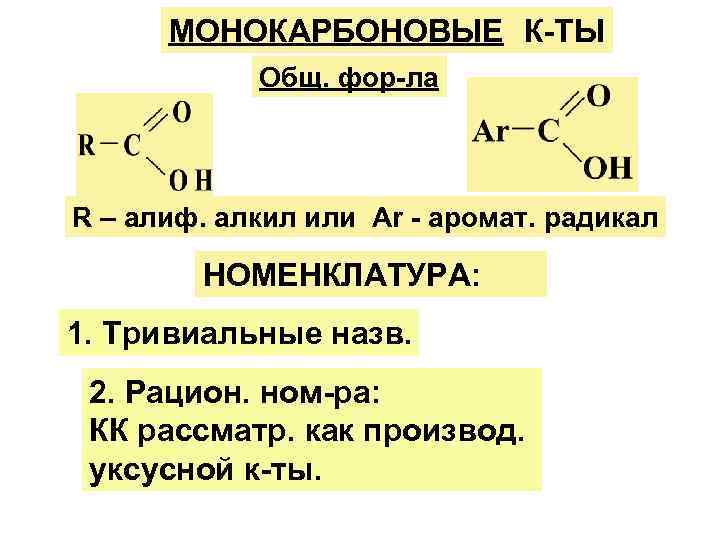
МОНОКАРБОНОВЫЕ К-ТЫ Общ. фор-ла R – алиф. алкил или Ar - аромат. радикал НОМЕНКЛАТУРА: 1. Тривиальные назв. 2. Рацион. ном-ра: КК рассматр. как производ. уксусной к-ты.
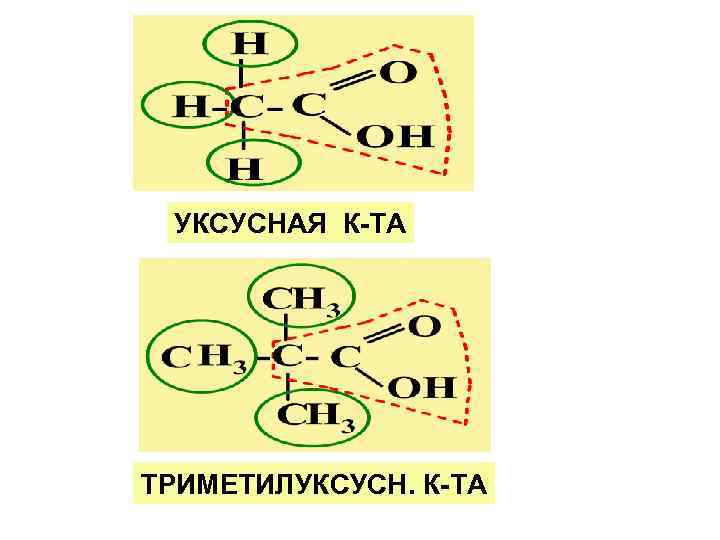
УКСУСНАЯ К-ТА ТРИМЕТИЛУКСУСН. К-ТА

3. ИЮПАК По ИЮПАК назв. КК : назв. соответств. у/в +овая кислота. Нумерация - от С-атома, входящ. в СООН. ЖИРНЫЕ к-ты - монокарбон. к-ты с алкильн. или алькенильн. R входят в виде сложн. эф. в состав жиров и масел).
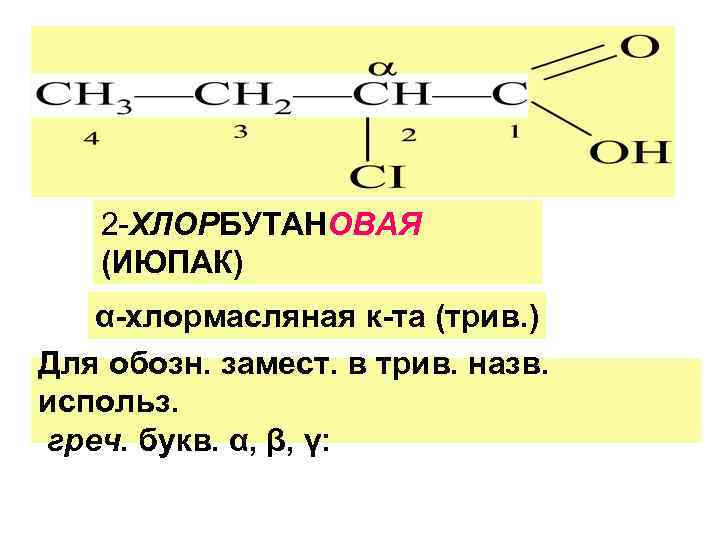
2 -ХЛОРБУТАНОВАЯ (ИЮПАК) α-хлормасляная к-та (трив. ) Для обозн. замест. в трив. назв. использ. греч. букв. α, β, γ:
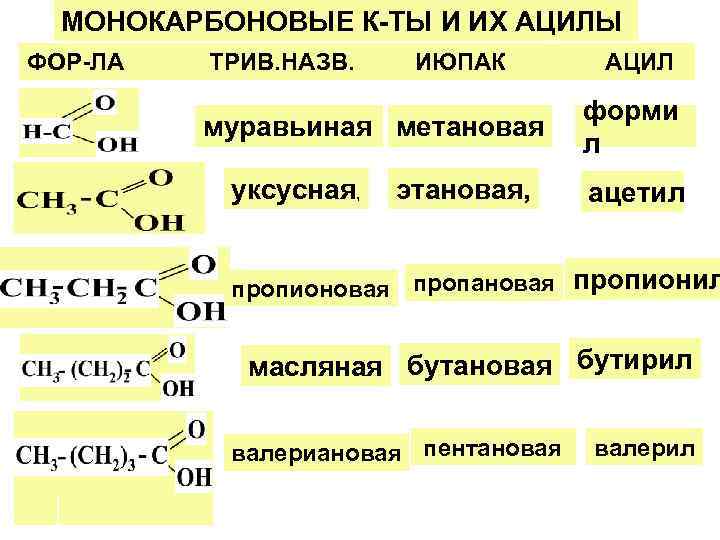
МОНОКАРБОНОВЫЕ К-ТЫ И ИХ АЦИЛЫ ФОР-ЛА ТРИВ. НАЗВ. ИЮПАК АЦИЛ форми муравьиная метановая л уксусная, этановая, ацетил пропионовая пропановая пропионил масляная бутановая бутирил валериановая пентановая валерил
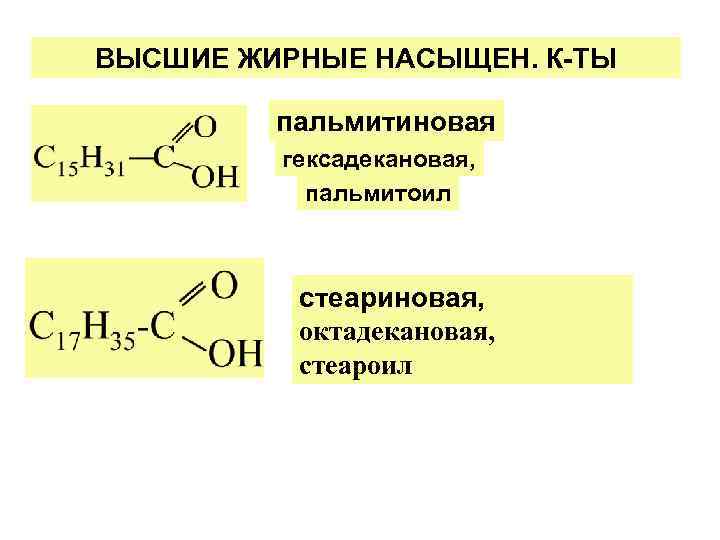
ВЫСШИЕ ЖИРНЫЕ НАСЫЩЕН. К-ТЫ пальмитиновая гексадекановая, пальмитоил стеариновая, октадекановая, стеароил
![Способы получения 1. Окисл. различ. у/в: R-CH 3 [O] Способы получения 1. Окисл. различ. у/в: R-CH 3 [O]](https://present5.com/presentation/3/3824820_29984204.pdf-img/3824820_29984204.pdf-8.jpg)
Способы получения 1. Окисл. различ. у/в: R-CH 3 [O] R-COOH Окис-ли : KMn. O 4, K 2 Cr 2 O 7, HNO 3 2. Окисл. перв. спиртов, альдег. и кетонов (см. соотв. разделы) 3. Карбонилирование (промышл. способ) а ) алкенов и алкинов (оксо-синтез): H 2 C=CH 2+ CO + H 2 O Т С, кат. Р О CH 3 -CH 2 -COOH пропионовая к-та
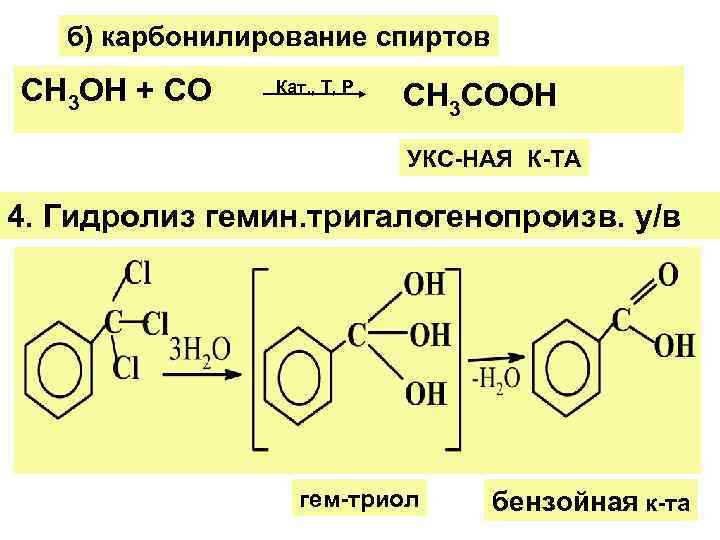
б) карбонилирование спиртов СН 3 ОН + СО Кат. , Т, Р СН 3 СООН УКС-НАЯ К-ТА 4. Гидролиз гемин. тригалогенопроизв. у/в гем-триол бензойная к-та
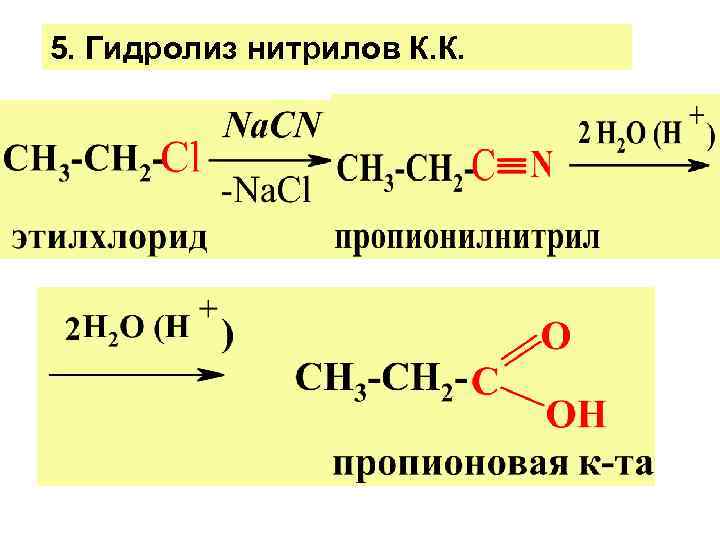
5. Гидролиз нитрилов К. К.
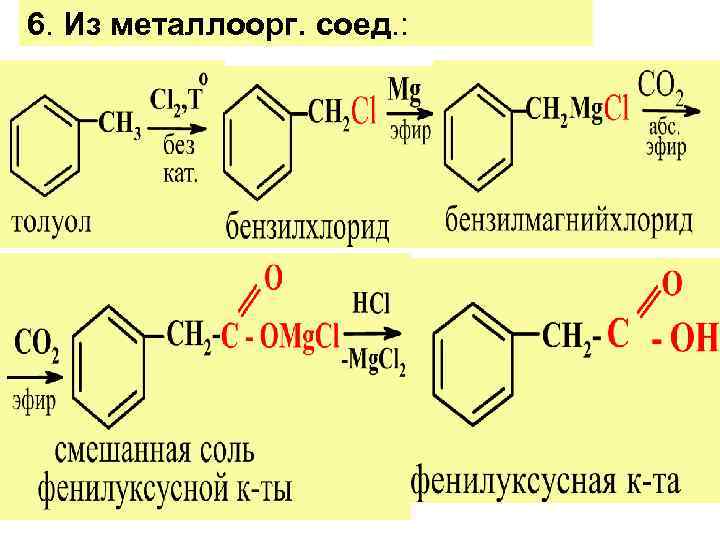
6. Из металлоорг. соед. :
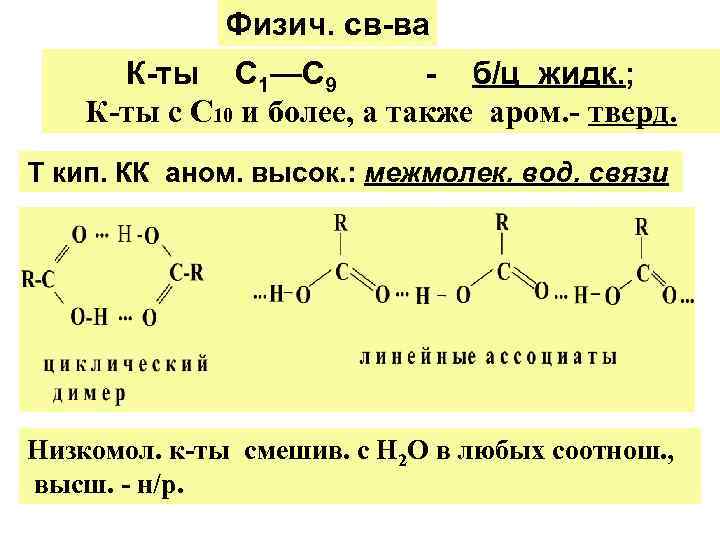
Физич. св-ва К-ты С 1—С 9 - б/ц жидк. ; К-ты с С 10 и более, а также аром. - тверд. Т кип. КК аном. высок. : межмолек. вод. связи Низкомол. к-ты смешив. с Н 2 О в любых соотнош. , высш. - н/р.

Строение и реакц. способн. СООН –гр. Реакц. способ. К. К. обусл. карбоксигруп. : в карбоксигруп. : атом С в sp 2 – гибр. ; три вида поляр. связей: С=О, С-О и О-Н поляр. связи С=О и С-О неравноценны. Вален. угол ОСО ~ 118 - 121 град
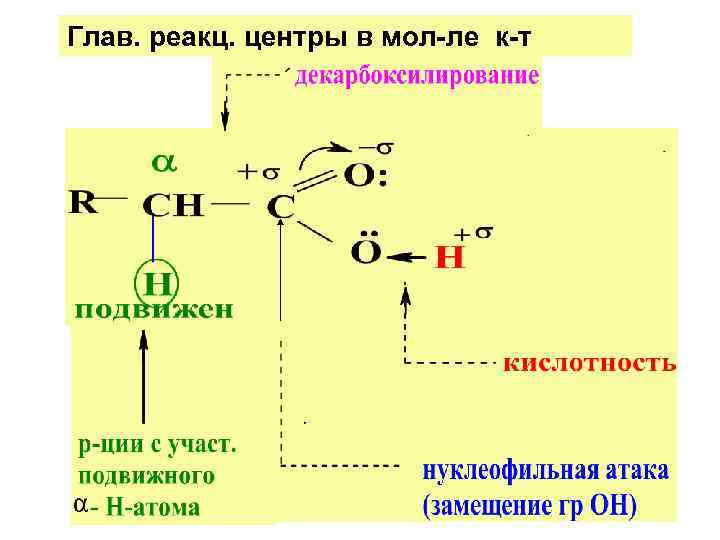
Глав. реакц. центры в мол-ле к-т

ХИМ. СВ-ВА КАРБ. К-Т Кис-ты вступают в р-ции: 1) иллюстр. кислот. св-ва; 2) нуклеоф. замещ. у ацил. атома С; 3) декарбоксилирования; 4) замещ. при α-углер. атоме К. К. ; 5) восстановл. К. К.
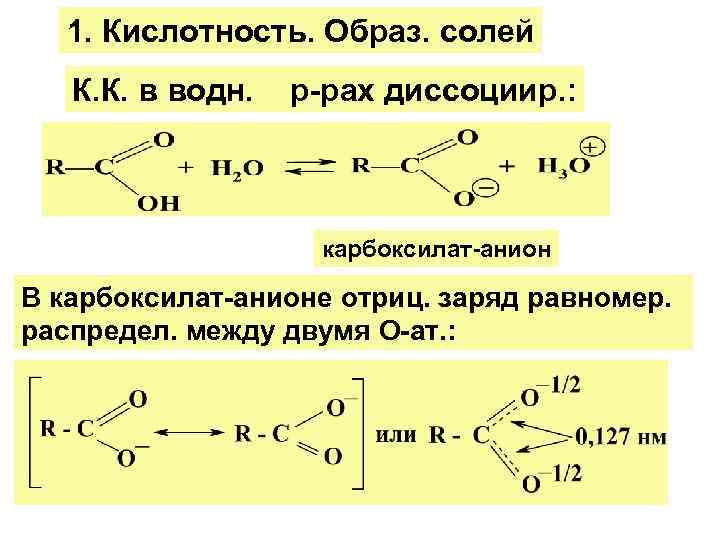
1. Кислотность. Образ. солей К. К. в водн. р-рах диссоциир. : карбоксилат-анион В карбоксилат-анионе отриц. заряд равномер. распредел. между двумя О-ат. :

Карб. к-ты – слабые: р. Ка ~ 4, 75 -4, 85 На кисл. св-ва К. К. влияет строение R: электроноакцептор. заместит. (галогены, NО 2 -, ОН-, карбонил. гр. и др. ) усилив. кислот-сть, электронодонор. (алкилы, арилы, и т. п. ) – снижают.

Сl 3 С-СООН > СН 3 -СН 2 -СООН 0, 75 4, 75 4, 85 -I-эффект + I-эффект По мере удален. заместителя от СООН- гр. его влияние на кислот-сть ослабевает
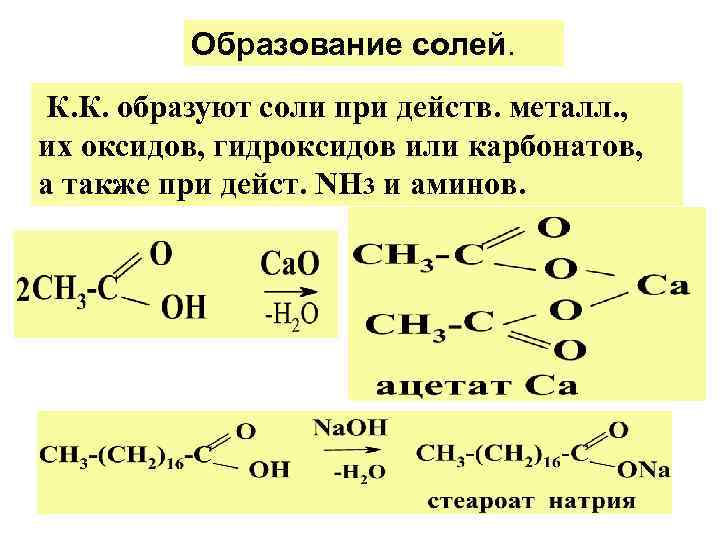
Образование солей. К. К. образуют соли при действ. металл. , их оксидов, гидроксидов или карбонатов, а также при дейст. NH 3 и аминов.

Карб. к. вытесняют Н 2 СО 3 из ее солей, что использ. как кач. р-ция на СООН- гр. в орг. соед: 2 CH 3 COOH +Na 2 CO 3 CH 3 COONa + +CO 2 +H 2 O Р-ции солей карб. к-т. 1. Электрохим. диссоц. солей К. К. ( см. синтез алканов по Кольбе). 2. Сплавление солей К. К. со щелочами (см. синтез алканов). 3. Пиролиз солей К. К. (см. способ. получ. оксосоед. )

2. Р-ции нуклеоф. замещ. В р-циях SN ОН-гр. карб. к-т замещ-ся на друг. нуклеофил. В рез-те образ. функц. произв. карб. к-т Эти р-ции назыв. ацилированием, т. к. происх. введен. в мол-лу ацил. R—CO- Важнейш. ацил. гр. : ацетил СН 3 СО-, формил НСО-, бензоил С 6 Н 5 СО-.

Различ. след. р-ции ацилир. : : О — ацилир. (спирт, фенол. , и кис-т); N — ацилир. (аммиака и аминов); С — ацилир. (аромат. у/в). Р-ция у sp 2 -гибрид. С-атома карбоксигр. проходит по двухстадийному мех-зму присоед. – отщепл. Катализ: кис-ты и основ. В рез-те образ-ся функц. произв. карб. к-т: галогенангидриды, сложные эфиры, амиды.
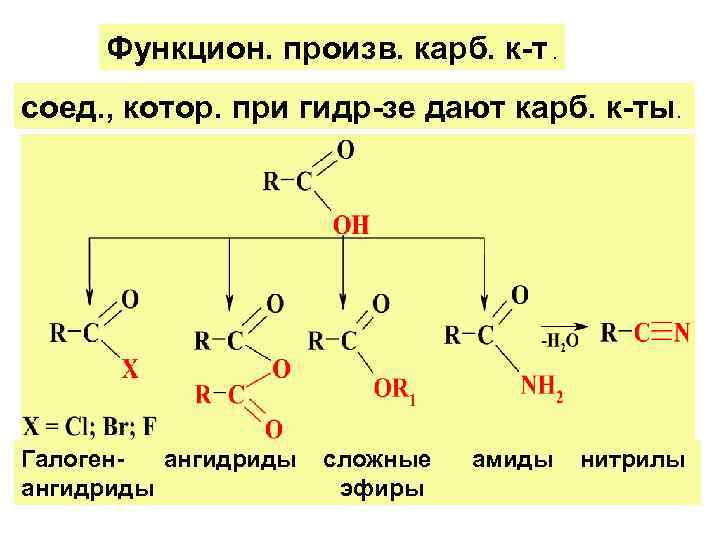
Функцион. произв. карб. к-т. соед. , котор. при гидр-зе дают карб. к-ты. Галоген- ангидриды сложные амиды нитрилы ангидриды эфиры
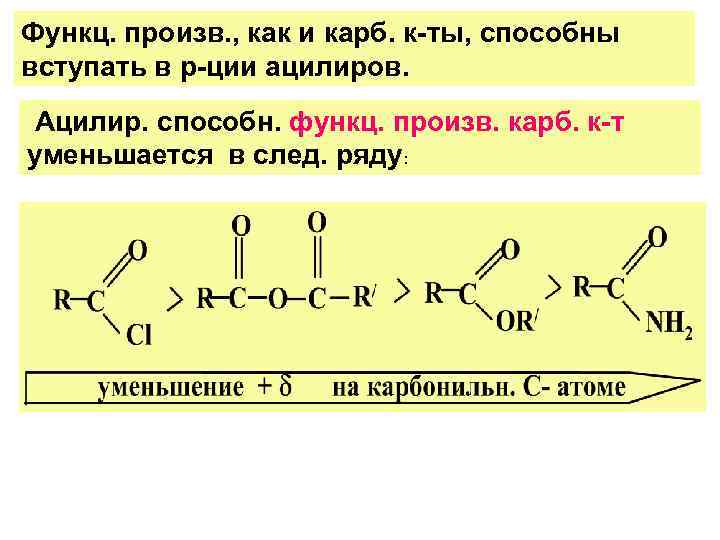
Функц. произв. , как и карб. к-ты, способны вступать в р-ции ацилиров. Ацилир. способн. функц. произв. карб. к-т уменьшается в след. ряду:

ГАЛОГЕНАНГИДРИДЫ. АЦИЛГАЛОГЕНИДЫ Общ. фор-ла НАИМЕНОВ. АЦИЛГАЛОГЕНИДОВ: назван. ацила + назв. галогена по ИЮПАК : оконч. «овая» к-ты замен-ся на «оил» с добавл. назв. галогена
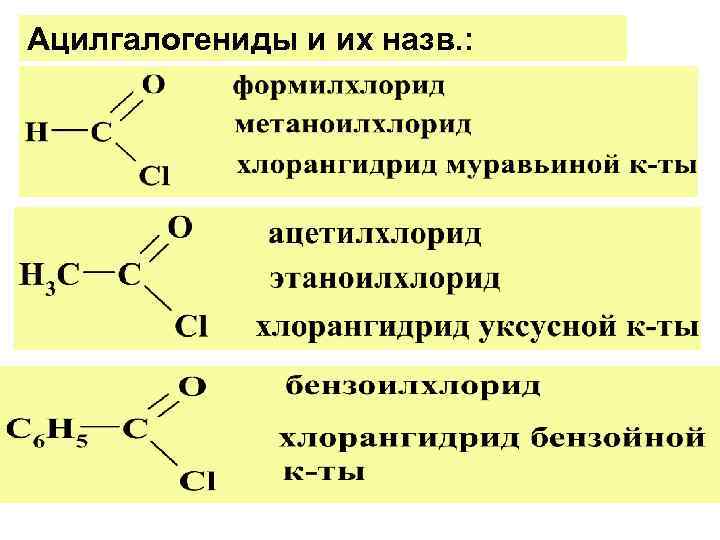
Ацилгалогениды и их назв. :
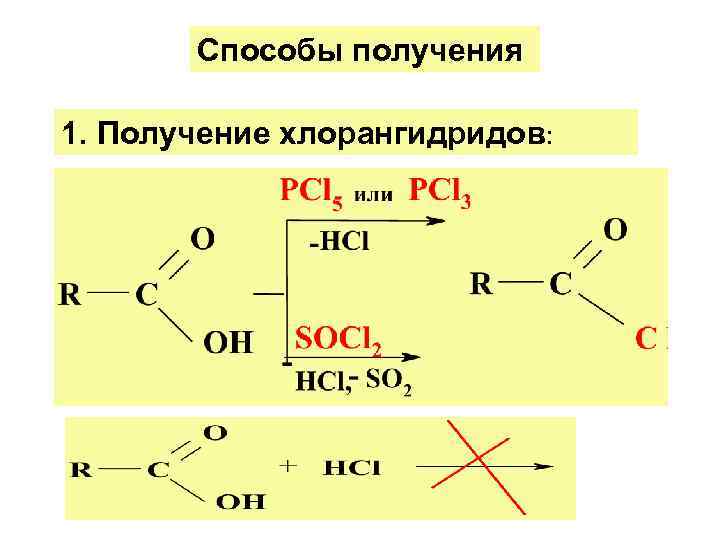
Способы получения 1. Получение хлорангидридов:
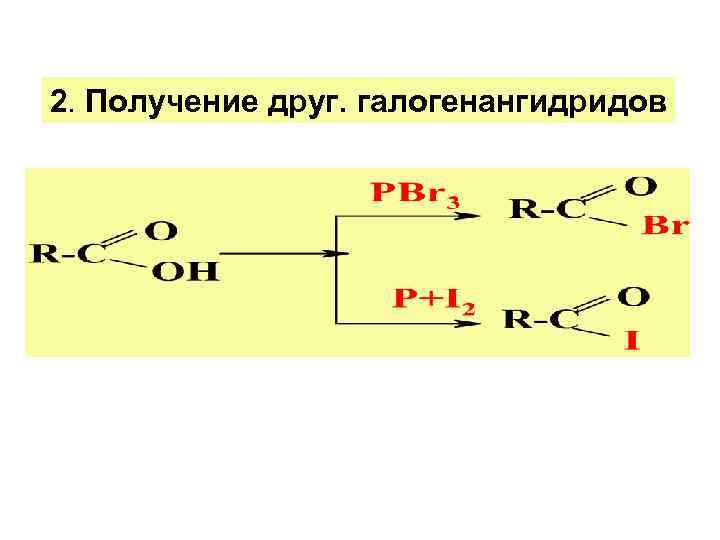
2. Получение друг. галогенангидридов
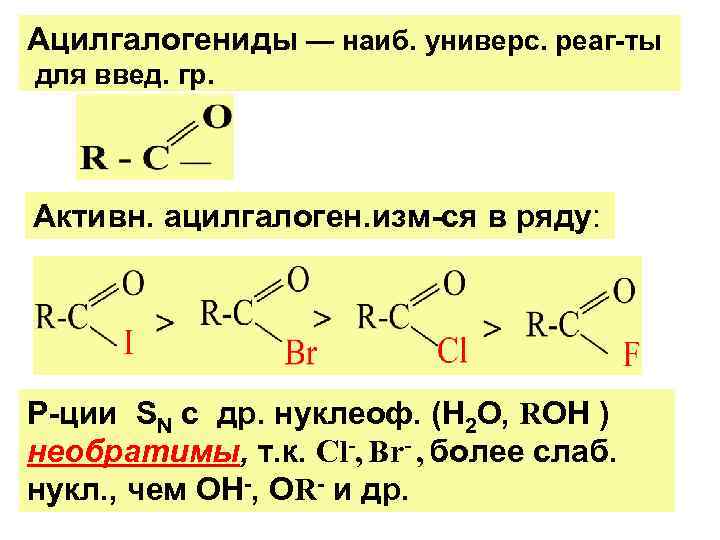
Ацилгалогениды — наиб. универс. реаг-ты для введ. гр. Активн. ацилгалоген. изм-ся в ряду: Р-ции SN с др. нуклеоф. (Н 2 О, RОН ) необратимы, т. к. Cl-, Br- , более слаб. нукл. , чем ОН-, ОR- и др.
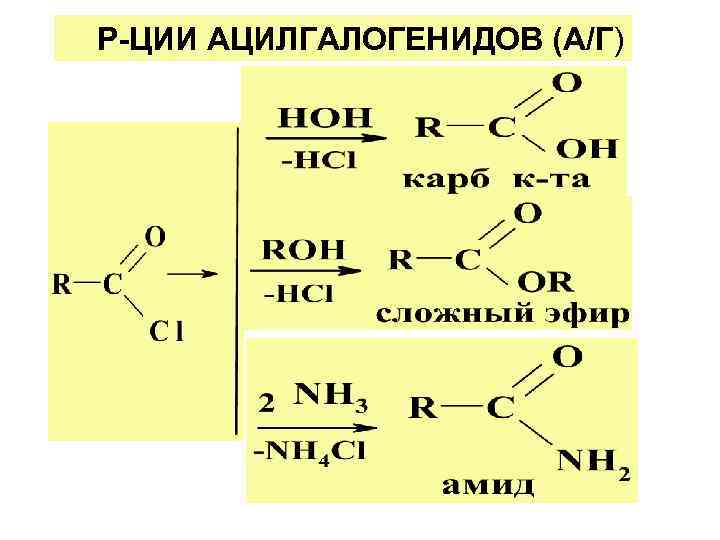
Р-ЦИИ АЦИЛГАЛОГЕНИДОВ (А/Г)
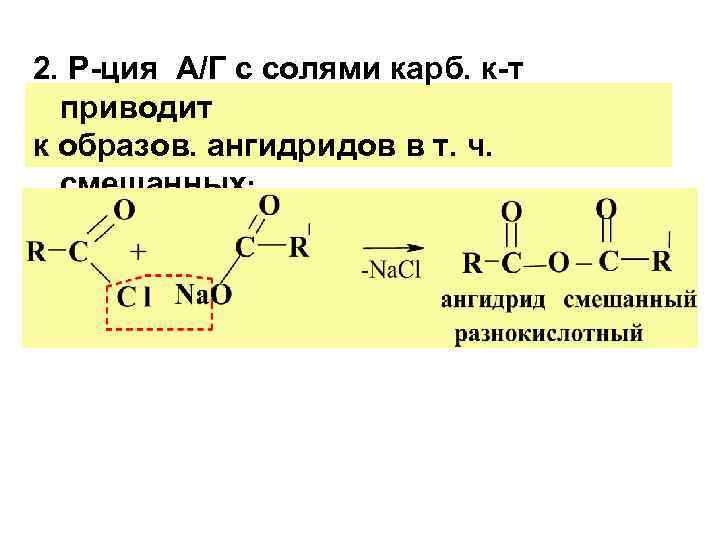
2. Р-ция А/Г с солями карб. к-т приводит к образов. ангидридов в т. ч. смешанных:
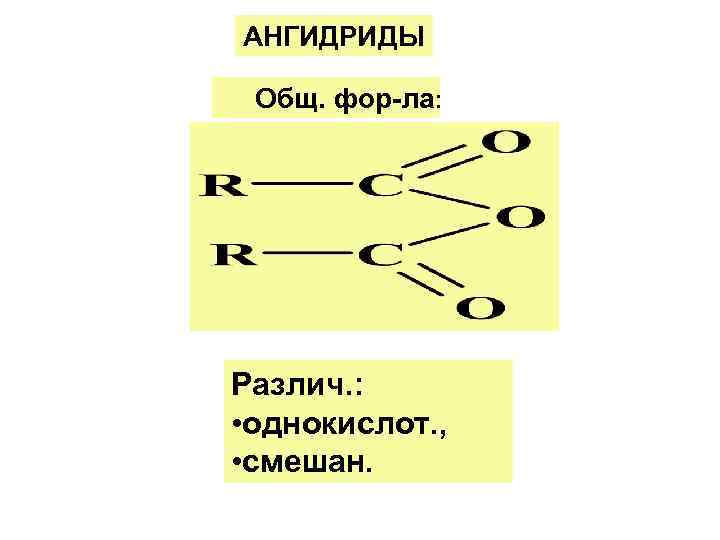
АНГИДРИДЫ Общ. фор-ла: Различ. : • однокислот. , • смешан.
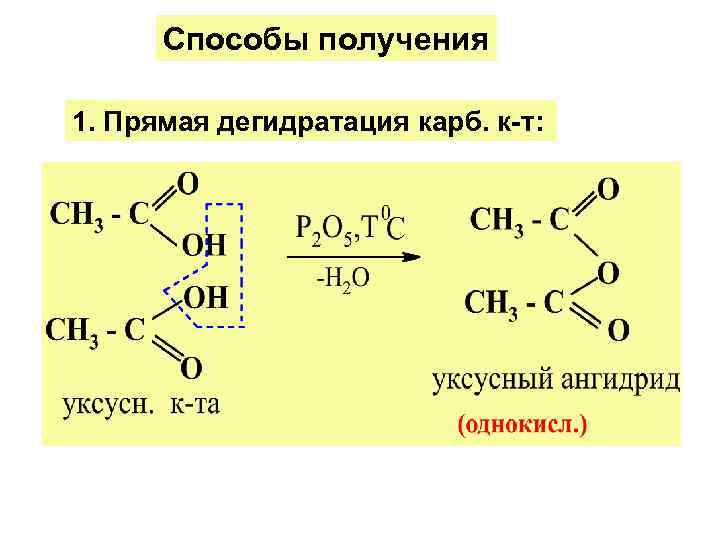
Способы получения 1. Прямая дегидратация карб. к-т:
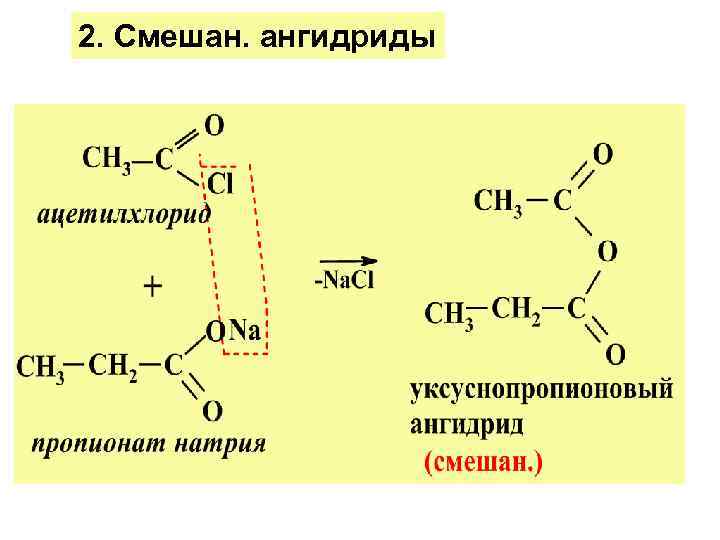
2. Смешан. ангидриды

3. Ангидриды ВЖК получают их дегидратацией с уксус. ангидридом: 2 С 17 Н 35 СООН + (СН 3 СО)2 О 2 СН 3 СООН + (С 17 Н 35 СО)2 О стеариновый ангидрид
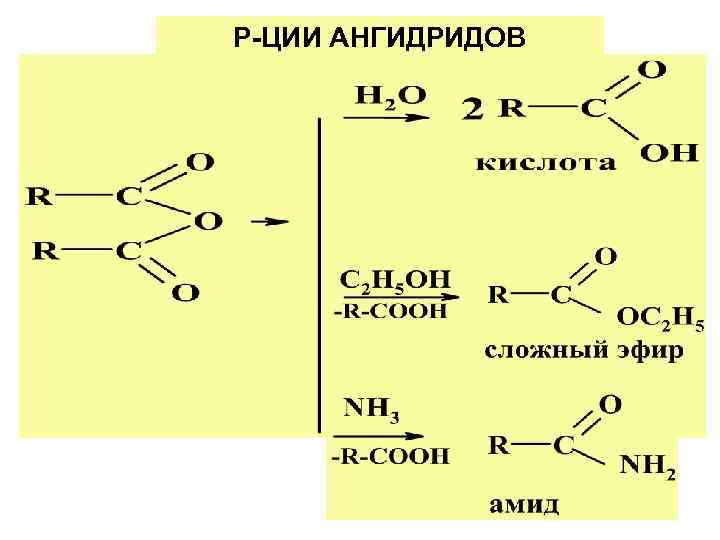
Р-ЦИИ АНГИДРИДОВ
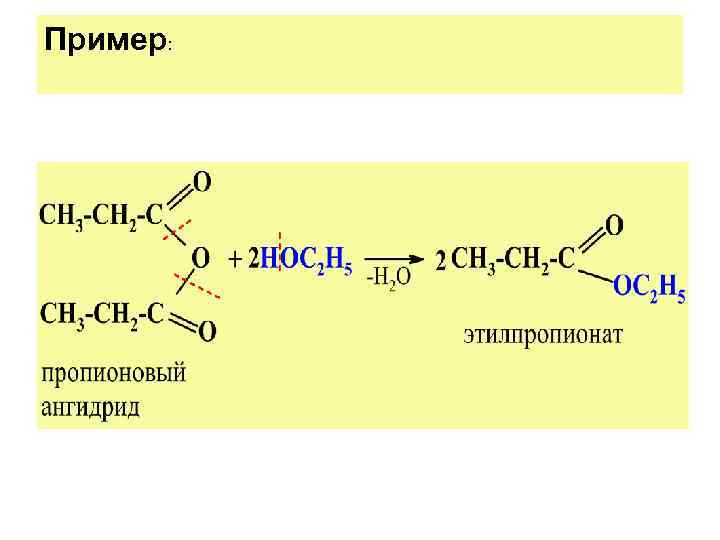
Пример:
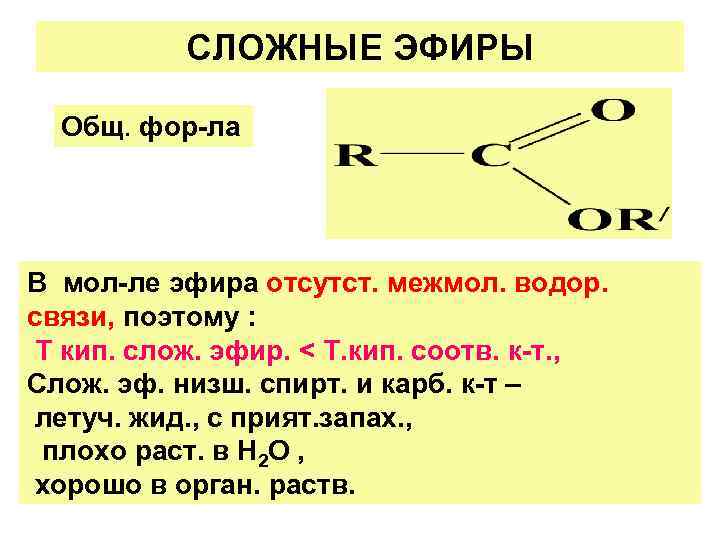
СЛОЖНЫЕ ЭФИРЫ Общ. фор-ла В мол-ле эфира отсутст. межмол. водор. связи, поэтому : Т кип. слож. эфир. < Т. кип. соотв. к-т. , Слож. эф. низш. спирт. и карб. к-т – летуч. жид. , с прият. запах. , плохо раст. в Н 2 О , хорошо в орган. раств.
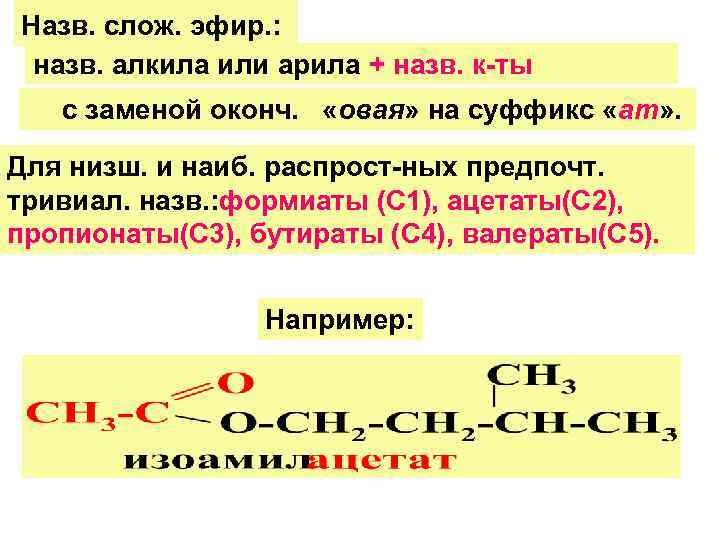
Назв. слож. эфир. : назв. алкила или арила + назв. к-ты с заменой оконч. «овая» на суффикс «ат» . Для низш. и наиб. распрост-ных предпочт. тривиал. назв. : формиаты (С 1), ацетаты(С 2), пропионаты(С 3), бутираты (С 4), валераты(С 5). Например:
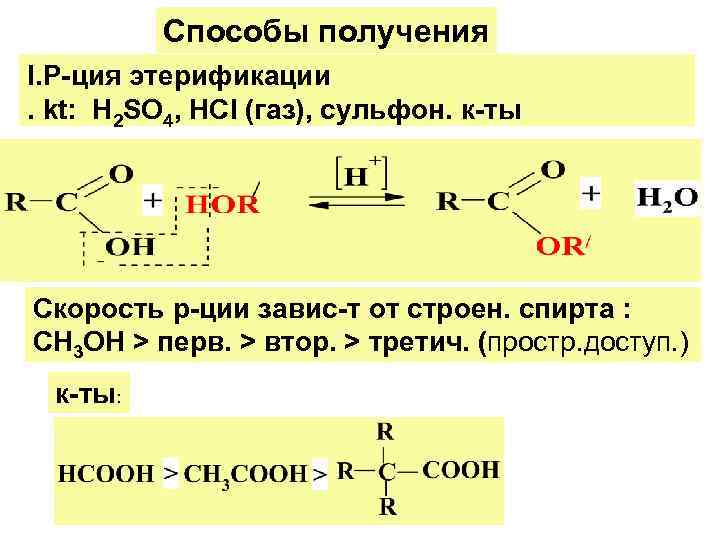
Способы получения I. Р-ция этерификации. kt: Н 2 SО 4, НСl (газ), сульфон. к-ты Скорость р-ции завис-т от строен. спирта : CH 3 OH > перв. > втор. > третич. (простр. доступ. ) к-ты:
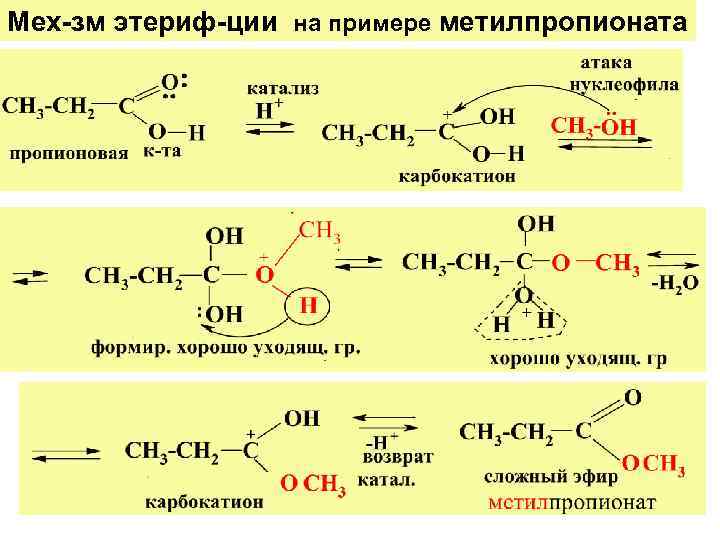
Мех-зм этериф-ции на примере метилпропионата
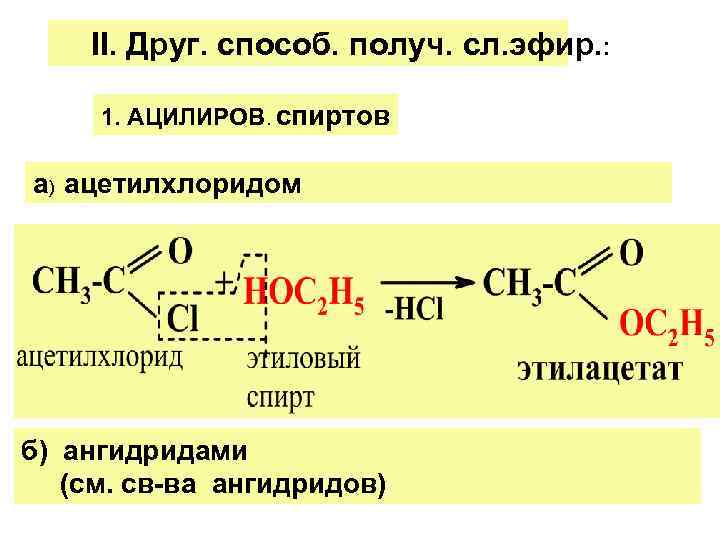
II. Друг. способ. получ. сл. эфир. : 1. АЦИЛИРОВ. спиртов а) ацетилхлоридом б) ангидридами (см. св-ва ангидридов)
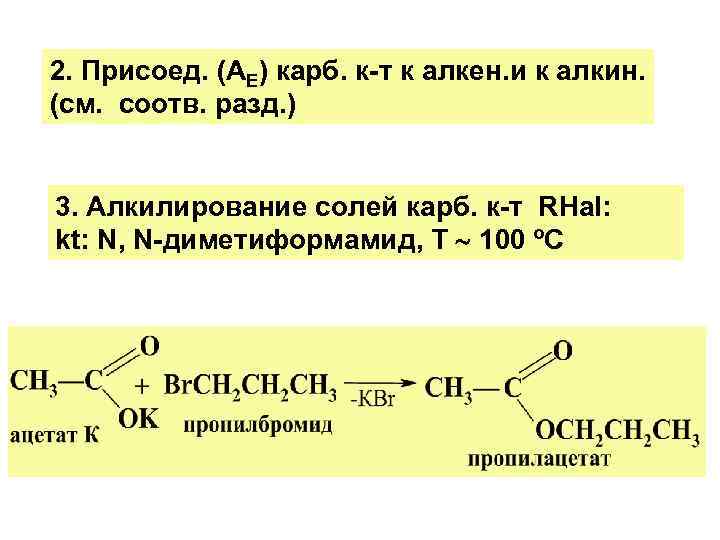
2. Присоед. (АЕ) карб. к-т к алкен. и к алкин. (см. соотв. разд. ) 3. Алкилирование солей карб. к-т RHal: kt: N, N-диметиформамид, Т 100 ºС
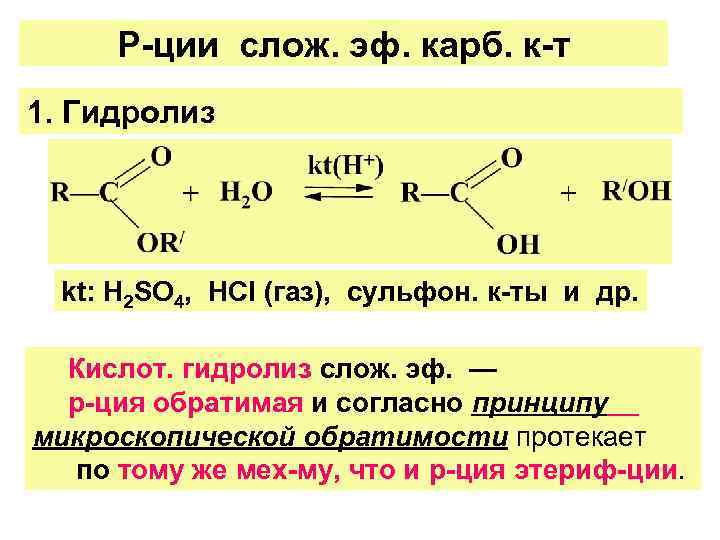
Р-ции слож. эф. карб. к-т 1. Гидролиз kt: Н 2 SО 4, НСl (газ), сульфон. к-ты и др. Кислот. гидролиз слож. эф. — р-ция обратимая и согласно принципу микроскопической обратимости протекает по тому же мех-му, что и р-ция этериф-ции.
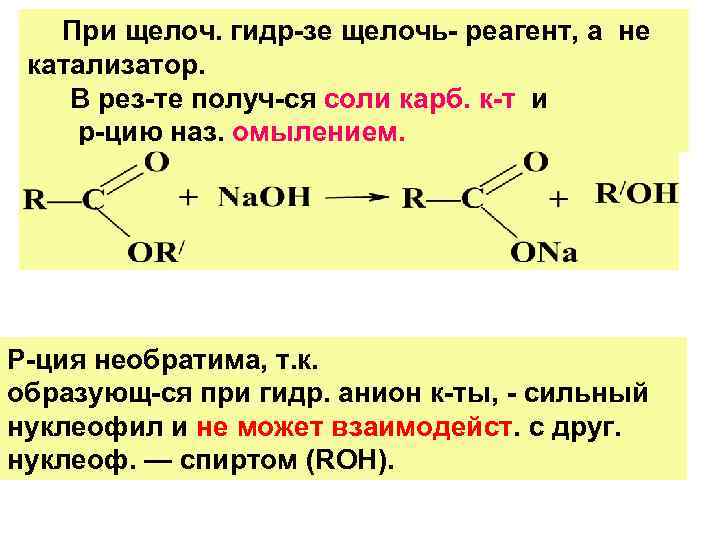
При щелоч. гидр-зе щелочь- реагент, а не катализатор. В рез-те получ-ся соли карб. к-т и р-цию наз. омылением. Р-ция необратима, т. к. образующ-ся при гидр. анион к-ты, - сильный нуклеофил и не может взаимодейст. с друг. нуклеоф. — спиртом (ROН).
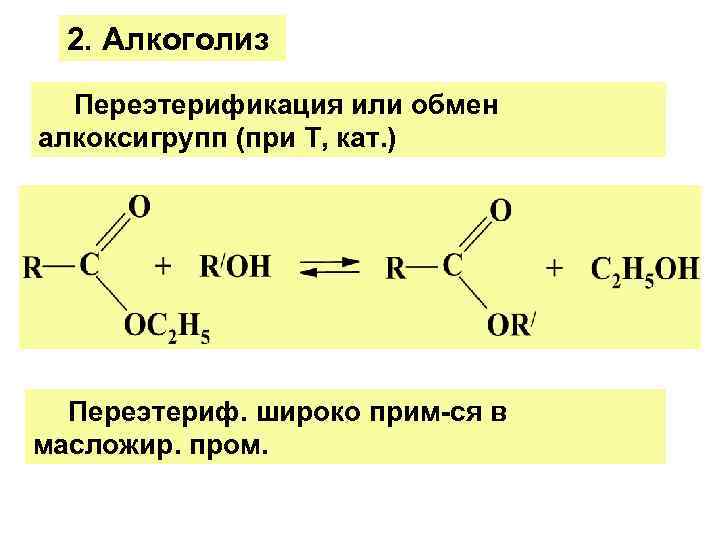
2. Алкоголиз Переэтерификация или обмен алкоксигрупп (при Т, кат. ) Переэтериф. широко прим-ся в масложир. пром.
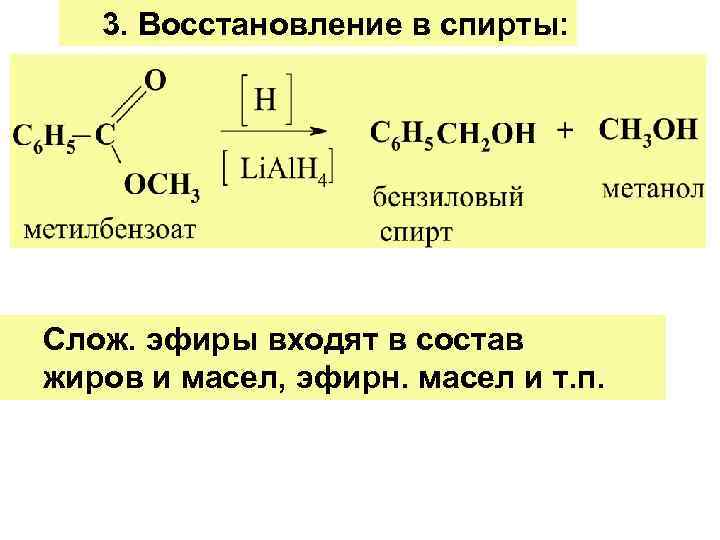
3. Восстановление в спирты: Слож. эфиры входят в состав жиров и масел, эфирн. масел и т. п.
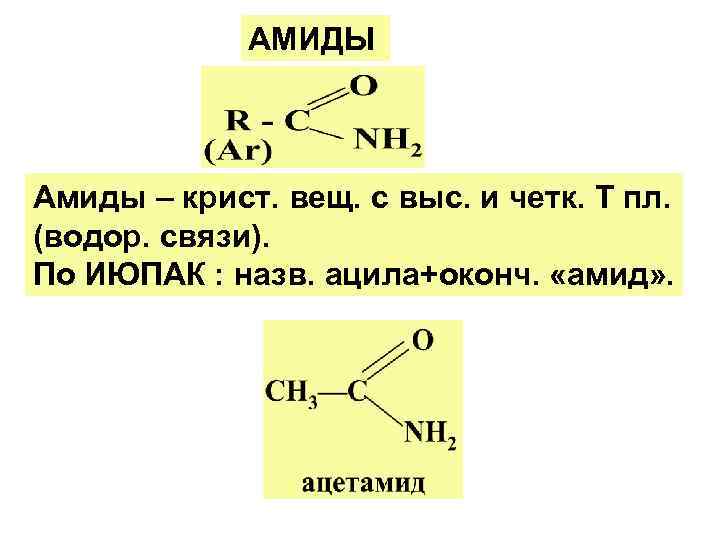
АМИДЫ Амиды – крист. вещ. с выс. и четк. Т пл. (водор. связи). По ИЮПАК : назв. ацила+оконч. «амид» .
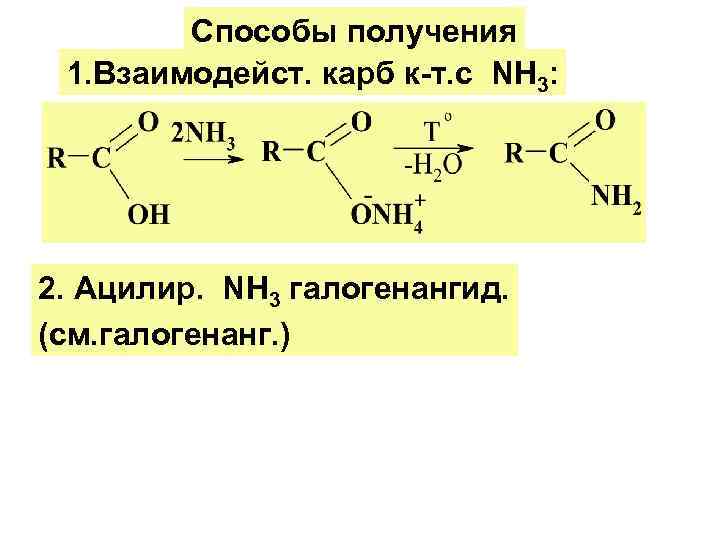
Способы получения 1. Взаимодейст. карб к-т. с NH 3: 2. Ацилир. NH 3 галогенангид. (см. галогенанг. )
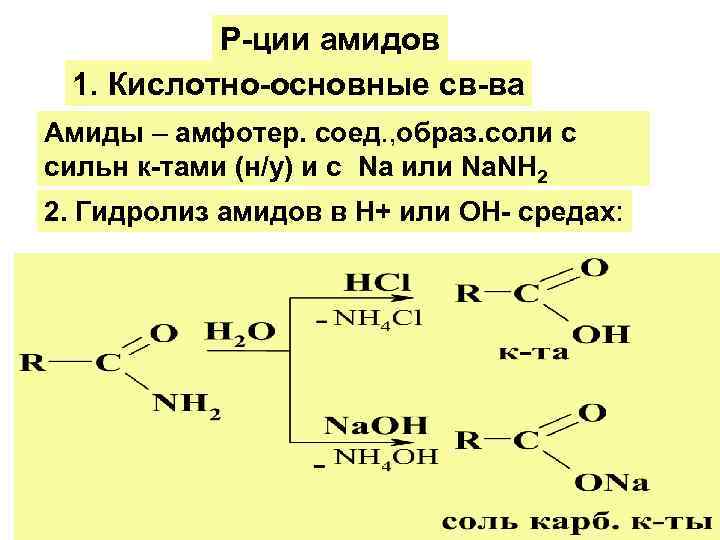
Р-ции амидов 1. Кислотно-основные св-ва Амиды – амфотер. соед. , образ. соли с сильн к-тами (н/у) и с Na или Na. NH 2 2. Гидролиз амидов в Н+ или ОН- средах:
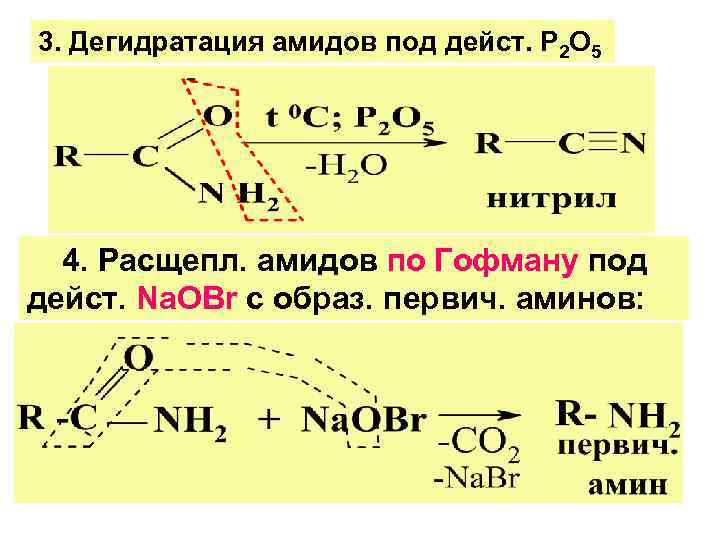
3. Дегидратация амидов под дейст. Р 2 О 5 4. Расщепл. амидов по Гофману под дейст. Na. ОBr с образ. первич. аминов:
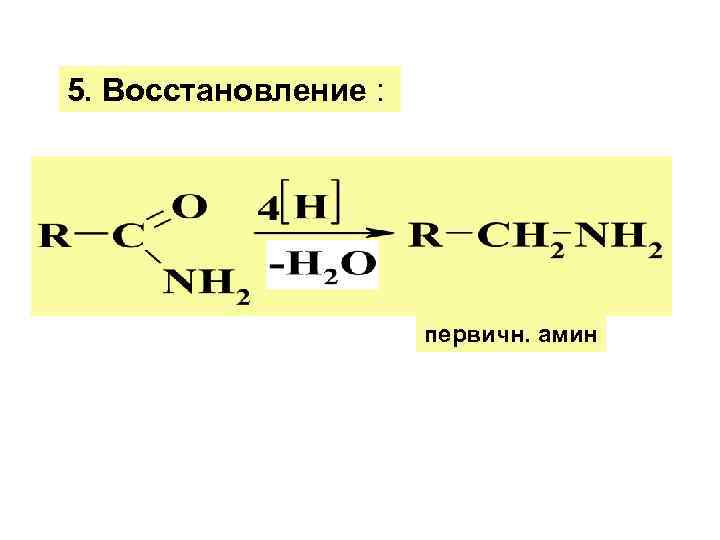
5. Восстановление : первичн. амин

НИТРИЛЫ Общ. фор-ла: R—C N По ИЮПАК: к назв. у/в с тем же числом С-атом. добавл. суффикс - нитрил : этанонитрил ацетонитрил метилцианид
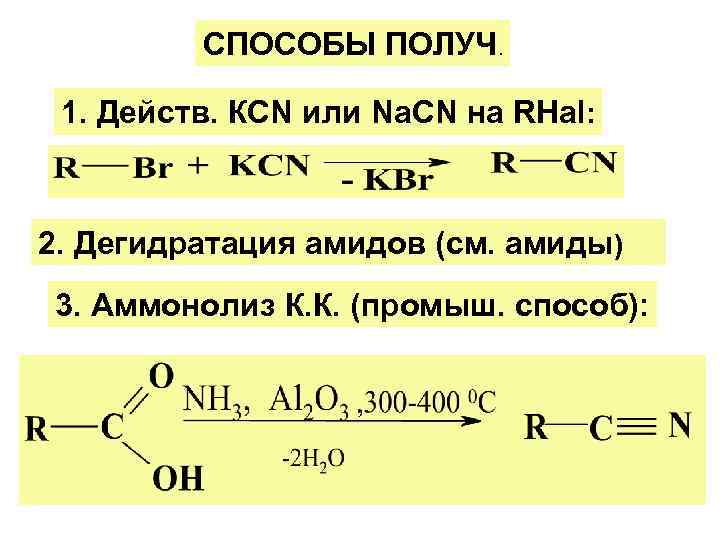
СПОСОБЫ ПОЛУЧ. 1. Действ. КСN или Na. СN на RHal: 2. Дегидратация амидов (см. амиды) 3. Аммонолиз К. К. (промыш. способ):
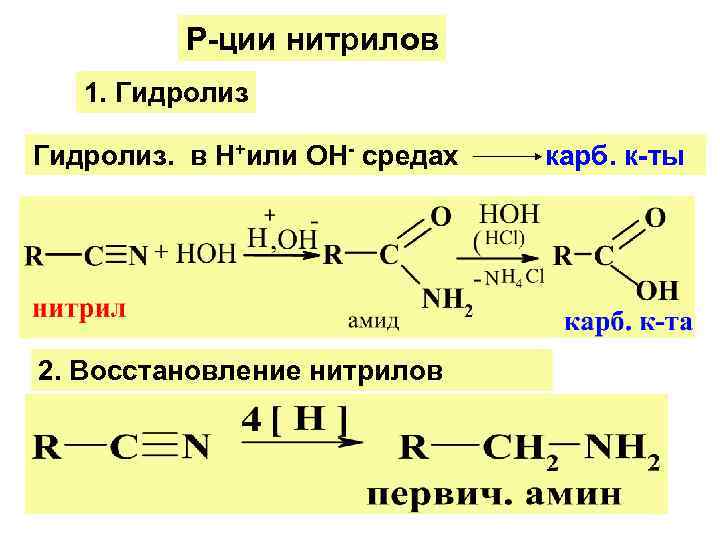
Р-ции нитрилов 1. Гидролиз. в Н+или ОН- средах карб. к-ты 2. Восстановление нитрилов
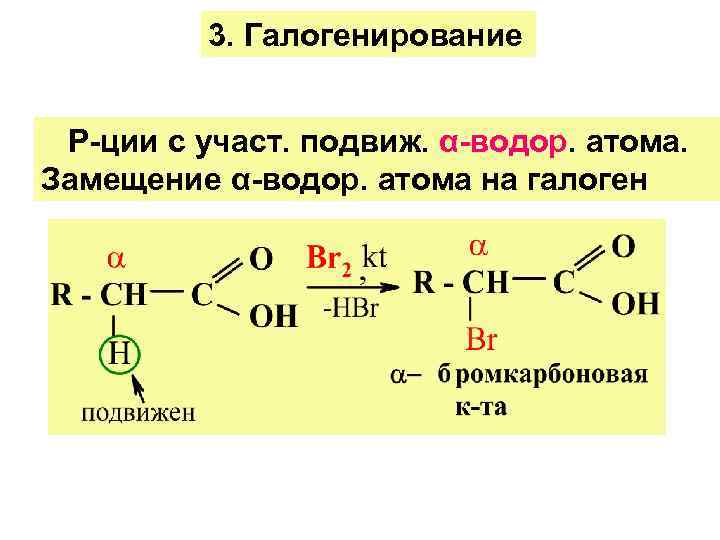
3. Галогенирование Р-ции с участ. подвиж. α-водор. атома. Замещение α-водор. атома на галоген
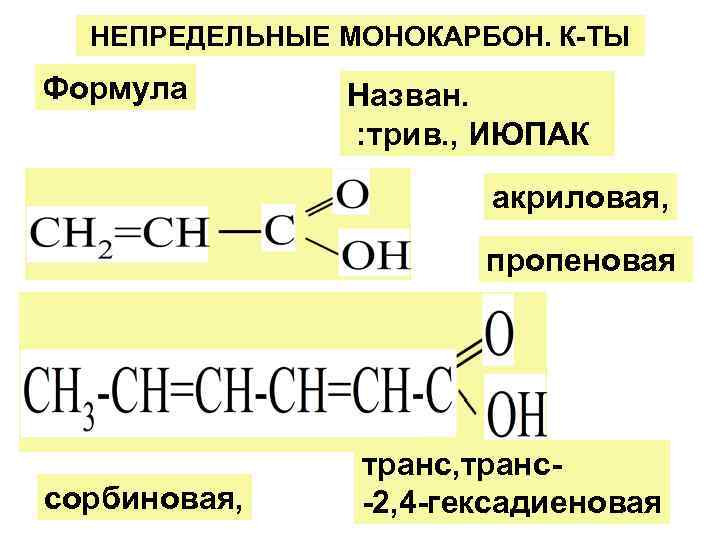
НЕПРЕДЕЛЬНЫЕ МОНОКАРБОН. К-ТЫ Формула Назван. : трив. , ИЮПАК акриловая, пропеновая транс, транс- сорбиновая, -2, 4 -гексадиеновая

Способы получения 1) введен. гр. СООН в мол-лу непредельн. у/в, альдег. и др. ; 2) введен. кратной связи в мол-лу карб. к-ты или ее произв.
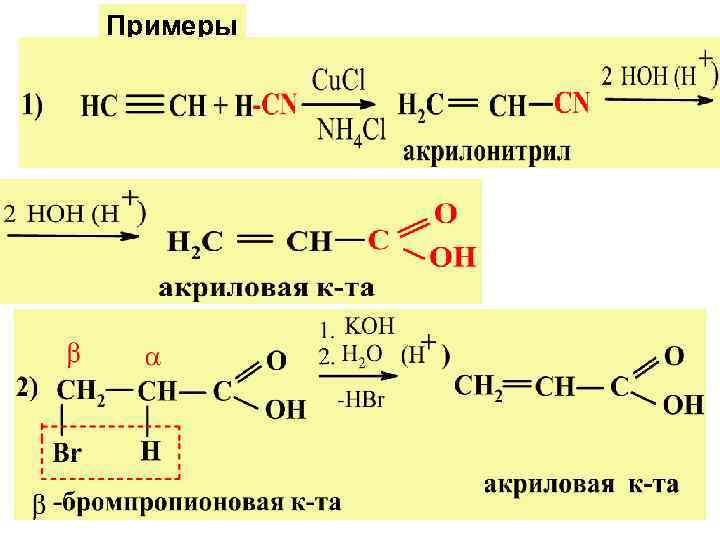
Примеры

ХИМИЧ. СВ-ВА α, β – непредел. к-ты проявл. большую кислот-ть по сравн. с предельн. : СН≡С-СООН > СН 2=СН-СООН > СН 3 -СН 2 -СООН, пропиновая пропеновая пропановая р. Ка ~ 1, 84 р. Ка~ 4, 26 р. Ка~ 4, 85

Р-ции ненасыщ. к-т можно подразделить на три группы: 1) по кратной связи (присоед. и полимер. ) 2) по -СООН гр. (образов. солей и функц. произв. карб. к-т);
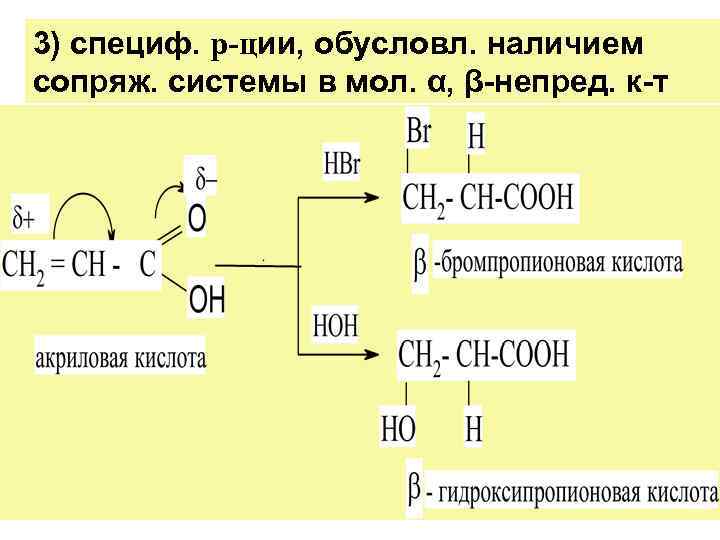
3) специф. р-ции, обусловл. наличием сопряж. системы в мол. α, β-непред. к-т

ДИКАРБОНОВЫЕ К-ТЫ НООС-(СН 2)n-СООН общая фор-ла Щавелевая (С 2), Малоновая(С 3), Янтарная (С 4), Глутаровая (С 5), Адипиновая(С 6) (ЩМЯГА) Способы получ. аналог. монокарб. к-т: а) окисл-е циклич. и аром. у/в; б) гидролиз нитрилов и др.
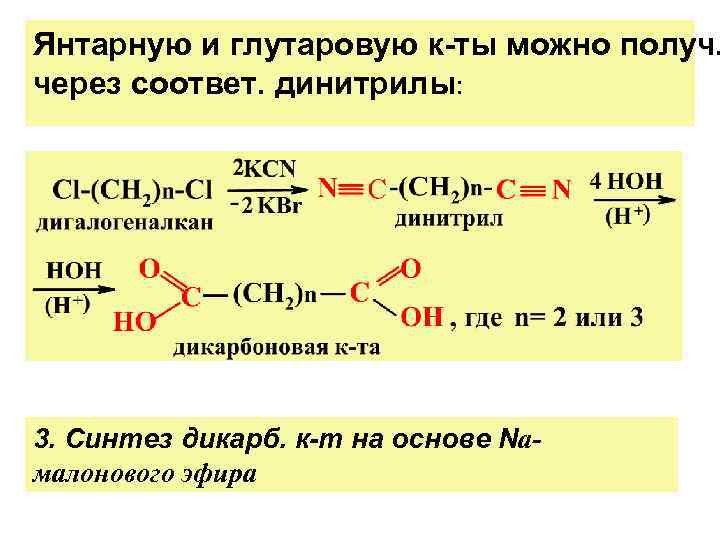
Янтарную и глутаровую к-ты можно получ. через соответ. динитрилы: 3. Синтез дикарб. к-т на основе Nа- малонового эфира

ХИМ. СВ-ВА 1. КИСЛОТНОСТЬ Дикарбон. к-ты более сильн. , чем монокарб. и в водн. р-ре диссоц. последов-но: р. Ка 1 > р. Ка 2 : р. Ка 1= 1, 27; р. Ка 2 = 4, 27 2. Образов. функц. произв. дикарб. к-т аналогич. монокарб. : получ. моно- и диэфиры, моно- и динитрилы и т. д.
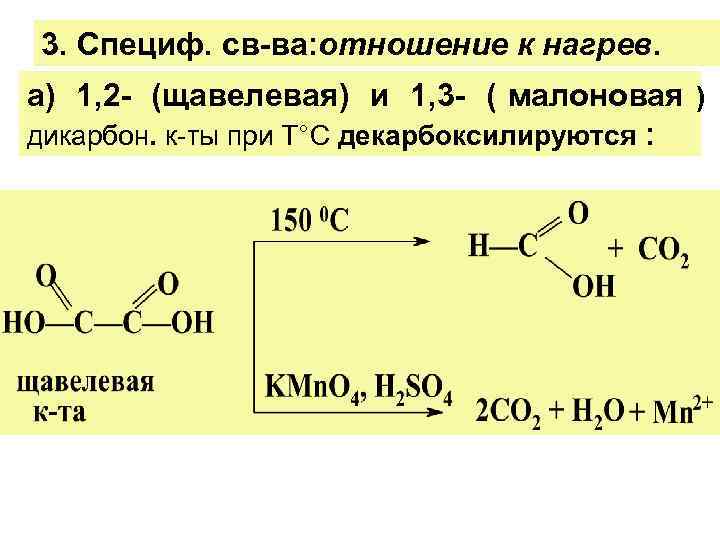
3. Специф. св-ва: отношение к нагрев. а) 1, 2 - (щавелевая) и 1, 3 - ( малоновая ) дикарбон. к-ты при Т°С декарбоксилируются :
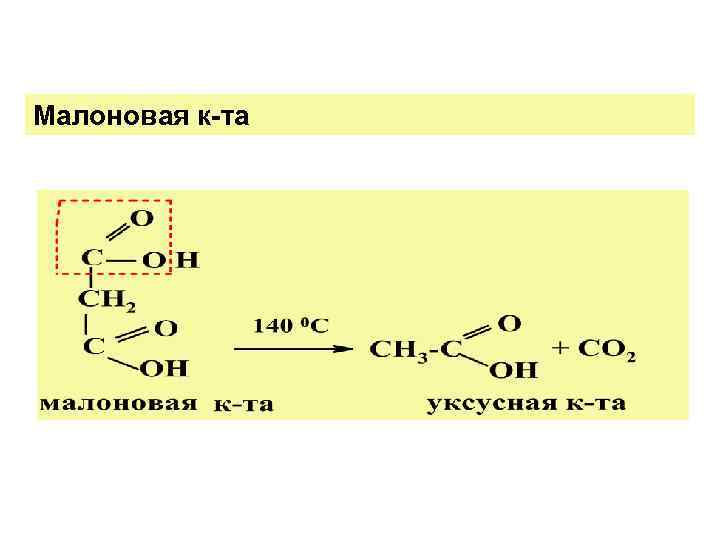
Малоновая к-та
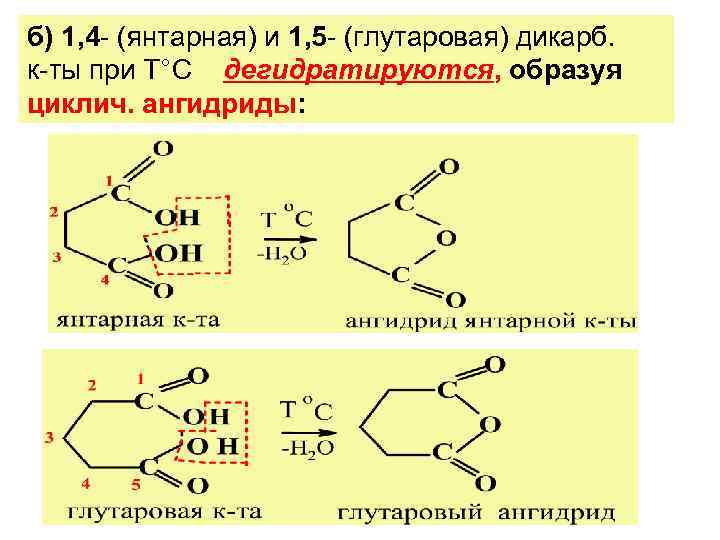
б) 1, 4 - (янтарная) и 1, 5 - (глутаровая) дикарб. к-ты при Т°С дегидратируются, образуя циклич. ангидриды:
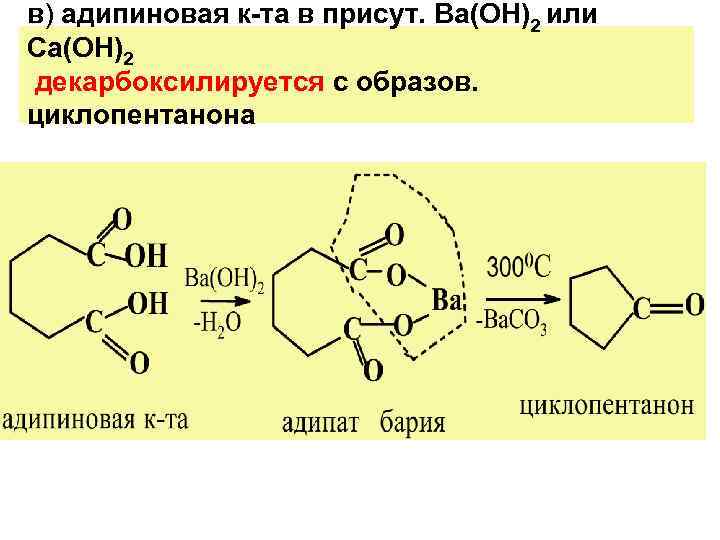
в) адипиновая к-та в присут. Ba(OH)2 или Ca(OH)2 декарбоксилируется с образов. циклопентанона

НЕНАСЫЩ. ДИКАРБОН. К-ТЫ Два стереоизомера:

ВЫСШ. ЖИРНЫЕ К-ТЫ (ВЖК) монокарбоновые, неразветвл. С-цепь (преимущ. ) четн. число С-атомов (С 12—С 18), цис-конфиг. . - (для ненасыщ. ) Насыщ. к-ты: СН 3—(СН 2)14—СООН пальмитиновая, СН 3—(СН 2)16—СООН стеариновая
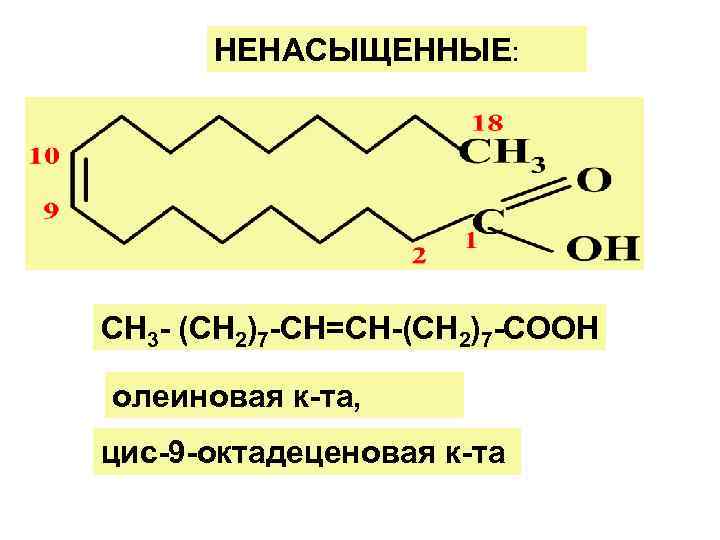
НЕНАСЫЩЕННЫЕ: СН 3 - (СН 2)7 -СН=СН-(СН 2)7 -СООН олеиновая к-та, цис-9 -октадеценовая к-та
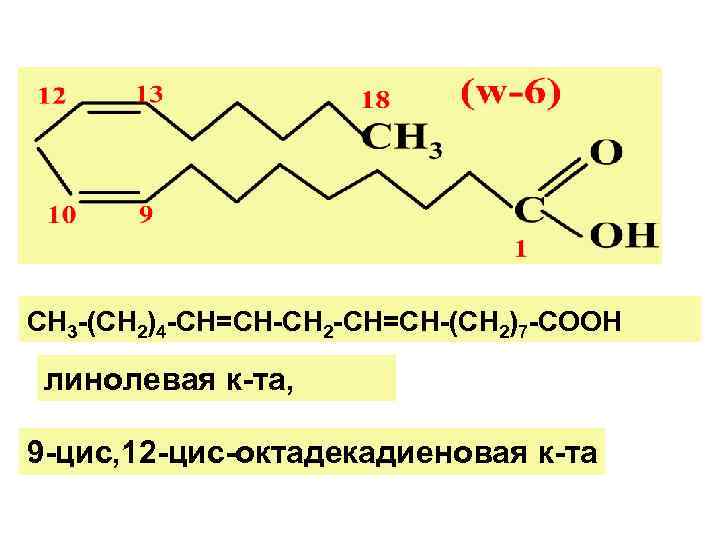
СН 3 -(СН 2)4 -СН=СН-СН 2 -СН=СН-(СН 2)7 -СООН линолевая к-та, 9 -цис, 12 -цис-октадекадиеновая к-та
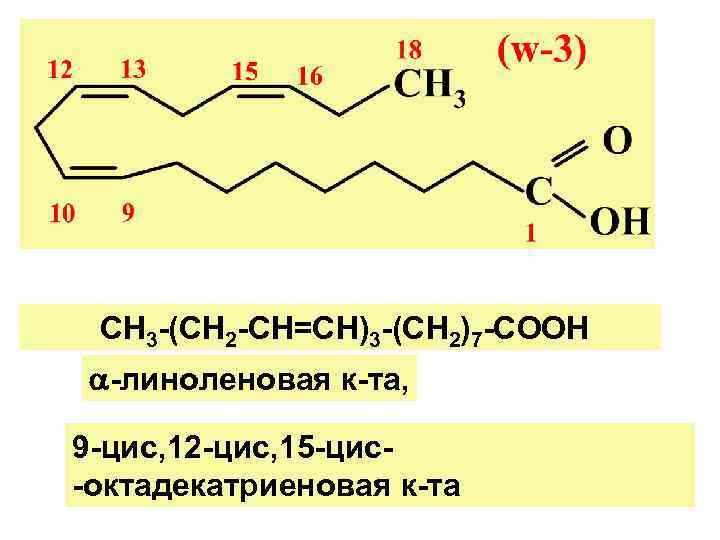
СН 3 -(СН 2 -СН=СН)3 -(СН 2)7 -СООН -линоленовая к-та, 9 -цис, 12 -цис, 15 -цис- -октадекатриеновая к-та
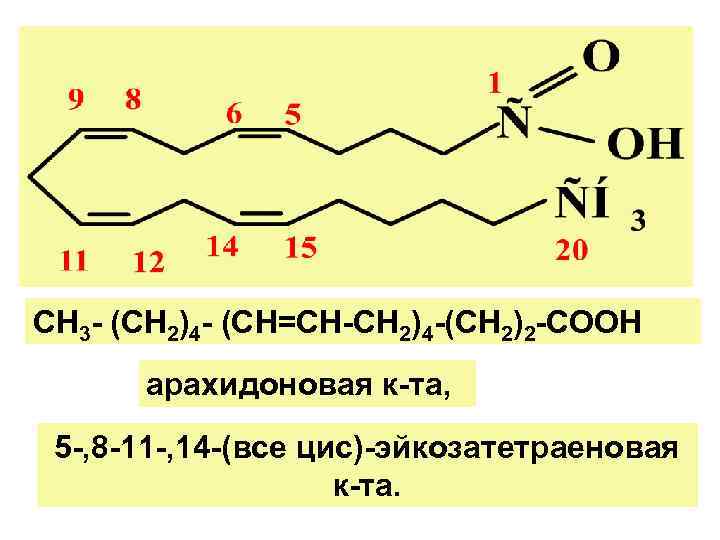
СН 3 - (СН 2)4 - (СН=СН-СН 2)4 -(СН 2)2 -СООН арахидоновая к-та, 5 -, 8 -11 -, 14 -(все цис)-эйкозатетраеновая к-та.

Ненасыщ. Ж. К при Н. У. имеют жидкую консист. , насыщ. ВЖК. - тверд. Ненасыщ. Ж. К. – основ. комп-ты жидк. растит. масел, насыщ. - тверд. живот. жиров. Линолевая, линоленовая и арахидоновая к-ты- эссенциальные, незаменимые ЖК.
Презентация моно-,непред.,дикарбкислот.ppt
- Количество слайдов: 76

