Карбоновые кислоты 11 хб


Карбоновые кислоты 11 хб
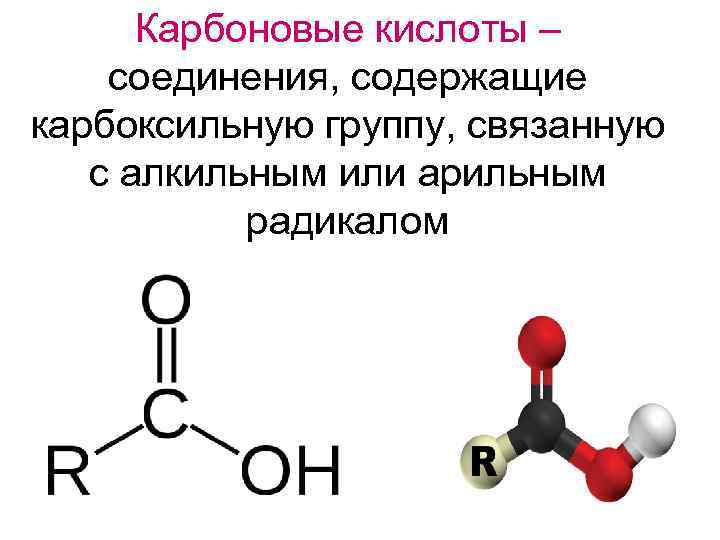
Карбоновые кислоты – соединения, содержащие карбоксильную группу, связанную с алкильным или арильным радикалом

Классификация • По характеру R- • Предельные • Непредельные • Ароматические • По количеству –СООН групп • Одноосновные • Двухосновные • Многоосновные

Номенклатура предельных однооосновных карбоновых кислот (Сn. H 2 n. O 2)

Номенклатура • Положение заместителей в углеродной цепи указывают, используя греческие буквы (γ- хлормасляная кислота, β-фенилпропионовая кислота) • IUPAC: основа – наиболее длинная цепь, содержащая карбоксильную группу, + окончание «овая кислота» , карбоксильный углерод - № 1 (пропановая кислота, 2 - метилбутановая кислота, 3, 3 - диметилпентановая кислота)

Номенклатура • Ароматические карбоновые кислоты называют по ароматической системе, содержащей карбоксильную группу (бензойная кислота, п-хлорбензойная кислота, м-нитробензойная кислота) • По рациональной номенклатуре карбоновые кислоты – производные уксусной кислоты (диметилуксусная кислота, триметилуксусная кислота)

Строение карбоксильной группы • Атом С находится в sp 2 -гибридном состоянии • Негибридная р-орбиталь атома С образует π- связь с атомом О в карбоксильной группе • Образование единой π-системы, с включением неподеленной пары электронов атома О ОН-группы (р- π –сопряжение) • Выравнивание электронной плотности в π- системе приводит к смещению пары р- электронов атома О ОН-группы в сторону группы СО (+М-эффект ОН-группы)

Взаимное влияние • +М ОН-группы выражен сильнее, чем в фенолах, т. к. смещение – в сторону атома О, а не С • -I эффект ОН-группы намного слабее, чем +М. Поэтому электронная плотность на атоме О ОН-группы уменьшается, он сильнее притягивает к себе электроны связи О-Н, что приводит к увеличению полярности связи О-Н (в большей степени, чем в фенолах) и увеличению кислотности • Влияние СО группы на группу ОН приводит к увеличению кислых свойств по сравнению с фенолами и спиртами

Взаимное влияние • Влияние ОН- группы на карбонильную – в том, что атом О ОН-группы, отдавая р- электроны в сопряжение с π-связью (р- π –сопряжение), уменьшае положительный заряд карбонильного углерода, поэтому реакции нуклеофильного присоединения в кислотах затруднены (по сравнению с альдегидами)

Кислотные свойства • Более слабые, чем минеральные кислоты (К=10 -5) • Кислый вкус • Окрашивание лакмуса в красный цвет • Диссоциация в водных растворах (RCOOH + H 2 O = RCOO- + H 3 O+) • Анионы карбоновых кислот стабилизированы сопряжением (2 -я причина большего значения константы кислотности по сравнению с фенолом) • Доказательство стабилизации аниона – измерение длин связей в формиат-анионе с помощью рентгеноструктурного анализа (С=O – 1, 23 А, С-О – 1, 36 А (в кислоте); 1, 27 А – в анионе) • Образование трехядерной связи – упрочение связи и повышение устойчивости аниона

Кислотные свойства • С металлами • С основными оксидами • С основаниями • С солями более слабых кислот

Влияние заместителей на кислотность • Электроноакцепторные заместители (галогены, нитрогруппа, оксигруппа) увеличивают силу кислот, т. к. увеличивают устойчивость карбоксилат- ионов (-I эффект заместителей увеличивает полярность связи О-Н) • Электронодонорные заместители (радикалы) уменьшают силу кислот

Превращение в функциональные производные

Механизм реакции этерификации

Восстановление карбоновых кислот • Реагент – алюмогидрид лития • Образование алкоголята 4 СН 3 СООН + 3 Li. Al. H 4 (эфир)→ [CH 3 CH 2 O]4 Al. Li + 2 Li. Al. O 2 +4 H 2 • Гидролиз алкоголята [CH 3 CH 2 O]4 Al. Li + 2 H 2 O → 4 CH 3 CH 2 OH + Li. Al. O 2 • Отличный выход продукта • Дорогой реагент (восстановление небольших количеств ценных сырьевых продуктов (лекарства, гормоны))

Замещение в алкильной или арильной группе • Галогенирование в α-положение предельных кислот (использование галогенозамещенных кислот в органическом синтезе, т. к. галоген легко вступает в реакции нуклеофильного замещения и элиминирования) • Замещение в кольце ароматических кислот (группа –СООН – мета ориентант в реакциях электрофильного замещения)

Непредельные кислоты • Акриловая СН 2 = СН – СООН (пропеновая) • Метакриловая СН 2 = С(СН 3) – СООН (2 - метилпропеновая) • Влияние карбоксильной группы на кратную связь – присоединение несимметричных реагентов против правила Марковникова • СН 2 = СН – СООН + HBr → Br. CH 2 – COOH • Полимеризация метилакрилата → полиметилакрилат (оргстекло)

Непредельные кислоты • Получение акриловой кислоты – окислительный аммонолиз пропена с последующим гидролизом акрилонитрила • 2 СН 2=СН-СН 3 +2 NH 3 +3 O 2 →(Co-Mo, 450º)→ 2 CH 2=СH-СN + 6 H 2 O • CH 2=СH-СN + 2 H 2 O → СН 2 = СН – СООН + NH 3

Непредельные кислоты • Олеиновая • Линоленовая • Нерастворимые в воде маслянистые жидкости, темнеющие на воздухе (из-за окисления кислородом кратных связей с образованием полимерных продуктов) • Цис-транс-изомерия (олеиновая – цис- изомер, элаидиновая – транс-изомер (более высокая температура плавления)) • Реакции присоединения

Ароматические кислоты • Бензойная кислота С 6 Н 5 СООН • Бесцветное кристаллическое вещество, плохо растворимое в холодной воде, хорошо – в горячей. • Карбоксильная группа – ориентант 2 -го рода – замещение в мета-положение • Нагревание бензоата натрия со щелочью – получение бензола

Ароматические кислоты • Салициловая кислота (2 - гидроксибензойная кислота) • Кипячение салициловой кислоты с уксусным ангидридом – получение сложного эфира (ацетилсалициловой кислоты (аспирина))

Дикарбоновые кислоты • Щавелевая НООС-СООН (этандиовая) • Кристаллическое вещество белогоцвета, хорошо растворима в воде. • Взаимное влияние карбоксильных групп – усиление кислотных свойств (сильнее муравьиной кислоты) • Двухосновная кислота (средние – оксалаты, кислые – гидрооксалаты) • Гидрооксалат калия – в щавеле • Оксалат кальция – в организме человека (почечные «камни» ) • Оксалат натрия – при разложении формиата натрия 2 НСООNa → Na 2 C 2 O 4 + H 2 • Промышленное получение щавелевой кислоты при подкислении оксалата натрия

Дикарбоновые кислоты • Малоновая кислота НООС-СН 2 -СООН • Подвижность водородного атома метиленовой группы из-за влияния двух карбоксильных групп, которые скачивают с него электронную плотность (кислотность атома водорода при центральном атоме углерода) • Кислотность малоновых эфиров: (под действием сильных оснований (метилат натрия) образует соль)

Дикарбоновые кислоты • Фталевая (1, 2 -бензолдикарбоновая) • Изофталевая (1, 3 -бензолдикарбоновая • Терефталевая (1, 4–бензолдикарбоновая) • Твердые кристаллические вещества, образующиеся при окислении ксилолов • Сложный эфир терефталевой кислоты и этиленгликоля – основа для получения пластика полиэтилентерефталата и волокна лавсан

Дикарбоновые кислоты • При нагревании разлагаются • НООС-СООН → НСООН + СО 2 • НООС-СН 2 -СООН → СН 3 СООН + СО 2 • Янтарная кислота (НООС-СН 2 - СООН) → янтарный ангидрид + Н 2 О • Фталевая кислота → фталевый ангидрид + Н 2 О

Гетерофункциональные кислоты • Молочная кислота (2 - гидроксипропионовая кислота) • Оптическая изомерия

