Карбонові кислоти ароматичного ряду. Ароматичними карбоновими кислотами називають

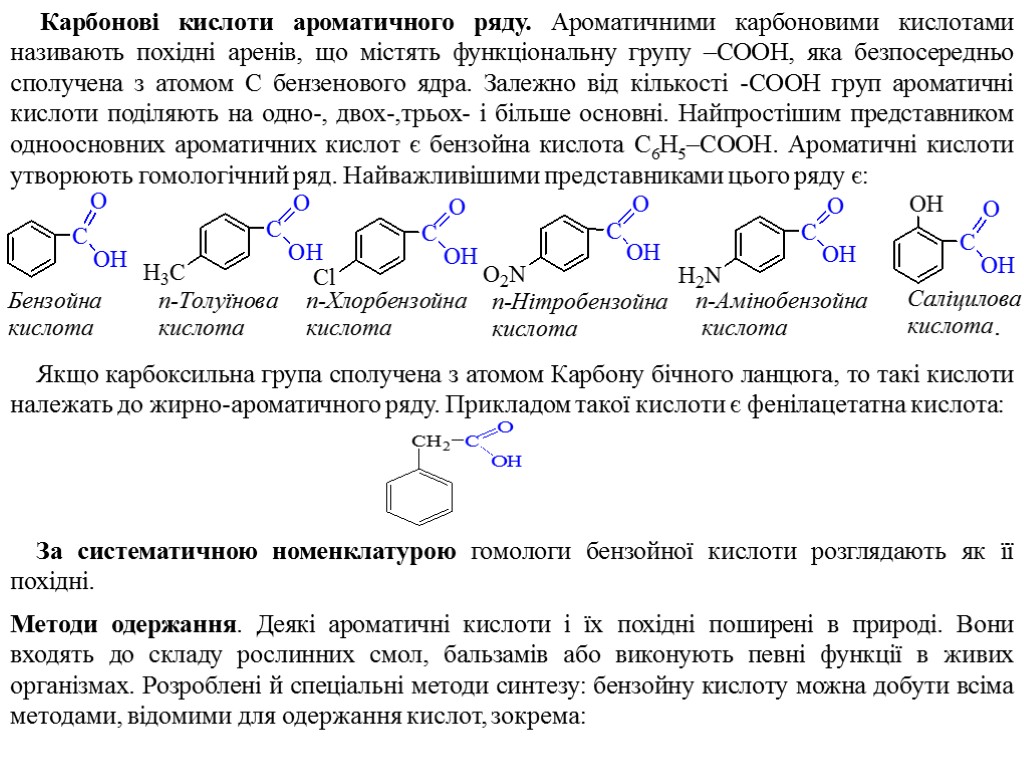
Карбонові кислоти ароматичного ряду. Ароматичними карбоновими кислотами називають похідні аренів, що містять функціональну групу –COOH, яка безпосередньо сполучена з атомом С бензенового ядра. Залежно від кількості -СООН груп ароматичні кислоти поділяють на одно-, двох-,трьох- і більше основні. Найпростішим представником одноосновних ароматичних кислот є бензойна кислота C6H5–COOH. Ароматичні кислоти утворюють гомологічний ряд. Найважливішими представниками цього ряду є: Якщо карбоксильна група сполучена з атомом Карбону бічного ланцюга, то такі кислоти належать до жирно-ароматичного ряду. Прикладом такої кислоти є фенілацетатна кислота: За систематичною номенклатурою гомологи бензойної кислоти розглядають як її похідні. Методи одержання. Деякі ароматичні кислоти і їх похідні поширені в природі. Вони входять до складу рослинних смол, бальзамів або виконують певні функції в живих організмах. Розроблені й спеціальні методи синтезу: бензойну кислоту можна добути всіма методами, відомими для одержання кислот, зокрема:
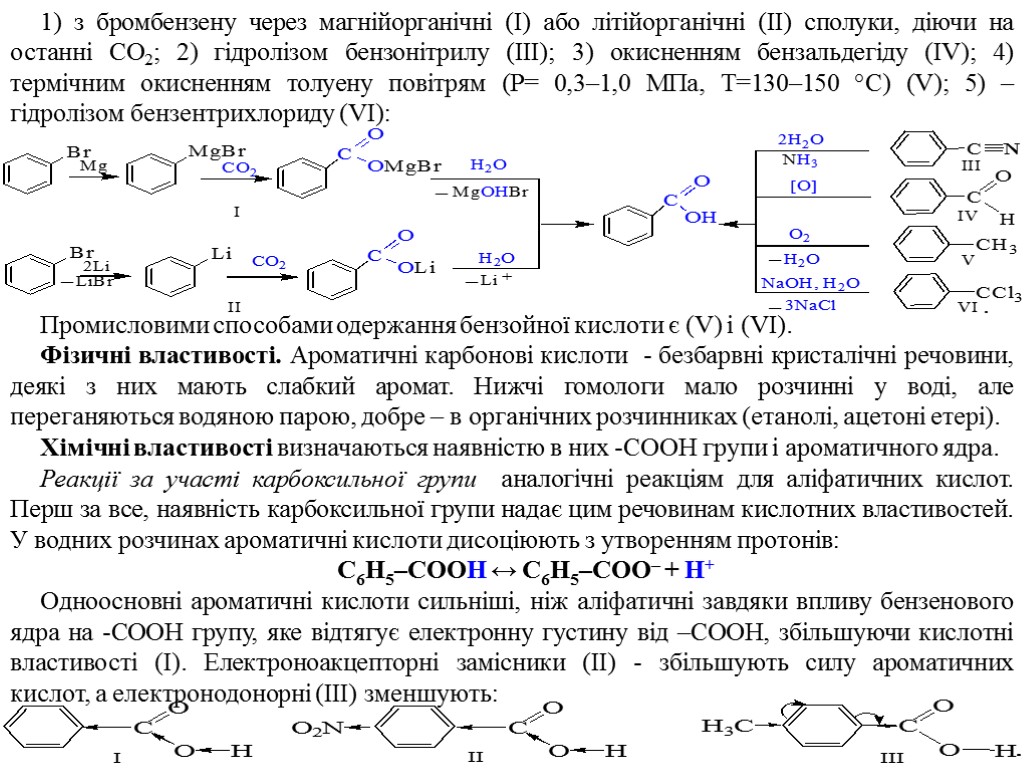
1) з бромбензену через магнійорганічні (І) або літійорганічні (ІІ) сполуки, діючи на останні СО2; 2) гідролізом бензонітрилу (ІІІ); 3) окисненням бензальдегіду (IV); 4) термічним окисненням толуену повітрям (Р= 0,3–1,0 МПа, Т=130–150 °С) (V); 5) – гідролізом бензентрихлориду (VI): Промисловими способами одержання бензойної кислоти є (V) і (VI). Фізичні властивості. Ароматичні карбонові кислоти - безбарвні кристалічні речовини, деякі з них мають слабкий аромат. Нижчі гомологи мало розчинні у воді, але переганяються водяною парою, добре – в органічних розчинниках (етанолі, ацетоні етері). Хімічні властивості визначаються наявністю в них -СООН групи і ароматичного ядра. Реакції за участі карбоксильної групи аналогічні реакціям для аліфатичних кислот. Перш за все, наявність карбоксильної групи надає цим речовинам кислотних властивостей. У водних розчинах ароматичні кислоти дисоціюють з утворенням протонів: С6Н5–СООН ↔ С6Н5–СОО– + Н+ Одноосновні ароматичні кислоти сильніші, ніж аліфатичні завдяки впливу бензенового ядра на -СООН групу, яке відтягує електронну густину від –СООН, збільшуючи кислотні властивості (І). Електроноакцепторні замісники (ІІ) - збільшують силу ароматичних кислот, а електронодонорні (ІІІ) зменшують:
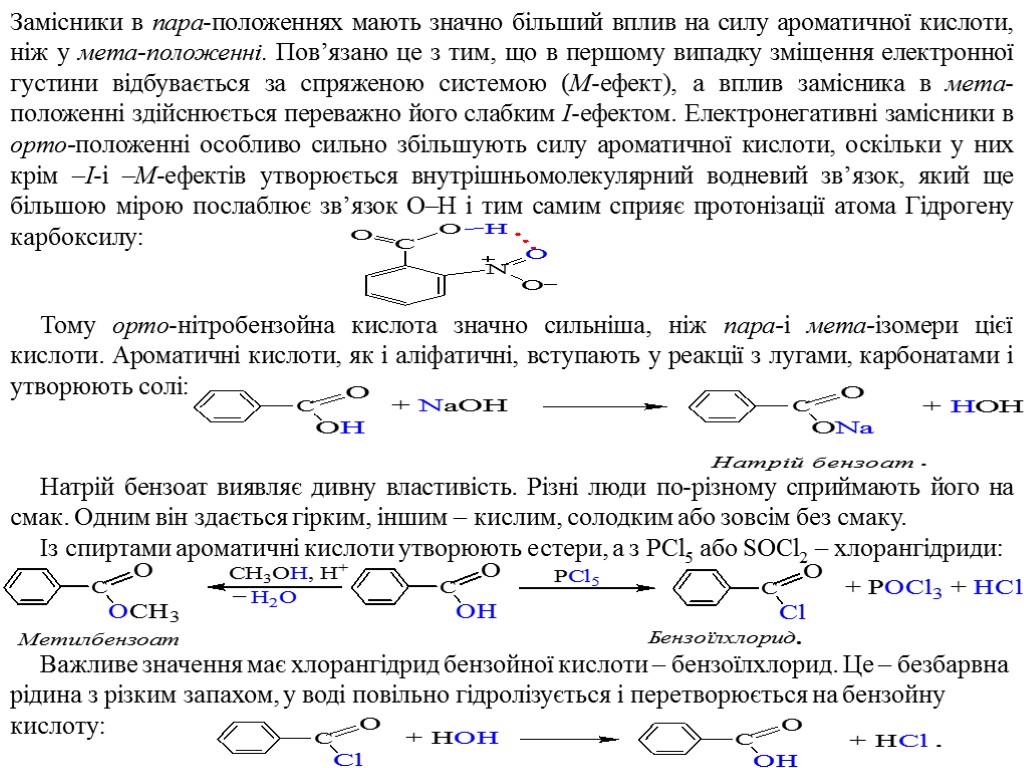
Замісники в пара-положеннях мають значно більший вплив на силу ароматичної кислоти, ніж у мета-положенні. Пов’язано це з тим, що в першому випадку зміщення електронної густини відбувається за спряженою системою (M-ефект), а вплив замісника в мета-положенні здійснюється переважно його слабким I-ефектом. Електронегативні замісники в орто-положенні особливо сильно збільшують силу ароматичної кислоти, оскільки у них крім –I-і –M-ефектів утворюється внутрішньомолекулярний водневий зв’язок, який ще більшою мірою послаблює зв’язок O–H і тим самим сприяє протонізації атома Гідрогену карбоксилу: Тому орто-нітробензойна кислота значно сильніша, ніж пара-і мета-ізомери цієї кислоти. Ароматичні кислоти, як і аліфатичні, вступають у реакції з лугами, карбонатами і утворюють солі: Натрій бензоат виявляє дивну властивість. Різні люди по-різному сприймають його на смак. Одним він здається гірким, іншим – кислим, солодким або зовсім без смаку. Із спиртами ароматичні кислоти утворюють естери, а з PCl5 або SOCl2 – хлорангідриди: Важливе значення має хлорангідрид бензойної кислоти – бензоїлхлорид. Це – безбарвна рідина з різким запахом, у воді повільно гідролізується і перетворюється на бензойну кислоту:
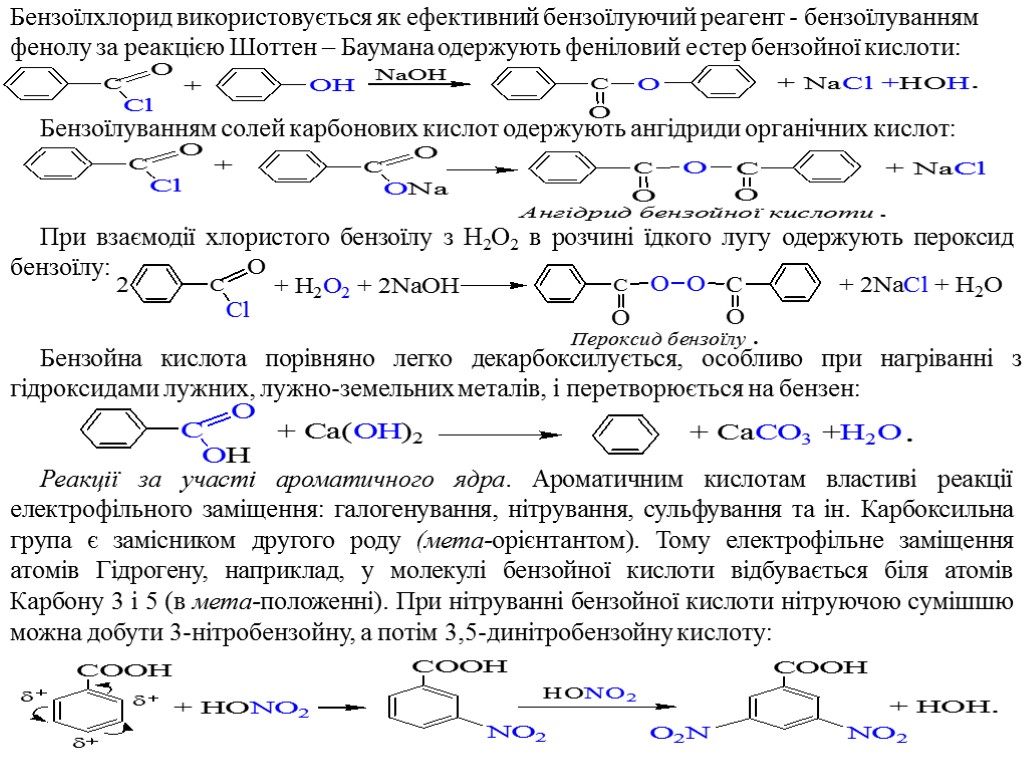
Бензоїлхлорид використовується як ефективний бензоїлуючий реагент - бензоїлуванням фенолу за реакцією Шоттен – Баумана одержують феніловий естер бензойної кислоти: Бензоїлуванням солей карбонових кислот одержують ангідриди органічних кислот: При взаємодії хлористого бензоїлу з H2O2 в розчині їдкого лугу одержують пероксид бензоїлу: Бензойна кислота порівняно легко декарбоксилується, особливо при нагріванні з гідроксидами лужних, лужно-земельних металів, і перетворюється на бензен: Реакції за участі ароматичного ядра. Ароматичним кислотам властиві реакції електрофільного заміщення: галогенування, нітрування, сульфування та ін. Карбоксильна група є замісником другого роду (мета-орієнтантом). Тому електрофільне заміщення атомів Гідрогену, наприклад, у молекулі бензойної кислоти відбувається біля атомів Карбону 3 і 5 (в мета-положенні). При нітруванні бензойної кислоти нітруючою сумішшю можна добути 3-нітробензойну, а потім 3,5-динітробензойну кислоту:
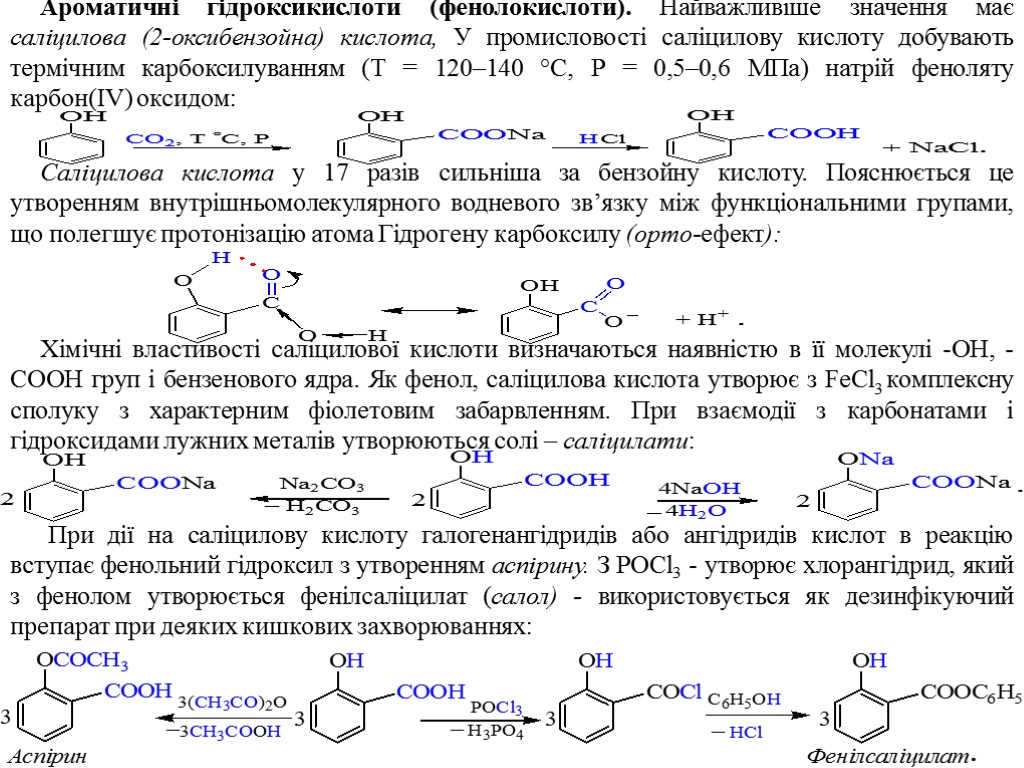
Ароматичні гідроксикислоти (фенолокислоти). Найважливіше значення має саліцилова (2-оксибензойна) кислота, У промисловості саліцилову кислоту добувають термічним карбоксилуванням (Т = 120–140 °С, Р = 0,5–0,6 МПа) натрій феноляту карбон(IV) оксидом: Саліцилова кислота у 17 разів сильніша за бензойну кислоту. Пояснюється це утворенням внутрішньомолекулярного водневого зв’язку між функціональними групами, що полегшує протонізацію атома Гідрогену карбоксилу (орто-ефект): Хімічні властивості саліцилової кислоти визначаються наявністю в її молекулі -ОН, -СООН груп і бензенового ядра. Як фенол, саліцилова кислота утворює з FeCl3 комплексну сполуку з характерним фіолетовим забарвленням. При взаємодії з карбонатами і гідроксидами лужних металів утворюються солі – саліцилати: При дії на саліцилову кислоту галогенангідридів або ангідридів кислот в реакцію вступає фенольний гідроксил з утворенням аспірину. З POCl3 - утворює хлорангідрид, який з фенолом утворюється фенілсаліцилат (салол) - використовується як дезинфікуючий препарат при деяких кишкових захворюваннях:
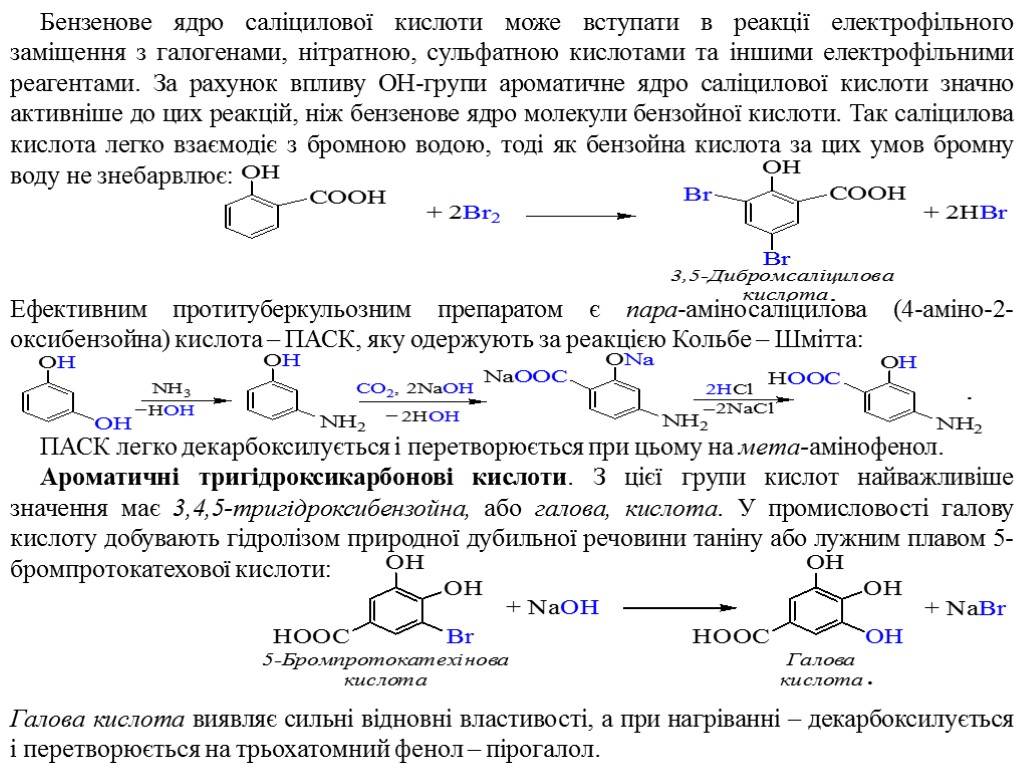
Бензенове ядро саліцилової кислоти може вступати в реакції електрофільного заміщення з галогенами, нітратною, сульфатною кислотами та іншими електрофільними реагентами. За рахунок впливу ОН-групи ароматичне ядро саліцилової кислоти значно активніше до цих реакцій, ніж бензенове ядро молекули бензойної кислоти. Так саліцилова кислота легко взаємодіє з бромною водою, тоді як бензойна кислота за цих умов бромну воду не знебарвлює: Ефективним протитуберкульозним препаратом є пара-аміносаліцилова (4-аміно-2-оксибензойна) кислота – ПАСК, яку одержують за реакцією Кольбе – Шмітта: ПАСК легко декарбоксилується і перетворюється при цьому на мета-амінофенол. Ароматичні тригідроксикарбонові кислоти. З цієї групи кислот найважливіше значення має 3,4,5-тригідроксибензойна, або галова, кислота. У промисловості галову кислоту добувають гідролізом природної дубильної речовини таніну або лужним плавом 5-бромпротокатехової кислоти: Галова кислота виявляє сильні відновні властивості, а при нагріванні – декарбоксилується і перетворюється на трьохатомний фенол – пірогалол.
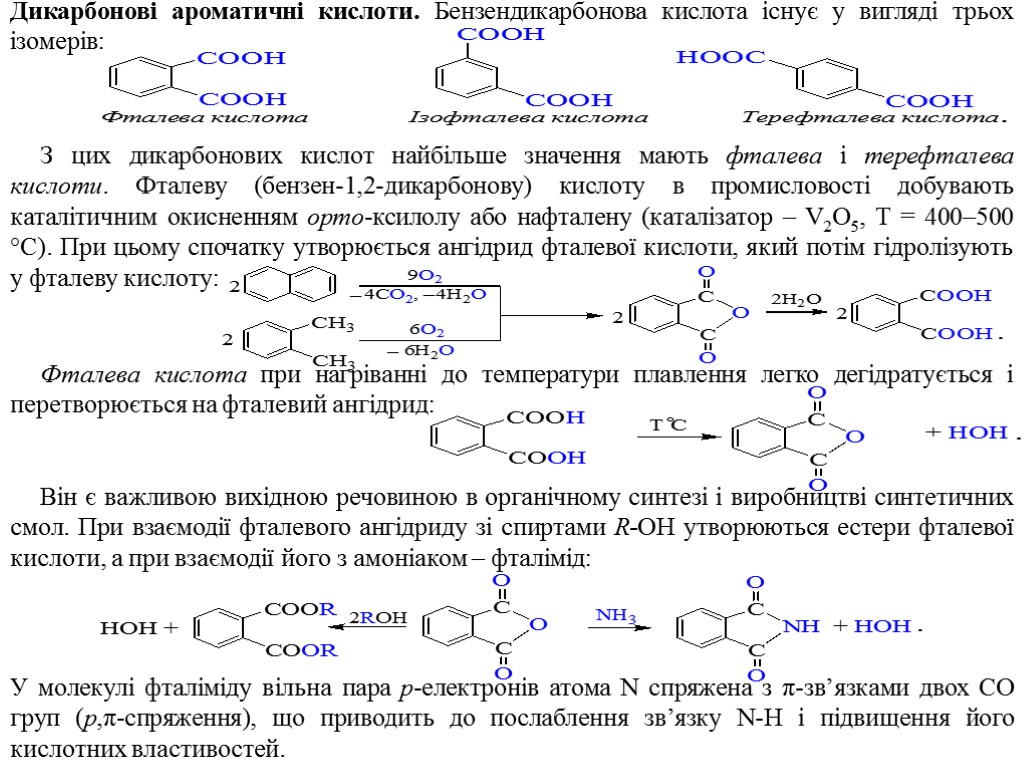
Дикарбонові ароматичні кислоти. Бензендикарбонова кислота існує у вигляді трьох ізомерів: З цих дикарбонових кислот найбільше значення мають фталева і терефталева кислоти. Фталеву (бензен-1,2-дикарбонову) кислоту в промисловості добувають каталітичним окисненням орто-ксилолу або нафталену (каталізатор – V2O5, Т = 400–500 °С). При цьому спочатку утворюється ангідрид фталевої кислоти, який потім гідролізують у фталеву кислоту: Фталева кислота при нагріванні до температури плавлення легко дегідратується і перетворюється на фталевий ангідрид: Він є важливою вихідною речовиною в органічному синтезі і виробництві синтетичних смол. При взаємодії фталевого ангідриду зі спиртами R-OH утворюються естери фталевої кислоти, а при взаємодії його з амоніаком – фталімід: У молекулі фталіміду вільна пара p-електронів атома N спряжена з π-зв’язками двох CO груп (p,π-спряження), що приводить до послаблення зв’язку N-H і підвищення його кислотних властивостей.
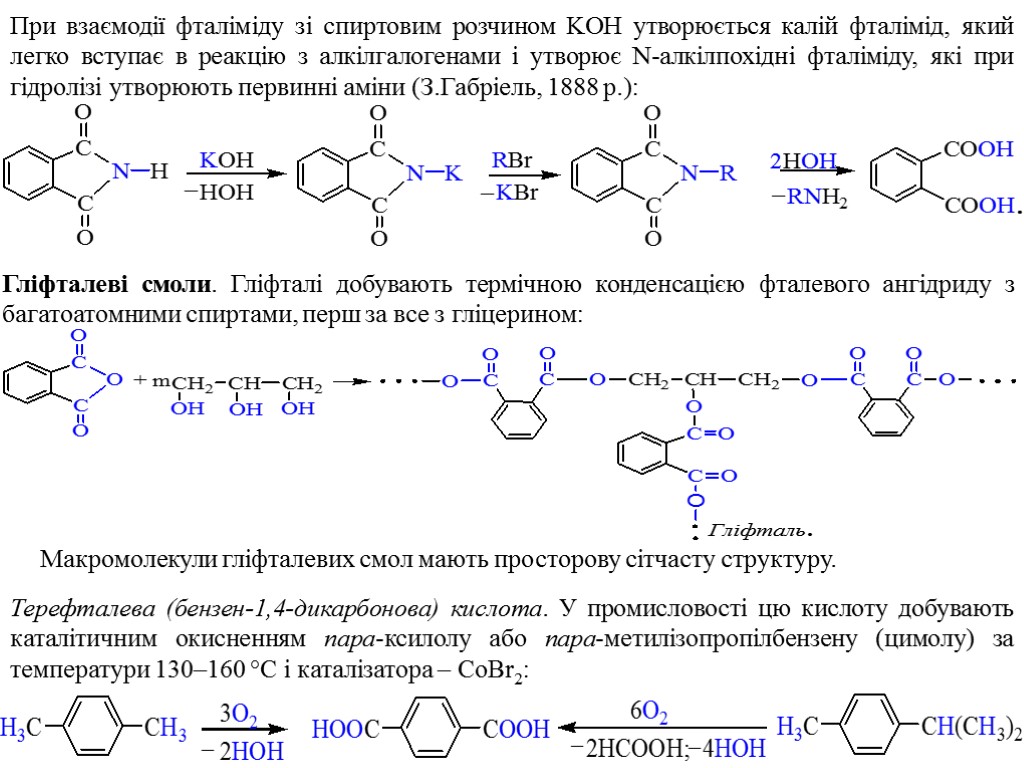
При взаємодії фталіміду зі спиртовим розчином KOH утворюється калій фталімід, який легко вступає в реакцію з алкілгалогенами і утворює N-алкілпохідні фталіміду, які при гідролізі утворюють первинні аміни (З.Габріель, 1888 p.): Гліфталеві смоли. Гліфталі добувають термічною конденсацією фталевого ангідриду з багатоатомними спиртами, перш за все з гліцерином: Макромолекули гліфталевих смол мають просторову сітчасту структуру. Терефталева (бензен-1,4-дикарбонова) кислота. У промисловості цю кислоту добувають каталітичним окисненням пара-ксилолу або пара-метилізопропілбензену (цимолу) за температури 130–160 °С і каталізатора – СoBr2:
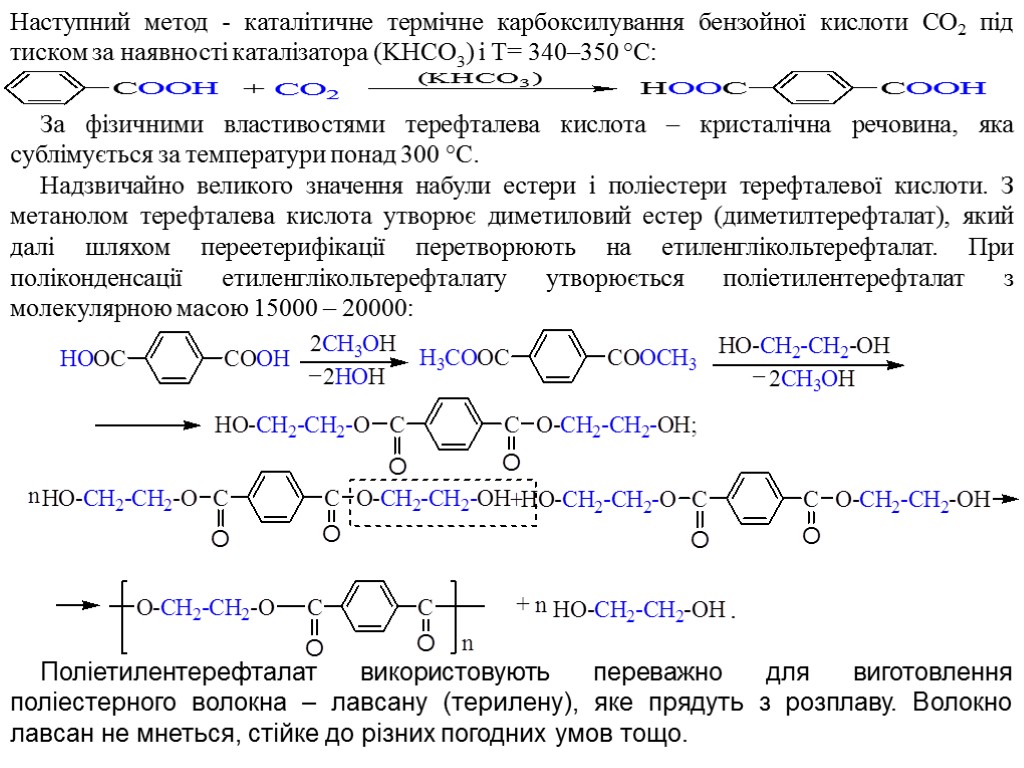
Наступний метод - каталітичне термічне карбоксилування бензойної кислоти СО2 під тиском за наявності каталізатора (KHCO3) і Т= 340–350 °С: За фізичними властивостями терефталева кислота – кристалічна речовина, яка сублімується за температури понад 300 °C. Надзвичайно великого значення набули естери і поліестери терефталевої кислоти. З метанолом терефталева кислота утворює диметиловий естер (диметилтерефталат), який далі шляхом переетерифікації перетворюють на етиленглікольтерефталат. При поліконденсації етиленглікольтерефталату утворюється поліетилентерефталат з молекулярною масою 15000 – 20000: Поліетилентерефталат використовують переважно для виготовлення поліестерного волокна – лавсану (терилену), яке прядуть з розплаву. Волокно лавсан не мнеться, стійке до різних погодних умов тощо.
ar-cooh-12.ppt
- Количество слайдов: 9

