9_карбонильные соединения 2013.pptx
- Количество слайдов: 47
Карбонильные соединения (альдегиды и кетоны)

Способы получения карбонильных соединений 1) Гидратация алкинов 2) Ацилирование аренов 3) Окисление спиртов
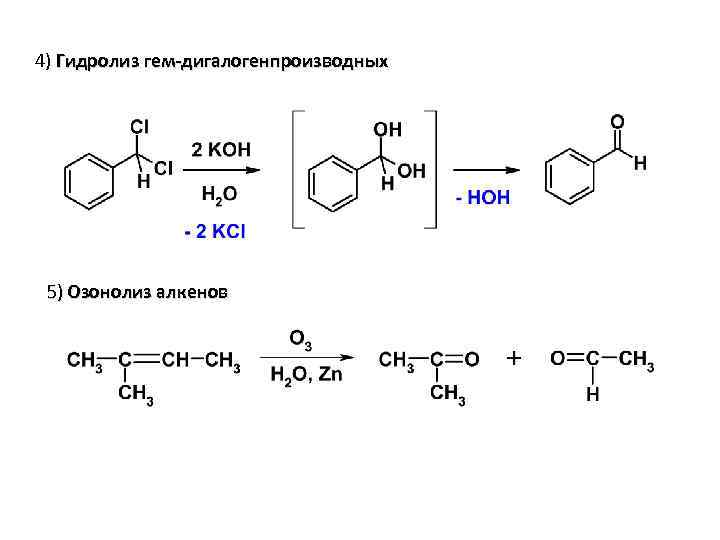
4) Гидролиз гем-дигалогенпроизводных 5) Озонолиз алкенов
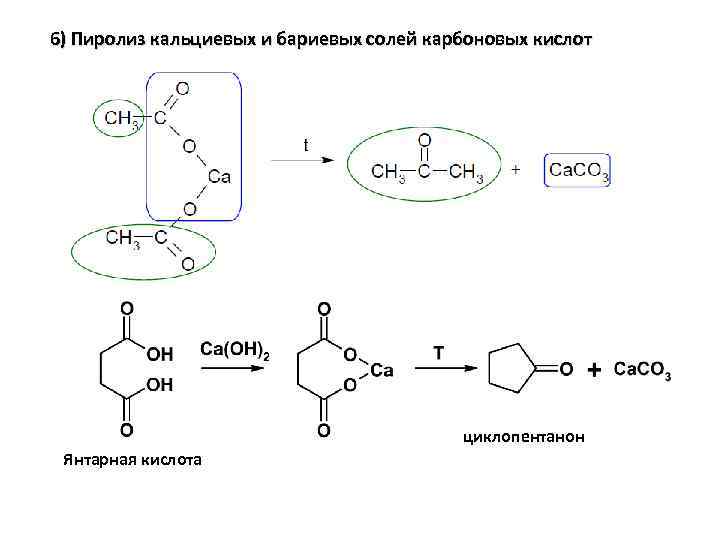
6) Пиролиз кальциевых и бариевых солей карбоновых кислот циклопентанон Янтарная кислота
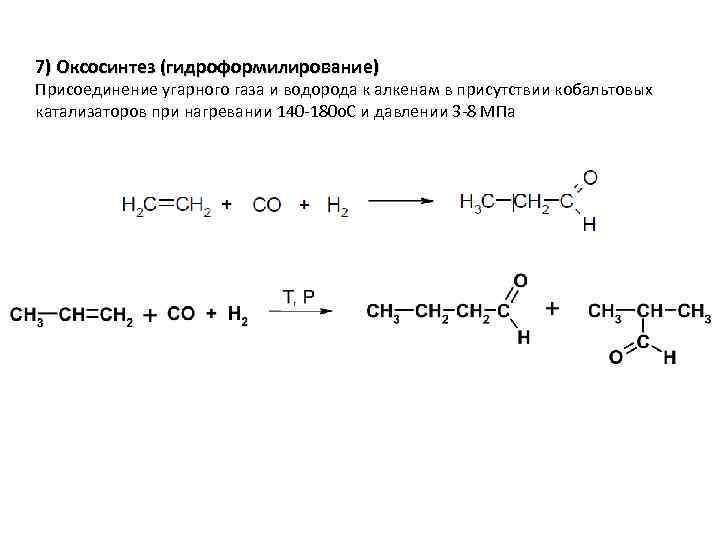
7) Оксосинтез (гидроформилирование) Присоединение угарного газа и водорода к алкенам в присутствии кобальтовых катализаторов при нагревании 140 -180 o. C и давлении 3 -8 МПа
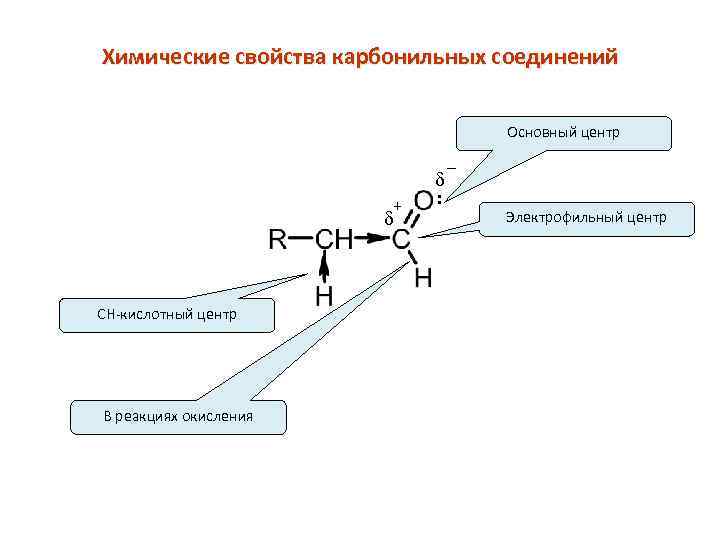
Химические свойства карбонильных соединений Основный центр + d CH-кислотный центр В реакциях окисления d : _ Электрофильный центр
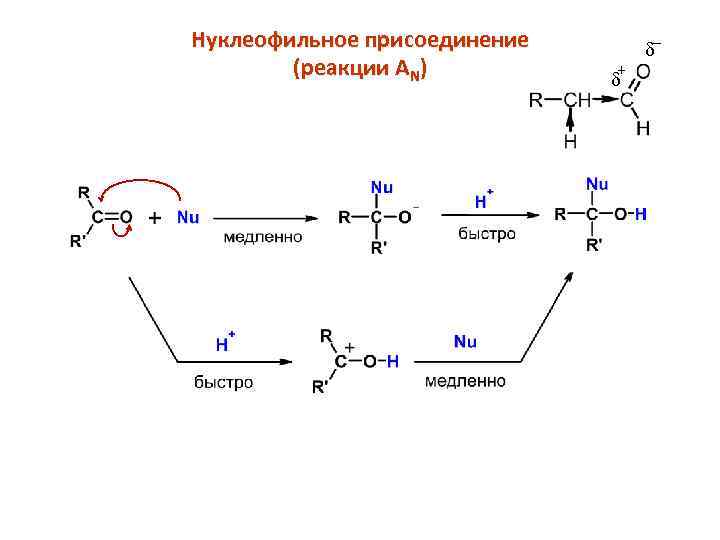
Нуклеофильное присоединение (реакции AN) _ + d d

Стереохимия реакции AN Присоединение нуклеофила к несимметричному карбонильному соединению приводит к образованию рацемической смеси

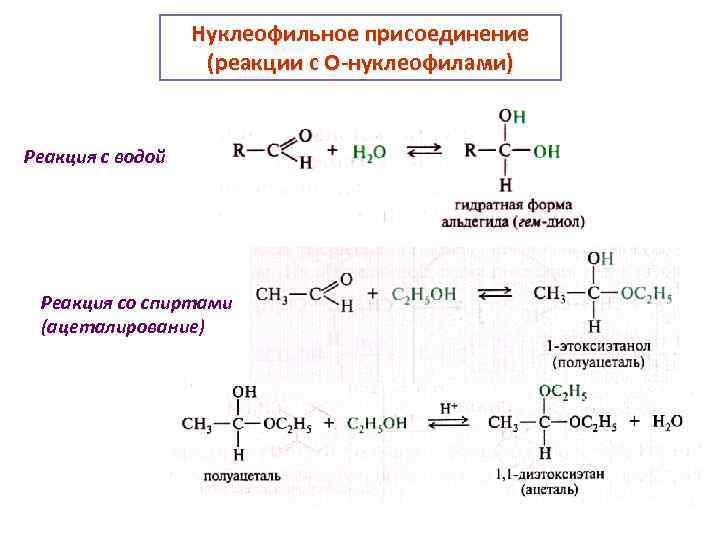
Нуклеофильное присоединение (реакции с О-нуклеофилами) Реакция с водой Реакция со спиртами (ацеталирование)

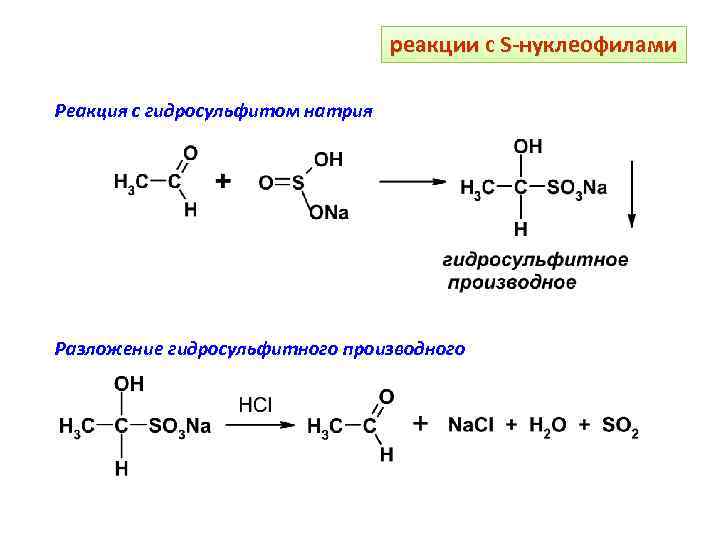
реакции с S-нуклеофилами Реакция с гидросульфитом натрия Разложение гидросульфитного производного

реакции с N-нуклеофилами Реакция с аминами Реакция с гидразинами

Реакция с аминами Реакция с гидразинами
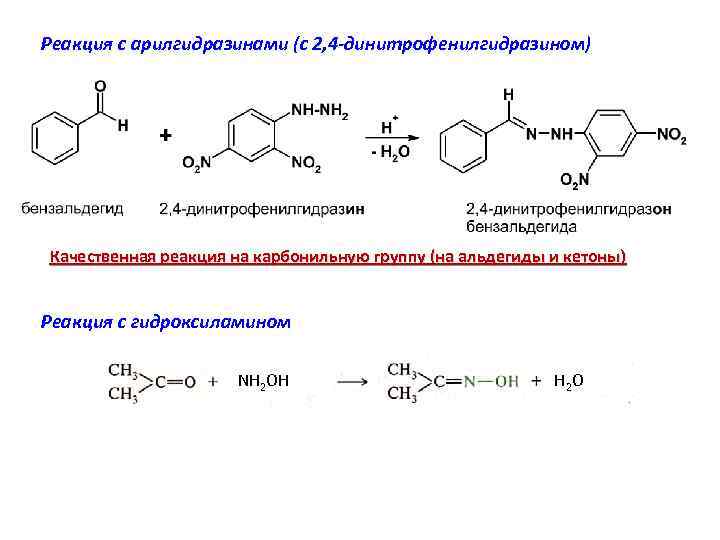
Реакция с арилгидразинами (с 2, 4 -динитрофенилгидразином) Качественная реакция на карбонильную группу (на альдегиды и кетоны) Реакция с гидроксиламином NH 2 OH H 2 O
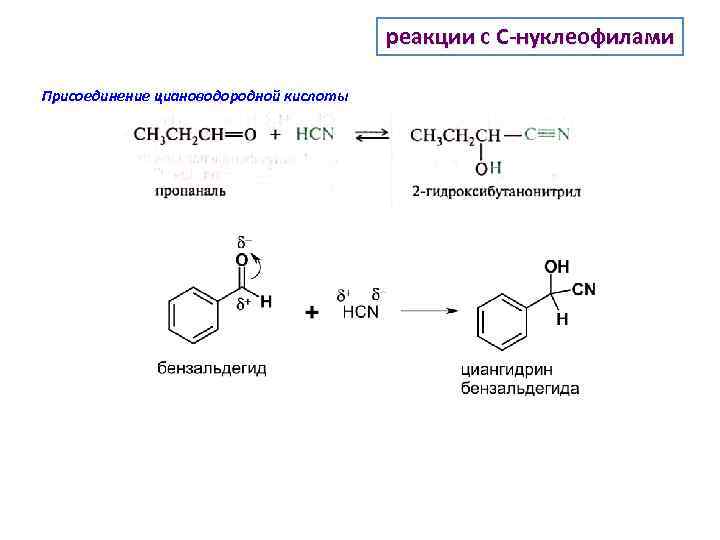
реакции с C-нуклеофилами Присоединение циановодородной кислоты
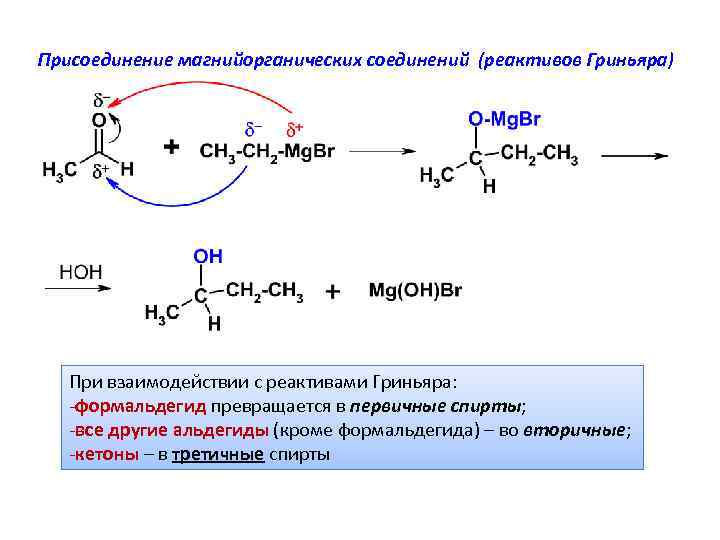
Присоединение магнийорганических соединений (реактивов Гриньяра) При взаимодействии с реактивами Гриньяра: -формальдегид превращается в первичные спирты; -все другие альдегиды (кроме формальдегида) – во вторичные; -кетоны – в третичные спирты


реакции с C-нуклеофилами Альдольная конденсация В альдольную конденсацию вступают альдегиды и кетоны, содержащие в -звене хотя бы один атом водорода

Механизм альдольной конденсации, катализируемой основаниями.

Взаимодействие с нитроалканами (реакция Анри)

Взаимодействие с терминальными алкинами (реакция Фаворского) Алкины с терминальной тройной связью могут присоединяться к альдегидам и кетонам в присутствии щелочных катализаторов с образованием ацетиленовых спиртов (Фаворский, 1905). Промышленный метод присоединения ацетилена к формальдегиду в присутствии ацетиленидов меди при 90 -120 o. C и давлении 5 атм. Разработан Реппе
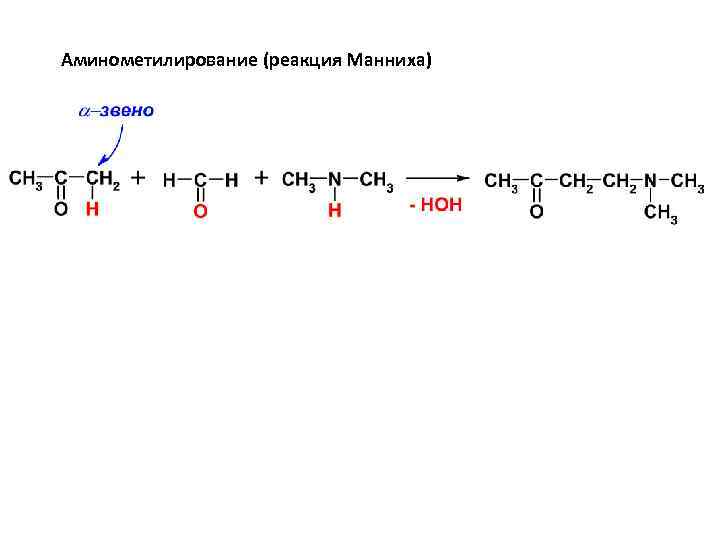
Аминометилирование (реакция Манниха)
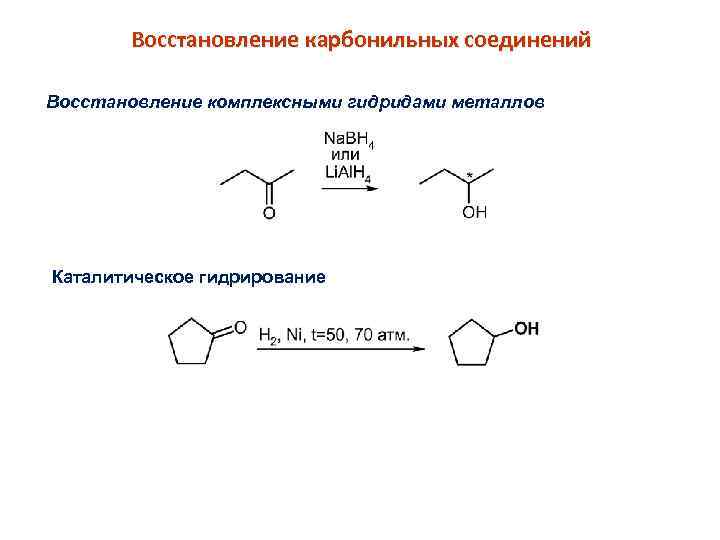
Восстановление карбонильных соединений Восстановление комплексными гидридами металлов Каталитическое гидрирование
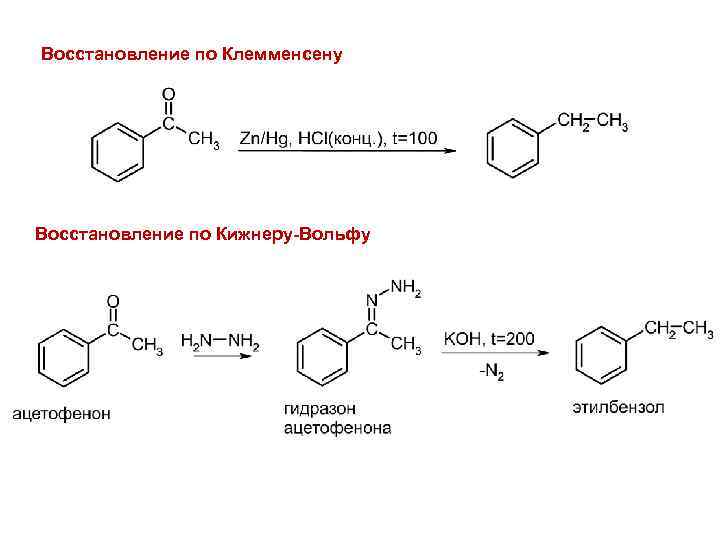
Восстановление по Клемменсену Восстановление по Кижнеру-Вольфу
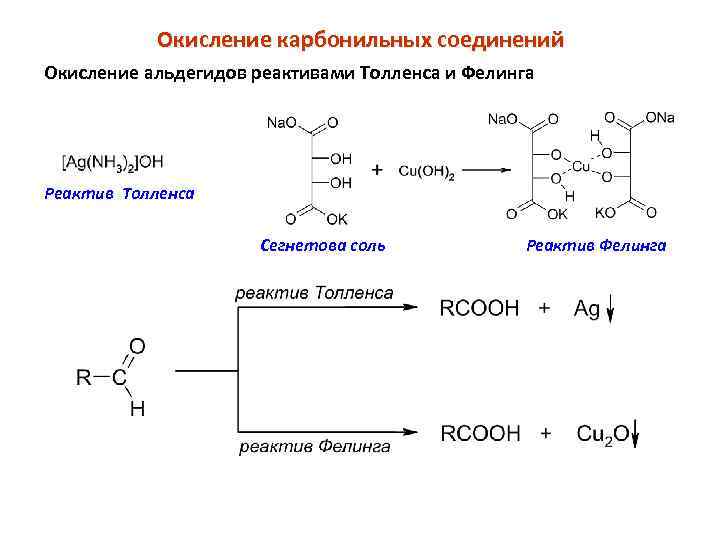
Окисление карбонильных соединений Окисление альдегидов реактивами Толленса и Фелинга Реактив Толленса Сегнетова соль Реактив Фелинга

Окисление кетонов Реакция Байера-Виллигера
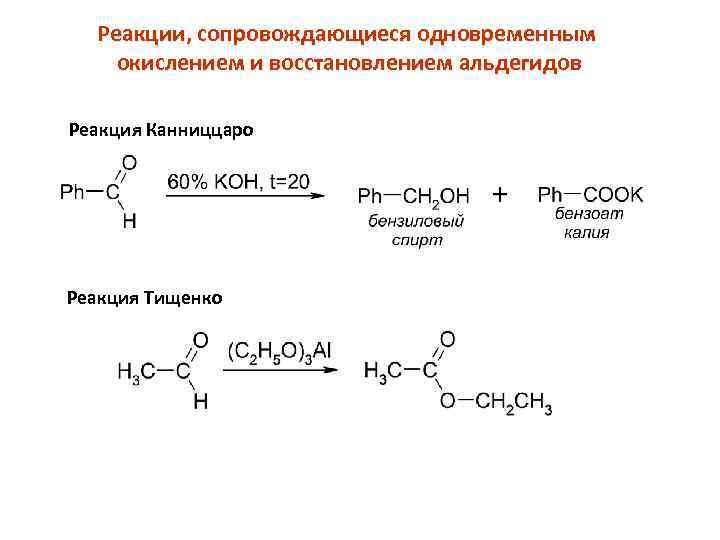
Реакции, сопровождающиеся одновременным окислением и восстановлением альдегидов Реакция Канниццаро Реакция Тищенко
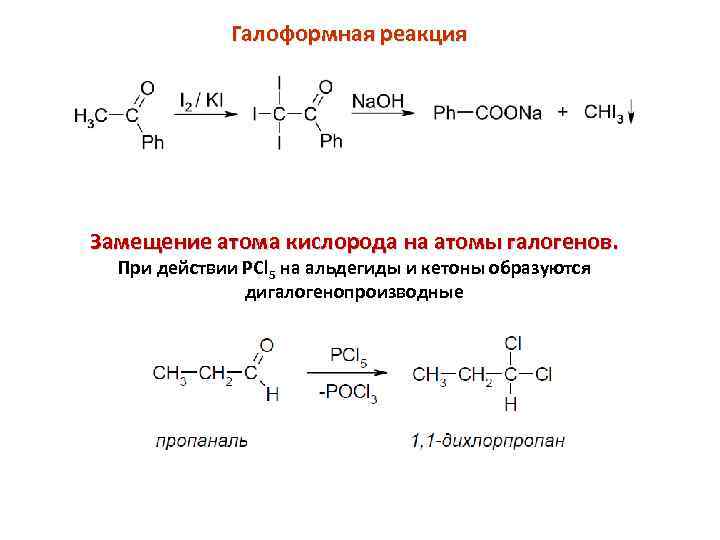
Галоформная реакция Замещение атома кислорода на атомы галогенов. При действии PCl 5 на альдегиды и кетоны образуются дигалогенопроизводные

Непредельные альдегиды и кетоны

Способы получения 1. Дегидратация глицерина 2. Каталитическое окисление пропена
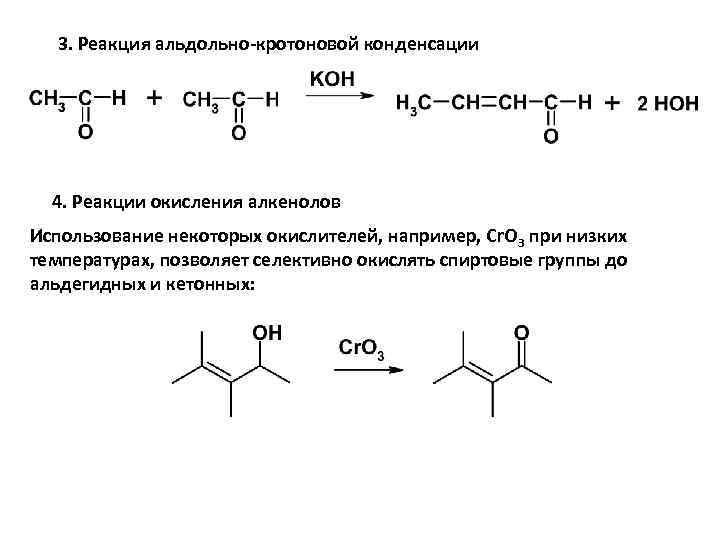
3. Реакция альдольно-кротоновой конденсации 4. Реакции окисления алкенолов Использование некоторых окислителей, например, Cr. O 3 при низких температурах, позволяет селективно окислять спиртовые группы до альдегидных и кетонных:
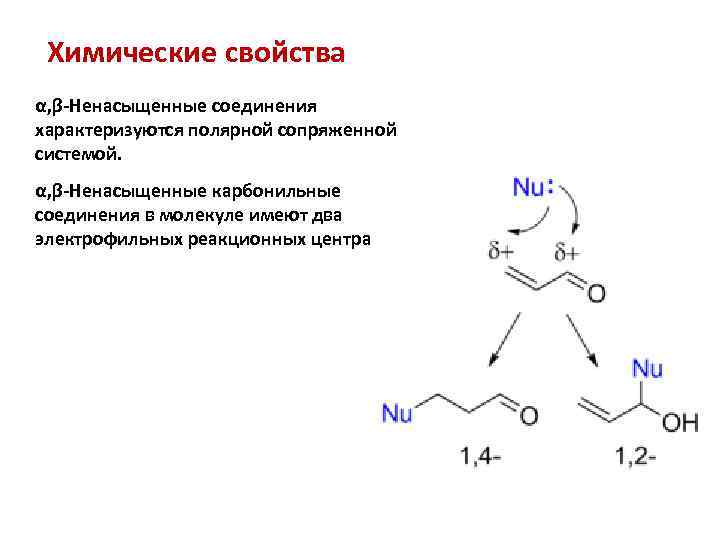
Химические свойства α, β-Ненасыщенные соединения характеризуются полярной сопряженной системой. α, β-Ненасыщенные карбонильные соединения в молекуле имеют два электрофильных реакционных центра

Присоединение синильной кислоты (HCN) Для непредельных альдегидов преобладает 1, 2 -присоединение, для кетонов – 1, 4 -присоединение

Гидрирование
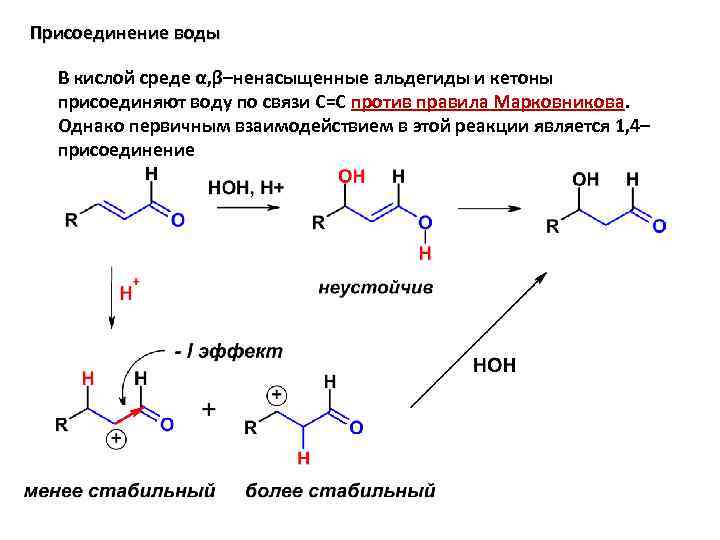
Присоединение воды В кислой среде α, β–ненасыщенные альдегиды и кетоны присоединяют воду по связи С=С против правила Марковникова. Однако первичным взаимодействием в этой реакции является 1, 4– присоединение

Присоединение галогеноводородов – 1, 4 -присоединение Присоединение аминов и аммиака

Некоторые представители ряда альдегидов и кетонов

ПРОСТЫЕ ЭФИРЫ Простые эфиры можно рассматривать как производные спиртов, в которых атом водорода гидроксильной группы замещен на углеводородный радикал

Классификация простых эфиров 1. Эфиры, содержащие связи С(sp 3)-O. К ним относятся эфиры структуры R-O-R’ и циклические эфиры. 2. Эфиры содержащие связь С(sp 2)-O - алкилалкениловые (виниловые) эфиры; - диалкениловые эфиры; - алкилариловые эфиры; - диариловые эфиры. 3. Эфиры, содержащие связь С(sp)-O

Способы получения 1. Межмолекулярная дегидратация спиртов 2. Синтез Вильямсона – алкилирование алкоголятов 3. О-Алкилирование фенолов
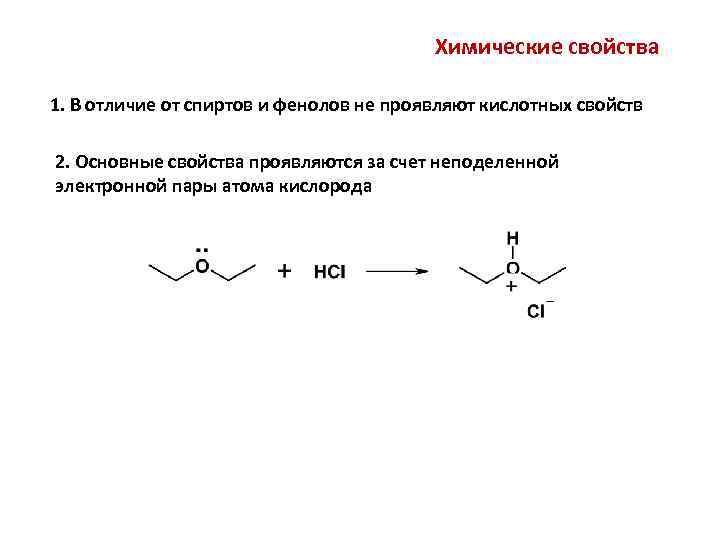
Химические свойства 1. В отличие от спиртов и фенолов не проявляют кислотных свойств 2. Основные свойства проявляются за счет неподеленной электронной пары атома кислорода

Реакции при α - углеродном атоме диалкиловых эфиров А) свободнорадикальное хлорирование Б) автоокисление
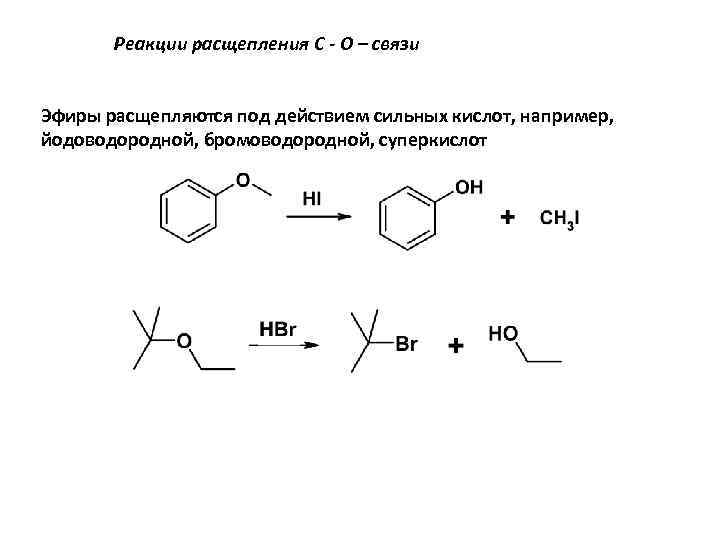
Реакции расщепления С - О – связи Эфиры расщепляются под действием сильных кислот, например, йодоводородной, бромоводородной, суперкислот

Циклические простые эфиры

Методы получения 1) Окисление (эпоксидирование) алкенов (реакция Прилежаева) 2) Дегидрогалогенирование галогеналканолов (галогенгидринов)

Химические свойства эпоксидов (оксиранов)
9_карбонильные соединения 2013.pptx