Заняття6.ppt
- Количество слайдов: 23

КАРБАНІОНИ. МЕТАЛООРГАНІЧНІ СПОЛУКИ (ТРИЛОГІЯ. ЧАСТИНА 1) Сучасні методи органічного синтезу

Карбаніони Карбаніон – негативно заряджена частинка, що містить неподілену електронну пару на атомі карбону (хоча б в одній з основних резонансних форм) Ковтуненко В. О. , Лозинський М. О. 2
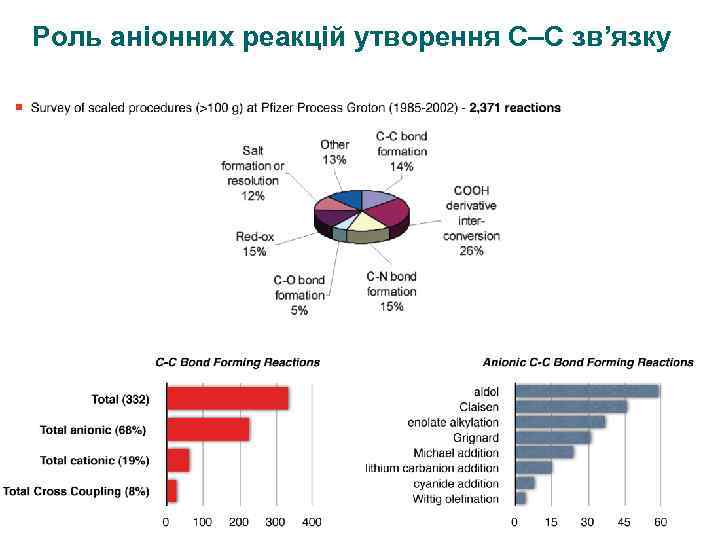
Роль аніонних реакцій утворення С–С зв’язку 3
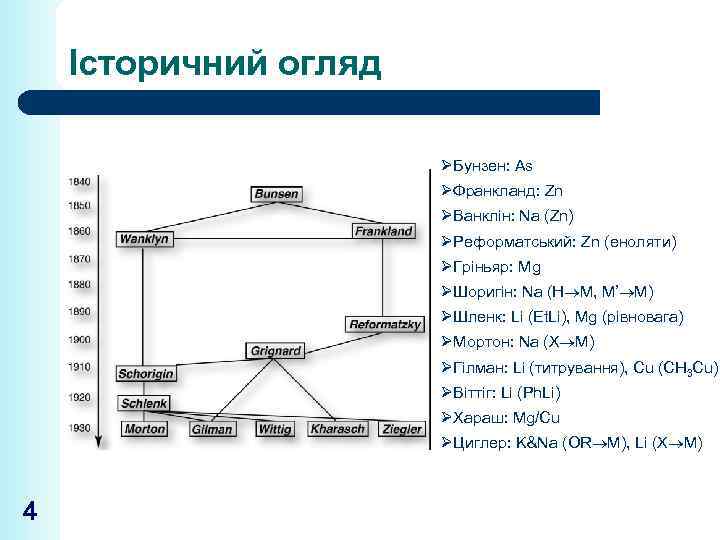
Історичний огляд ØБунзен: As ØФранкланд: Zn ØВанклін: Na (Zn) ØРеформатський: Zn (еноляти) ØГріньяр: Mg ØШоригін: Na (Н M, M’ M) ØШленк: Li (Et. Li), Mg (рівновага) ØМортон: Na (X M) ØГілман: Li (титрування), Cu (CH 3 Cu) ØВіттіг: Li (Ph. Li) ØХараш: Mg/Cu ØЦиглер: K&Na (OR M), Li (X M) 4
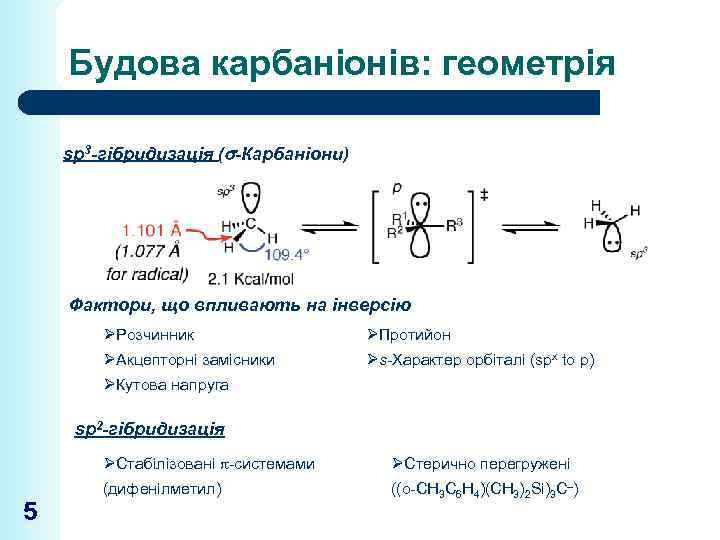
Будова карбаніонів: геометрія sp 3 -гібридизація ( -Карбаніони) Фактори, що впливають на інверсію ØРозчинник ØПротийон ØАкцепторні замісники Øs-Характер орбіталі (spx to p) ØКутова напруга sp 2 -гібридизація ØСтабілізовані -системами 5 ØСтерично перегружені (дифенілметил) ((o-CH 3 C 6 H 4)(CH 3)2 Si)3 C–)
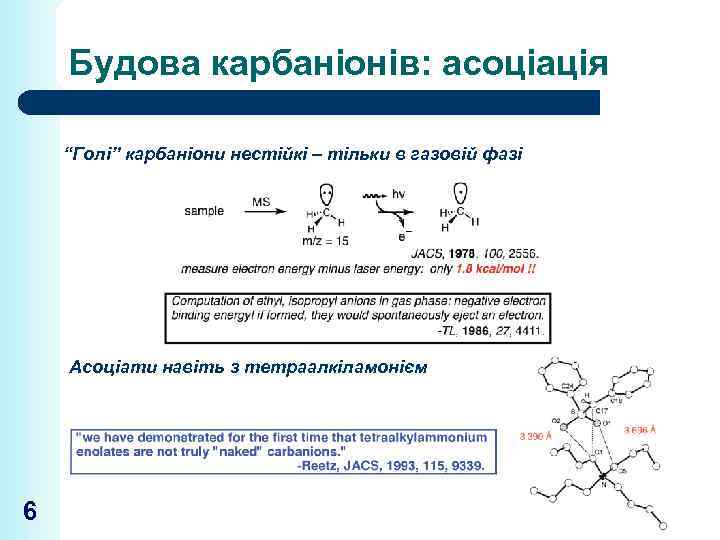
Будова карбаніонів: асоціація “Голі” карбаніони нестійкі – тільки в газовій фазі Асоціати навіть з тетраалкіламонієм 6

Хімічний зв’язок у МОС Ковалентний -зв’язок Si, Sn, Se, Cd, Hg, Ti Mg, B, Al, Zn, Cu Іонний зв’язок Na, K, Rb, Cs а також стабільні карбаніони Багатоцентрові (електронодефіцитні) зв’язки Li, Be, Mg, Al, B -Зв’язки переважно перехідні метали з -делокалізованими карбаніонами 7 Ковтуненко В. О. , Лозинський М. О.
![Літійорганічні сполуки: будова Твердий стан [Me. Li]4; [Et. Li]4 [(HC(CH 2)3 C)(TMEDA)Li]2 [cyclo-C 6 Літійорганічні сполуки: будова Твердий стан [Me. Li]4; [Et. Li]4 [(HC(CH 2)3 C)(TMEDA)Li]2 [cyclo-C 6](https://present5.com/presentation/3/-30038723_131586555.pdf-img/-30038723_131586555.pdf-8.jpg)
Літійорганічні сполуки: будова Твердий стан [Me. Li]4; [Et. Li]4 [(HC(CH 2)3 C)(TMEDA)Li]2 [cyclo-C 6 H 12 Li]6(C 6 H 6)2 8 Розчин

Літійорганічні сполуки: будова Розчин 9
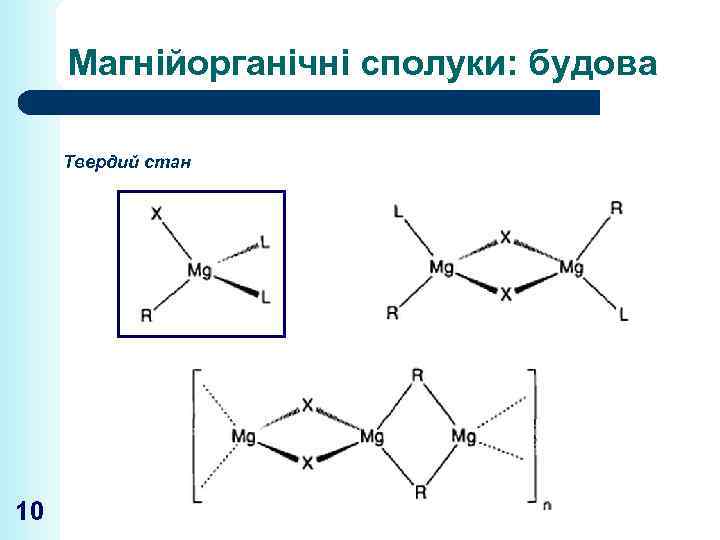
Магнійорганічні сполуки: будова Твердий стан 10
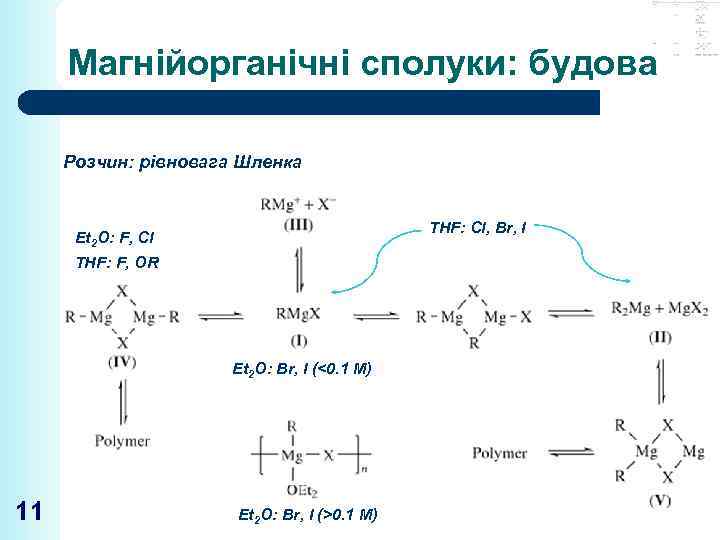
Магнійорганічні сполуки: будова Розчин: рівновага Шленка THF: Cl, Br, I Et 2 O: F, Cl THF: F, OR Et 2 O: Br, I (<0. 1 M) 11 Et 2 O: Br, I (>0. 1 M)

Стійкість карбаніонів Фактори, що впливають на стійкість Ø індуктивний ефект/ефект поля Ø резонансний ефект Ø гібридизація карбаніонного центру (+вплив алкільних груп!) Ø ароматичність Ø близькість та кількість стабілізуючих груп Ø стереоелектронні ефекти 12

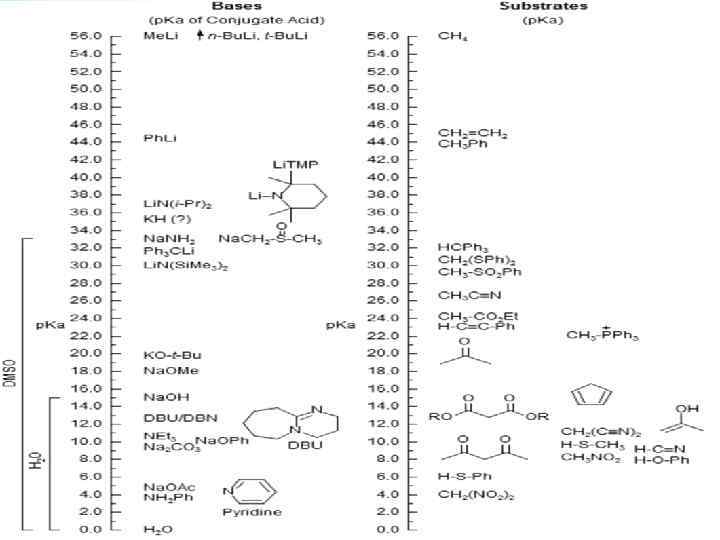
Кількісна оцінка стійкості карбаніонів Термодинамічна кислотність – p. Ka Ø у газовій фазі (часто у к. Дж/моль) Ø у воді Ø у ДМСО (шкала Бордвела) The change in p. Ka in going from water to DMSO is increasingly diminished as the conjugate base becomes resonance stabilized Ø шкала МСЕД (MSAD: Mc. Ewen, Streitwieser, Applequist, Dessy) Працює для розчинників з низькою полярністю МакІвен: рівновага RH з ментилатом натрію, за кутом обертання Стрейтвізер: металювання RH + R’H недостачею аміду металу (флуорен як “ 0”) Еплквіст: рівновага RLi та R’I Дессі: рівновага R 2 Mg та R 2 Hg Кінетична кислотність – k Ø реакції: галогенування, дейтерообмін Ø кореляція кінет. та термод. кислотностей: lgk = – p. Ka + const (є багато винятків) 13
14

Способи добування МОС Металювання (Н М) ØПряме металювання Ø Металювання за участі солей металів ØДепротонування за участі основ (зокрема МОС) Переметалювання (М’ М) ØПереметалювання за участі металів ØПереметалювання за участі солей металів ØПереметалювання за участі металоорганічних сполук Обмін галогену та інших груп на метал (Х М) ØВідновлення металом Ø Відновлення за участі солей аніон-радикалів ØОбмін галогену за участі металоорганічних сполук Реакції приєднання до кратних зв’язків ØВідновлення металом 15 ØПриєднання гідридів (псевдо)металів ØПриєднання металоорганічних сполук
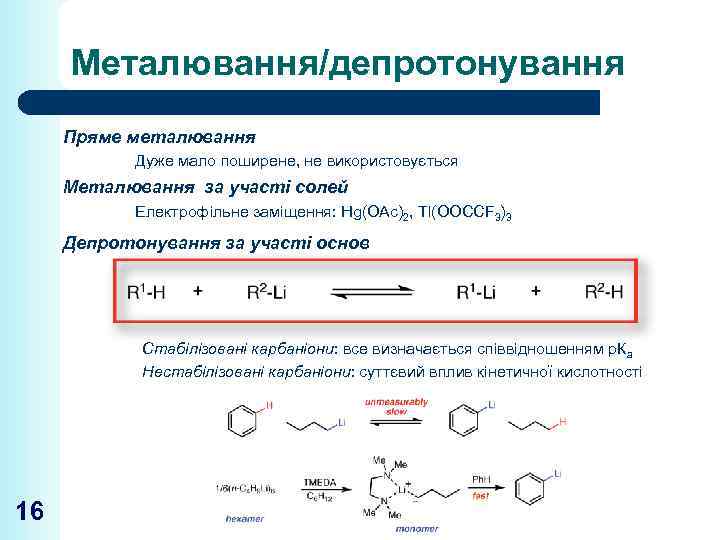
Металювання/депротонування Пряме металювання Дуже мало поширене, не використовується Металювання за участі солей Електрофільне заміщення: Hg(OAc)2, Tl(OOCCF 3)3 Депротонування за участі основ Стабілізовані карбаніони: все визначається співвідношенням р. Ка Нестабілізовані карбаніони: суттєвий вплив кінетичної кислотності 16
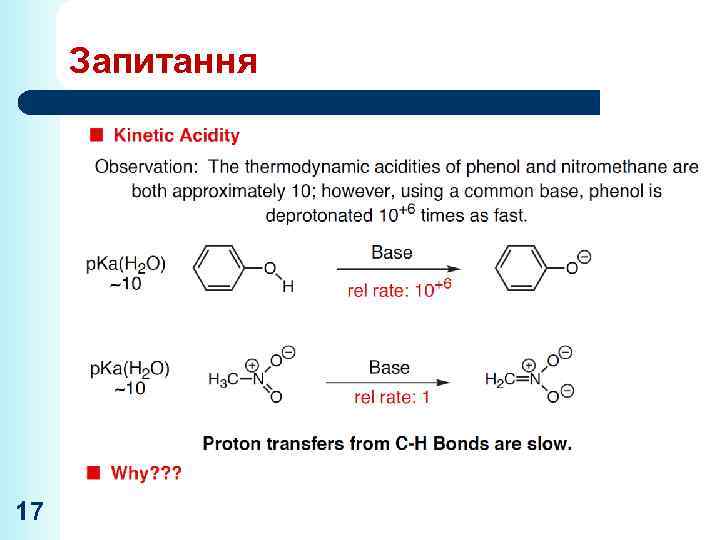
Запитання 17
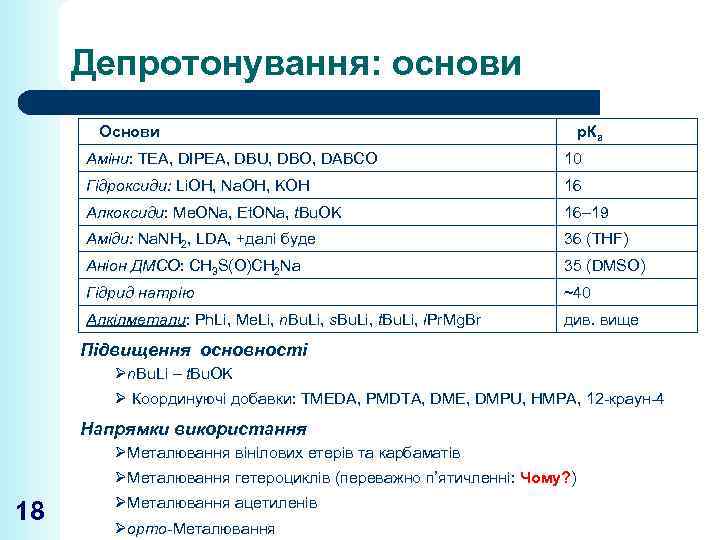
Депротонування: основи Основи р. Ка Аміни: TEA, DIPEA, DBU, DBO, DABCO 10 Гідроксиди: Li. OH, Na. OH, KOH 16 Алкоксиди: Me. ONa, Et. ONa, t. Bu. OK 16– 19 Аміди: Na. NH 2, LDA, +далі буде 36 (THF) Аніон ДМСО: CH 3 S(O)CH 2 Na 35 (DMSO) Гідрид натрію ~40 Алкілметали: Ph. Li, Me. Li, n. Bu. Li, s. Bu. Li, t. Bu. Li, i. Pr. Mg. Br див. вище Підвищення основності Øn. Bu. Li – t. Bu. OK Ø Координуючі добавки: TMEDA, PMDTA, DME, DMPU, HMPA, 12 -краун-4 Напрямки використання ØМеталювання вінілових етерів та карбаматів ØМеталювання гетероциклів (переважно п’ятичленні: Чому? ) 18 ØМеталювання ацетиленів Øорто-Металювання
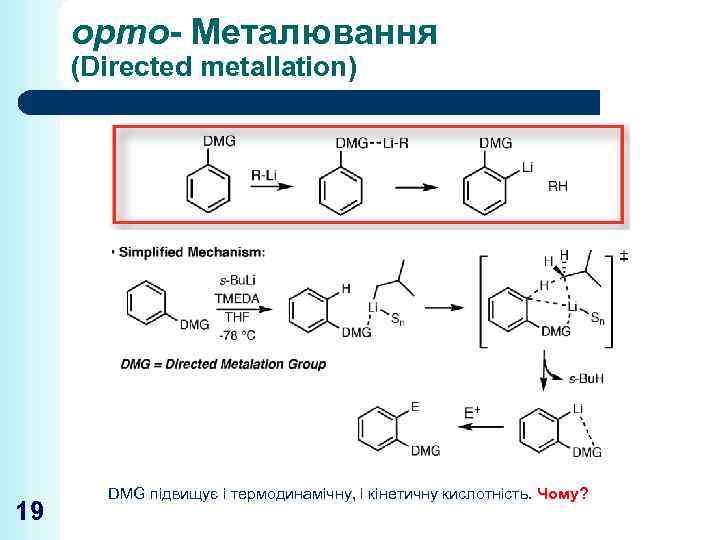
орто- Металювання (Directed metallation) 19 DMG підвищує і термодинамічну, і кінетичну кислотність. Чому?
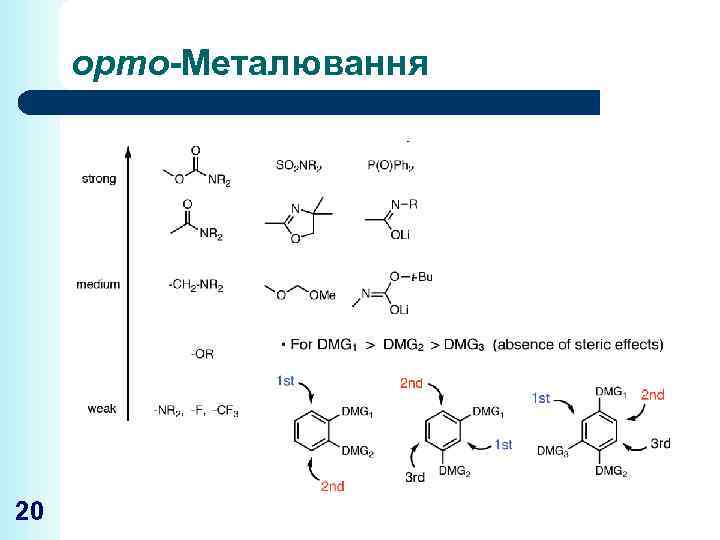
орто-Металювання 20
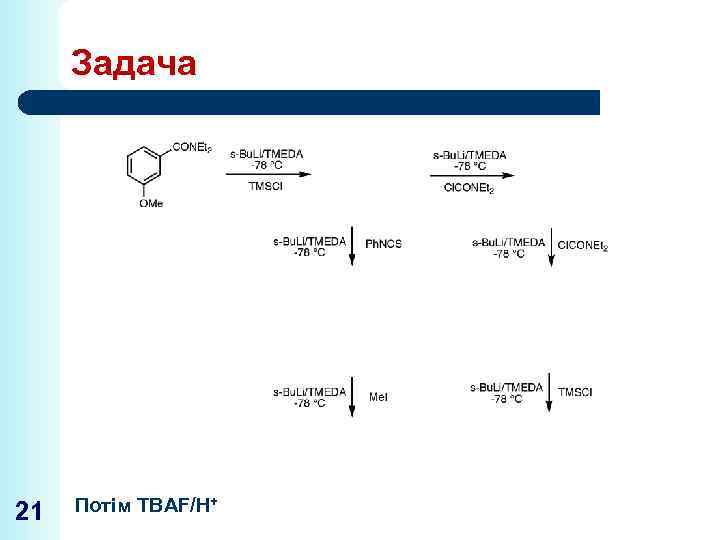
Задача 21 Потім TBAF/H+

TO BE CONTINUED… 22
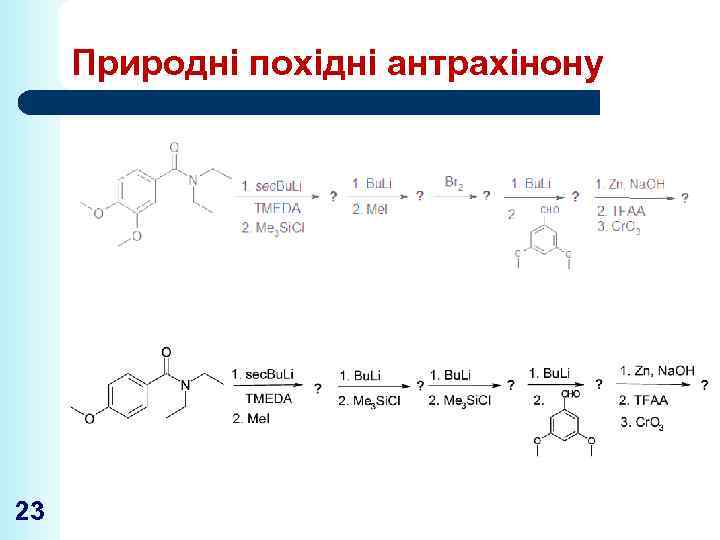
Природні похідні антрахінону 23
Заняття6.ppt