ЗабировД.2071.Патфиз.Апоптоз.pptx
- Количество слайдов: 21
 Карагандинский государственный медицинский университет Кафедра патофизиологии Патофизиология апоптоза Выполнил: Забиров Д. 2071 ОМ Проверила: Таласпекова Ю. П. Караганда 2013
Карагандинский государственный медицинский университет Кафедра патофизиологии Патофизиология апоптоза Выполнил: Забиров Д. 2071 ОМ Проверила: Таласпекова Ю. П. Караганда 2013
 Введение Введён в 1972 году Керром с соавторами для обозначения формы гибели клеток, прототипом которой является гибель тимоцитов под действием глюкокортикоидов. Эта форма клеточной смерти была отождествлена с ранее описанной программированной гибелью клеток: разница в обозначениях отражает способы идентификации гибели — морфологический в первом и биохимический во втором случае. Несмотря на критику, это отождествление, допускающее использование двух терминов как равнозначных, сохраняется до настоящего времени.
Введение Введён в 1972 году Керром с соавторами для обозначения формы гибели клеток, прототипом которой является гибель тимоцитов под действием глюкокортикоидов. Эта форма клеточной смерти была отождествлена с ранее описанной программированной гибелью клеток: разница в обозначениях отражает способы идентификации гибели — морфологический в первом и биохимический во втором случае. Несмотря на критику, это отождествление, допускающее использование двух терминов как равнозначных, сохраняется до настоящего времени.
 Понятие апоптоз Апоптоз - явление программируемой клеточной смерти, сопровождаемой набором характерных цитологических признаков и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов. Апоптоз — форма гибели клетки, проявляющаяся в уменьшении её размера, конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода содержимого клетки в окружающую среду. Несмотря на то, что обычно более принципиальным является аспект программированности и активный характер гибели, чем сопутствующие ей морфологические изменения, чаще используется термин «апоптоз» , вероятно, из-за его краткости.
Понятие апоптоз Апоптоз - явление программируемой клеточной смерти, сопровождаемой набором характерных цитологических признаков и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов. Апоптоз — форма гибели клетки, проявляющаяся в уменьшении её размера, конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода содержимого клетки в окружающую среду. Несмотря на то, что обычно более принципиальным является аспект программированности и активный характер гибели, чем сопутствующие ей морфологические изменения, чаще используется термин «апоптоз» , вероятно, из-за его краткости.
 Механизм умирания клетки при апоптозе I. Поступление индукторного сигнала II. Активация определенных генов (в первую очередь р53) и синтез специфических протеаз III. Разрушение цитоскелета IV. Формирование и отпочковывание везикул, окруженных мембраной V. Фрагментация ДНК, затем сморщивание ядра VI. Поглощение везикул и остатков клетки соседними клетками и тканевыми макрофагами без развития воспаления и соединительнотканного замещения.
Механизм умирания клетки при апоптозе I. Поступление индукторного сигнала II. Активация определенных генов (в первую очередь р53) и синтез специфических протеаз III. Разрушение цитоскелета IV. Формирование и отпочковывание везикул, окруженных мембраной V. Фрагментация ДНК, затем сморщивание ядра VI. Поглощение везикул и остатков клетки соседними клетками и тканевыми макрофагами без развития воспаления и соединительнотканного замещения.
 Признаки апоптоза I. III. IV. V. VIII. IX. Сжатие клетки за счет выкачивания ионов К и С 1, перестройка цитоскелета. Потеря ею контактов с окружающими клетками и межклеточным матриксом. На поверхности плазматической мембраны возрастает содержание фосфатидилсерина. Это является сигналом для соседних клеток. Клетка сигнализирует, что вступила в апоптоз. На плазматической мембране образуются пузырьки. Эти пузырьки содержат часть цитоплазмы и органеллы. Уплотнение нуклеоплазмы (жидкого содержимого ядра). Объединение (агрегация) хроматина. Ядро распадается на несколько фрагментов. Этот процесс идет с расходом энергии. Происходит расщепление ядерной ДНК в местах между нуклеосомами, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180 -200. Эта картина является биохимическим признаком апоптоза. Клетка поглощается соседними клетками, чаще макрофагами. Окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство.
Признаки апоптоза I. III. IV. V. VIII. IX. Сжатие клетки за счет выкачивания ионов К и С 1, перестройка цитоскелета. Потеря ею контактов с окружающими клетками и межклеточным матриксом. На поверхности плазматической мембраны возрастает содержание фосфатидилсерина. Это является сигналом для соседних клеток. Клетка сигнализирует, что вступила в апоптоз. На плазматической мембране образуются пузырьки. Эти пузырьки содержат часть цитоплазмы и органеллы. Уплотнение нуклеоплазмы (жидкого содержимого ядра). Объединение (агрегация) хроматина. Ядро распадается на несколько фрагментов. Этот процесс идет с расходом энергии. Происходит расщепление ядерной ДНК в местах между нуклеосомами, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180 -200. Эта картина является биохимическим признаком апоптоза. Клетка поглощается соседними клетками, чаще макрофагами. Окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство.
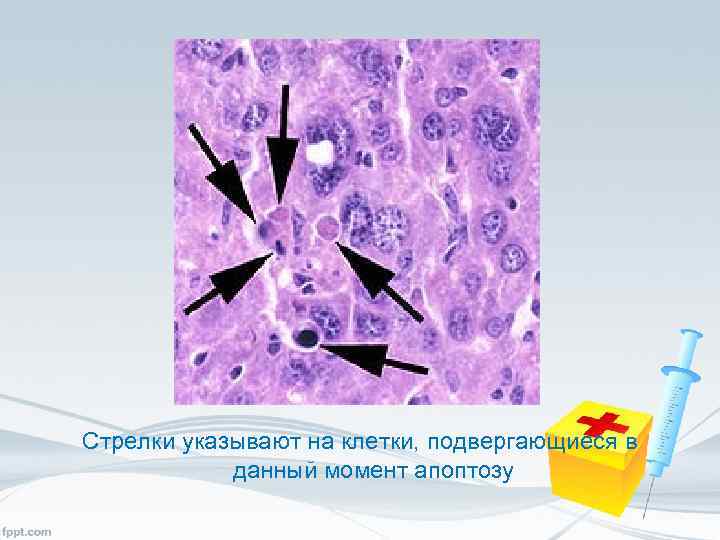 Стрелки указывают на клетки, подвергающиеся в данный момент апоптозу
Стрелки указывают на клетки, подвергающиеся в данный момент апоптозу
 Последовательность событий апоптоза 1 – Нормальная клетка 2 – Начало апоптоза 3 – Фрагментация клетки 4 – Фагоцитоз апоптотических телец окружающими клетками 5 – Гибель внутриклеточных структур при некрозе 6 – Разрушение клеточной мембраны.
Последовательность событий апоптоза 1 – Нормальная клетка 2 – Начало апоптоза 3 – Фрагментация клетки 4 – Фагоцитоз апоптотических телец окружающими клетками 5 – Гибель внутриклеточных структур при некрозе 6 – Разрушение клеточной мембраны.
 Реализация программы ПКС • • Среди них важное место занимает путь, опосредованный физиологическими индукторами, действие которых реализуется через клеточные рецепторы, специально предназначенные для включения программы апоптоза. Этот путь передачи сигнала ПКС схематически можно изобразить следующим образом: индукторы ’ рецепторы ’ адаптеры ’ каспазы первого эшелона ’ регуляторы ’ каспазы второго эшелона. Так, рецептор, обозначаемый Fas, взаимодействуя с соответствующим лигандом (лигандом Fas. L), трансмембранным белком Т-киллера, активируется и запускает программу смерти клетки, инфицированной вирусом. Fas – член семейства рецепторов TNF. Все они представлены трансмембранными белками, которые внеклеточными участками взаимодействуют с тримерами лигандовиндукторов. Взаимодействие рецептора и лиганда приводит к образованию кластеров рецепторных молекул и связыванию их внутриклеточных участков с адаптерами. Адаптер, связавшись с рецептором, вступает во взаимодействие с эффекторами, пока еще неактивными предшественниками протеаз из семейства каспаз первого эшелона (инициирующих каспаз).
Реализация программы ПКС • • Среди них важное место занимает путь, опосредованный физиологическими индукторами, действие которых реализуется через клеточные рецепторы, специально предназначенные для включения программы апоптоза. Этот путь передачи сигнала ПКС схематически можно изобразить следующим образом: индукторы ’ рецепторы ’ адаптеры ’ каспазы первого эшелона ’ регуляторы ’ каспазы второго эшелона. Так, рецептор, обозначаемый Fas, взаимодействуя с соответствующим лигандом (лигандом Fas. L), трансмембранным белком Т-киллера, активируется и запускает программу смерти клетки, инфицированной вирусом. Fas – член семейства рецепторов TNF. Все они представлены трансмембранными белками, которые внеклеточными участками взаимодействуют с тримерами лигандовиндукторов. Взаимодействие рецептора и лиганда приводит к образованию кластеров рецепторных молекул и связыванию их внутриклеточных участков с адаптерами. Адаптер, связавшись с рецептором, вступает во взаимодействие с эффекторами, пока еще неактивными предшественниками протеаз из семейства каспаз первого эшелона (инициирующих каспаз).
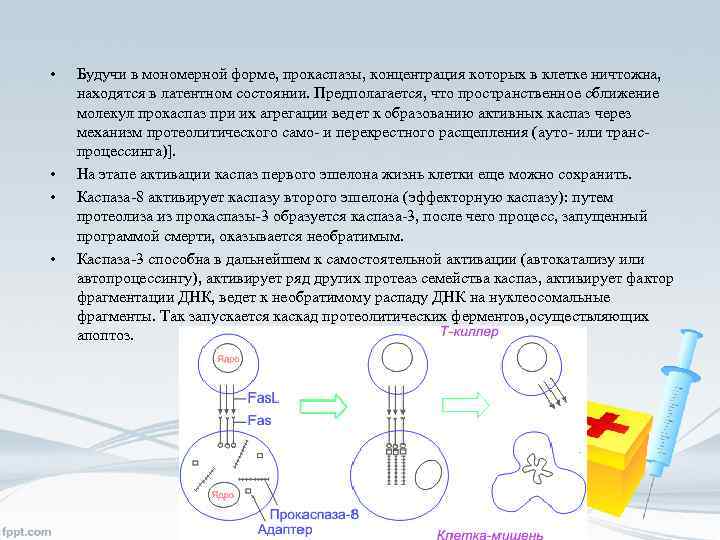 • • Будучи в мономерной форме, прокаспазы, концентрация которых в клетке ничтожна, находятся в латентном состоянии. Предполагается, что пространственное сближение молекул прокaспаз при их агрегации ведет к образованию активных каспаз через механизм протеолитического само- и перекрестного расщепления (ауто- или транспроцессинга)]. На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Каспаза-8 активирует каспазу второго эшелона (эффекторную каспазу): путем протеолиза из прокаспазы-3 образуется каспаза-3, после чего процесс, запущенный программой смерти, оказывается необратимым. Каспаза-3 способна в дальнейшем к самостоятельной активации (автокатализу или автопроцессингу), активирует ряд других протеаз семейства каспаз, активирует фактор фрагментации ДНК, ведет к необратимому распаду ДНК на нуклеосомальные фрагменты. Так запускается каскад протеолитических ферментов, осуществляющих апоптоз.
• • Будучи в мономерной форме, прокаспазы, концентрация которых в клетке ничтожна, находятся в латентном состоянии. Предполагается, что пространственное сближение молекул прокaспаз при их агрегации ведет к образованию активных каспаз через механизм протеолитического само- и перекрестного расщепления (ауто- или транспроцессинга)]. На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Каспаза-8 активирует каспазу второго эшелона (эффекторную каспазу): путем протеолиза из прокаспазы-3 образуется каспаза-3, после чего процесс, запущенный программой смерти, оказывается необратимым. Каспаза-3 способна в дальнейшем к самостоятельной активации (автокатализу или автопроцессингу), активирует ряд других протеаз семейства каспаз, активирует фактор фрагментации ДНК, ведет к необратимому распаду ДНК на нуклеосомальные фрагменты. Так запускается каскад протеолитических ферментов, осуществляющих апоптоз.
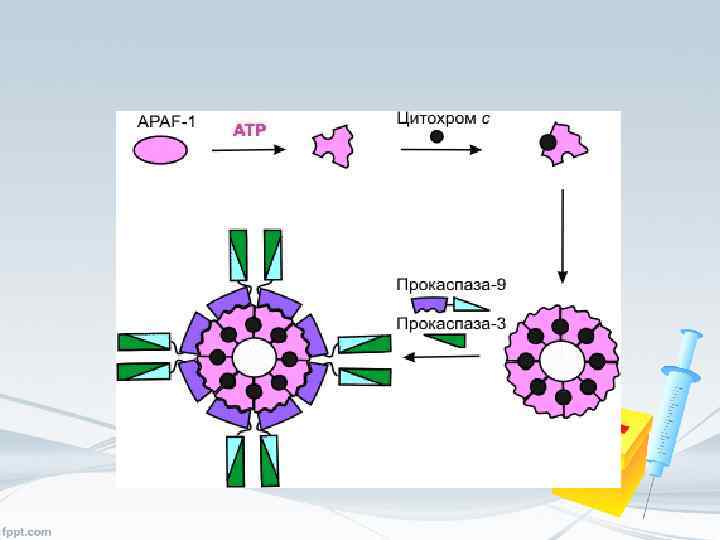
 Второй путь реализации программы ПКС • • В клетках, подвергшихся воздействию индуктора апоптоза, резко снижается мембранный потенциал (Dy)митохондрий. Падение Dy обусловлено увеличением проницаемости внутренней мембраны митохондрий вследствие образования гигантских пор. Разнообразны факторы, вызывающие раскрытие пор. К ним относятся истощение клеток восстановленным глутатионом, NAD(P)H, ATP и ADP, образование активных форм кислорода, разобщение окислительного фосфорелирования протонофорными соединениями, увеличение содержания Ca 2+ в цитоплазме. Образование пор в митохондриях можно вызвать церамидом, NO, каспазами, амфипатическими пептидами, жирными кислотами. Поры имеют диаметр 2, 9 нм, позволяющий пересекать мембрану веществам с молекулярной массой 1, 5 к. Да и ниже. Следствием раскрытия поры является набухание митохондриального матрикса, разрыв наружной мембраны митохондрий и высвобождение растворимых белков межмембранного объема. Среди этих белков – ряд апоптогенных факторов: цитохром с , прокаспазы 2, 3 и 9 , белок AIF (apoptosis inducing factor). Высвобождаемый из митохондрий цитохром с вместе с цитоплазматическим фактором APAF-1 (apoptosis protease activating factor-1) участвует в активации каспазы-9.
Второй путь реализации программы ПКС • • В клетках, подвергшихся воздействию индуктора апоптоза, резко снижается мембранный потенциал (Dy)митохондрий. Падение Dy обусловлено увеличением проницаемости внутренней мембраны митохондрий вследствие образования гигантских пор. Разнообразны факторы, вызывающие раскрытие пор. К ним относятся истощение клеток восстановленным глутатионом, NAD(P)H, ATP и ADP, образование активных форм кислорода, разобщение окислительного фосфорелирования протонофорными соединениями, увеличение содержания Ca 2+ в цитоплазме. Образование пор в митохондриях можно вызвать церамидом, NO, каспазами, амфипатическими пептидами, жирными кислотами. Поры имеют диаметр 2, 9 нм, позволяющий пересекать мембрану веществам с молекулярной массой 1, 5 к. Да и ниже. Следствием раскрытия поры является набухание митохондриального матрикса, разрыв наружной мембраны митохондрий и высвобождение растворимых белков межмембранного объема. Среди этих белков – ряд апоптогенных факторов: цитохром с , прокаспазы 2, 3 и 9 , белок AIF (apoptosis inducing factor). Высвобождаемый из митохондрий цитохром с вместе с цитоплазматическим фактором APAF-1 (apoptosis protease activating factor-1) участвует в активации каспазы-9.
 • • APAF-1 – белок с молекулярной массой 130 к. Да, содержащий CARD-домен (caspase activation and recruitment domain) образует комплекс с прокаспазой-9 в присутствии цитохрома с и d. ATP или АТР. APAF-1 – белок с молекулярной массой 130 к. Да, содержащий CARD-домен образует комплекс с прокаспазой-9 в присутствии цитохрома с и d. ATP или АТР. . APAF-1 играет роль арматуры, на которой происходит аутокаталитический процессинг каспазы-9. Предполагается, что в результате зависимого от гидролиза d. ATP (или АТР) конформационного изменения APAF-1 приобретает способность связывать цитохром с. Связав цитохром с, APAF-1 претерпевает дальнейшее конформационное изменение, способствующее его олигомеризации и открывающее доступ CARD-домена APAF-1 для прокаспазы9, которая тоже содержит CARD-домен. Так образуется конструкция, называемая тоже апоптосомой, , в составе которой – не менее 8 субъединиц APAF-1. Благодаря гомофильному CARD-взаимодействию с APAF-1 в эквимолярном соотношении связывается прокаспаза-9, а затем прокаспаза-9 связывает прокаспазу-3. Пространственное сближение молекул прокаспазы-9 на мультимерной арматуре из APAF-1 -цитохром-с-комплексов, по-видимому, приводит к межмолекулярному протеолитическому процессингу прокаспазы-9 с образованием активной каспазы-9. Зрелая каспаза-9 затем расщепляет и активирует прокаспазу-3.
• • APAF-1 – белок с молекулярной массой 130 к. Да, содержащий CARD-домен (caspase activation and recruitment domain) образует комплекс с прокаспазой-9 в присутствии цитохрома с и d. ATP или АТР. APAF-1 – белок с молекулярной массой 130 к. Да, содержащий CARD-домен образует комплекс с прокаспазой-9 в присутствии цитохрома с и d. ATP или АТР. . APAF-1 играет роль арматуры, на которой происходит аутокаталитический процессинг каспазы-9. Предполагается, что в результате зависимого от гидролиза d. ATP (или АТР) конформационного изменения APAF-1 приобретает способность связывать цитохром с. Связав цитохром с, APAF-1 претерпевает дальнейшее конформационное изменение, способствующее его олигомеризации и открывающее доступ CARD-домена APAF-1 для прокаспазы9, которая тоже содержит CARD-домен. Так образуется конструкция, называемая тоже апоптосомой, , в составе которой – не менее 8 субъединиц APAF-1. Благодаря гомофильному CARD-взаимодействию с APAF-1 в эквимолярном соотношении связывается прокаспаза-9, а затем прокаспаза-9 связывает прокаспазу-3. Пространственное сближение молекул прокаспазы-9 на мультимерной арматуре из APAF-1 -цитохром-с-комплексов, по-видимому, приводит к межмолекулярному протеолитическому процессингу прокаспазы-9 с образованием активной каспазы-9. Зрелая каспаза-9 затем расщепляет и активирует прокаспазу-3.
 • • Флавопротеин AIF, будучи добавленным к изолированным ядрам из клеток He. La, вызывает конденсацию хроматина и фрагментацию ДНК, а при добавлении к изолированным митохондриям печени крыс – высвобождение цитохрома с и каспазы- AIF является митохондриальным эффектором ПКС у животных, действующим независимо от каспаз. Кроме рассмотренных компонентов, при нарушении наружной мембраны митохондрий из межмембранного объема выделяется термолабильный фактор, вызывающий необратимое превращение ксантиндегидрогеназы в ксантиноксидазу. Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О 2 в качестве акцептора электронов. При этом образуются О 2 A, Н 2 О 2, а из них – и другие активные формы кислорода (АФК), которые разрушают митохондрии и являются мощными индукторами апоптоза. Механизмы образования АФК, конечно, не ограничиваются ксантиноксидазной реакцией. Главным источником АФК в клетках являются митохондрии. Резкое увеличение АФК происходит при возрастании мембранного потенциала в митохондриях, когда снижено потребление ATP и скорость дыхания лимитируется ADP. Цитоплазматическая мембрана макрофагов и нейтрофилов содержит О 2 A – генерирующую NADPH-оксидазу.
• • Флавопротеин AIF, будучи добавленным к изолированным ядрам из клеток He. La, вызывает конденсацию хроматина и фрагментацию ДНК, а при добавлении к изолированным митохондриям печени крыс – высвобождение цитохрома с и каспазы- AIF является митохондриальным эффектором ПКС у животных, действующим независимо от каспаз. Кроме рассмотренных компонентов, при нарушении наружной мембраны митохондрий из межмембранного объема выделяется термолабильный фактор, вызывающий необратимое превращение ксантиндегидрогеназы в ксантиноксидазу. Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О 2 в качестве акцептора электронов. При этом образуются О 2 A, Н 2 О 2, а из них – и другие активные формы кислорода (АФК), которые разрушают митохондрии и являются мощными индукторами апоптоза. Механизмы образования АФК, конечно, не ограничиваются ксантиноксидазной реакцией. Главным источником АФК в клетках являются митохондрии. Резкое увеличение АФК происходит при возрастании мембранного потенциала в митохондриях, когда снижено потребление ATP и скорость дыхания лимитируется ADP. Цитоплазматическая мембрана макрофагов и нейтрофилов содержит О 2 A – генерирующую NADPH-оксидазу.
 Генетический контроль • Существует две альтернативные точки зрения на генетический контроль апоптоза. Согласно первой из них апоптоз представляет собой вариант реализации генетических программ пролиферации и дифференцировки клетки. Об этом, в частности, свидетельствует участие в апоптозе серинтреониновой киназы, фактора транскрипции NF-k. B, протоонкогена c-myc и других регуляторов клеточного цикла. Согласно другой апоптоз имеет собственную генетическую программу и механизм ее реализации.
Генетический контроль • Существует две альтернативные точки зрения на генетический контроль апоптоза. Согласно первой из них апоптоз представляет собой вариант реализации генетических программ пролиферации и дифференцировки клетки. Об этом, в частности, свидетельствует участие в апоптозе серинтреониновой киназы, фактора транскрипции NF-k. B, протоонкогена c-myc и других регуляторов клеточного цикла. Согласно другой апоптоз имеет собственную генетическую программу и механизм ее реализации.
 Старение и апоптоз • Предположение о роли апоптотической гибели в процессах старения было высказано ещё в 1982 году. Со временем выяснилось, что различные виды возрастзависимой дисрегуляции апоптоза присущи многим типам клеток. Например, в стареющем организме повышается чувствительность к индукции апоптоза для следующих типов клеток: гепатоцитов, кардиомиоцитов, макрофагов, мегакариоцитов, нейронов, ооцитов, спленоцитов, T-лимфоцитов, хондроцитов, эндотелиоцитов. Но в то же время, для фибробластов наблюдается обратная тенденция к снижению чувствительности к апоптозу, а для кератиноцитов данная чувствительность не изменяется • Согласно одной из версий нормальные (гомеостатические) апоптотические процессы могут участвовать в развитии возрастных патологий и фенотипов старения. Согласно другой точке зрения накопление стареющих клеток в тканях объясняется возрастной резистентностью к апоптозу. •
Старение и апоптоз • Предположение о роли апоптотической гибели в процессах старения было высказано ещё в 1982 году. Со временем выяснилось, что различные виды возрастзависимой дисрегуляции апоптоза присущи многим типам клеток. Например, в стареющем организме повышается чувствительность к индукции апоптоза для следующих типов клеток: гепатоцитов, кардиомиоцитов, макрофагов, мегакариоцитов, нейронов, ооцитов, спленоцитов, T-лимфоцитов, хондроцитов, эндотелиоцитов. Но в то же время, для фибробластов наблюдается обратная тенденция к снижению чувствительности к апоптозу, а для кератиноцитов данная чувствительность не изменяется • Согласно одной из версий нормальные (гомеостатические) апоптотические процессы могут участвовать в развитии возрастных патологий и фенотипов старения. Согласно другой точке зрения накопление стареющих клеток в тканях объясняется возрастной резистентностью к апоптозу. •
 Инфекционный мононуклеоз • Инфекционный мононуклеоз (ИМ) – лимфопролиферативное заболевание, возбудителем которого является вирус Эпштейна-Барр (EBV), относящийся к семейству герпесвирусов.
Инфекционный мононуклеоз • Инфекционный мононуклеоз (ИМ) – лимфопролиферативное заболевание, возбудителем которого является вирус Эпштейна-Барр (EBV), относящийся к семейству герпесвирусов.
 • У больных ИМ, при индукции апоптоза in vitro, отмечалось достоверное снижение количества апоптотически измененных клеток (в среднем на 17 %). • Снижение апоптотической активности лимфоцитов вероятно объясняется тем, что некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается разными способами, но их принцип сводится к двум механизмам – повышение экспрессии антиапоптозных (рост-стимулирующих) генов клетки или инактивация эффекторных молекул апоптоза. В случае инфицирования EBV, происходит стимуляция протоонкогенов типа bcl-2, подавляющих апоптоз.
• У больных ИМ, при индукции апоптоза in vitro, отмечалось достоверное снижение количества апоптотически измененных клеток (в среднем на 17 %). • Снижение апоптотической активности лимфоцитов вероятно объясняется тем, что некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается разными способами, но их принцип сводится к двум механизмам – повышение экспрессии антиапоптозных (рост-стимулирующих) генов клетки или инактивация эффекторных молекул апоптоза. В случае инфицирования EBV, происходит стимуляция протоонкогенов типа bcl-2, подавляющих апоптоз.
 • Апоптоз Т-клеток при ИМ • Исходя из способствует вышеизложенного, можно восстановлению части предположить, что поврежденных вирусом Вапоптоз при ИМ служит лимфоцитов. механизмом, • Защиту В-лимфоцитов от регулирующим численное апоптотической гибели соотношение В- и Т-клеток обеспечивают в популяции лимфоцитов экспрессируемые ими на разных стадиях мембранные белки -LMP 1 инфекционного процесса. и BHRF 1, кодируемые EBV
• Апоптоз Т-клеток при ИМ • Исходя из способствует вышеизложенного, можно восстановлению части предположить, что поврежденных вирусом Вапоптоз при ИМ служит лимфоцитов. механизмом, • Защиту В-лимфоцитов от регулирующим численное апоптотической гибели соотношение В- и Т-клеток обеспечивают в популяции лимфоцитов экспрессируемые ими на разных стадиях мембранные белки -LMP 1 инфекционного процесса. и BHRF 1, кодируемые EBV
 Заключение • Поддержание численности клеточной популяции на необходимом для организма уровне; • определении формы и размеров организма и его составных частей; • Обеспечении правильного, адекватного потребностям организма, соотношения численности, размеров и формы клеток различных типов; • Адекватное изменение числа клеток под влиянием различных как экзогенных, так и эндогенных сигналов; • Обеспечении селекции разновидностей клеток внутри популяции, в том числе в удалении из неё генетически дефектных клеток.
Заключение • Поддержание численности клеточной популяции на необходимом для организма уровне; • определении формы и размеров организма и его составных частей; • Обеспечении правильного, адекватного потребностям организма, соотношения численности, размеров и формы клеток различных типов; • Адекватное изменение числа клеток под влиянием различных как экзогенных, так и эндогенных сигналов; • Обеспечении селекции разновидностей клеток внутри популяции, в том числе в удалении из неё генетически дефектных клеток.
 v Использованная литература : : I. Гордеева А. В. , Лабас Ю. А. , Звягильская Р. А. Апоптоз одноклеточных организмов: механизмы и эволюция // Биохимия, 2008, том 69, вып. 10, с. 1301— 1313 II. Галицкий В. А. Возникновение эукариотических клеток и происхождение апоптоза // Цитология, 2005, том 47, вып. 2, с. 103— 120 III. Брокко С. Т. Патофизиология. Светоч. 2004 г. С. 140. IV. Ресурсы сети Интернет : : http: //support-doctor. narod. ru/ http: //yourkaluga. ru/094510. htm http: //www. gastroscan. ru/
v Использованная литература : : I. Гордеева А. В. , Лабас Ю. А. , Звягильская Р. А. Апоптоз одноклеточных организмов: механизмы и эволюция // Биохимия, 2008, том 69, вып. 10, с. 1301— 1313 II. Галицкий В. А. Возникновение эукариотических клеток и происхождение апоптоза // Цитология, 2005, том 47, вып. 2, с. 103— 120 III. Брокко С. Т. Патофизиология. Светоч. 2004 г. С. 140. IV. Ресурсы сети Интернет : : http: //support-doctor. narod. ru/ http: //yourkaluga. ru/094510. htm http: //www. gastroscan. ru/



