Жакупов Салимжан СРС 2063 ОМ.pptx
- Количество слайдов: 21

КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА МИКРОБИОЛОГИИ СРС ГЕНЕТИЧЕСКОЕ КАРТИРОВАНИЕ МИКРООРГАНИЗМОВ. ГЕННАЯ ИНЖЕНЕРИЯ. СОВРЕМЕННЫЕ МОЛЕКУЛЯРНО ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. Выполнил: ст 2 -063 группы Жакупов. С Проверила: Назаренко Г. А

ГЕНЕТИКА МИКРООРГАНИЗМОВ СОСТАВЛЯЕТ ОСНОВУ МОЛЕКУЛЯРНОЙ БИОЛОГИИ. НАИБОЛЕЕ ВАЖНЫЕ ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ ИЗУЧАЮТСЯ НА МИКРООРГАНИЗМАХ. МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ОБЯЗАНА СВОИМИ ДОСТИЖЕНИЯМИ УСПЕХАМ ГЕНЕТИКИ БАКТЕРИЙ И ВИРУСОВ. МНОГИЕ ОТКРЫТИЯ В ОБЛАСТИ ГЕНЕТИКИ МИКРООРГАНИЗМОВ БЫЛИ ВЕСЬМА ЭФФЕКТИВНО ИСПОЛЬЗОВАНЫ В БИОЛОГИИ И МЕДИЦИНЕ.
![ГЕНЕТИЧЕСКОЕ КАРТИРОВАНИЕ [греч. genetikos — относящийся к рождению, происхождению; лат. charta — бумага, грамота] ГЕНЕТИЧЕСКОЕ КАРТИРОВАНИЕ [греч. genetikos — относящийся к рождению, происхождению; лат. charta — бумага, грамота]](https://present5.com/presentation/112919355_343887782/image-3.jpg)
ГЕНЕТИЧЕСКОЕ КАРТИРОВАНИЕ [греч. genetikos — относящийся к рождению, происхождению; лат. charta — бумага, грамота] — локализация различных нуклеотидных последовательностей ДНК и определение их взаимного расположения в геноме основанная на методах классической генетики: определение групп сцепления, частоты рекомбинации, построение генетических карт, где единицей измерения служат проценты рекомбинации или сантиморганы

ГЕНЕТИЧЕСКОЕ КАРТИРОВАНИЕ МИКРООРГАНИЗМОВ ВКЛЮЧАЕТ В СЕБЯ: Картирование генов грибов. Картирование генов органелл. Картирование генов бактерий. Картирование генов актиномицетов. Картирование плазмид.

ГЕНЕТИЧЕСКАЯ КАРТА СЦЕПЛЕНИЯ. (Карта сцепления, генетическая карта, linkage map, genetic map) [лат. charta — бумага, грамота] — одномерная схема взаиморасположения локусов генов (генетических маркеров) в группах сцепления (на индивидуальных хромосомах) данного организма с указанием расстояний между ними в парах нуклеотидов, определенных с помощью секвенирования, или в сантиморганах, установленных по частоте кроссинговера.

ГЕНЕТИЧЕСКИЕ КАРТЫ СЦЕПЛЕНИЯ правильно отражают порядок расположения генетических маркеров на хромосомах, однако полученные при этом значения расстояний между ними не соответствуют реальным физическим расстояниям. Обычно данный факт связывают с тем, что эффективность рекомбинации между хроматидами на отдельных участках хромосом может сильно различаться. В частности, она подавлена в гетерохроматиновых участках хромосом. С другой стороны, в хромосомах часто встречаются "горячие точки" рекомбинации. Использование частот рекомбинации для построения физических генетических карт без учета этих факторов будет приводить к искажениям реальных расстояний между генетическими маркерами.

РЕСТРИКЦИОННОЕ КАРТИРОВАНИЕ. Определение положения гена на генетической (физической) карте с помощью рестриктаз <restriction endonucleases>; заключается в получении фрагментов анализируемой последовательности (гена), вырезанных разными рестриктазами и электрофоретические разделенных с последующим сопоставлением их размеров и определением расстояний на генетической карте; также Р. к. - определение с помощью рестриктаз соотношения экзонов и интронов в составе гена (в этом случае один из вариантов - картирование по методу Берка-Шарпа разрешающая способность. Р. к. - около 20 пар нуклеотидов.
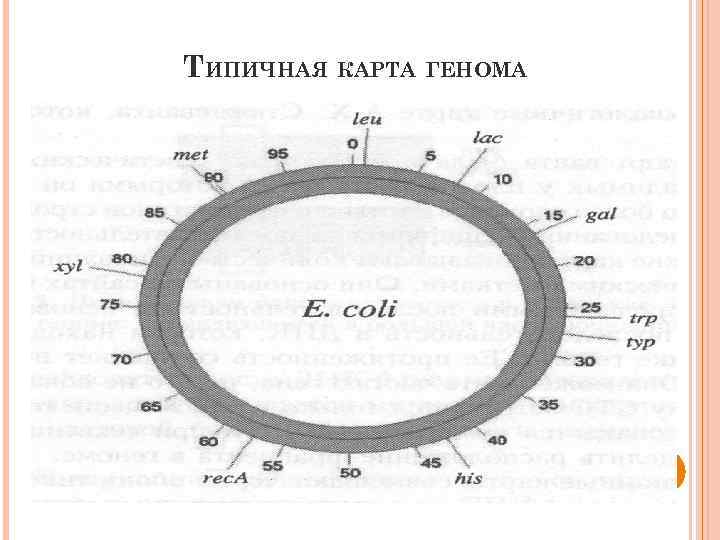
ТИПИЧНАЯ КАРТА ГЕНОМА

Генная инженерия Экспериментальная наука Возникла на стыке молекулярной биологии и генетики официально в 1972 г. , когда в лаборатории П. Берга (Стенфордский университет, США) была получена первая рекомбинантная (гибридная) ДНК на базе объединения генетического материала, полный геном вируса обезьян 40, часть генома измерного бактериофага и гены галактозного оперона.

ГЕННАЯ ИНЖЕНЕРИЯ нацелена на создание орга низмов с новыми комбинациями наследственных свойств пу тем конструирования функционально активных генетических структур в форме рекомбинантных ДНК из фрагментов гено мов разных организмов, которые вводились в клетку.

Проблемы и перспективы генной инженерии. ВОЗМОЖНОСТЬ ВОЗДЕЙСТВОВАТЬ НА ГЕНЫ ПОЗВОЛЯЕТ УСТРАНЯТЬ ПРИЧИНЫ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ, ИЗМЕНЯТЬ СВОЙСТВА ОРГАНИЗМОВ В НУЖНОМ НАПРАВЛЕНИИ, ПЕРЕСАЖИВАТЬ ГЕНЫ ИЗ ОДНОГО ОРГАНИЗМА В ДРУГОЙ И ПРИВНОСИТЬ В НЕГО НОВЫЕ ПРИЗНАКИ. НАПРИМЕР, УЖЕ СОЗДАЮТСЯ НОВЫЕ ОРГАНИЗМЫ, СОЧЕТАЮЩИЕ В СЕБЕ СВОЙСТВА ЖИВОТНЫХ И РАСТЕНИЙ. ОДНАКО ДОВОЛЬНО СЛОЖНО ОПРЕДЕЛИТЬ ДОЛГОВРЕМЕННЫЕ ПОСЛЕДСТВИЯ ГЕННЫХ МАНИПУЛЯЦИЙ.

ПРОТИВ ГЕННОЙ ИНЖЕНЕРИИ В настоящее время генная инженерия технически несовершенна, так как она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты добавленного гена. Даже в том случае, если местоположение гена окажется возможным установить после его встраивания в геном, имеющиеся сведения о ДНК очень неполны для того, чтобы предсказать результаты.

МЕДИЦИНСКИЕ РИСКИ 1. Повышенная аллергеноопасность. 2. Возможная токсичность и опасность для здоровья. 3. Устойчивость к действиям антибиотиков. 4. Возникновение новых и более опасных вирусов.

ПЛЮСЫ ГЕННОЙ ИНЖЕНЕРИИ. 1. Генетическая трансформация растений может ускорить селекционный процесс, сохранить наиболее желательные признаки сорта и привить два-три новых полезных 2. С помощью применения ГМР создают более дешевые лекарства (инсулин), обеспечивают промышленность сырьем 3. Генетически модифицированные продукты в силу своих качеств адаптации к среде, высокой стабильной урожайности могут решить проблему «голодающих стран» 4. С помощью методов генетической инженерии возможно лечение тяжелых заболеваний человека: онкологических, наследственных заболеваний мозга и нервной системы, для исследования воспалительных и иммунологических заболеваний человека.

ПЕРСПЕКТИВЫ ГЕННОЙ ИНЖЕНЕРИИ Конечно, выше описаны вероятные, но не гарантированные варианты развития генной инженерии. Успех в этой отрасли науки сможет радикально поднять производительность труда и способствовать решению многих существующих проблем, прежде всего, подъему уровня жизни каждого человека, но, в то же время, и создать новые разрушительные средства.

СОВРЕМЕННЫЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. ПЦР (полимеразная цепная реакция) – выявление ДНК возбудителей; Рестрикционный анализ. ИФА (иммуноферментный анализ) – выявление антител (иммуноглобулинов – Ig. M, Ig. A, Ig. G), выработанных организмом человека в ответ на присутствие возбудителей, Микробиологический метод выделения культур возбудителей с определением их чувствительности к антибиотикам.

ДОСТОИНСТВА МЕТОДА ПЦР диагностика является одним из наиболее современных и совершенных лабораторных диагностических методов, позволяющий специфично выявлять ДНК единичных клеток возбудителей инфекционных заболеваний в образце. Можно сказать, что ПЦР достигает предельно возможной чувствительности. Чувствительность ПЦР-тест-систем составляет 10 -1000 клеток в пробе, в то время как чувствительность иммунологических и микроскопических методов – 1000 -100000 клеток в пробе. Благодаря высокой чувствительности, тестсистемы на основе ПЦР незаменимы в тех случаях, когда исследуемого материала (возбудителя заболевания) очень мало.

РЕСТРИКЦИОННЫЙ АНАЛИЗ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонуклеазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее. В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК. В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.

ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (СОКРАЩЁННО ИФА) enzyme-linked immunosorbent assay, ELISA) — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр. , в основе которого лежит специфическая реакция антигенантитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.

ЗАКЛЮЧЕНИЕ Не зная закономерности геномной организации патогенных бактерий и вирусов невозможно точно понять природу инфекционного процесса, определить направление создания вакцин, уточнить патогенные мишени микроорганизмов для создания лекарств. На основе выше сказанного я пришел к выводу, знание генетики микроорганизмов крайне необходимо для компетентной деятельности врача.

СПАСИБО ЗА ВНИМАНИЕ !!!
Жакупов Салимжан СРС 2063 ОМ.pptx