 Кальций(Ca)
Кальций(Ca)
 История и происхождение названия От лат. Calx — «известь» , «мягкий камень» . Оно было предложено английским химиком Хэмфри Дэви, в 1808 г.
История и происхождение названия От лат. Calx — «известь» , «мягкий камень» . Оно было предложено английским химиком Хэмфри Дэви, в 1808 г.
 Символ – Ca Атомный вес - 40. 08 Плотность - 1. 54 Температура плавления – 842°C Температура кипения - 1495°C
Символ – Ca Атомный вес - 40. 08 Плотность - 1. 54 Температура плавления – 842°C Температура кипения - 1495°C
 Химические свойства Кальция 1. Реагирует с водой: Ca+ 2 Н 2 О→Ca(ОН)2+Н 2↑+ Q. 2. С активными неметаллами 2 Са + О 2 → 2 Са. О Са + Br 2 → Ca. Br 2. 3. С менее активными неметаллами при нагревании: Са + Н 2 → Са. Н 2, Ca + 6 B = Ca. B 6, 3 Ca + N 2 → Ca 3 N 2, Са + 2 С → Са. С 2
Химические свойства Кальция 1. Реагирует с водой: Ca+ 2 Н 2 О→Ca(ОН)2+Н 2↑+ Q. 2. С активными неметаллами 2 Са + О 2 → 2 Са. О Са + Br 2 → Ca. Br 2. 3. С менее активными неметаллами при нагревании: Са + Н 2 → Са. Н 2, Ca + 6 B = Ca. B 6, 3 Ca + N 2 → Ca 3 N 2, Са + 2 С → Са. С 2
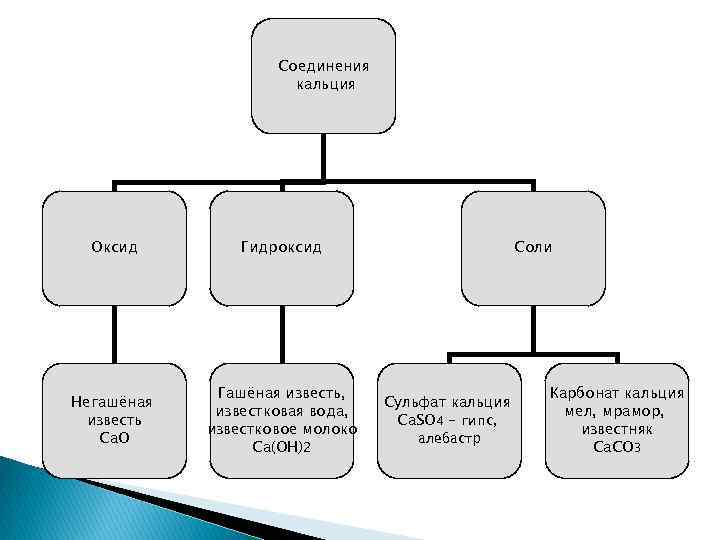 Соединения кальция Оксид Гидроксид Негашёная известь Са. О Гашёная известь, известковая вода, известковое молоко Са(ОН)2 Соли Сульфат кальция Са. SО 4 – гипс, алебастр Карбонат кальция мел, мрамор, известняк Са. СО 3
Соединения кальция Оксид Гидроксид Негашёная известь Са. О Гашёная известь, известковая вода, известковое молоко Са(ОН)2 Соли Сульфат кальция Са. SО 4 – гипс, алебастр Карбонат кальция мел, мрамор, известняк Са. СО 3
 Оксид кальция
Оксид кальция
 Гидроксид кальция – известковая вода, известковое молоко
Гидроксид кальция – известковая вода, известковое молоко
 Гипс
Гипс
 Мел
Мел
 Известняк
Известняк
 Получение Кальция В промышленности Ca получают двумя способами: 1) 6 Ca. O + 2 Al = 3 Ca. O·Al 2 O 3 + 3 Ca 2) электролизом расплава Ca. Cl 2 и KCl.
Получение Кальция В промышленности Ca получают двумя способами: 1) 6 Ca. O + 2 Al = 3 Ca. O·Al 2 O 3 + 3 Ca 2) электролизом расплава Ca. Cl 2 и KCl.
 Приминение
Приминение