3. Ниши, клональность кроветворения и старение 1.pptx
- Количество слайдов: 107
 Как регулируются и где локализуются СКК • Существует дистантная регуляция СКК с помощью ростовых факторов. • Локальная регуляция в «нишах» для СКК
Как регулируются и где локализуются СКК • Существует дистантная регуляция СКК с помощью ростовых факторов. • Локальная регуляция в «нишах» для СКК
 Ниша для стволовых клеток – прошлое и настоящее • Термин «ниша для стволовых клеток» ввел Schofield в 1970 году. И это была гипотеза для объяснения поведения СКК в селезенках облученных мышей. • В молекулярных терминах ниша была описана у Drosophila melanogaster при изучении половых стволовых клеток. • Стало ясно, что для различных тканей ниши различаются. • Сейчас это понятие связано с микроокружением, которое позволяет стволовым клеткам сохранять состояние покоя и способность к самоподдержанию.
Ниша для стволовых клеток – прошлое и настоящее • Термин «ниша для стволовых клеток» ввел Schofield в 1970 году. И это была гипотеза для объяснения поведения СКК в селезенках облученных мышей. • В молекулярных терминах ниша была описана у Drosophila melanogaster при изучении половых стволовых клеток. • Стало ясно, что для различных тканей ниши различаются. • Сейчас это понятие связано с микроокружением, которое позволяет стволовым клеткам сохранять состояние покоя и способность к самоподдержанию.
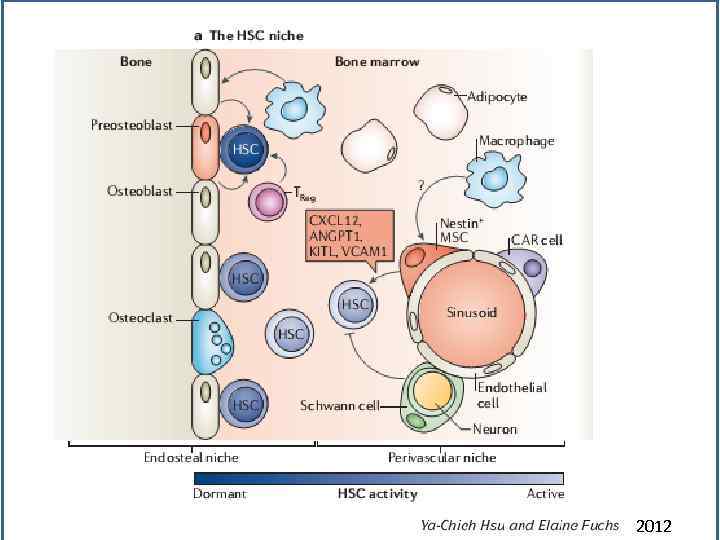
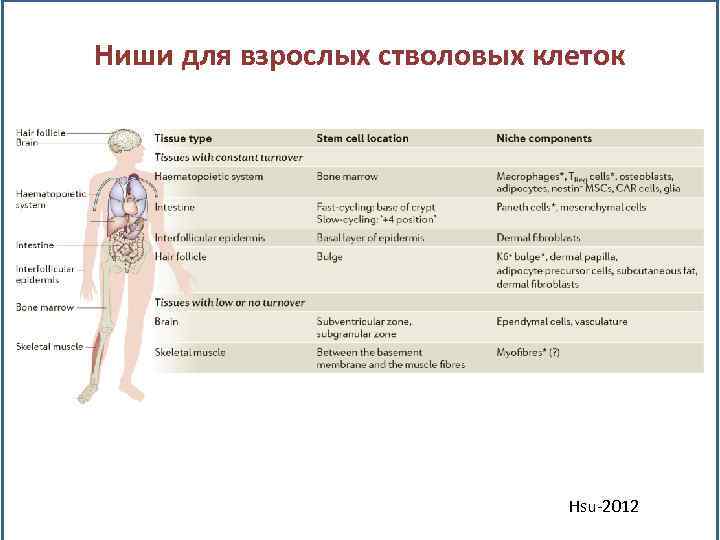 Ниши для взрослых стволовых клеток Hsu-2012
Ниши для взрослых стволовых клеток Hsu-2012
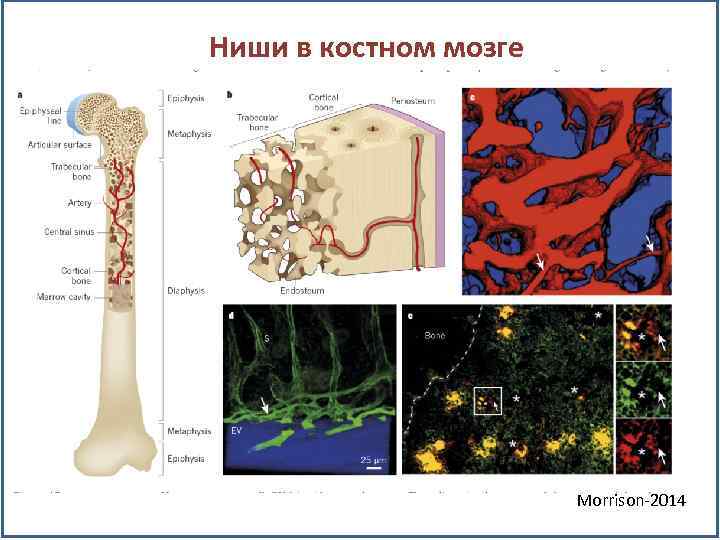 Ниши в костном мозге Morrison-2014
Ниши в костном мозге Morrison-2014
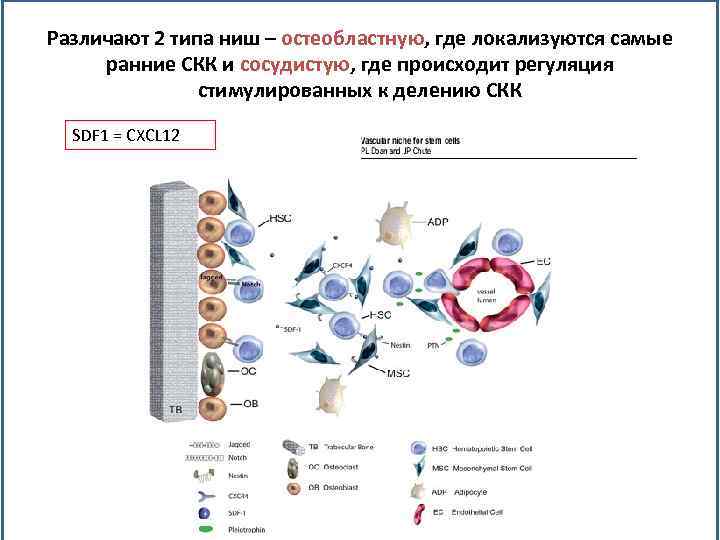 Различают 2 типа ниш – остеобластную, где локализуются самые ранние СКК и сосудистую, где происходит регуляция стимулированных к делению СКК SDF 1 = CXCL 12
Различают 2 типа ниш – остеобластную, где локализуются самые ранние СКК и сосудистую, где происходит регуляция стимулированных к делению СКК SDF 1 = CXCL 12
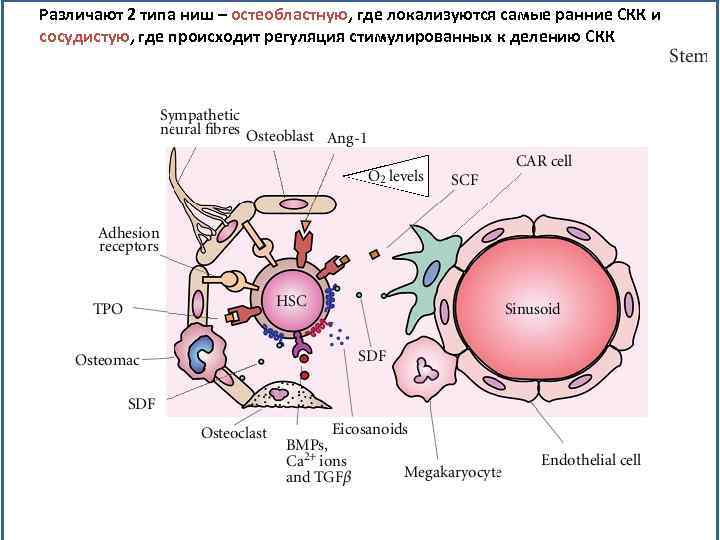 Различают 2 типа ниш – остеобластную, где локализуются самые ранние СКК и сосудистую, где происходит регуляция стимулированных к делению СКК
Различают 2 типа ниш – остеобластную, где локализуются самые ранние СКК и сосудистую, где происходит регуляция стимулированных к делению СКК
 2012
2012
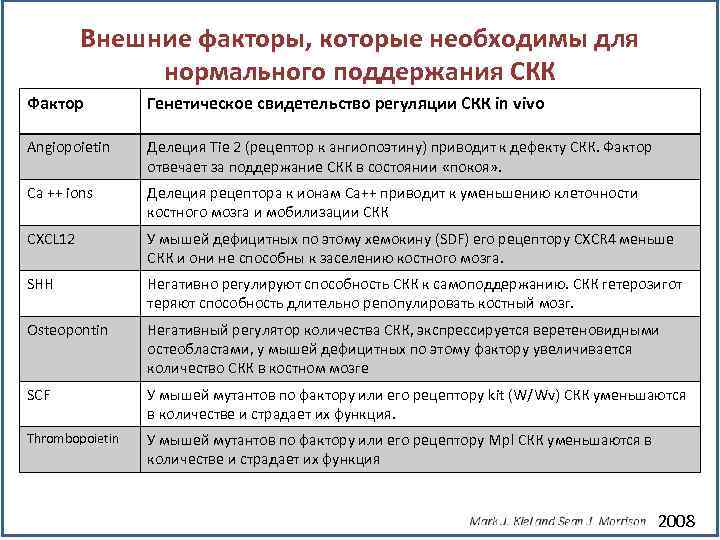 Внешние факторы, которые необходимы для нормального поддержания СКК Фактор Генетическое свидетельство регуляции СКК in vivo Angiopoietin Делеция Tie 2 (рецептор к ангиопоэтину) приводит к дефекту СКК. Фактор отвечает за поддержание СКК в состоянии «покоя» . Ca ++ ions Делеция рецептора к ионам Са++ приводит к уменьшению клеточности костного мозга и мобилизации СКК CXCL 12 У мышей дефицитных по этому хемокину (SDF) его рецептору CXCR 4 меньше СКК и они не способны к заселению костного мозга. SHH Негативно регулируют способность СКК к самоподдержанию. СКК гетерозигот теряют способность длительно репопулировать костный мозг. Osteopontin Негативный регулятор количества СКК, экспрессируется веретеновидными остеобластами, у мышей дефицитных по этому фактору увеличивается количество СКК в костном мозге SCF У мышей мутантов по фактору или его рецептору kit (W/Wv) СКК уменьшаются в количестве и страдает их функция. Thrombopoietin У мышей мутантов по фактору или его рецептору Mpl СКК уменьшаются в количестве и страдает их функция 2008
Внешние факторы, которые необходимы для нормального поддержания СКК Фактор Генетическое свидетельство регуляции СКК in vivo Angiopoietin Делеция Tie 2 (рецептор к ангиопоэтину) приводит к дефекту СКК. Фактор отвечает за поддержание СКК в состоянии «покоя» . Ca ++ ions Делеция рецептора к ионам Са++ приводит к уменьшению клеточности костного мозга и мобилизации СКК CXCL 12 У мышей дефицитных по этому хемокину (SDF) его рецептору CXCR 4 меньше СКК и они не способны к заселению костного мозга. SHH Негативно регулируют способность СКК к самоподдержанию. СКК гетерозигот теряют способность длительно репопулировать костный мозг. Osteopontin Негативный регулятор количества СКК, экспрессируется веретеновидными остеобластами, у мышей дефицитных по этому фактору увеличивается количество СКК в костном мозге SCF У мышей мутантов по фактору или его рецептору kit (W/Wv) СКК уменьшаются в количестве и страдает их функция. Thrombopoietin У мышей мутантов по фактору или его рецептору Mpl СКК уменьшаются в количестве и страдает их функция 2008
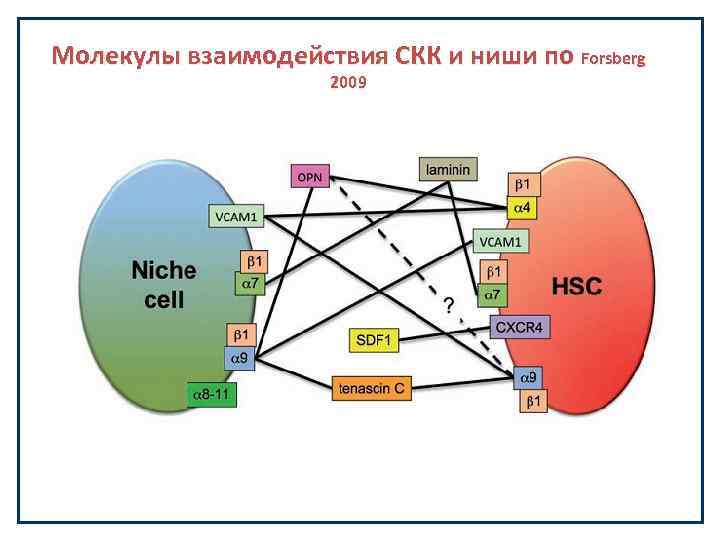 Молекулы взаимодействия СКК и ниши по Forsberg 2009
Молекулы взаимодействия СКК и ниши по Forsberg 2009
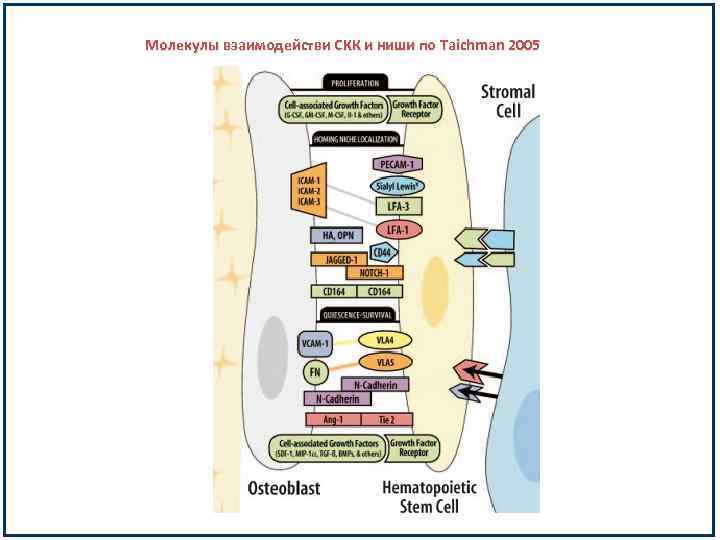 Молекулы взаимодействи СКК и ниши по Taichman 2005
Молекулы взаимодействи СКК и ниши по Taichman 2005
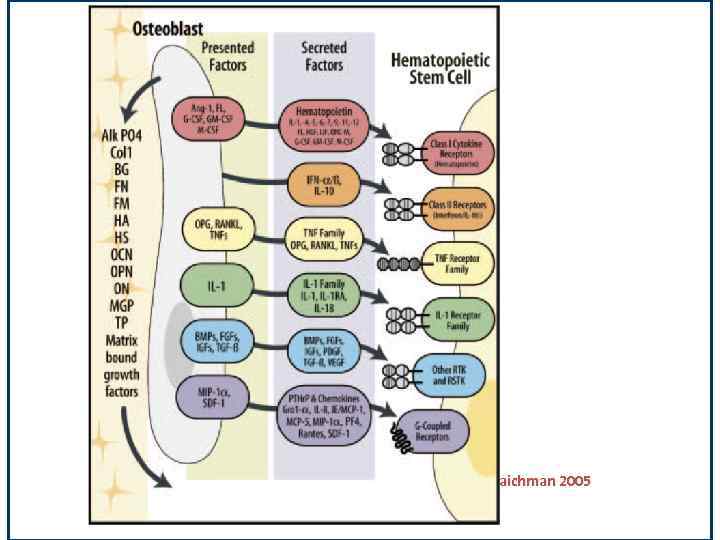 Молекулы взаимодействи СКК и ниши по Taichman 2005
Молекулы взаимодействи СКК и ниши по Taichman 2005
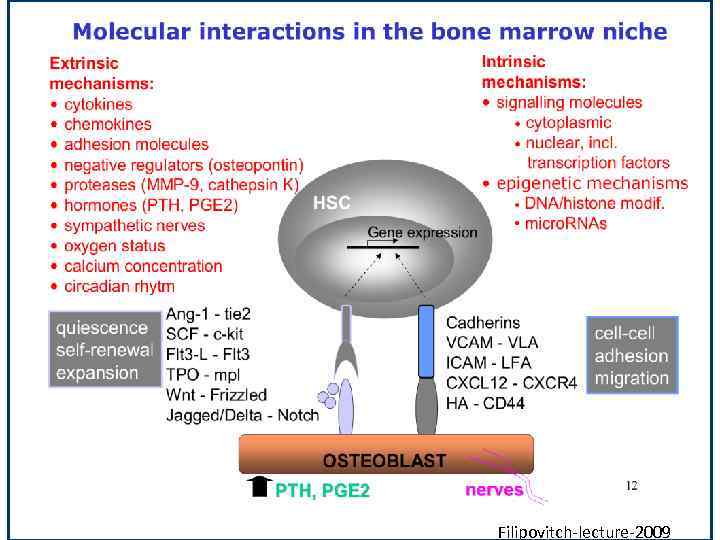 Filipovitch-lecture-2009
Filipovitch-lecture-2009
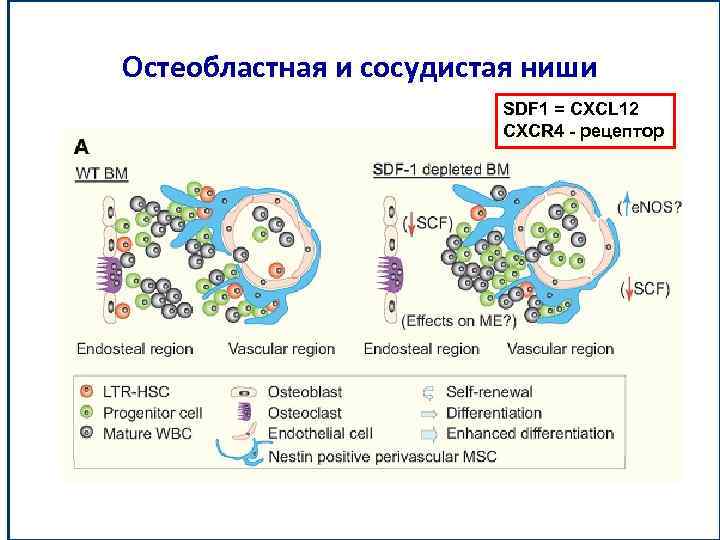 Остеобластная и сосудистая ниши SDF 1 = CXCL 12 CXCR 4 - рецептор
Остеобластная и сосудистая ниши SDF 1 = CXCL 12 CXCR 4 - рецептор
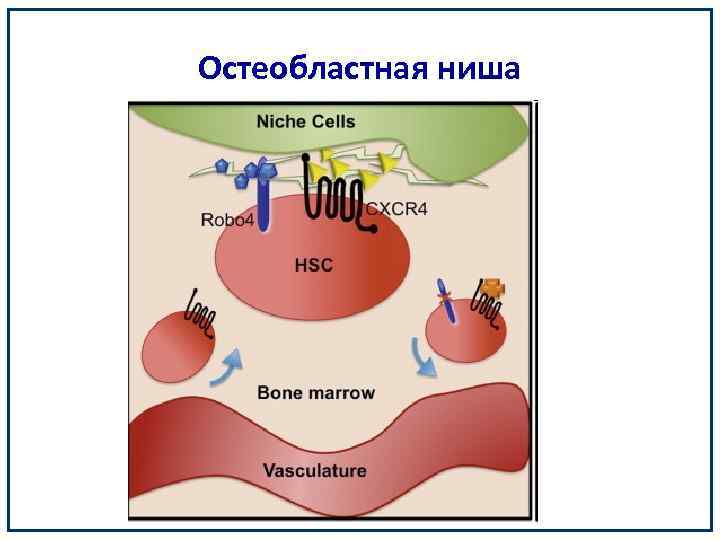 Остеобластная ниша
Остеобластная ниша
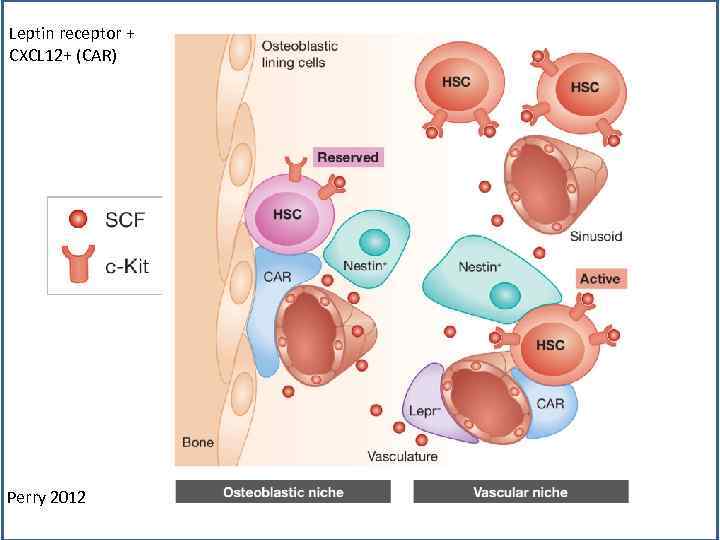 Leptin receptor + CXCL 12+ (CAR) Perry 2012
Leptin receptor + CXCL 12+ (CAR) Perry 2012
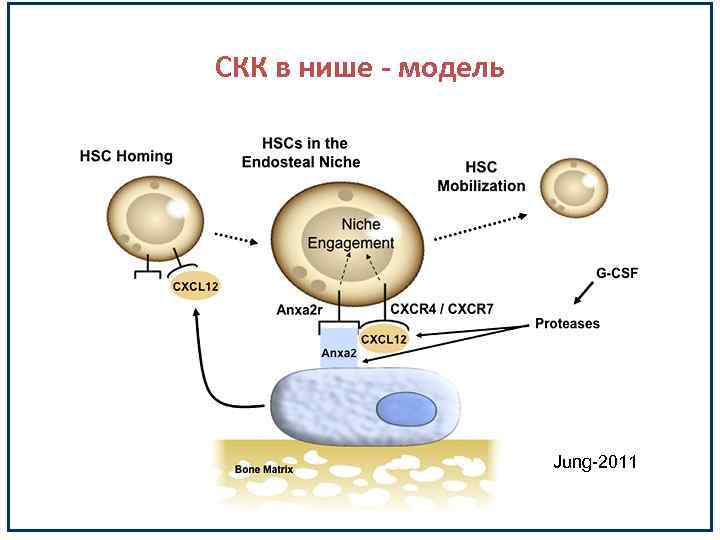 СКК в нише - модель Jung-2011
СКК в нише - модель Jung-2011
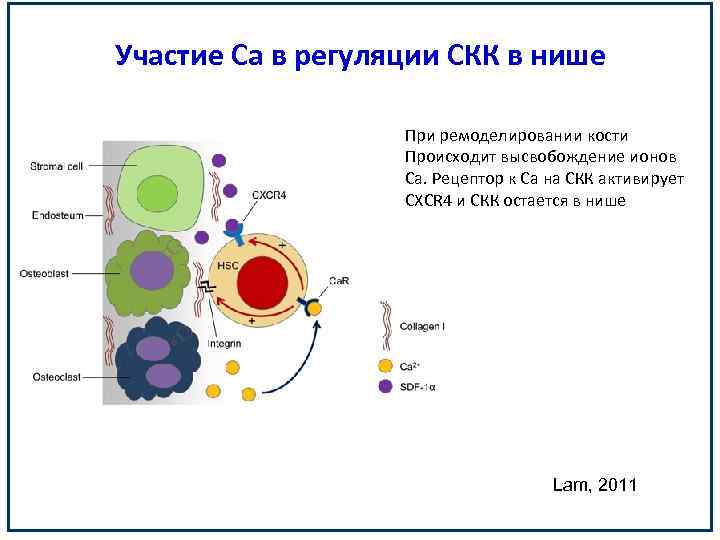 Участие Са в регуляции СКК в нише При ремоделировании кости Происходит высвобождение ионов Са. Рецептор к Са на СКК активирует CXCR 4 и СКК остается в нише Lam, 2011
Участие Са в регуляции СКК в нише При ремоделировании кости Происходит высвобождение ионов Са. Рецептор к Са на СКК активирует CXCR 4 и СКК остается в нише Lam, 2011
 Нервная регуляция кроветворения • TGF-b ингибирует пролиферацию стволовых кроветворных клеток. • TGF-b секретируется многими типами клеток костного мозга в неактивной форме в виде комплекса с белками, который получил название «большой латентный комплекс» (Large Latent Complex (LLC)). Однако механизмы, благодаря которым происходит высвобождение активной формы TGF-b, до сих пор оставались малоизученными.
Нервная регуляция кроветворения • TGF-b ингибирует пролиферацию стволовых кроветворных клеток. • TGF-b секретируется многими типами клеток костного мозга в неактивной форме в виде комплекса с белками, который получил название «большой латентный комплекс» (Large Latent Complex (LLC)). Однако механизмы, благодаря которым происходит высвобождение активной формы TGF-b, до сих пор оставались малоизученными.
 Нервная регуляция кроветворения • одним из компонентов гемопоэтических ниш костного мозга является дискретная популяция клеток, которые по ряду признаков соответствует не экспрессирующим миелин Шванновским клеткам. Этому виду глиальных клеток костного мозга, по-видимому, принадлежит исключительная роль в продукции активной формы TGF-b, одной из функций которого является поддержание ГСК в состоянии покоя.
Нервная регуляция кроветворения • одним из компонентов гемопоэтических ниш костного мозга является дискретная популяция клеток, которые по ряду признаков соответствует не экспрессирующим миелин Шванновским клеткам. Этому виду глиальных клеток костного мозга, по-видимому, принадлежит исключительная роль в продукции активной формы TGF-b, одной из функций которого является поддержание ГСК в состоянии покоя.

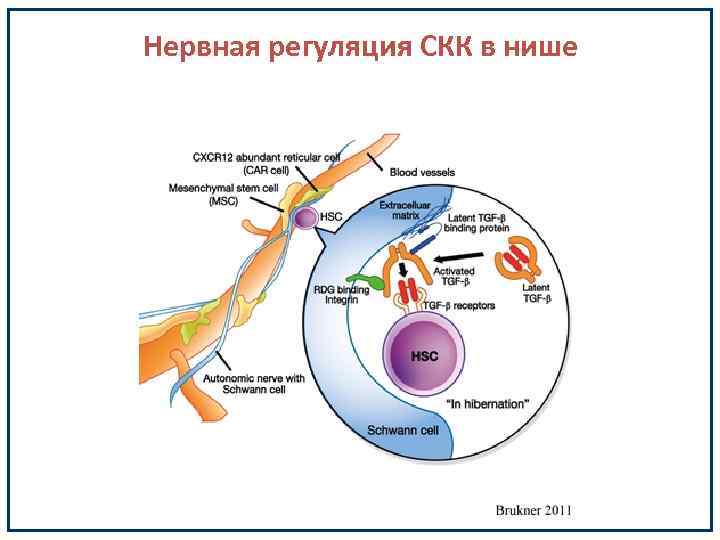 Нервная регуляция СКК в нише
Нервная регуляция СКК в нише
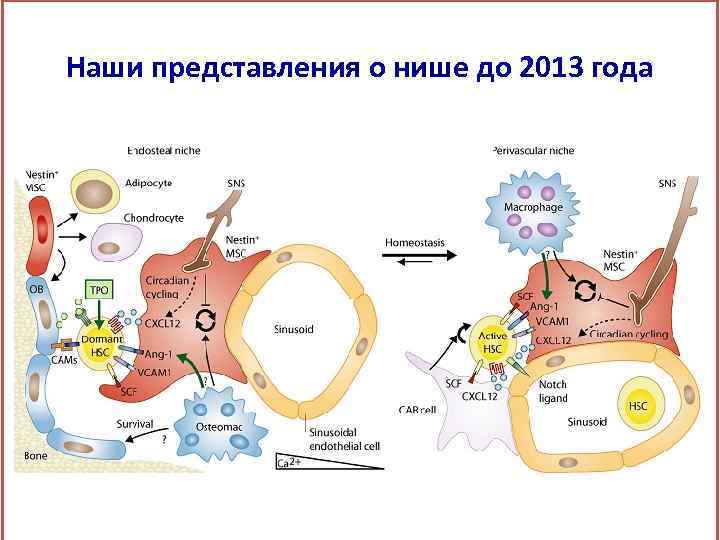 Наши представления о нише до 2013 года
Наши представления о нише до 2013 года
 • Был этот мир глубокой тьмой окутан. Да будет свет! И вот явился Ньютон. (Alexander Pope, 1688 -1744), XVIII век) • Но сатана недолго ждал реванша. Пришел Эйнштейн - и стало все, как раньше. (Эпиграмма Джона Сквайра (Sir John Collins Squire, 1884 -1958), XX век) • Перевод С. Маршак
• Был этот мир глубокой тьмой окутан. Да будет свет! И вот явился Ньютон. (Alexander Pope, 1688 -1744), XVIII век) • Но сатана недолго ждал реванша. Пришел Эйнштейн - и стало все, как раньше. (Эпиграмма Джона Сквайра (Sir John Collins Squire, 1884 -1958), XX век) • Перевод С. Маршак
 Новые данные о нише для СКК • Показано, что СКК локализуются в периваскулярной нише, тогда как предшественники В-клеток в остеобластной
Новые данные о нише для СКК • Показано, что СКК локализуются в периваскулярной нише, тогда как предшественники В-клеток в остеобластной
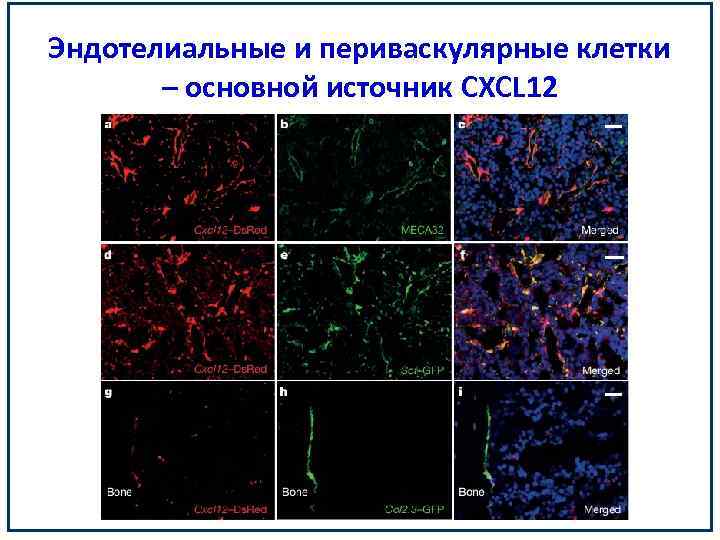 Эндотелиальные и периваскулярные клетки – основной источник CXCL 12
Эндотелиальные и периваскулярные клетки – основной источник CXCL 12
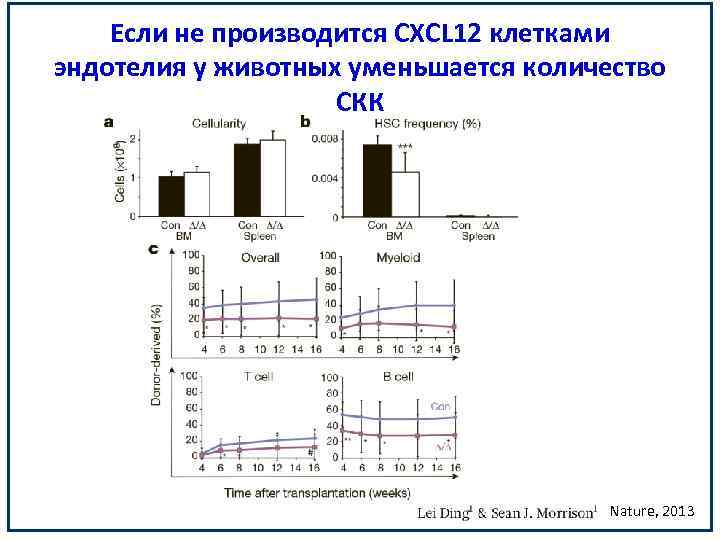 Если не производится CXCL 12 клетками эндотелия у животных уменьшается количество СКК Nature, 2013
Если не производится CXCL 12 клетками эндотелия у животных уменьшается количество СКК Nature, 2013
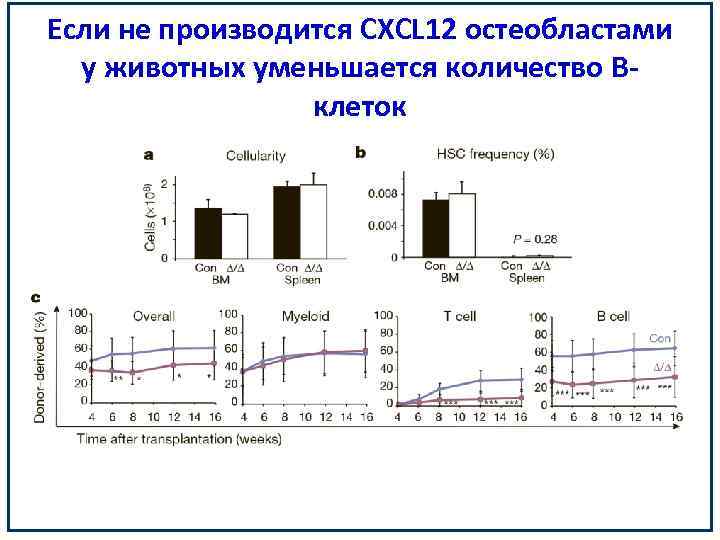 Если не производится CXCL 12 остеобластами у животных уменьшается количество Вклеток
Если не производится CXCL 12 остеобластами у животных уменьшается количество Вклеток
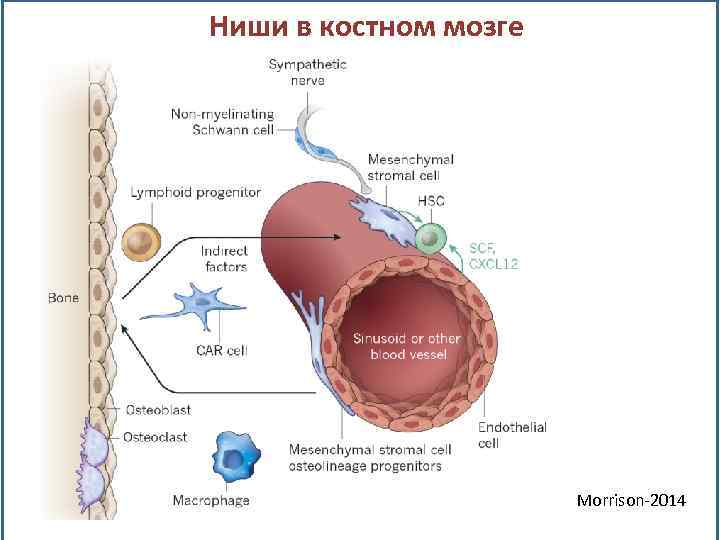 Ниши в костном мозге Morrison-2014
Ниши в костном мозге Morrison-2014
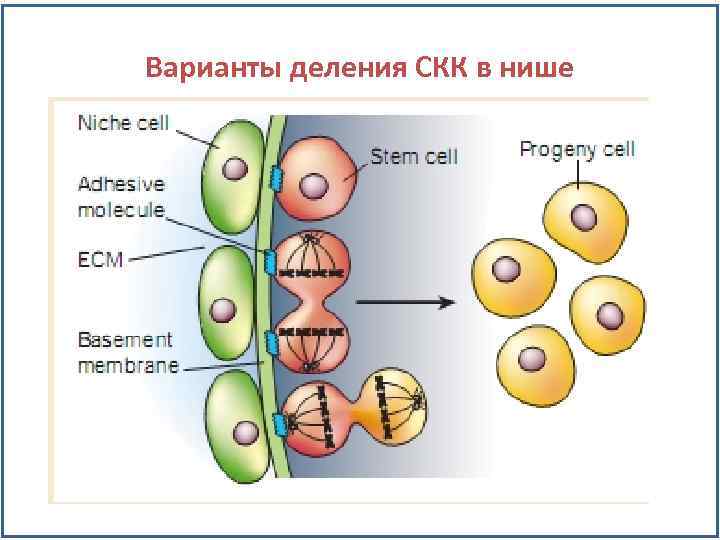 Варианты деления СКК в нише
Варианты деления СКК в нише
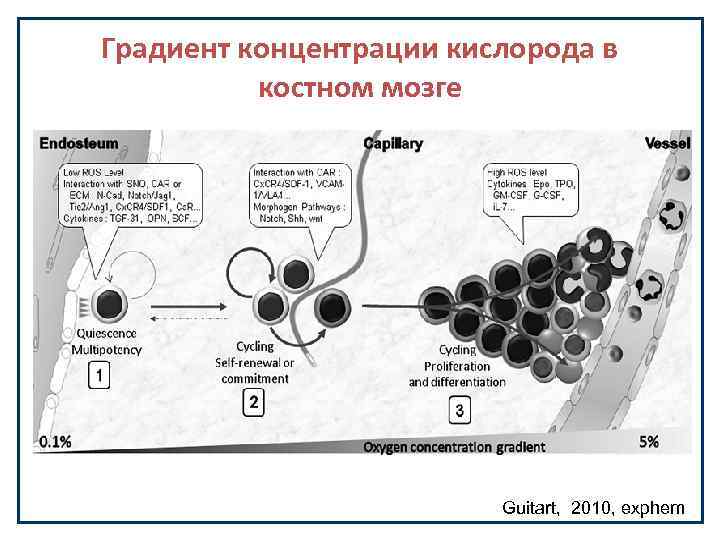 Градиент концентрации кислорода в костном мозге Guitart, 2010, exphem
Градиент концентрации кислорода в костном мозге Guitart, 2010, exphem

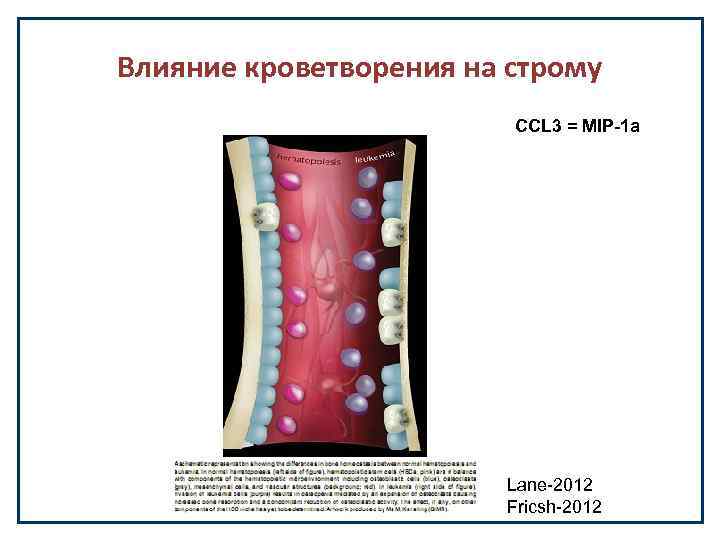 Влияние кроветворения на строму CCL 3 = MIP-1 a Lane-2012 Fricsh-2012
Влияние кроветворения на строму CCL 3 = MIP-1 a Lane-2012 Fricsh-2012
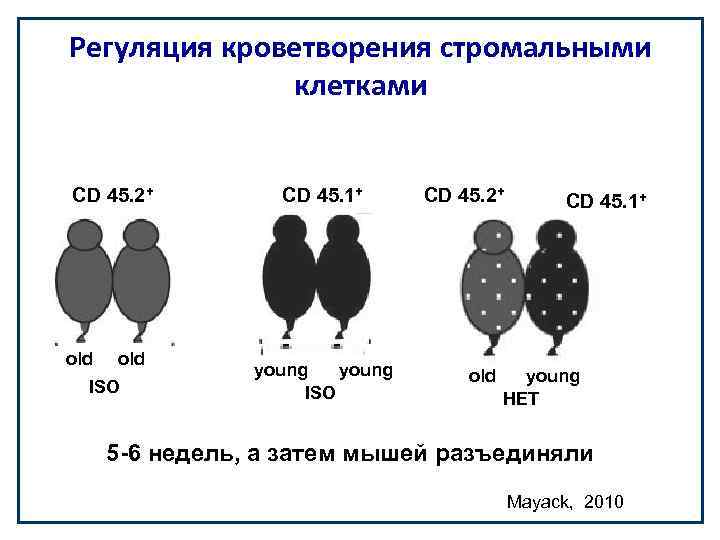 Регуляция кроветворения стромальными клетками CD 45. 2+ old ISO CD 45. 1+ young ISO CD 45. 2+ old CD 45. 1+ young HET 5 -6 недель, а затем мышей разъединяли Mayack, 2010
Регуляция кроветворения стромальными клетками CD 45. 2+ old ISO CD 45. 1+ young ISO CD 45. 2+ old CD 45. 1+ young HET 5 -6 недель, а затем мышей разъединяли Mayack, 2010
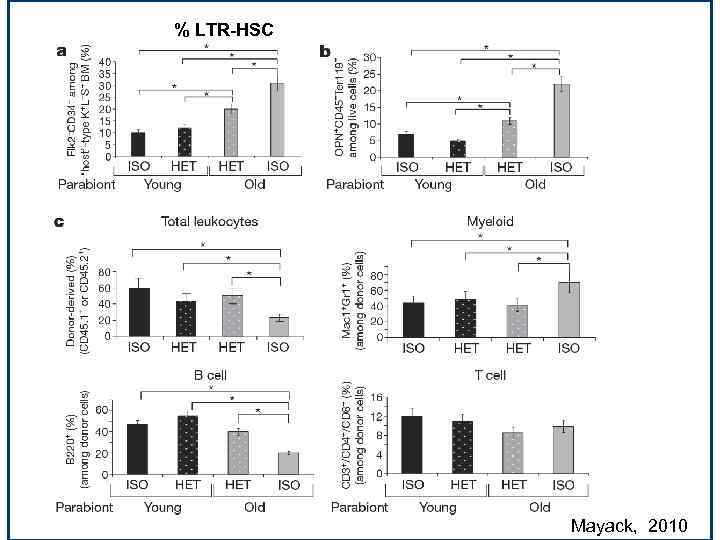 % LTR-HSC Mayack, 2010
% LTR-HSC Mayack, 2010
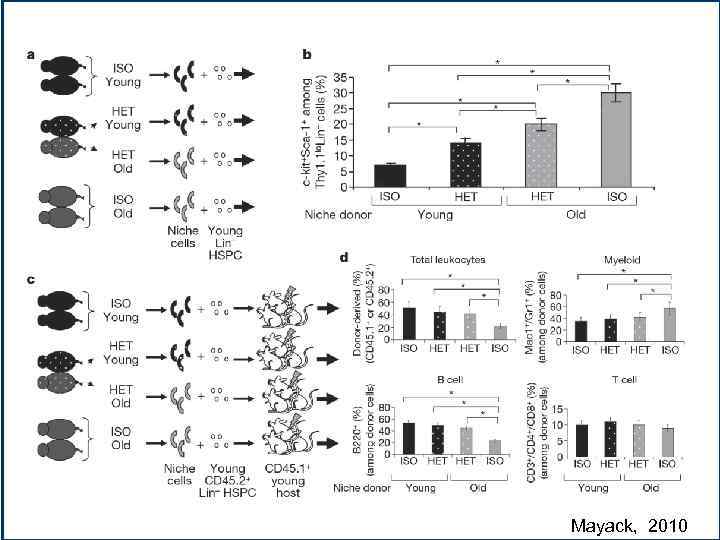 Mayack, 2010
Mayack, 2010
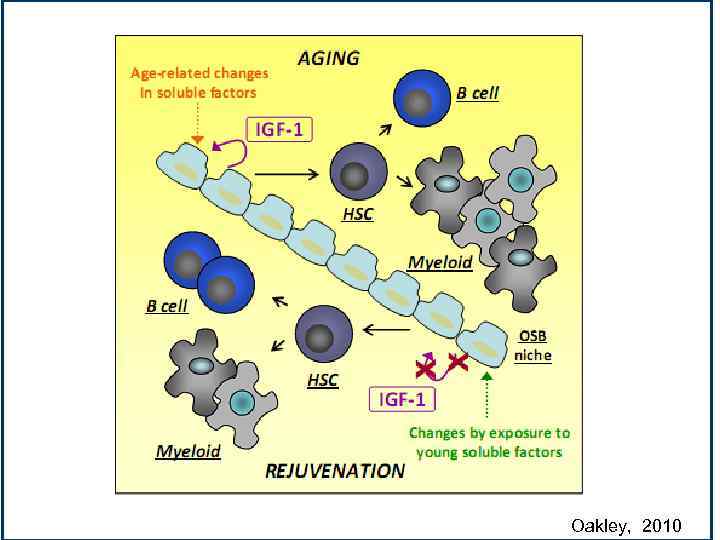 Oakley, 2010
Oakley, 2010
 Клональность кроветворения и старение Как функционирует система кроветворения? Каким количеством СКК и как она поддерживается? Существуют ли бессмертные СКК?
Клональность кроветворения и старение Как функционирует система кроветворения? Каким количеством СКК и как она поддерживается? Существуют ли бессмертные СКК?
 Самоподдержание Способность образовывать дочерние клетки, идентичные родительской. Ни наличие, ни отсутствие доказать не удавалось.
Самоподдержание Способность образовывать дочерние клетки, идентичные родительской. Ни наличие, ни отсутствие доказать не удавалось.
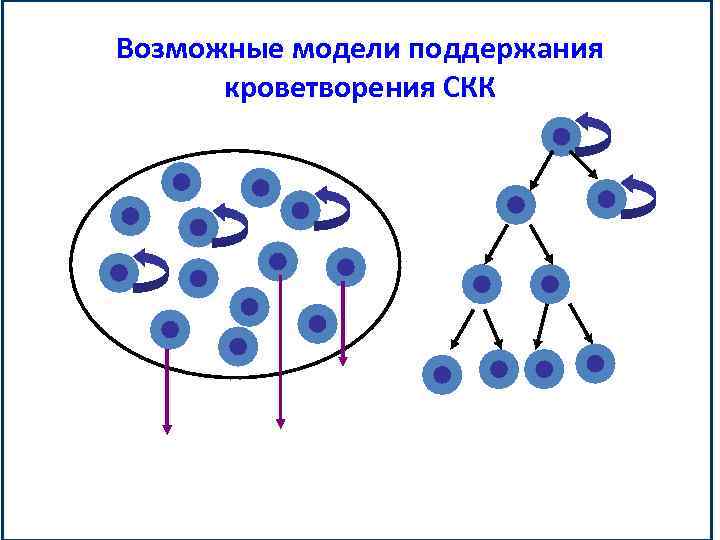 Возможные модели поддержания кроветворения СКК
Возможные модели поддержания кроветворения СКК
 Самоподдержание Решить проблему самоподдержания возможно путем изучения судьбы в организме индивидуальной стволовой кроветворной клетки. Каждая стволовая клетка должна иметь стабильный, т. е. сохраняющийся в потомках, маркер.
Самоподдержание Решить проблему самоподдержания возможно путем изучения судьбы в организме индивидуальной стволовой кроветворной клетки. Каждая стволовая клетка должна иметь стабильный, т. е. сохраняющийся в потомках, маркер.
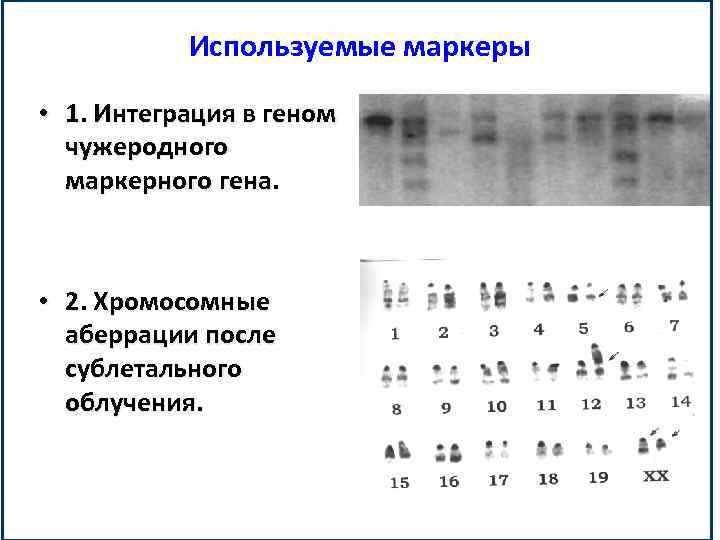 Используемые маркеры • 1. Интеграция в геном чужеродного маркерного гена. • 2. Хромосомные аберрации после сублетального облучения.
Используемые маркеры • 1. Интеграция в геном чужеродного маркерного гена. • 2. Хромосомные аберрации после сублетального облучения.
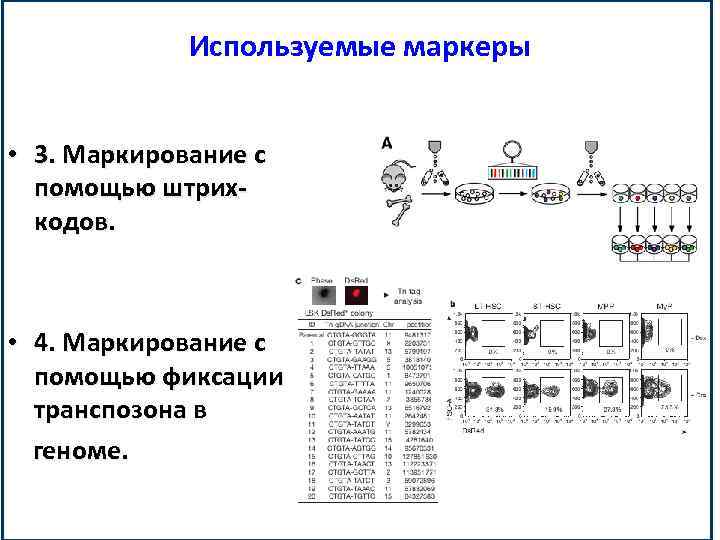 Используемые маркеры • 3. Маркирование с помощью штрихкодов. • 4. Маркирование с помощью фиксации транспозона в геноме.
Используемые маркеры • 3. Маркирование с помощью штрихкодов. • 4. Маркирование с помощью фиксации транспозона в геноме.
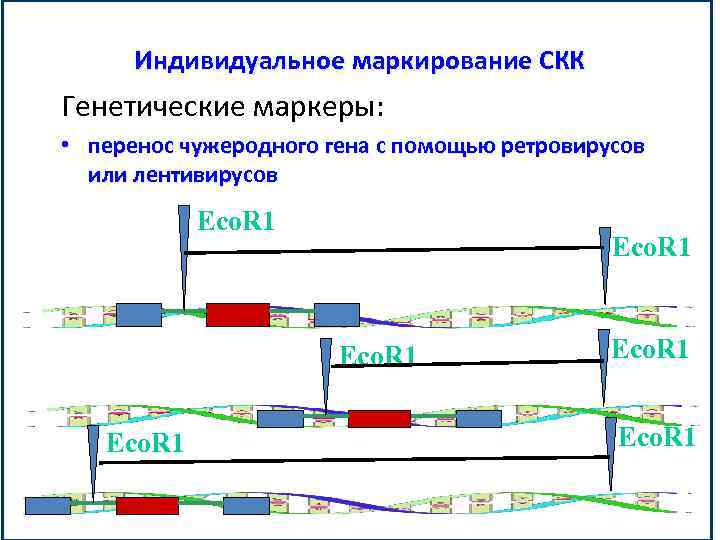 Индивидуальное маркирование СКК Генетические маркеры: • перенос чужеродного гена с помощью ретровирусов или лентивирусов Eco. R 1
Индивидуальное маркирование СКК Генетические маркеры: • перенос чужеродного гена с помощью ретровирусов или лентивирусов Eco. R 1
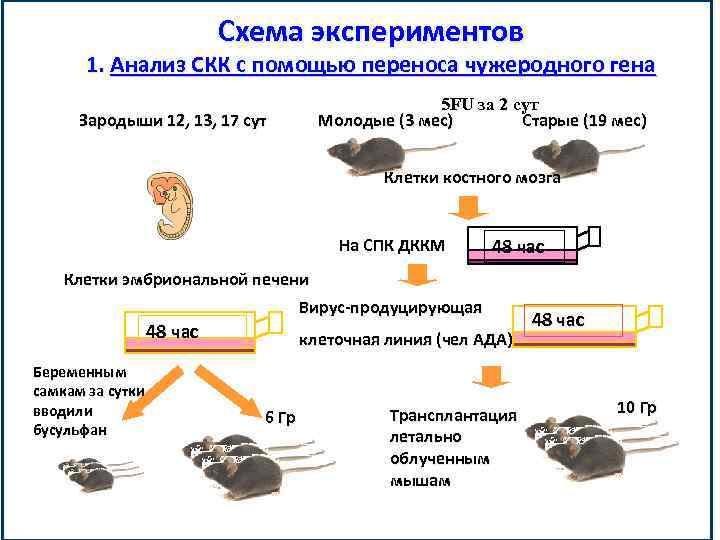 Схема экспериментов 1. Анализ СКК с помощью переноса чужеродного гена 5 FU за 2 сут Молодые (3 мес) Старые (19 мес) Зародыши 12, 13, 17 сут Клетки костного мозга На СПК ДККМ 48 час Клетки эмбриональной печени Вирус-продуцирующая 48 час Беременным самкам за сутки вводили бусульфан клеточная линия (чел АДА) 6 Гр Трансплантация летально облученным мышам 48 час 10 Гр
Схема экспериментов 1. Анализ СКК с помощью переноса чужеродного гена 5 FU за 2 сут Молодые (3 мес) Старые (19 мес) Зародыши 12, 13, 17 сут Клетки костного мозга На СПК ДККМ 48 час Клетки эмбриональной печени Вирус-продуцирующая 48 час Беременным самкам за сутки вводили бусульфан клеточная линия (чел АДА) 6 Гр Трансплантация летально облученным мышам 48 час 10 Гр
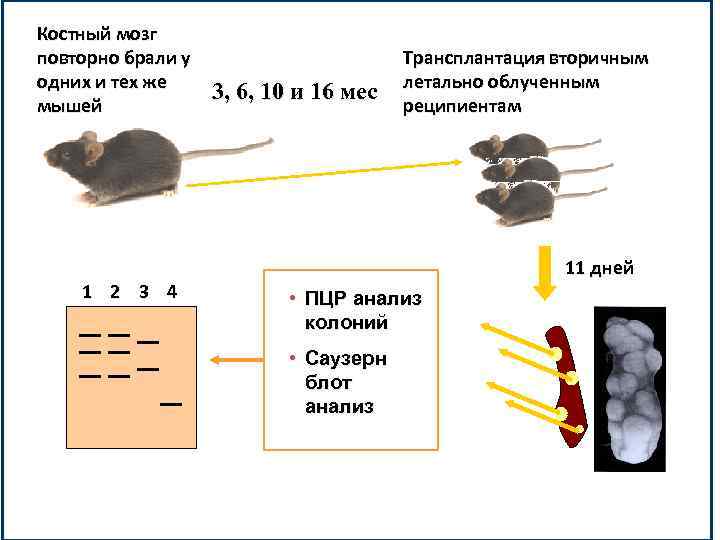 Костный мозг повторно брали у одних и тех же мышей 1 2 3 4 3, 6, 10 и 16 мес Трансплантация вторичным летально облученным реципиентам 11 дней • ПЦР анализ колоний • Саузерн блот анализ
Костный мозг повторно брали у одних и тех же мышей 1 2 3 4 3, 6, 10 и 16 мес Трансплантация вторичным летально облученным реципиентам 11 дней • ПЦР анализ колоний • Саузерн блот анализ
 Что удалось установить: • • Кроветворение в течение всей жизни восстановленной мыши имеет поликлональный характер. Кроветворение в основном поддерживается множеством небольших короткоживущих (1 -3 месяца) сменяющих друга клонов. Только СКК специально не индуцированные к пролиферации после эмбриогенеза способны образовывать долгоживущие клоны. Число последних составляет примерно 10% от всех СКК.
Что удалось установить: • • Кроветворение в течение всей жизни восстановленной мыши имеет поликлональный характер. Кроветворение в основном поддерживается множеством небольших короткоживущих (1 -3 месяца) сменяющих друга клонов. Только СКК специально не индуцированные к пролиферации после эмбриогенеза способны образовывать долгоживущие клоны. Число последних составляет примерно 10% от всех СКК.
 Каким образом это удалось сделать? 1. Судьба уникальных клонов кроветворных клеток может быть изучена только с помощью индивидуального маркирования СКК. 2. Индивидуальные клоны должны быть прослежены на протяжении всей жизни организма. 3. Чувствительность метода должна быть достаточно высока для определения малых клонов.
Каким образом это удалось сделать? 1. Судьба уникальных клонов кроветворных клеток может быть изучена только с помощью индивидуального маркирования СКК. 2. Индивидуальные клоны должны быть прослежены на протяжении всей жизни организма. 3. Чувствительность метода должна быть достаточно высока для определения малых клонов.
 4. Судьба клонов не должна искажаться длительно живущими клетками. 5. Метод маркирования СКК не должен существенно влиять на их биологию.
4. Судьба клонов не должна искажаться длительно живущими клетками. 5. Метод маркирования СКК не должен существенно влиять на их биологию.
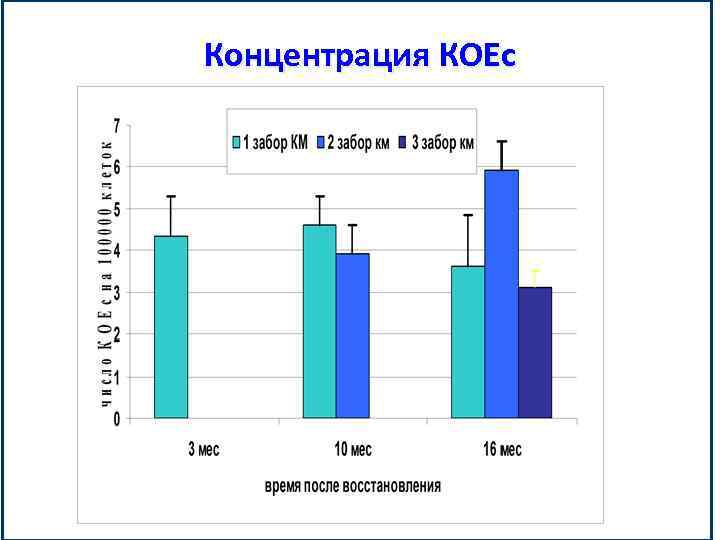 Концентрация КОЕс
Концентрация КОЕс
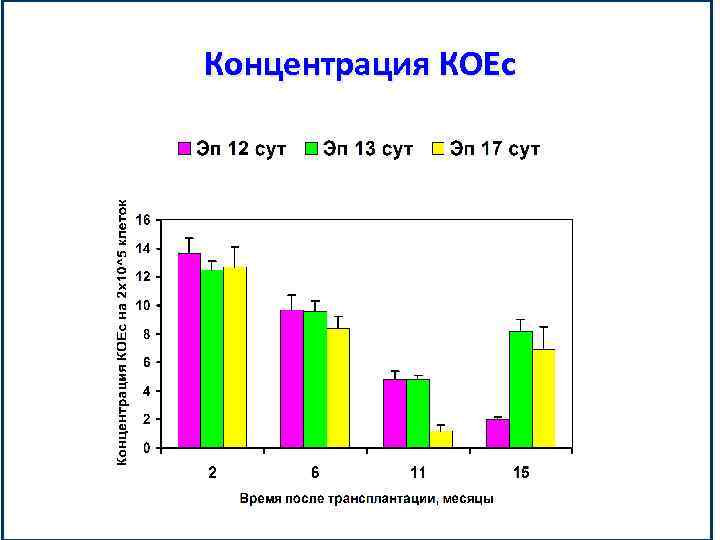 Концентрация КОЕс
Концентрация КОЕс
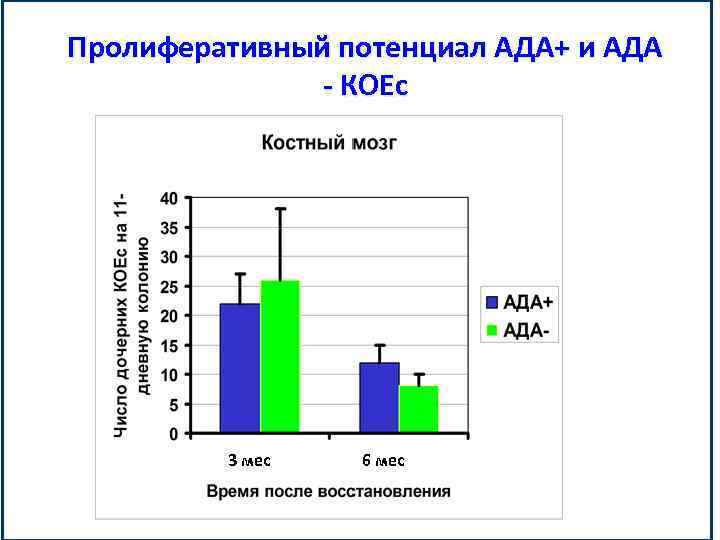 Пролиферативный потенциал АДА+ и АДА - КОЕс 3 мес 6 мес
Пролиферативный потенциал АДА+ и АДА - КОЕс 3 мес 6 мес
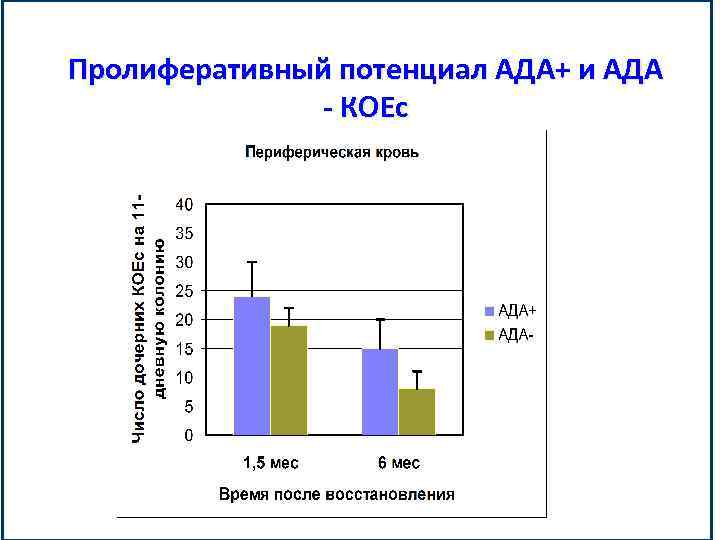 Пролиферативный потенциал АДА+ и АДА - КОЕс
Пролиферативный потенциал АДА+ и АДА - КОЕс
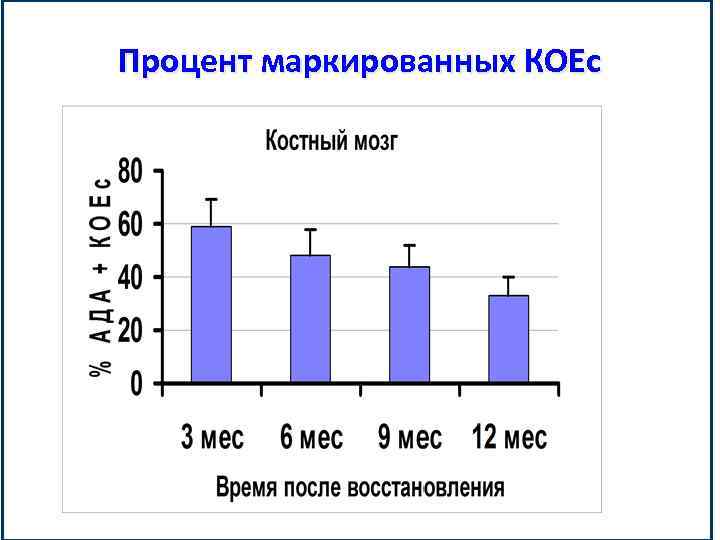 Процент маркированных КОЕс
Процент маркированных КОЕс
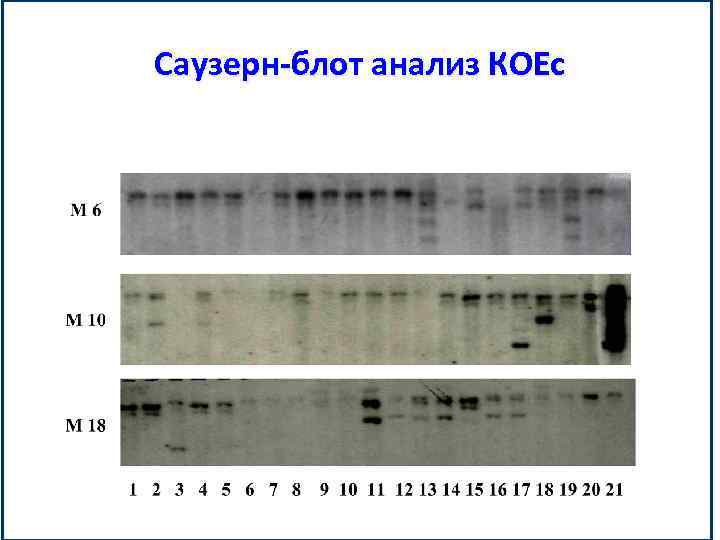 Саузерн-блот анализ КОЕс
Саузерн-блот анализ КОЕс
 Распределение клонов у восстановленных мышей Индивидуальные клоны у мышей, восстановленных клетками эмбриональной печени, 13 суток 2 мес мышь 8 3 4 5 6 7 км 1, 2 (7) 6 мес 0 1 2 1 3 2 4 5 6 3 4 км 7 8 5 9 6 10 11 7 8 9 15 мес (9) км 1, 2 (16) 11 мес 3 4 5 6 7 8 км 8 9 10 км 11 12 13 14 15 16 км
Распределение клонов у восстановленных мышей Индивидуальные клоны у мышей, восстановленных клетками эмбриональной печени, 13 суток 2 мес мышь 8 3 4 5 6 7 км 1, 2 (7) 6 мес 0 1 2 1 3 2 4 5 6 3 4 км 7 8 5 9 6 10 11 7 8 9 15 мес (9) км 1, 2 (16) 11 мес 3 4 5 6 7 8 км 8 9 10 км 11 12 13 14 15 16 км
 Эта часть исследований показала: 1. Кроветворение в течение всей жизни восстановленной мыши имеет поликлональный характер. 2. Кроветворение в основном поддерживается множеством небольших короткоживущих (1 -3 месяца) сменяющих друга клонов.
Эта часть исследований показала: 1. Кроветворение в течение всей жизни восстановленной мыши имеет поликлональный характер. 2. Кроветворение в основном поддерживается множеством небольших короткоживущих (1 -3 месяца) сменяющих друга клонов.
 Гематопоэз охарактеризован на уровне ранних предшественников, КОЕс. Кроветворение - это процесс образования зрелых клеток.
Гематопоэз охарактеризован на уровне ранних предшественников, КОЕс. Кроветворение - это процесс образования зрелых клеток.
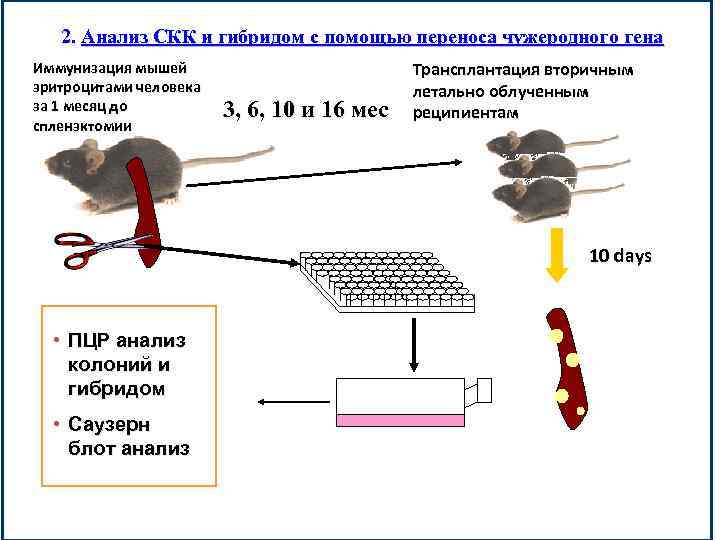 2. Анализ СКК и гибридом с помощью переноса чужеродного гена Иммунизация мышей эритроцитами человека за 1 месяц до спленэктомии 3, 6, 10 и 16 мес Трансплантация вторичным летально облученным реципиентам 10 days • ПЦР анализ колоний и гибридом • Саузерн блот анализ
2. Анализ СКК и гибридом с помощью переноса чужеродного гена Иммунизация мышей эритроцитами человека за 1 месяц до спленэктомии 3, 6, 10 и 16 мес Трансплантация вторичным летально облученным реципиентам 10 days • ПЦР анализ колоний и гибридом • Саузерн блот анализ
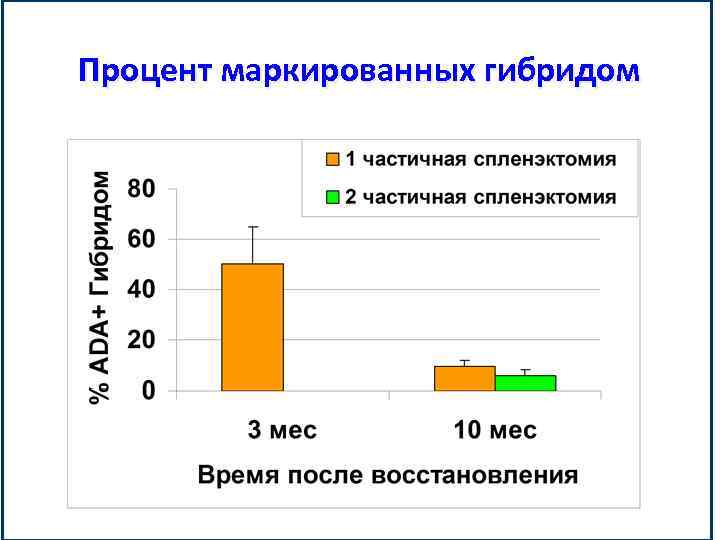 Процент маркированных гибридом
Процент маркированных гибридом
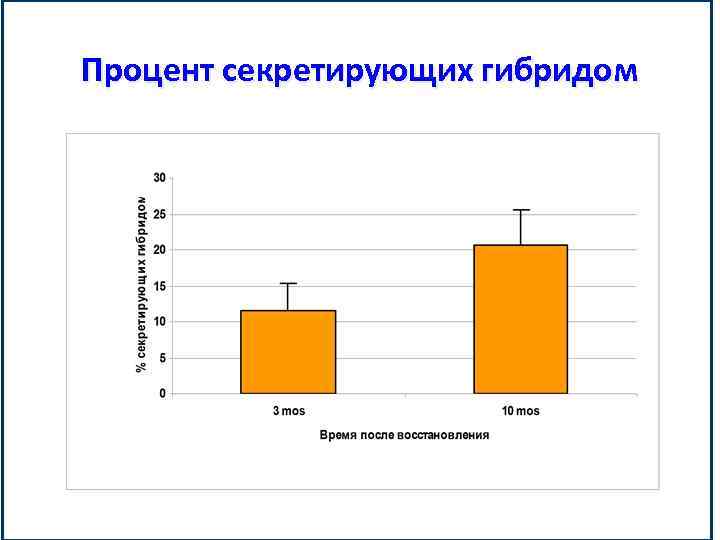 Процент секретирующих гибридом
Процент секретирующих гибридом
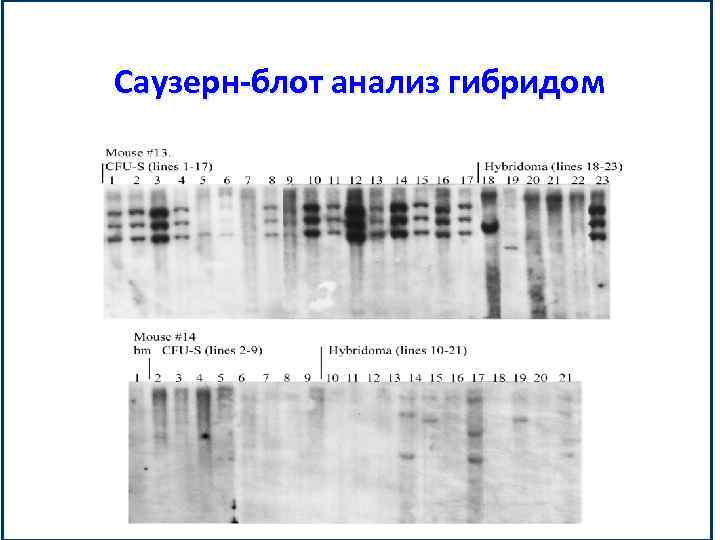 Саузерн-блот анализ гибридом
Саузерн-блот анализ гибридом
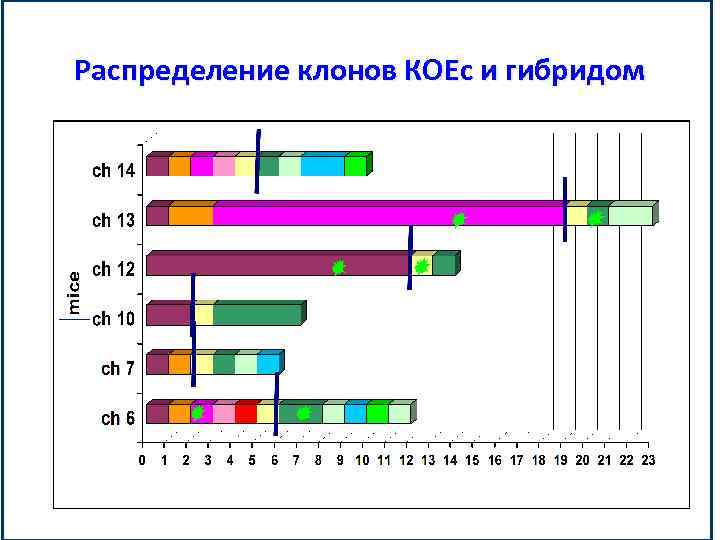 Распределение клонов КОЕс и гибридом
Распределение клонов КОЕс и гибридом
 Эта часть исследований показала: 1. Кроветворение поликлонально и клоны зрелых клеток меняют друга. 2. Время дифференцировки КОЕс не очень отличается от времени образования зрелого В-лимфоцита.
Эта часть исследований показала: 1. Кроветворение поликлонально и клоны зрелых клеток меняют друга. 2. Время дифференцировки КОЕс не очень отличается от времени образования зрелого В-лимфоцита.
 Ограничения использованных методов 1. Разобщение СКК с субстратом. 2. Престимуляция клеток к делению. 3. Маркируются только СКК находившиеся в клеточном цикле. 4. СКК подвергали процедуре трансплантации.
Ограничения использованных методов 1. Разобщение СКК с субстратом. 2. Престимуляция клеток к делению. 3. Маркируются только СКК находившиеся в клеточном цикле. 4. СКК подвергали процедуре трансплантации.
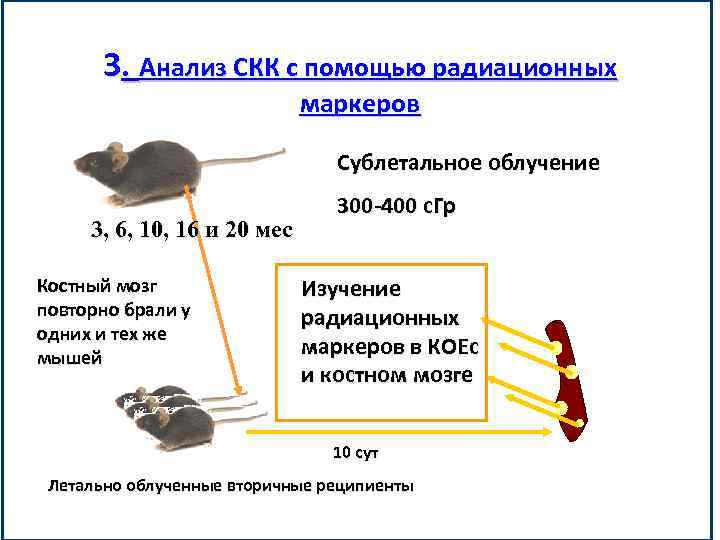 3. Анализ СКК с помощью радиационных маркеров Сублетальное облучение 3, 6, 10, 16 и 20 мес Костный мозг повторно брали у одних и тех же мышей 300 -400 с. Гр Изучение радиационных маркеров в КОЕс и костном мозге 10 сут Летально облученные вторичные реципиенты
3. Анализ СКК с помощью радиационных маркеров Сублетальное облучение 3, 6, 10, 16 и 20 мес Костный мозг повторно брали у одних и тех же мышей 300 -400 с. Гр Изучение радиационных маркеров в КОЕс и костном мозге 10 сут Летально облученные вторичные реципиенты
 Пример радиационного маркера
Пример радиационного маркера
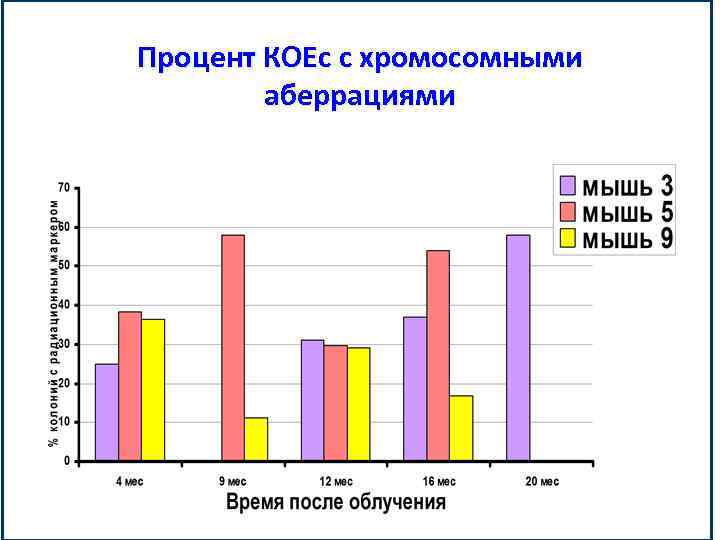 Процент КОЕс с хромосомными аберрациями
Процент КОЕс с хромосомными аберрациями
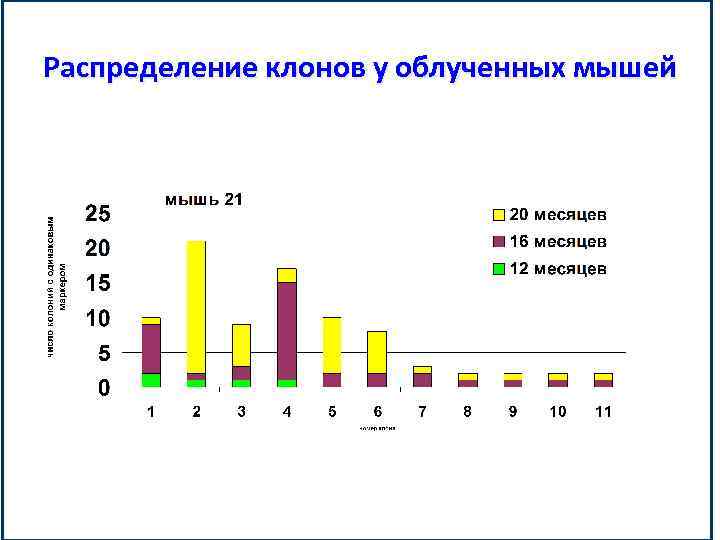 Распределение клонов у облученных мышей
Распределение клонов у облученных мышей
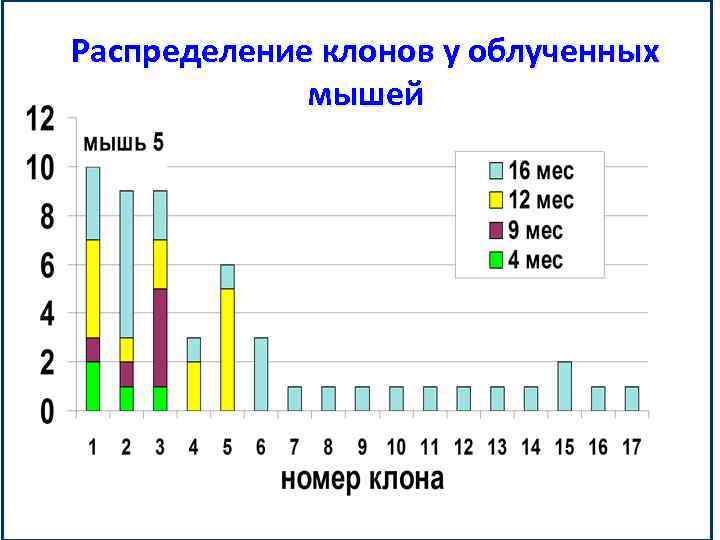 Распределение клонов у облученных мышей
Распределение клонов у облученных мышей
 Кариологические исследования показали: Только СКК редко пролиферировавшие после эмбриогенеза способны образовывать долгоживущие клоны. Число последних составляет примерно 10%.
Кариологические исследования показали: Только СКК редко пролиферировавшие после эмбриогенеза способны образовывать долгоживущие клоны. Число последних составляет примерно 10%.
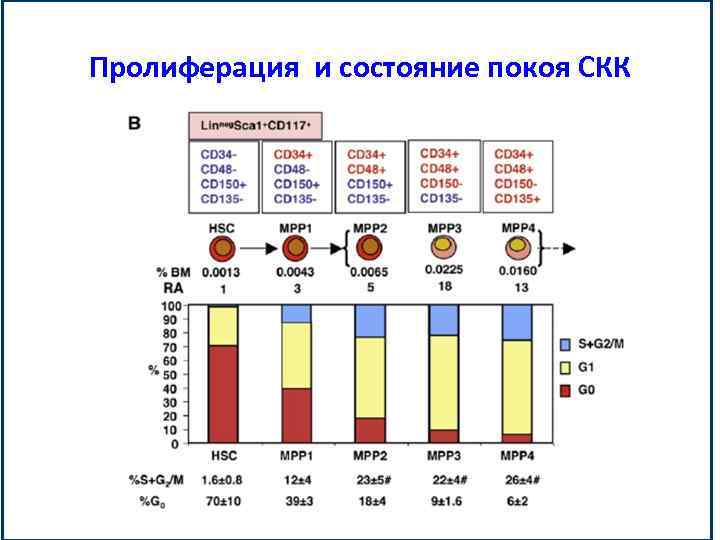 Пролиферация и состояние покоя СКК
Пролиферация и состояние покоя СКК
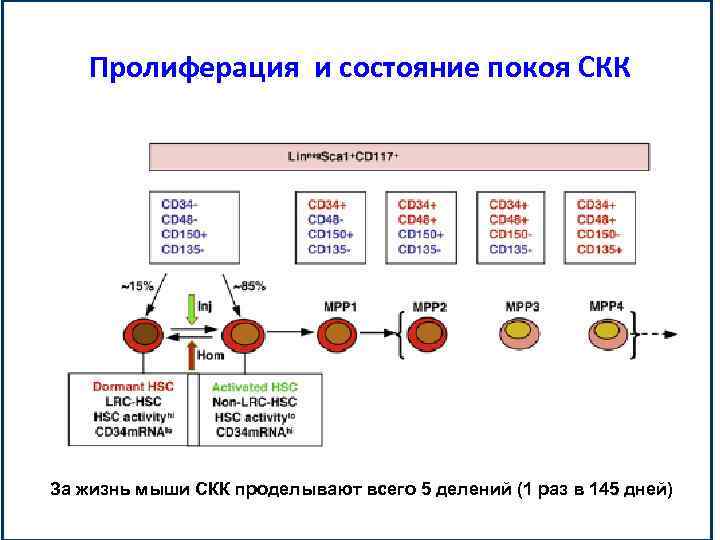 Пролиферация и состояние покоя СКК За жизнь мыши СКК проделывают всего 5 делений (1 раз в 145 дней)
Пролиферация и состояние покоя СКК За жизнь мыши СКК проделывают всего 5 делений (1 раз в 145 дней)
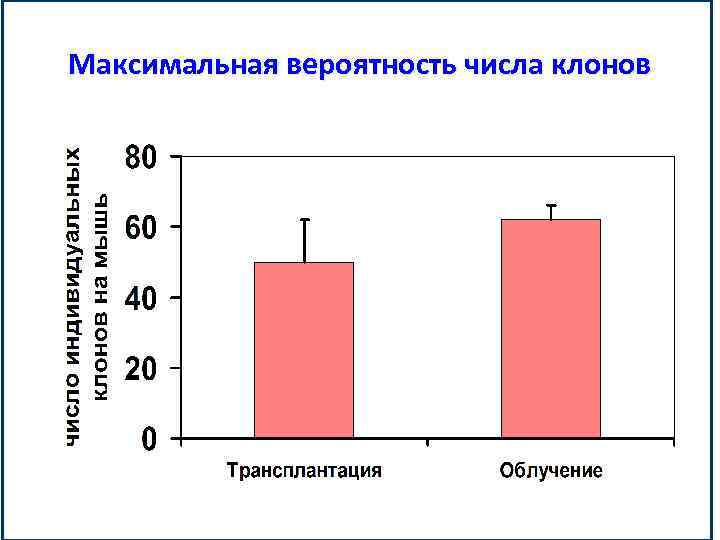 Максимальная вероятность числа клонов
Максимальная вероятность числа клонов
 Количество клонов на мышь
Количество клонов на мышь
 Заключение • 1. Гемопоэз обеспечивается последовательным • образованием кроветворных клонов стволовыми клетками. • 2. Стволовая кроветворная клетка не бессмертна и обладает высоким, но лимитированным пролиферативным потенциалом. • 3. Стволовые клетки гетерогенны и являются транзиторной клеточной популяцией.
Заключение • 1. Гемопоэз обеспечивается последовательным • образованием кроветворных клонов стволовыми клетками. • 2. Стволовая кроветворная клетка не бессмертна и обладает высоким, но лимитированным пролиферативным потенциалом. • 3. Стволовые клетки гетерогенны и являются транзиторной клеточной популяцией.
 Заключение СКК является членом, возможно исходным, транзитной клеточной популяции созревающих клеток крови. СКК не способна к бесконечному самоподдержанию.
Заключение СКК является членом, возможно исходным, транзитной клеточной популяции созревающих клеток крови. СКК не способна к бесконечному самоподдержанию.
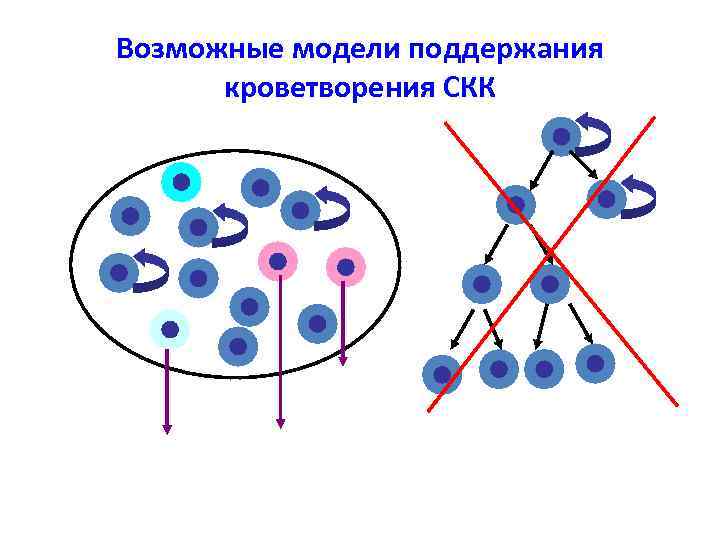 Возможные модели поддержания кроветворения СКК
Возможные модели поддержания кроветворения СКК
 Метаморфозы
Метаморфозы
 Авторы этой работы Главный автор Чертков И. Л. Эршлер М. А. Шипунова И. Н. Свинарева Д. А. Сац Н. В. Оловникова Н. И. Дризе Н. И. Ольшанская Ю. В. Самойлина Н. Л. Тодрия Т. В.
Авторы этой работы Главный автор Чертков И. Л. Эршлер М. А. Шипунова И. Н. Свинарева Д. А. Сац Н. В. Оловникова Н. И. Дризе Н. И. Ольшанская Ю. В. Самойлина Н. Л. Тодрия Т. В.
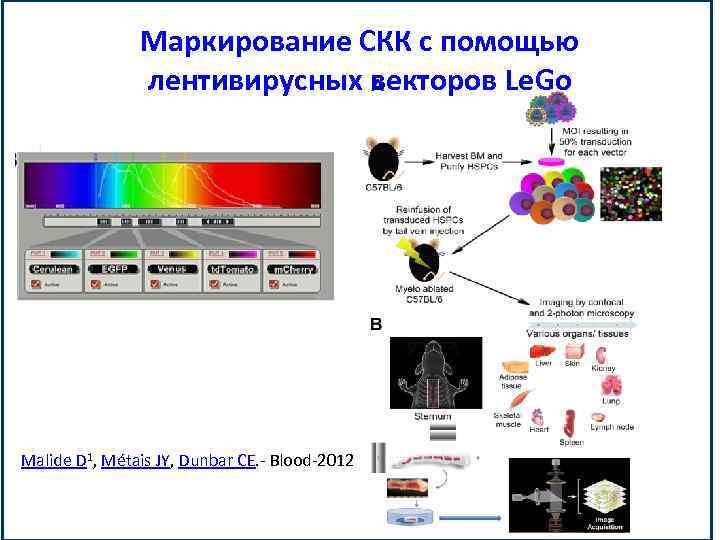 Маркирование СКК с помощью лентивирусных векторов Le. Go Malide D 1, Métais JY, Dunbar CE. - Blood-2012
Маркирование СКК с помощью лентивирусных векторов Le. Go Malide D 1, Métais JY, Dunbar CE. - Blood-2012
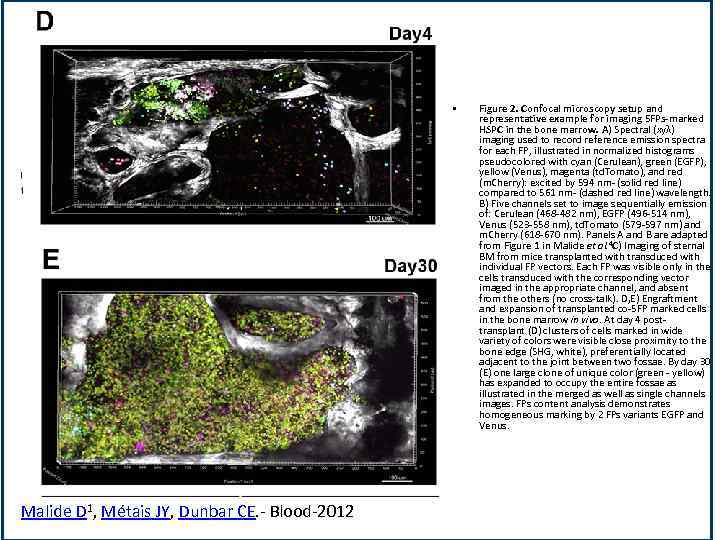 • Malide D 1, Métais JY, Dunbar CE. - Blood-2012 Figure 2. Confocal microscopy setup and representative example for imaging 5 FPs-marked HSPC in the bone marrow. A) Spectral (xyλ) imaging used to record reference emission spectra for each FP, illustrated in normalized histograms pseudocolored with cyan (Cerulean), green (EGFP), yellow (Venus), magenta (td. Tomato), and red (m. Cherry): excited by 594 nm- (solid red line) compared to 561 nm- (dashed red line) wavelength. B) Five channels set to image sequentially emission of: Cerulean (468 -482 nm), EGFP (496 -514 nm), Venus (523 -558 nm), td. Tomato (579 -597 nm) and m. Cherry (618 -670 nm). Panels A and B are adapted from Figure 1 in Malide et al. 4 C) Imaging of sternal BM from mice transplanted with transduced with individual FP vectors. Each FP was visible only in the cells transduced with the corresponding vector imaged in the appropriate channel, and absent from the others (no cross-talk). D, E) Engraftment and expansion of transplanted co-5 FP marked cells in the bone marrow in vivo. At day 4 posttransplant (D) clusters of cells marked in wide variety of colors were visible close proximity to the bone edge (SHG, white), preferentially located adjacent to the joint between two fossae. By day 30 (E) one large clone of unique color (green - yellow) has expanded to occupy the entire fossae as illustrated in the merged as well as single channels images. FPs content analysis demonstrates homogeneous marking by 2 FPs variants EGFP and Venus.
• Malide D 1, Métais JY, Dunbar CE. - Blood-2012 Figure 2. Confocal microscopy setup and representative example for imaging 5 FPs-marked HSPC in the bone marrow. A) Spectral (xyλ) imaging used to record reference emission spectra for each FP, illustrated in normalized histograms pseudocolored with cyan (Cerulean), green (EGFP), yellow (Venus), magenta (td. Tomato), and red (m. Cherry): excited by 594 nm- (solid red line) compared to 561 nm- (dashed red line) wavelength. B) Five channels set to image sequentially emission of: Cerulean (468 -482 nm), EGFP (496 -514 nm), Venus (523 -558 nm), td. Tomato (579 -597 nm) and m. Cherry (618 -670 nm). Panels A and B are adapted from Figure 1 in Malide et al. 4 C) Imaging of sternal BM from mice transplanted with transduced with individual FP vectors. Each FP was visible only in the cells transduced with the corresponding vector imaged in the appropriate channel, and absent from the others (no cross-talk). D, E) Engraftment and expansion of transplanted co-5 FP marked cells in the bone marrow in vivo. At day 4 posttransplant (D) clusters of cells marked in wide variety of colors were visible close proximity to the bone edge (SHG, white), preferentially located adjacent to the joint between two fossae. By day 30 (E) one large clone of unique color (green - yellow) has expanded to occupy the entire fossae as illustrated in the merged as well as single channels images. FPs content analysis demonstrates homogeneous marking by 2 FPs variants EGFP and Venus.
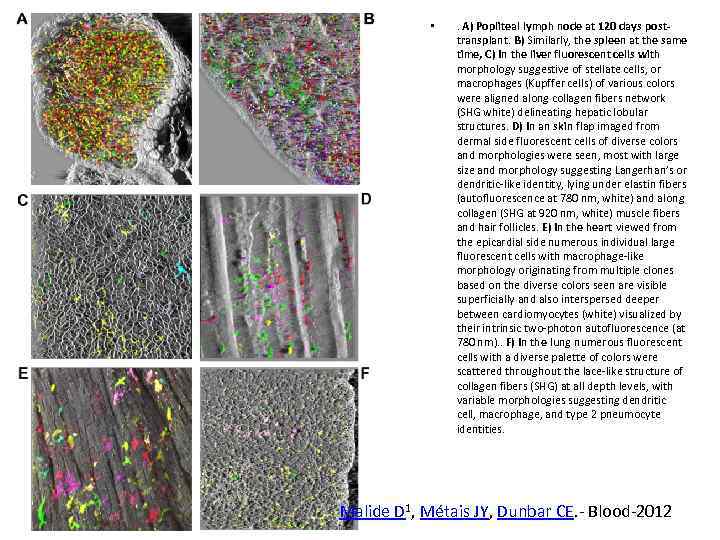 • . A) Popliteal lymph node at 120 days posttransplant. B) Similarly, the spleen at the same time, C) In the liver fluorescent cells with morphology suggestive of stellate cells, or macrophages (Kupffer cells) of various colors were aligned along collagen fibers network (SHG white) delineating hepatic lobular structures. D) In an skin flap imaged from dermal side fluorescent cells of diverse colors and morphologies were seen, most with large size and morphology suggesting Langerhan’s or dendritic-like identity, lying under elastin fibers (autofluorescence at 780 nm, white) and along collagen (SHG at 920 nm, white) muscle fibers and hair follicles. E) In the heart viewed from the epicardial side numerous individual large fluorescent cells with macrophage-like morphology originating from multiple clones based on the diverse colors seen are visible superficially and also interspersed deeper between cardiomyocytes (white) visualized by their intrinsic two-photon autofluorescence (at 780 nm). . F) In the lung numerous fluorescent cells with a diverse palette of colors were scattered throughout the lace-like structure of collagen fibers (SHG) at all depth levels, with variable morphologies suggesting dendritic cell, macrophage, and type 2 pneumocyte identities. Malide D 1, Métais JY, Dunbar CE. - Blood-2012
• . A) Popliteal lymph node at 120 days posttransplant. B) Similarly, the spleen at the same time, C) In the liver fluorescent cells with morphology suggestive of stellate cells, or macrophages (Kupffer cells) of various colors were aligned along collagen fibers network (SHG white) delineating hepatic lobular structures. D) In an skin flap imaged from dermal side fluorescent cells of diverse colors and morphologies were seen, most with large size and morphology suggesting Langerhan’s or dendritic-like identity, lying under elastin fibers (autofluorescence at 780 nm, white) and along collagen (SHG at 920 nm, white) muscle fibers and hair follicles. E) In the heart viewed from the epicardial side numerous individual large fluorescent cells with macrophage-like morphology originating from multiple clones based on the diverse colors seen are visible superficially and also interspersed deeper between cardiomyocytes (white) visualized by their intrinsic two-photon autofluorescence (at 780 nm). . F) In the lung numerous fluorescent cells with a diverse palette of colors were scattered throughout the lace-like structure of collagen fibers (SHG) at all depth levels, with variable morphologies suggesting dendritic cell, macrophage, and type 2 pneumocyte identities. Malide D 1, Métais JY, Dunbar CE. - Blood-2012
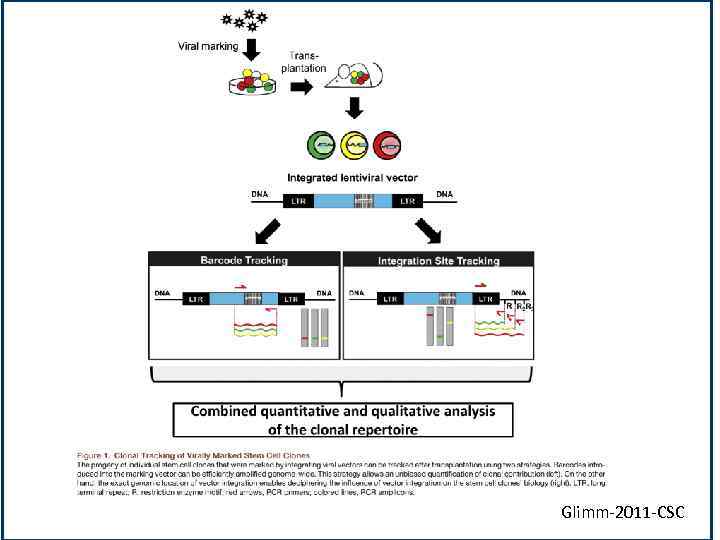 Glimm-2011 -CSC
Glimm-2011 -CSC
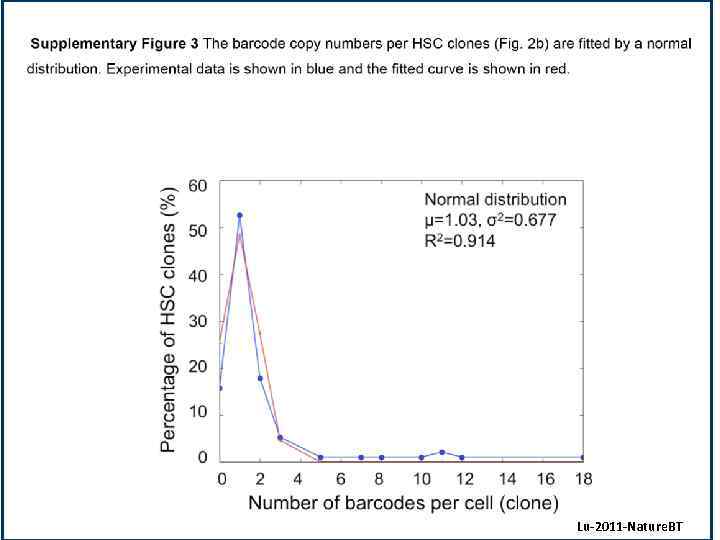 Lu-2011 -Nature. BT
Lu-2011 -Nature. BT
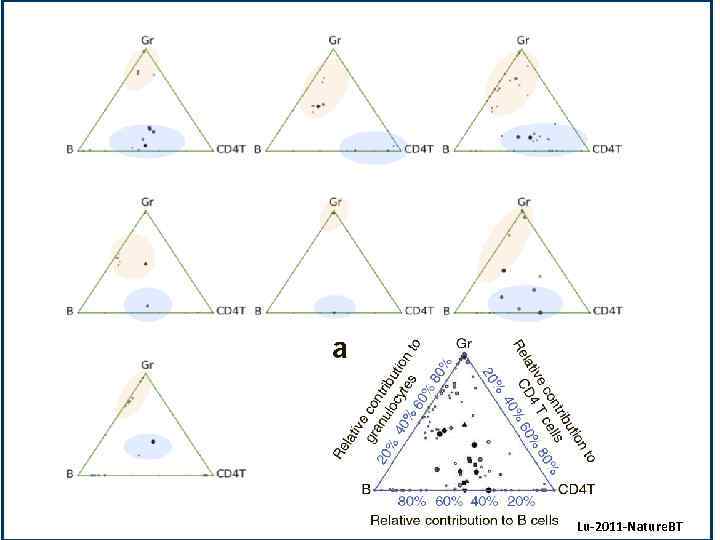 Lu. Lu Lu-2011 -Nature. BT
Lu. Lu Lu-2011 -Nature. BT
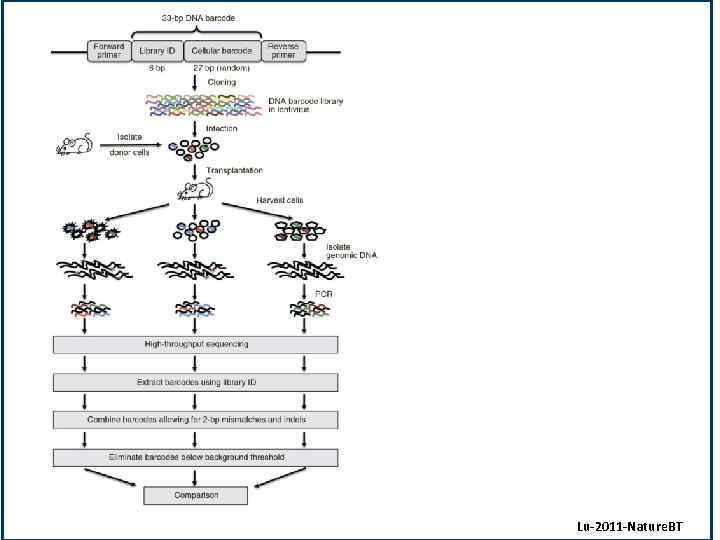 Lu-2011 -Nature. BT
Lu-2011 -Nature. BT
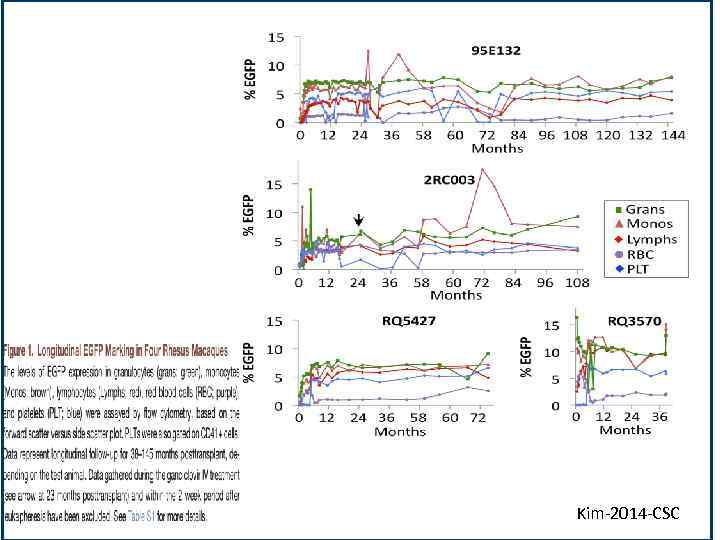 Kim Kim-2014 -CSC
Kim Kim-2014 -CSC
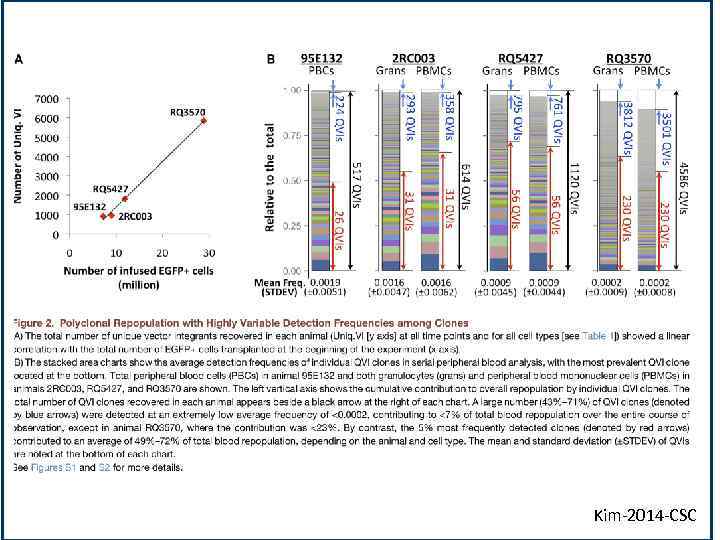 Kim-2014 -CSC
Kim-2014 -CSC
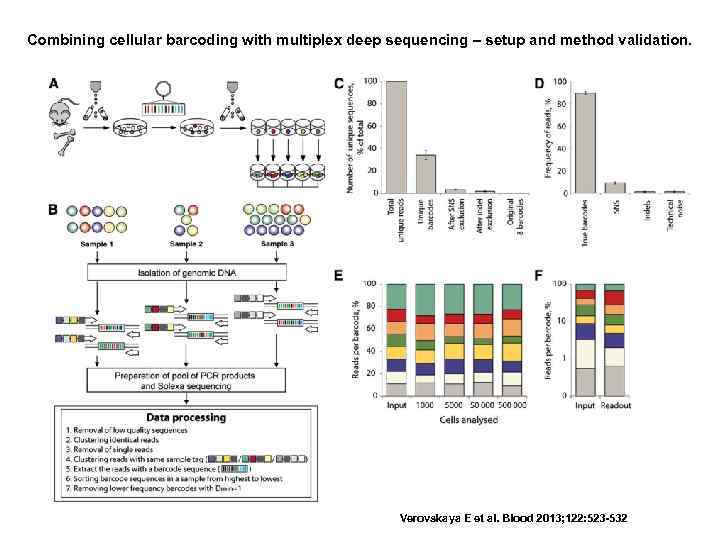 Combining cellular barcoding with multiplex deep sequencing – setup and method validation. Verovskaya E et al. Blood 2013; 122: 523 -532
Combining cellular barcoding with multiplex deep sequencing – setup and method validation. Verovskaya E et al. Blood 2013; 122: 523 -532
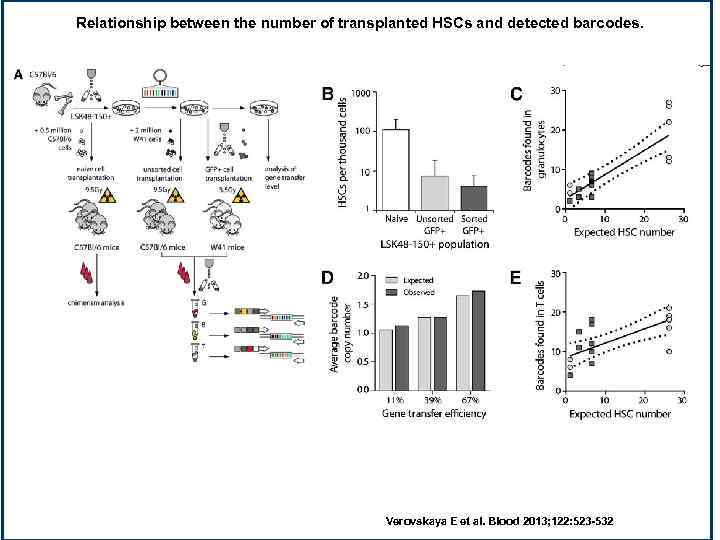 Relationship between the number of transplanted HSCs and detected barcodes. Verovskaya E et al. Blood 2013; 122: 523 -532
Relationship between the number of transplanted HSCs and detected barcodes. Verovskaya E et al. Blood 2013; 122: 523 -532
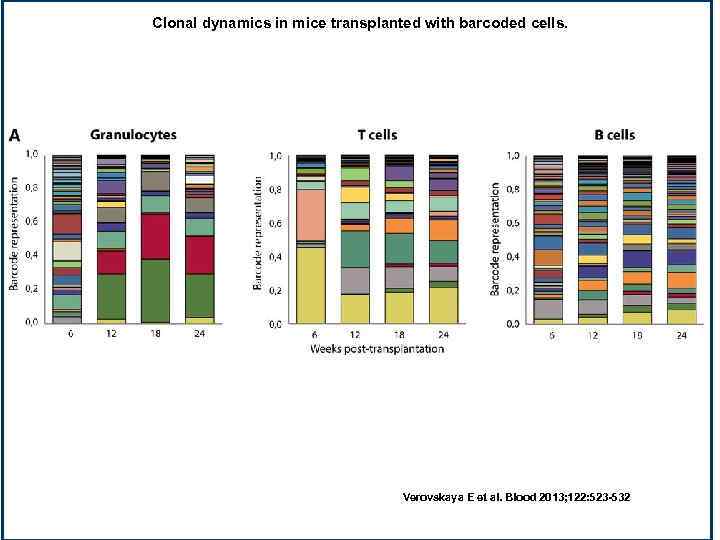 Clonal dynamics in mice transplanted with barcoded cells. Verovskaya E et al. Blood 2013; 122: 523 -532
Clonal dynamics in mice transplanted with barcoded cells. Verovskaya E et al. Blood 2013; 122: 523 -532
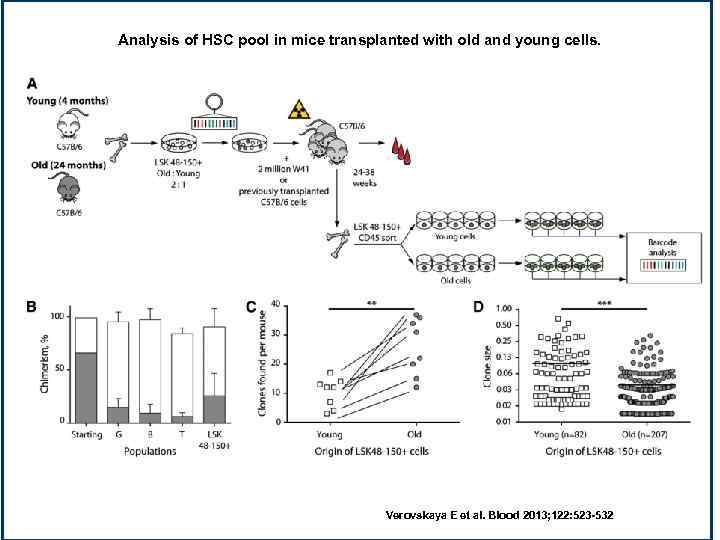 Analysis of HSC pool in mice transplanted with old and young cells. Verovskaya E et al. Blood 2013; 122: 523 -532
Analysis of HSC pool in mice transplanted with old and young cells. Verovskaya E et al. Blood 2013; 122: 523 -532
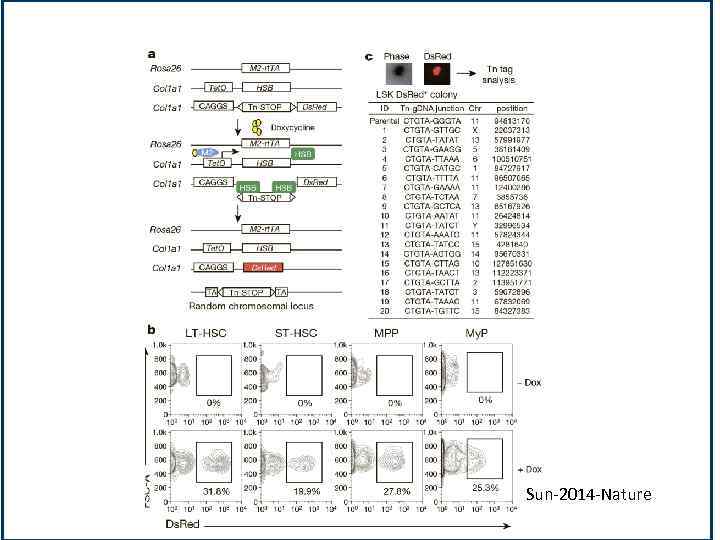
 Анализ клонов в системе без трансплантации • Транспозоны активируется с помощью фермента 'транспозазы «Спящая красавица» , экспрессия которого контролируется доксициклином. В течение короткого периода времени, когда доксициклин вводится мышам , транспозон может случайным образом менять свое расположение в геноме. Эта транспозиция создает наследуемые геномные вставки в ДНК, которые является уникальными для индивидуальных клеток и их потомства. Клетки, происходящие от общего предка могут быть идентифицированы по общим сайтам. • Авторы провели серии экспериментов для демонстрации достоверности и чувствительности этой экспериментальной системы. Lu-2014 -CSC
Анализ клонов в системе без трансплантации • Транспозоны активируется с помощью фермента 'транспозазы «Спящая красавица» , экспрессия которого контролируется доксициклином. В течение короткого периода времени, когда доксициклин вводится мышам , транспозон может случайным образом менять свое расположение в геноме. Эта транспозиция создает наследуемые геномные вставки в ДНК, которые является уникальными для индивидуальных клеток и их потомства. Клетки, происходящие от общего предка могут быть идентифицированы по общим сайтам. • Авторы провели серии экспериментов для демонстрации достоверности и чувствительности этой экспериментальной системы. Lu-2014 -CSC
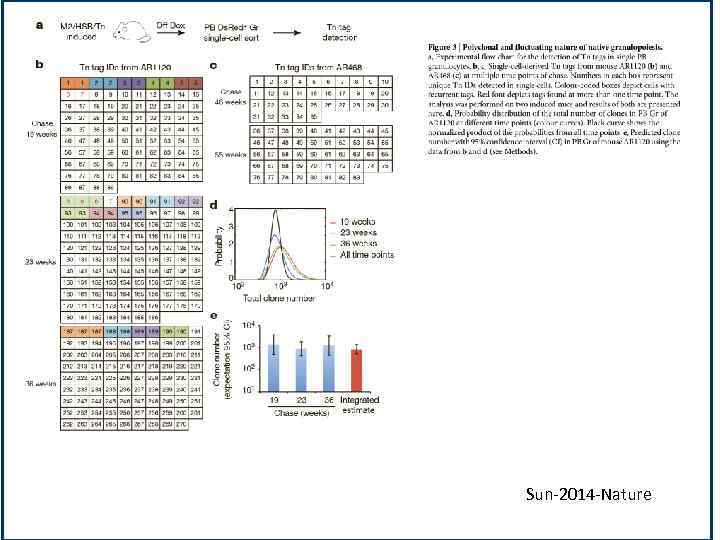
 Sun-2014 -Nature
Sun-2014 -Nature
 Sun-2014 -Nature
Sun-2014 -Nature
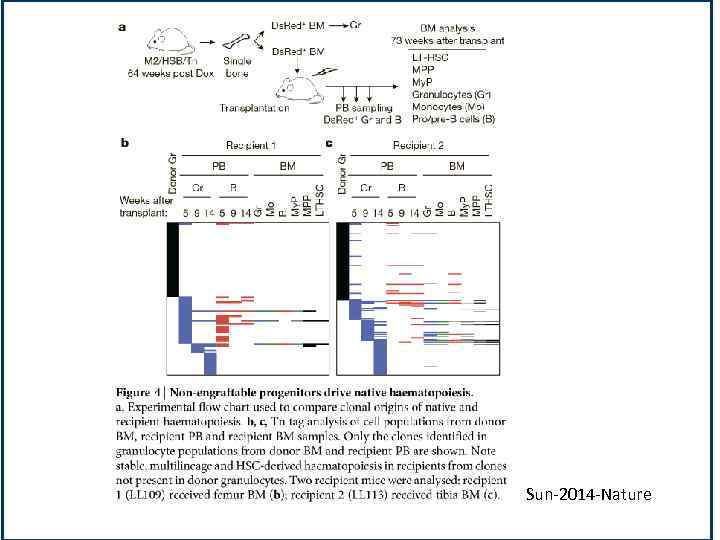
 Sun-2014 -Nature
Sun-2014 -Nature
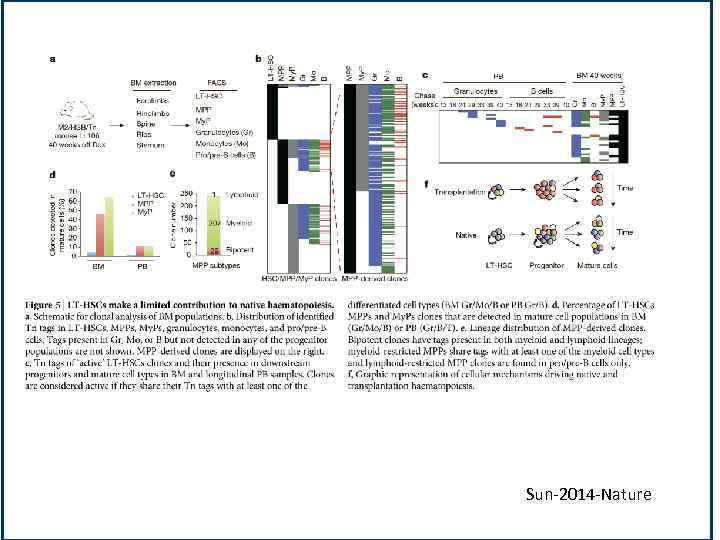
 Sun-2014 -Nature
Sun-2014 -Nature
 Sun-2014 -Nature
Sun-2014 -Nature
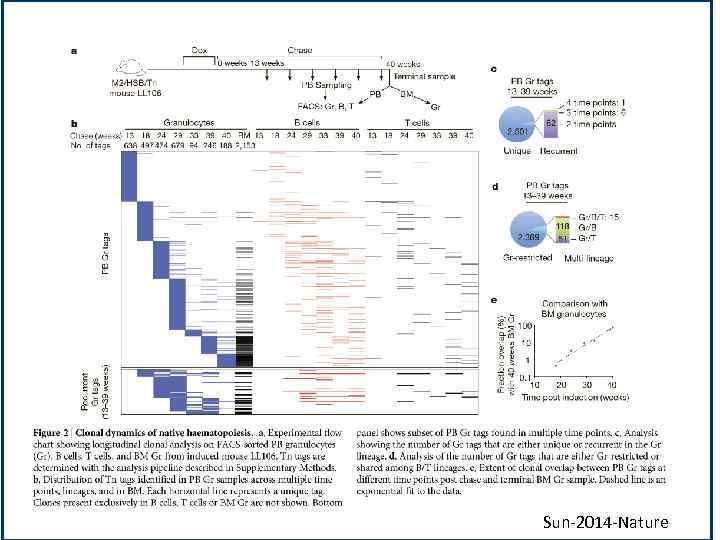
 Выводы • Авторы приходят к выводу о том, что клетки, которые обеспечивают поддержание кроветворения при равновесном гемопоезе, не относятся к пулу СКК. Они предполагают, что большое количество клеток-предшественников, в том числе и определенные ранее как МРР и являются основным источником постоянного кроветворения. Эти данные не исключают возможности того, что ССК начав пролиферировать и дифференцироваться выходят из пула СКК. • Необходимо изучить уменьшается ли число клонов СКК с течением времени. Lu-2014 -CSC
Выводы • Авторы приходят к выводу о том, что клетки, которые обеспечивают поддержание кроветворения при равновесном гемопоезе, не относятся к пулу СКК. Они предполагают, что большое количество клеток-предшественников, в том числе и определенные ранее как МРР и являются основным источником постоянного кроветворения. Эти данные не исключают возможности того, что ССК начав пролиферировать и дифференцироваться выходят из пула СКК. • Необходимо изучить уменьшается ли число клонов СКК с течением времени. Lu-2014 -CSC
 • • Клональные мутации в периферической крови Анализировали данные полно-экзомного секвенирования ДНК в клетках периферической крови у 12380 лиц, не отобранных по наличию рака или гематологических заболевакний. Были определены соматические мутации на основе необычных аллельных фракций. Использовали данные из Шведского национального общества, регистрирующего пациентов и отмечали заболевших в течение 2 - 7 лет людей после отбора проб ДНК. Клональное гемопоэз с соматическими мутациями наблюдалась у 10% людей старше 65 лет, но только в 1% от лиц моложе 50 лет. Соматические мутации часто наблюдаются в трех генах (Dnmt 3 a, ASXL 1 и TET 2), которые ранее были замешаны в гематологические раковые заболевания. Олигоклональный характер кроветворения сильныый фактор риска для последующего развития гематологических заболеваний. Примерно 42% лейкозов в этой когорте возникли у лиц, имевших клональность в момент отбора образцов ДНК, более чем за 6 месяцев до первого диагноза рака. Анализ костного мозга от двух пациентов с острым миелоидным лейкозом показал, что опухоль возникла из ранее обнаруженных клонов. Genoweae-2014 -NEJM • Проанализировали данные полно-экзомного секвенирования ДНК из клеток периферической крови 17182 человек, не отобранных по наличию рака или гематологических заболеваний. Были определены соматические мутации путем выявления однонуклеотидных замен и небольшие вставки или делеции в 160 генов. Наличие мутаций анализировалась для ассоциации с гематологическими фенотипами и сердечно-сосудистыми событиями. Обнаруживаемые соматические мутации были редки у лиц моложе 40 лет, но заметно взрастали по частоте с возрастом. Среди лиц от 70 до 79 лет, от 80 до 89 лет, и от 90 до 108 лет наблюдались клональные мутации в 9, 5% (219 из 2300 человек), 11, 7% (37 из 317) и 18, 4% (19 из 103), соответственно. Большинство мутаций произошли в трех генах: Dnmt 3 a, TET 2, и ASXL 1. Наличие соматической мутации было связано с увеличением риска гематологических заболеваний. • Jaiswal-2014 -NEJM
• • Клональные мутации в периферической крови Анализировали данные полно-экзомного секвенирования ДНК в клетках периферической крови у 12380 лиц, не отобранных по наличию рака или гематологических заболевакний. Были определены соматические мутации на основе необычных аллельных фракций. Использовали данные из Шведского национального общества, регистрирующего пациентов и отмечали заболевших в течение 2 - 7 лет людей после отбора проб ДНК. Клональное гемопоэз с соматическими мутациями наблюдалась у 10% людей старше 65 лет, но только в 1% от лиц моложе 50 лет. Соматические мутации часто наблюдаются в трех генах (Dnmt 3 a, ASXL 1 и TET 2), которые ранее были замешаны в гематологические раковые заболевания. Олигоклональный характер кроветворения сильныый фактор риска для последующего развития гематологических заболеваний. Примерно 42% лейкозов в этой когорте возникли у лиц, имевших клональность в момент отбора образцов ДНК, более чем за 6 месяцев до первого диагноза рака. Анализ костного мозга от двух пациентов с острым миелоидным лейкозом показал, что опухоль возникла из ранее обнаруженных клонов. Genoweae-2014 -NEJM • Проанализировали данные полно-экзомного секвенирования ДНК из клеток периферической крови 17182 человек, не отобранных по наличию рака или гематологических заболеваний. Были определены соматические мутации путем выявления однонуклеотидных замен и небольшие вставки или делеции в 160 генов. Наличие мутаций анализировалась для ассоциации с гематологическими фенотипами и сердечно-сосудистыми событиями. Обнаруживаемые соматические мутации были редки у лиц моложе 40 лет, но заметно взрастали по частоте с возрастом. Среди лиц от 70 до 79 лет, от 80 до 89 лет, и от 90 до 108 лет наблюдались клональные мутации в 9, 5% (219 из 2300 человек), 11, 7% (37 из 317) и 18, 4% (19 из 103), соответственно. Большинство мутаций произошли в трех генах: Dnmt 3 a, TET 2, и ASXL 1. Наличие соматической мутации было связано с увеличением риска гематологических заболеваний. • Jaiswal-2014 -NEJM
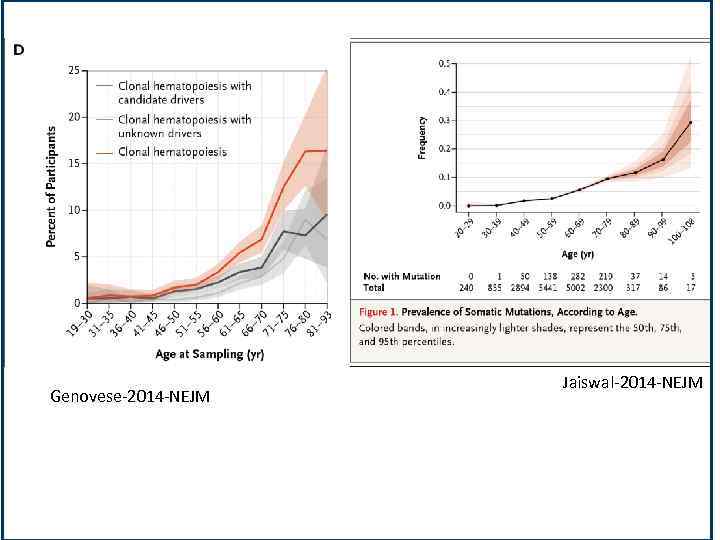 Genovese-2014 -NEJM Jaiswal-2014 -NEJM
Genovese-2014 -NEJM Jaiswal-2014 -NEJM
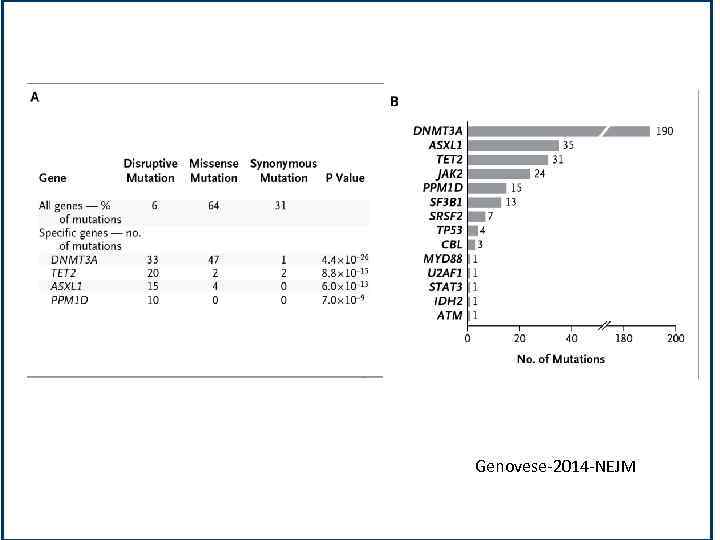 Genovese-2014 -NEJM
Genovese-2014 -NEJM
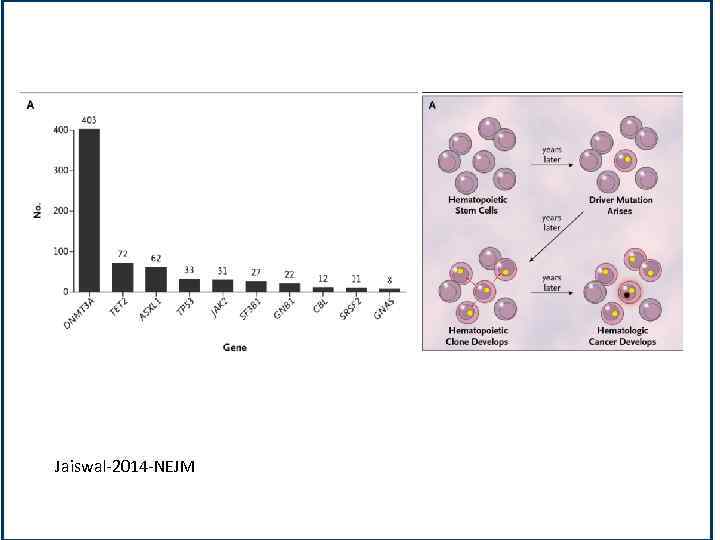 Jaiswal-2014 -NEJM
Jaiswal-2014 -NEJM
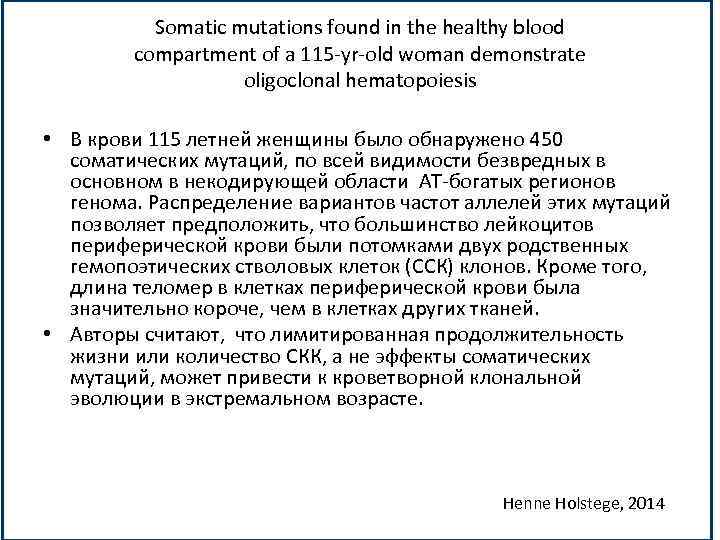 Somatic mutations found in the healthy blood compartment of a 115 -yr-old woman demonstrate oligoclonal hematopoiesis • В крови 115 летней женщины было обнаружено 450 соматических мутаций, по всей видимости безвредных в основном в некодирующей области АТ-богатых регионов генома. Распределение вариантов частот аллелей этих мутаций позволяет предположить, что большинство лейкоцитов периферической крови были потомками двух родственных гемопоэтических стволовых клеток (ССК) клонов. Кроме того, длина теломер в клетках периферической крови была значительно короче, чем в клетках других тканей. • Авторы считают, что лимитированная продолжительность жизни или количество СКК, а не эффекты соматических мутаций, может привести к кроветворной клональной эволюции в экстремальном возрасте. Henne Holstege, 2014
Somatic mutations found in the healthy blood compartment of a 115 -yr-old woman demonstrate oligoclonal hematopoiesis • В крови 115 летней женщины было обнаружено 450 соматических мутаций, по всей видимости безвредных в основном в некодирующей области АТ-богатых регионов генома. Распределение вариантов частот аллелей этих мутаций позволяет предположить, что большинство лейкоцитов периферической крови были потомками двух родственных гемопоэтических стволовых клеток (ССК) клонов. Кроме того, длина теломер в клетках периферической крови была значительно короче, чем в клетках других тканей. • Авторы считают, что лимитированная продолжительность жизни или количество СКК, а не эффекты соматических мутаций, может привести к кроветворной клональной эволюции в экстремальном возрасте. Henne Holstege, 2014
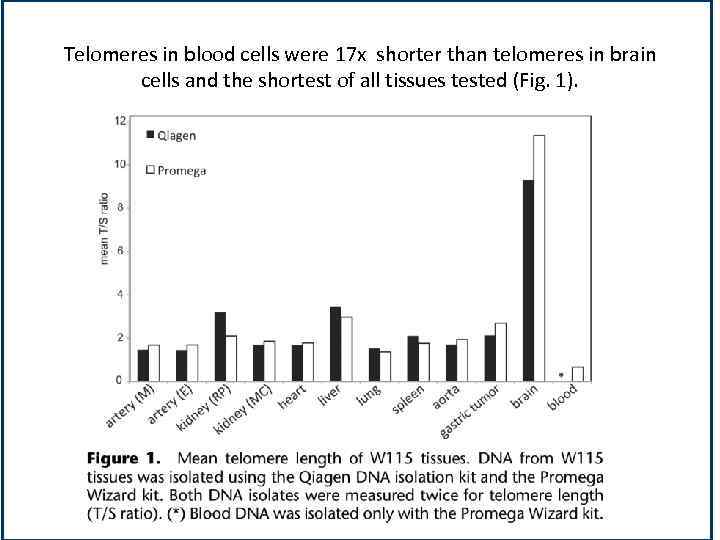 Telomeres in blood cells were 17 х shorter than telomeres in brain cells and the shortest of all tissues tested (Fig. 1).
Telomeres in blood cells were 17 х shorter than telomeres in brain cells and the shortest of all tissues tested (Fig. 1).
 • Идентифицированы 612 соматических мутаций в периферической крови, которые на были обнаружены в геноме мозга. • Авторы считают, что это новые мутации, связанные с возрастом.
• Идентифицированы 612 соматических мутаций в периферической крови, которые на были обнаружены в геноме мозга. • Авторы считают, что это новые мутации, связанные с возрастом.
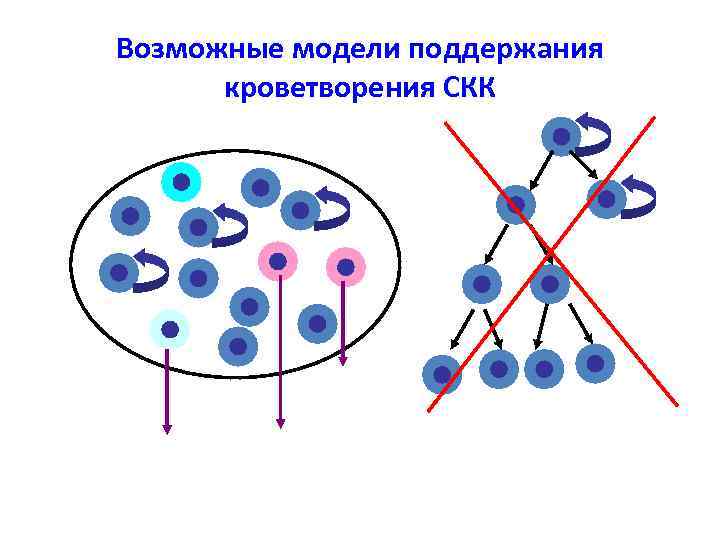 Возможные модели поддержания кроветворения СКК
Возможные модели поддержания кроветворения СКК


