1. хим связь. эл.эфф. сопряжение.pptx
- Количество слайдов: 71
 Кафедра химии Химическая связь, взаимное влияние атомов, электронные эффекты Минаева Нина Николаевна Хабаровск 2014
Кафедра химии Химическая связь, взаимное влияние атомов, электронные эффекты Минаева Нина Николаевна Хабаровск 2014
 Отыщи всему начало, и ты многое поймешь Козьма Прутков
Отыщи всему начало, и ты многое поймешь Козьма Прутков
 Химические свойства органических соединений обусловлены: -типом химических связей, -природой связываемых атомов и их взаимным влиянием в молекуле. Эти факторы, в свою очередь, определяются электронным строением атомов и взаимодействием их атомных орбиталей.
Химические свойства органических соединений обусловлены: -типом химических связей, -природой связываемых атомов и их взаимным влиянием в молекуле. Эти факторы, в свою очередь, определяются электронным строением атомов и взаимодействием их атомных орбиталей.
 В теоретической органической химии фундаментальными вопросами являются: «химическая связь» и «электронные эффекты» , позволяющие объяснить и предвидеть: -реакционную способность соединений, -направление реакций, их механизмы и особенности. Химическая связь Учение о химической связи –центральный вопрос современной химии. Химическая связь –способ соединения атомов в молекулы. А + В → А ––В + Е атом хим. связь в молекуле энергия химической связи Химическая связь имеет электронную природу –объединение атомов в молекулу осуществляется за счёт взаимодействия их электронов, – это характер распределения электронной плотности в молекуле.
В теоретической органической химии фундаментальными вопросами являются: «химическая связь» и «электронные эффекты» , позволяющие объяснить и предвидеть: -реакционную способность соединений, -направление реакций, их механизмы и особенности. Химическая связь Учение о химической связи –центральный вопрос современной химии. Химическая связь –способ соединения атомов в молекулы. А + В → А ––В + Е атом хим. связь в молекуле энергия химической связи Химическая связь имеет электронную природу –объединение атомов в молекулу осуществляется за счёт взаимодействия их электронов, – это характер распределения электронной плотности в молекуле.
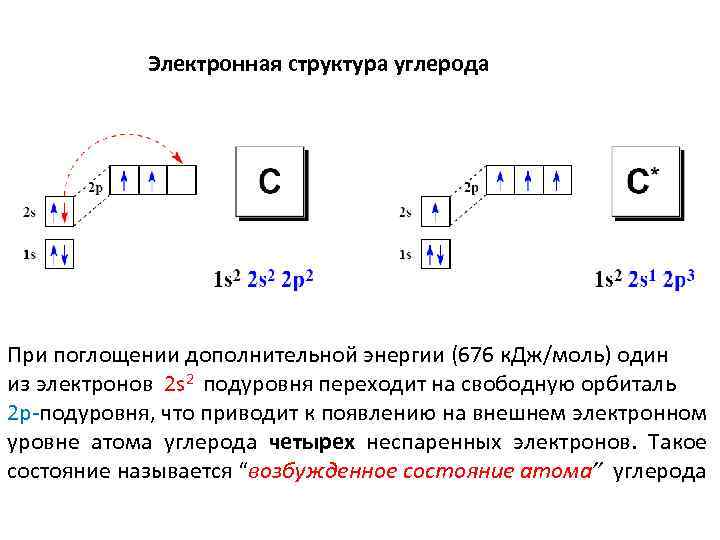 Электронная структура углерода С +6 ) ) 2 1 s 2 2 s 2 2 p 2 4 При поглощении дополнительной энергии (676 к. Дж/моль) один из электронов 2 s 2 подуровня переходит на свободную орбиталь 2 р-подуровня, что приводит к появлению на внешнем электронном уровне атома углерода четырех неспаренных электронов. Такое состояние называется “возбужденное состояние атома” углерода
Электронная структура углерода С +6 ) ) 2 1 s 2 2 s 2 2 p 2 4 При поглощении дополнительной энергии (676 к. Дж/моль) один из электронов 2 s 2 подуровня переходит на свободную орбиталь 2 р-подуровня, что приводит к появлению на внешнем электронном уровне атома углерода четырех неспаренных электронов. Такое состояние называется “возбужденное состояние атома” углерода
 В молекуле метана СН 4 - четыре σ-связи С–Н имеют: -одинаковую длину (0, 110 нм), -энергию (414 к. Дж/моль), -валентные углы между связями (109º 28‘) (хотя в образовании этих связей участвовали разные атомные орбитали возбужденного атома углерода: -одна s-орбиталь и три р-орбитали) Единственное объяснение симметричного строения молекулы метана - это предположение о перераспределении, усреднении, выравнивании электронной плотности, т. е. о гибридизации (смешении) орбиталей. Понятие гибридизации было ввел в 1931 г. Л. Полинг для объяснения геометрии молекул и фактических данных о длинах, энергиях связей, величинах валентных углов.
В молекуле метана СН 4 - четыре σ-связи С–Н имеют: -одинаковую длину (0, 110 нм), -энергию (414 к. Дж/моль), -валентные углы между связями (109º 28‘) (хотя в образовании этих связей участвовали разные атомные орбитали возбужденного атома углерода: -одна s-орбиталь и три р-орбитали) Единственное объяснение симметричного строения молекулы метана - это предположение о перераспределении, усреднении, выравнивании электронной плотности, т. е. о гибридизации (смешении) орбиталей. Понятие гибридизации было ввел в 1931 г. Л. Полинг для объяснения геометрии молекул и фактических данных о длинах, энергиях связей, величинах валентных углов.
 Сущность гибридизации в том, что из нескольких различных по форме, но близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Гибридные орбитали могут быть описаны как линейные комбинации s- и р–орбиталей. По форме гибридная орбиталь отличается как от исходных s- и рорбиталей предсталавяют собой несимметричную объемную восьмерку: s-орбиталь p-орбиталь исходные формы орбиталей гибридная орбиталь
Сущность гибридизации в том, что из нескольких различных по форме, но близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Гибридные орбитали могут быть описаны как линейные комбинации s- и р–орбиталей. По форме гибридная орбиталь отличается как от исходных s- и рорбиталей предсталавяют собой несимметричную объемную восьмерку: s-орбиталь p-орбиталь исходные формы орбиталей гибридная орбиталь
 Для атома углерода характерны три вида гибридизации (три валентных состояния) с участием s- и р-орбиталей: sp 3 -, sp 2 - и s- гибридизации и каждому из этих видов соответствует определенное валентное состояние.
Для атома углерода характерны три вида гибридизации (три валентных состояния) с участием s- и р-орбиталей: sp 3 -, sp 2 - и s- гибридизации и каждому из этих видов соответствует определенное валентное состояние.
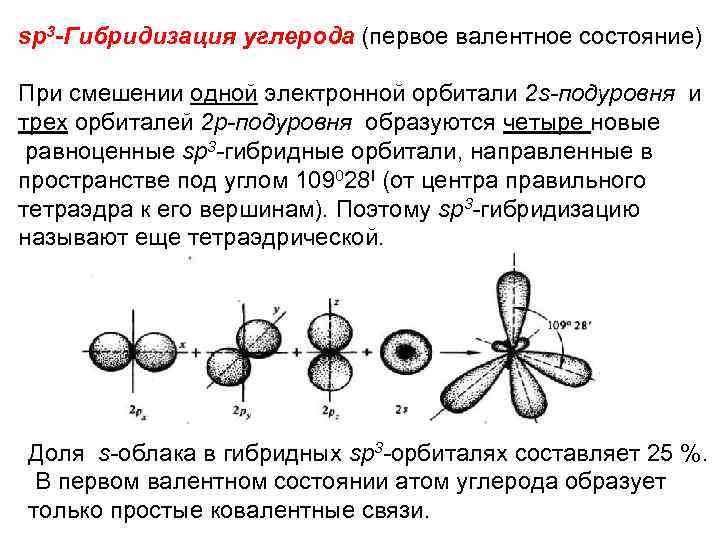 sp 3 -Гибридизация углерода (первое валентное состояние) При смешении одной электронной орбитали 2 s-подуровня и трех орбиталей 2 р-подуровня образуются четыре новые равноценные sp 3 -гибридные орбитали, направленные в пространстве под углом 109028 I (от центра правильного тетраэдра к его вершинам). Поэтому sp 3 -гибридизацию называют еще тетраэдрической. Доля s-облака в гибридных sp 3 -орбиталях составляет 25 %. В первом валентном состоянии атом углерода образует только простые ковалентные связи.
sp 3 -Гибридизация углерода (первое валентное состояние) При смешении одной электронной орбитали 2 s-подуровня и трех орбиталей 2 р-подуровня образуются четыре новые равноценные sp 3 -гибридные орбитали, направленные в пространстве под углом 109028 I (от центра правильного тетраэдра к его вершинам). Поэтому sp 3 -гибридизацию называют еще тетраэдрической. Доля s-облака в гибридных sp 3 -орбиталях составляет 25 %. В первом валентном состоянии атом углерода образует только простые ковалентные связи.
 sp 2 -Гибридизация углерода(второе валентное состояние) Состояние sp 2 -гибридизации – результат взаимодействия одной s- и двух р-орбиталей : → 2 s 2 px 2 py три sp 2 -гибридные орбитали Образованные три эквивалентные sp 2 -гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sp 2 гибридизация называется тригональной (плоскостной).
sp 2 -Гибридизация углерода(второе валентное состояние) Состояние sp 2 -гибридизации – результат взаимодействия одной s- и двух р-орбиталей : → 2 s 2 px 2 py три sp 2 -гибридные орбитали Образованные три эквивалентные sp 2 -гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sp 2 гибридизация называется тригональной (плоскостной).
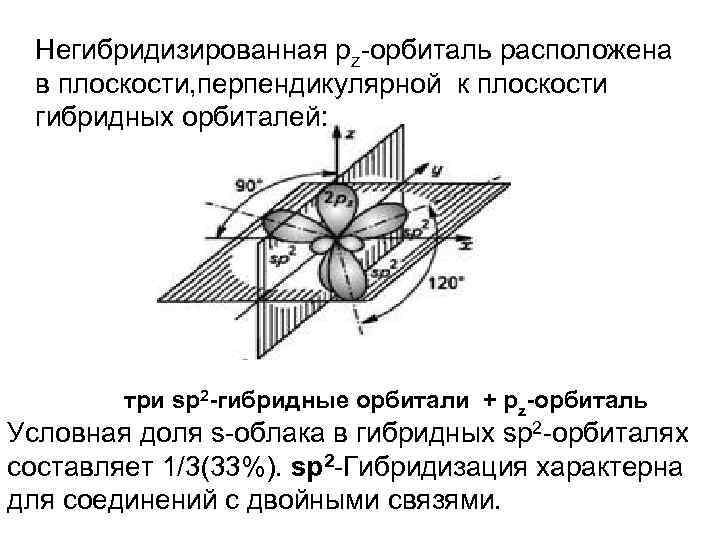 Негибридизированная рz-орбиталь расположена в плоскости, перпендикулярной к плоскости гибридных орбиталей: три sp 2 -гибридные орбитали + рz-орбиталь Условная доля s-облака в гибридных sp 2 -орбиталях составляет 1/3(33%). sp 2 -Гибридизация характерна для соединений с двойными связями.
Негибридизированная рz-орбиталь расположена в плоскости, перпендикулярной к плоскости гибридных орбиталей: три sp 2 -гибридные орбитали + рz-орбиталь Условная доля s-облака в гибридных sp 2 -орбиталях составляет 1/3(33%). sp 2 -Гибридизация характерна для соединений с двойными связями.
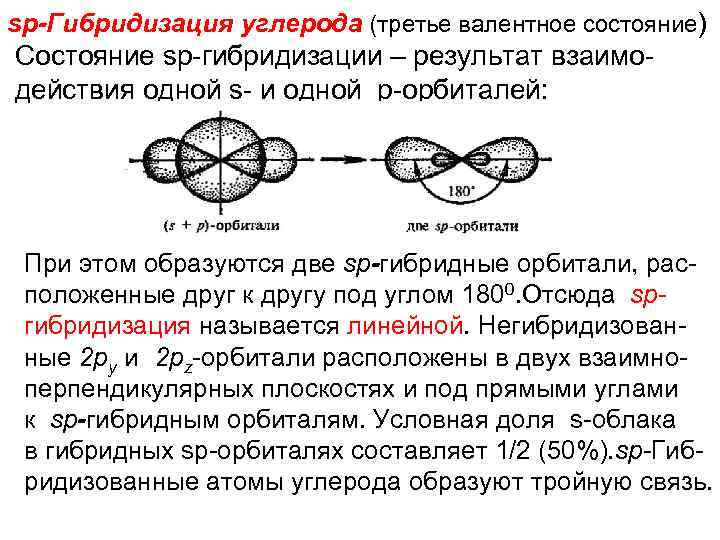 sp-Гибридизация углерода (третье валентное состояние) Состояние sp-гибридизации – результат взаимо действия одной s- и одной р-орбиталей: При этом образуются две sp-гибридные орбитали, расположенные друг к другу под углом 1800. Отсюда spгибридизация называется линейной. Негибридизованные 2 py и 2 pz-орбитали расположены в двух взаимноперпендикулярных плоскостях и под прямыми углами к sp-гибридным орбиталям. Условная доля s-облака в гибридных sp-орбиталях составляет 1/2 (50%). sp-Гибридизованные атомы углерода образуют тройную связь.
sp-Гибридизация углерода (третье валентное состояние) Состояние sp-гибридизации – результат взаимо действия одной s- и одной р-орбиталей: При этом образуются две sp-гибридные орбитали, расположенные друг к другу под углом 1800. Отсюда spгибридизация называется линейной. Негибридизованные 2 py и 2 pz-орбитали расположены в двух взаимноперпендикулярных плоскостях и под прямыми углами к sp-гибридным орбиталям. Условная доля s-облака в гибридных sp-орбиталях составляет 1/2 (50%). sp-Гибридизованные атомы углерода образуют тройную связь.
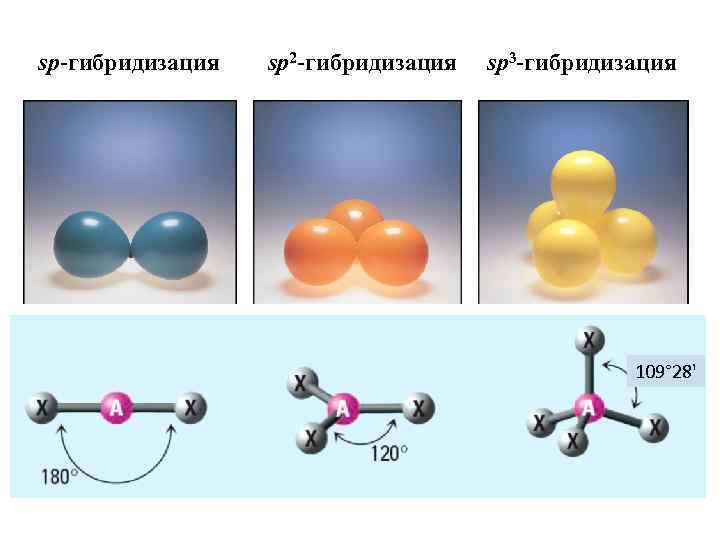 sp-гибридизация sp 2 -гибридизация sp 3 -гибридизация 109° 28'
sp-гибридизация sp 2 -гибридизация sp 3 -гибридизация 109° 28'
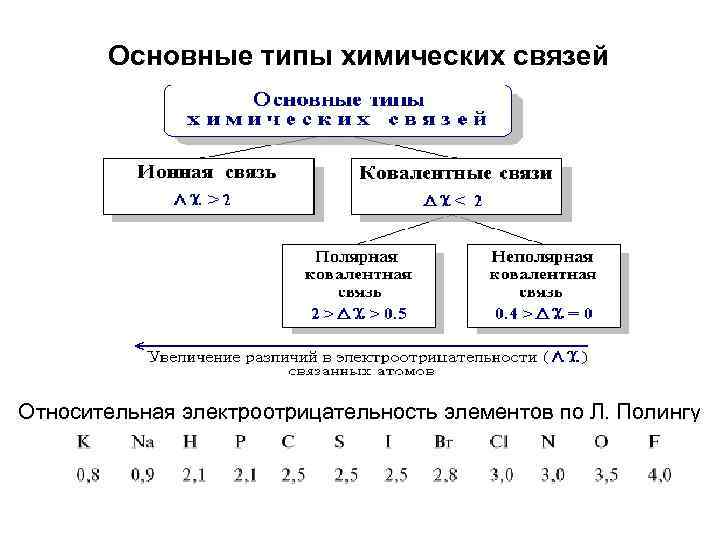 Основные типы химических связей Относительная электроотрицательность элементов по Л. Полингу
Основные типы химических связей Относительная электроотрицательность элементов по Л. Полингу
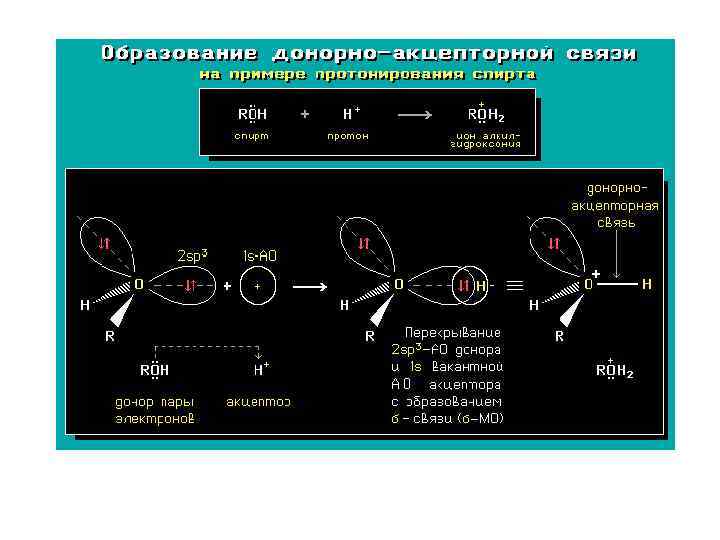
 КОВАЛЕНТНАЯ СВЯЗЬ является основным типом химической связи в орг. соединениях и образуется между атомами, равными или близкими по электроотрицательности атомами. Ковалентная связь – это химическая связь, осуществляемая за счет общих электронных пар между атомами. Ковалентная связь имеет два механизма образования – обменный и донорно-акцепторный. В обменном механизме общая электронная пара образуется за счет электронов каждого из атомов: А • + • B → A • • B В донорно-акцепторном механизме общая электронная пара образуется за счет неподеленной электронной пары атома - донора и вакантной орбитали другого атома–акцептора: A: + B → A • • B
КОВАЛЕНТНАЯ СВЯЗЬ является основным типом химической связи в орг. соединениях и образуется между атомами, равными или близкими по электроотрицательности атомами. Ковалентная связь – это химическая связь, осуществляемая за счет общих электронных пар между атомами. Ковалентная связь имеет два механизма образования – обменный и донорно-акцепторный. В обменном механизме общая электронная пара образуется за счет электронов каждого из атомов: А • + • B → A • • B В донорно-акцепторном механизме общая электронная пара образуется за счет неподеленной электронной пары атома - донора и вакантной орбитали другого атома–акцептора: A: + B → A • • B



 КОВАЛЕНТНАЯ СВЯЗЬ ХАРАКТЕРИЗУЕТСЯ: -длиной, -направленностью, -поляризуемостью, -энергией.
КОВАЛЕНТНАЯ СВЯЗЬ ХАРАКТЕРИЗУЕТСЯ: -длиной, -направленностью, -поляризуемостью, -энергией.
 ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ Энергия связи - это энергия, выделяющаяся при образовании связи или необходимая для разъединения двух связанных атомов. Это мера прочности связи: чем больше энергия, тем прочнее связь. Длина связи - это расстояние между центрами связанных атомов. Двойная связь короче одинарной, а тройная короче двойной. Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ Энергия связи - это энергия, выделяющаяся при образовании связи или необходимая для разъединения двух связанных атомов. Это мера прочности связи: чем больше энергия, тем прочнее связь. Длина связи - это расстояние между центрами связанных атомов. Двойная связь короче одинарной, а тройная короче двойной. Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
 Поляризуемость связи –это смещение электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер атомов. По поляризуемости π-связь значительно превосходит σ-связь, так как максимум электронной плотности π-связи располагается дальше от связываемых ядер. Поляризуемость в значительной мере определяет реакционную способность молекул по отношению к полярным реагентам.
Поляризуемость связи –это смещение электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер атомов. По поляризуемости π-связь значительно превосходит σ-связь, так как максимум электронной плотности π-связи располагается дальше от связываемых ядер. Поляризуемость в значительной мере определяет реакционную способность молекул по отношению к полярным реагентам.
 Полярность связи - это распределение электронной плотности между атомами (поляризация связи). Полярность молекулы количественно оценивают величиной ее дипольного момента. Чем больше дипольный момент, тем полярнее связь. Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3, 4· 10 -30 Кл·м). Причиной полярности связи служит различие в электроотрицательности связанных атомов.
Полярность связи - это распределение электронной плотности между атомами (поляризация связи). Полярность молекулы количественно оценивают величиной ее дипольного момента. Чем больше дипольный момент, тем полярнее связь. Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3, 4· 10 -30 Кл·м). Причиной полярности связи служит различие в электроотрицательности связанных атомов.
 Следует отличать понятия «поляризуемость» и «полярность» связи. Если полярность обусловлена различной электроотрицательностью связанных атомов, то поляризуемость определяется степенью подвижности электронов связи. Полярность — это статическое явление, а поляризуемость — динамическое. Поляризуемость не всегда согласуется с полярностью: полярность связи С-Hal в ряду С-F > С-Сl > С-Вг > С-I уменьшается, а ее поляризуемость, напротив, увеличивается.
Следует отличать понятия «поляризуемость» и «полярность» связи. Если полярность обусловлена различной электроотрицательностью связанных атомов, то поляризуемость определяется степенью подвижности электронов связи. Полярность — это статическое явление, а поляризуемость — динамическое. Поляризуемость не всегда согласуется с полярностью: полярность связи С-Hal в ряду С-F > С-Сl > С-Вг > С-I уменьшается, а ее поляризуемость, напротив, увеличивается.
 Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой δ (дельта). Смещение электронной плотности полярной σ-связи обозначают прямой стрелкой, полярной кратной связи - изогнутой стрелкой. Ковалентная связь, образованная атомами с одинаковой электроотрицательностью, неполярна, электронная плотность общей электронной пары не смещена ни к одному из атомов. Например, углерод-углеродные связи в этане, этилене, ацетилене. δ+ δ- Н 3 С – СН 3 Н 3 С → Сl Н 2 С = О неполярная связь полярные связи
Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой δ (дельта). Смещение электронной плотности полярной σ-связи обозначают прямой стрелкой, полярной кратной связи - изогнутой стрелкой. Ковалентная связь, образованная атомами с одинаковой электроотрицательностью, неполярна, электронная плотность общей электронной пары не смещена ни к одному из атомов. Например, углерод-углеродные связи в этане, этилене, ацетилене. δ+ δ- Н 3 С – СН 3 Н 3 С → Сl Н 2 С = О неполярная связь полярные связи
 Электроотрицательность характеризует способность атома в молекуле удерживать валентные электроны. С увеличением электроотри- цательности атома (шкала Полинга) возрастает степень смещения в его сторону электронов связи. Чем больше разность электроотрицательностей атомов, тем выше полярность связи. F > О > N, Cl 4, 0 3, 5 3, 0 > Br > Csp 2 > Csp 3 S > H 2, 8 2, 78 2, 69 2, 5 2, 2 Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра, вида гибридизации атомных орбиталй и влияния заместителей.
Электроотрицательность характеризует способность атома в молекуле удерживать валентные электроны. С увеличением электроотри- цательности атома (шкала Полинга) возрастает степень смещения в его сторону электронов связи. Чем больше разность электроотрицательностей атомов, тем выше полярность связи. F > О > N, Cl 4, 0 3, 5 3, 0 > Br > Csp 2 > Csp 3 S > H 2, 8 2, 78 2, 69 2, 5 2, 2 Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра, вида гибридизации атомных орбиталй и влияния заместителей.
 Лайнус Карл Полинг (1901— 1994) Американский химик и физик, общественный деятель. Главное научное достижение — учение о химической связи (1931— 1934). Разработал метод направленных валентных связей, представления о гибридизации и перекрывании атомных орбиталей, концепцию электроотрицательности атомов и частично-ионного характера связи. Его монография «Природа химической связи» (1939) является шедевром химической литературы. Создал (1931— 1933) теорию резонанса. В области биохимии высказал идею о спиральном строении полипептидной цепи. Изучал строение ДНК, антител, природу иммунологических реакций. Дважды лауреат Нобелевской премии: в области химии (1954) и борьбы против ядерных испытаний (1962).
Лайнус Карл Полинг (1901— 1994) Американский химик и физик, общественный деятель. Главное научное достижение — учение о химической связи (1931— 1934). Разработал метод направленных валентных связей, представления о гибридизации и перекрывании атомных орбиталей, концепцию электроотрицательности атомов и частично-ионного характера связи. Его монография «Природа химической связи» (1939) является шедевром химической литературы. Создал (1931— 1933) теорию резонанса. В области биохимии высказал идею о спиральном строении полипептидной цепи. Изучал строение ДНК, антител, природу иммунологических реакций. Дважды лауреат Нобелевской премии: в области химии (1954) и борьбы против ядерных испытаний (1962).
 ИОННАЯ СВЯЗЬ–химическая связь, образованная за счет электростатического притяжения противоположно заряженных ионов. Ионная связь образуется между атомами, которые отличаются электроотрицательностью (разность более 2): при этом один атом передает электроны другому атому, образуются катион и анион, взаимодействующие электростатически: 1ē A + B → A+ B атом катион анион Ионная связь не имеет определенного направления в пространстве. Характерные черты веществ с ионными связями – кристаллическое строение, высокие температуры кипения и плавления, растворимость в полярных растворителях.
ИОННАЯ СВЯЗЬ–химическая связь, образованная за счет электростатического притяжения противоположно заряженных ионов. Ионная связь образуется между атомами, которые отличаются электроотрицательностью (разность более 2): при этом один атом передает электроны другому атому, образуются катион и анион, взаимодействующие электростатически: 1ē A + B → A+ B атом катион анион Ионная связь не имеет определенного направления в пространстве. Характерные черты веществ с ионными связями – кристаллическое строение, высокие температуры кипения и плавления, растворимость в полярных растворителях.
 Образование ковалентных связей в органических молекулах В зависимости от способа перекрывания атомных орбиталей различают ковалентные связи двух типов: σ (сигма)- связи и π (пи)- связи. σ–Связи образуются в результате перекрывания двух различных атомных орбиталей – s-( p-, d-) и гибридных sp 3 -, sp 2 -, sp- вдоль линии, соединяющей ядра атомов (максимум перекрывания атомных орбиталей находится вдоль линии, соединяющей ядра; это –осевое перекрывание): Образование -связи
Образование ковалентных связей в органических молекулах В зависимости от способа перекрывания атомных орбиталей различают ковалентные связи двух типов: σ (сигма)- связи и π (пи)- связи. σ–Связи образуются в результате перекрывания двух различных атомных орбиталей – s-( p-, d-) и гибридных sp 3 -, sp 2 -, sp- вдоль линии, соединяющей ядра атомов (максимум перекрывания атомных орбиталей находится вдоль линии, соединяющей ядра; это –осевое перекрывание): Образование -связи
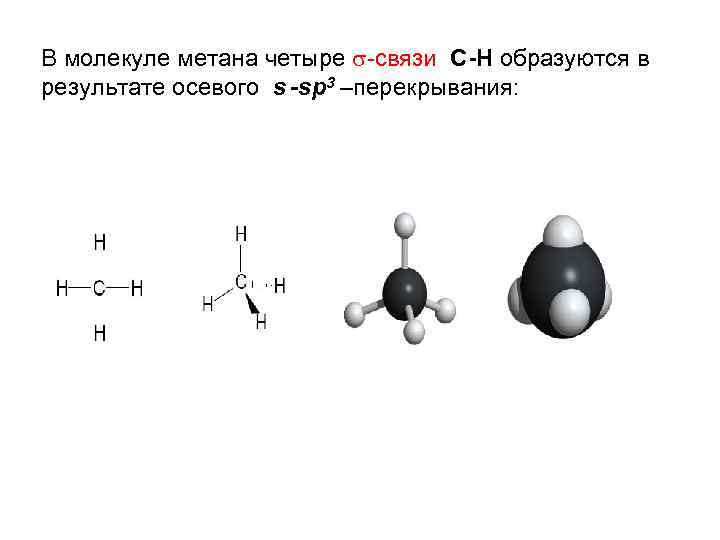 В молекуле метана четыре -связи С-Н образуются в результате осевого s -sp 3 –перекрывания:
В молекуле метана четыре -связи С-Н образуются в результате осевого s -sp 3 –перекрывания:
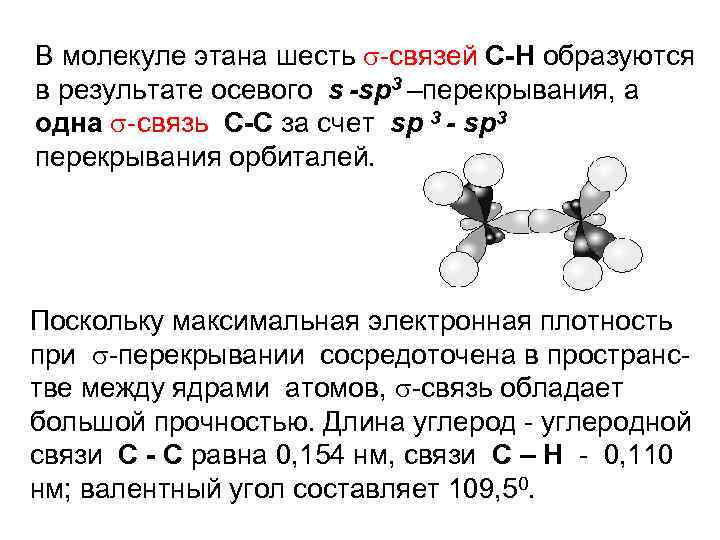 В молекуле этана шесть -связей С-Н образуются в результате осевого s -sp 3 –перекрывания, а одна -связь С-С за счет sp 3 - sp 3 перекрывания орбиталей. Поскольку максимальная электронная плотность при -перекрывании сосредоточена в пространс- тве между ядрами атомов, -связь обладает большой прочностью. Длина углерод - углеродной связи С - С равна 0, 154 нм, связи С – Н - 0, 110 нм; валентный угол составляет 109, 50.
В молекуле этана шесть -связей С-Н образуются в результате осевого s -sp 3 –перекрывания, а одна -связь С-С за счет sp 3 - sp 3 перекрывания орбиталей. Поскольку максимальная электронная плотность при -перекрывании сосредоточена в пространс- тве между ядрами атомов, -связь обладает большой прочностью. Длина углерод - углеродной связи С - С равна 0, 154 нм, связи С – Н - 0, 110 нм; валентный угол составляет 109, 50.
 π-Связь –такой вид ковалентной связи, когда максимум перекрывания атомных орбиталей находится вне линии, соединяющей ядра. Это–боковое перекрывание. Электроны, принимающие участие в образовании π-связи, часто называют π-электронами. Образование π-связи π-Связи образуются негибридизованными р -орбиталями соединяющихся атомов
π-Связь –такой вид ковалентной связи, когда максимум перекрывания атомных орбиталей находится вне линии, соединяющей ядра. Это–боковое перекрывание. Электроны, принимающие участие в образовании π-связи, часто называют π-электронами. Образование π-связи π-Связи образуются негибридизованными р -орбиталями соединяющихся атомов

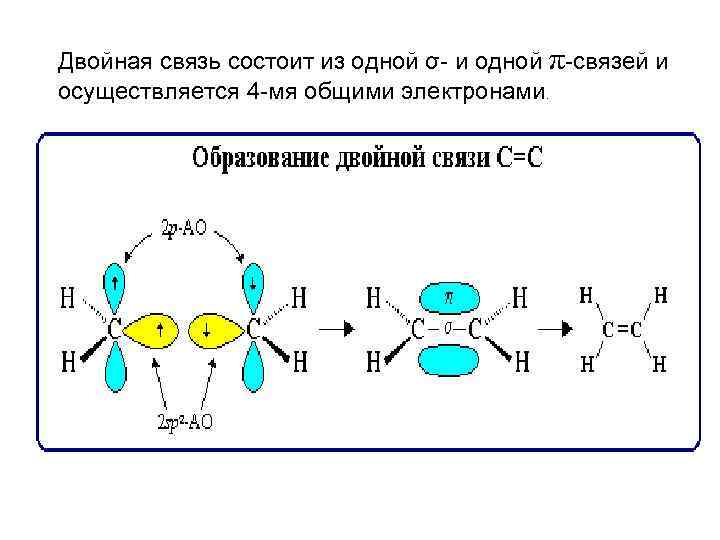 Двойная связь состоит из одной σ- и одной π-связей и осуществляется 4 -мя общими электронами.
Двойная связь состоит из одной σ- и одной π-связей и осуществляется 4 -мя общими электронами.
 В молекуле этилена между атомами углерода имеется одна π-связь, для которой каждый атом углерода предоставляет одну негибридизованную р-орбиталь. Три другие орбитали (s+p+p) каждый атом углерода предоставляет для образования σсвязей, тип гибридизации sp 2.
В молекуле этилена между атомами углерода имеется одна π-связь, для которой каждый атом углерода предоставляет одну негибридизованную р-орбиталь. Три другие орбитали (s+p+p) каждый атом углерода предоставляет для образования σсвязей, тип гибридизации sp 2.
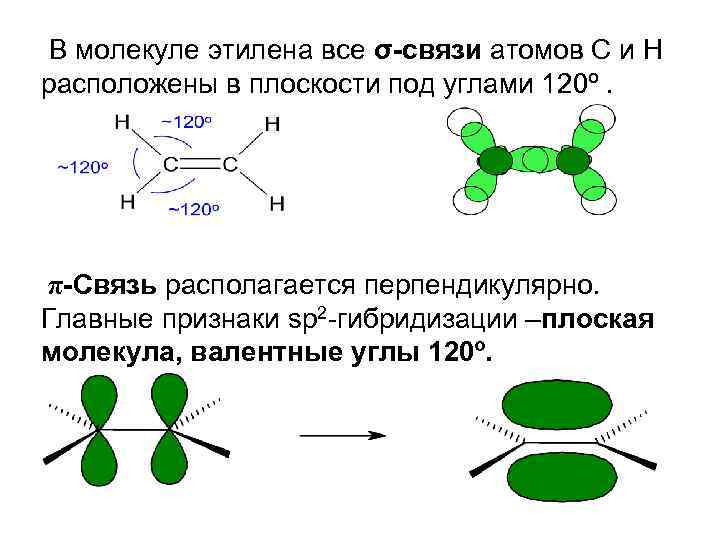 В молекуле этилена все σ-связи атомов С и Н расположены в плоскости под углами 120º. π-Связь располагается перпендикулярно. Главные признаки sp 2 -гибридизации –плоская молекула, валентные углы 120º.
В молекуле этилена все σ-связи атомов С и Н расположены в плоскости под углами 120º. π-Связь располагается перпендикулярно. Главные признаки sp 2 -гибридизации –плоская молекула, валентные углы 120º.
 Модель этилена
Модель этилена
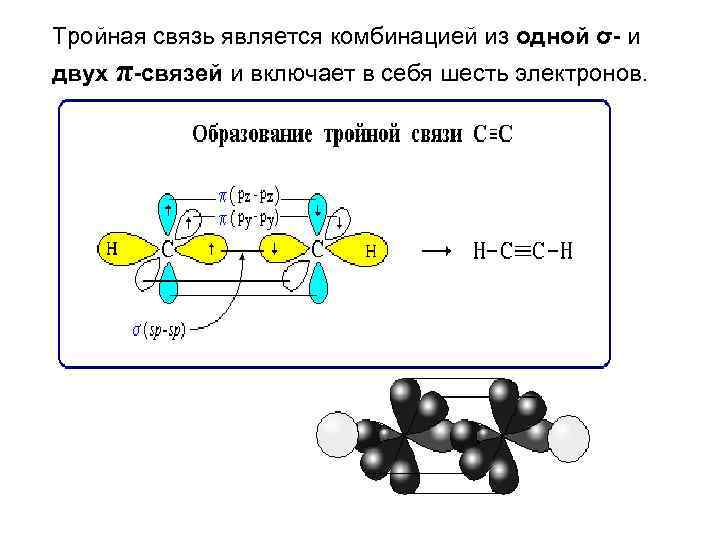 Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
 Характеристики ковалентных связей
Характеристики ковалентных связей
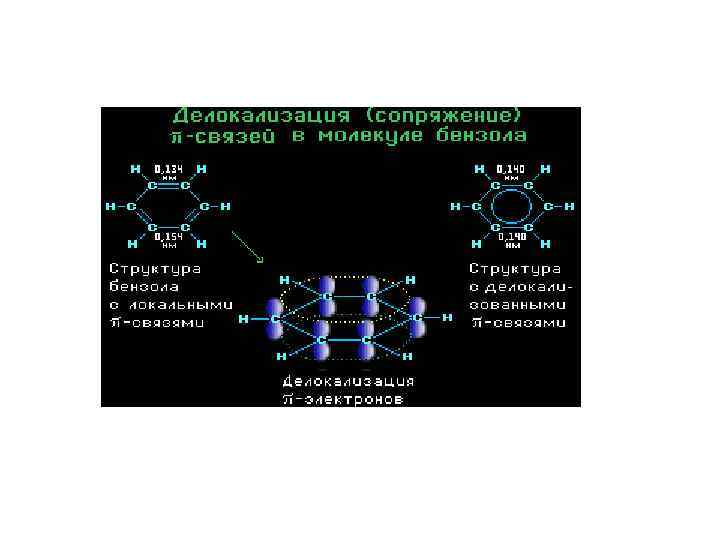
 СОПРЯЖЕНИЕ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Ковалентная -связь может быть локализованной и делокализованной. Локализованной ( «местная» )называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов. Делокализованная ( «размытая» ) связь характерна для опряженных систем. Если в молекулах присутствуют две двойные связи (или более) разделенные одной одинарной связью или у атома, соседнего с двойной связью, имеется р-орбиталь, то р-орбитали соседних атомов мо- гут перекрываться друг с другом, образуя общую -электронную систему. Такая система называется сопряженной
СОПРЯЖЕНИЕ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Ковалентная -связь может быть локализованной и делокализованной. Локализованной ( «местная» )называется двойная связь, в которой электронная плотность -связи охватывает только два ядра связываемых атомов. Делокализованная ( «размытая» ) связь характерна для опряженных систем. Если в молекулах присутствуют две двойные связи (или более) разделенные одной одинарной связью или у атома, соседнего с двойной связью, имеется р-орбиталь, то р-орбитали соседних атомов мо- гут перекрываться друг с другом, образуя общую -электронную систему. Такая система называется сопряженной
 Сопряжение (мезомерия, от греч. mesos-средний) – явление выравнивания, делокализации связей в молекуле, частице. Выравнивание электронной плотности происходит по всей цепи сопряжения, без затухания. Сопряженные системы в большинстве случаев содержат - связь. Известно два вида сопряженных систем: – , - сопряженные систем, состоящие из чередую щихся простых и кратных связей (= ─ = и т. д. ); -p, - сопряженные системы, состоящие из кратной связи, отделенной одной - связью от соседнего ● ● атома с неподеленной парой р-электронов (= ─ Х ). Сопряженные системы делятся на системы с открытой и замкнутой цепью сопряжения
Сопряжение (мезомерия, от греч. mesos-средний) – явление выравнивания, делокализации связей в молекуле, частице. Выравнивание электронной плотности происходит по всей цепи сопряжения, без затухания. Сопряженные системы в большинстве случаев содержат - связь. Известно два вида сопряженных систем: – , - сопряженные систем, состоящие из чередую щихся простых и кратных связей (= ─ = и т. д. ); -p, - сопряженные системы, состоящие из кратной связи, отделенной одной - связью от соседнего ● ● атома с неподеленной парой р-электронов (= ─ Х ). Сопряженные системы делятся на системы с открытой и замкнутой цепью сопряжения
 Открытые , -сопряженные системы , - сопряжение в бутадиене 1 1 2 3 4 Сопряженная 4π-электронная система Образование , - сопряженной системы в молекуле бутадиена-1, 3: бутадиен-1, 3; перекрывание р-атомных орбиталей в молекуле бутадиена-1, 3; делокализованная -молекулярная орбиталь; длина С-С связей
Открытые , -сопряженные системы , - сопряжение в бутадиене 1 1 2 3 4 Сопряженная 4π-электронная система Образование , - сопряженной системы в молекуле бутадиена-1, 3: бутадиен-1, 3; перекрывание р-атомных орбиталей в молекуле бутадиена-1, 3; делокализованная -молекулярная орбиталь; длина С-С связей
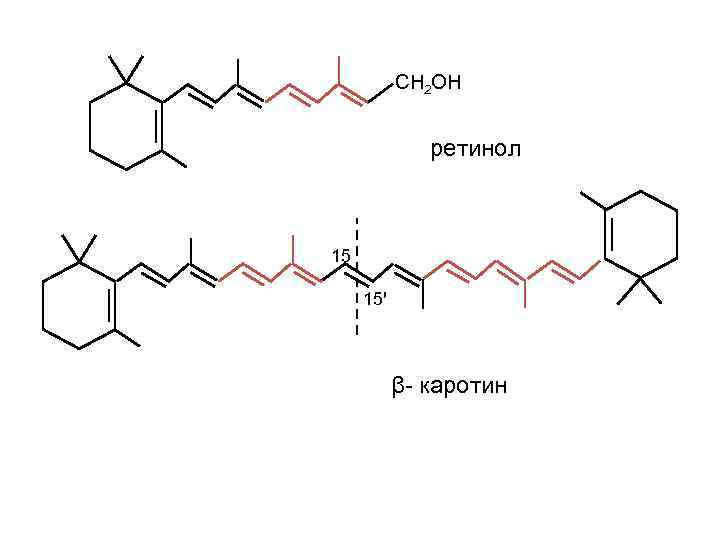 СН 2 ОН ретинол 15 15ꞌ β- каротин
СН 2 ОН ретинол 15 15ꞌ β- каротин
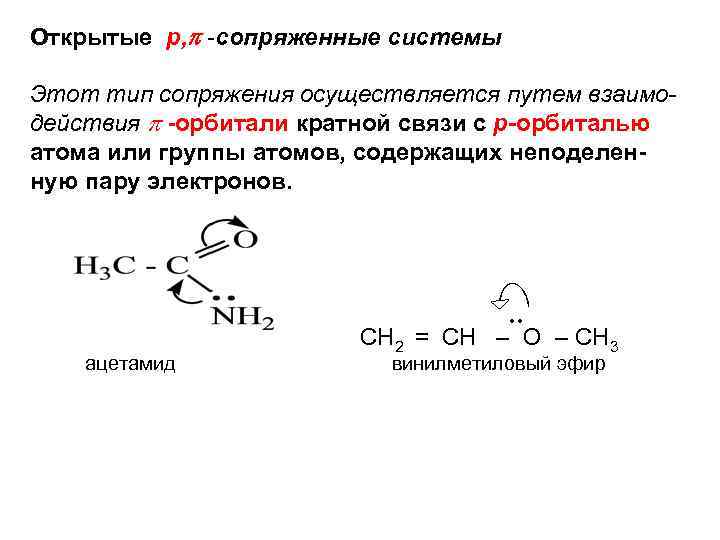 Открытые p, -сопряженные системы Этот тип сопряжения осуществляется путем взаимодействия -орбитали кратной связи с р-орбиталью атома или группы атомов, содержащих неподеленную пару электронов. ●● СН 2 = СН – О – СН 3 ацетамид винилметиловый эфир
Открытые p, -сопряженные системы Этот тип сопряжения осуществляется путем взаимодействия -орбитали кратной связи с р-орбиталью атома или группы атомов, содержащих неподеленную пару электронов. ●● СН 2 = СН – О – СН 3 ацетамид винилметиловый эфир
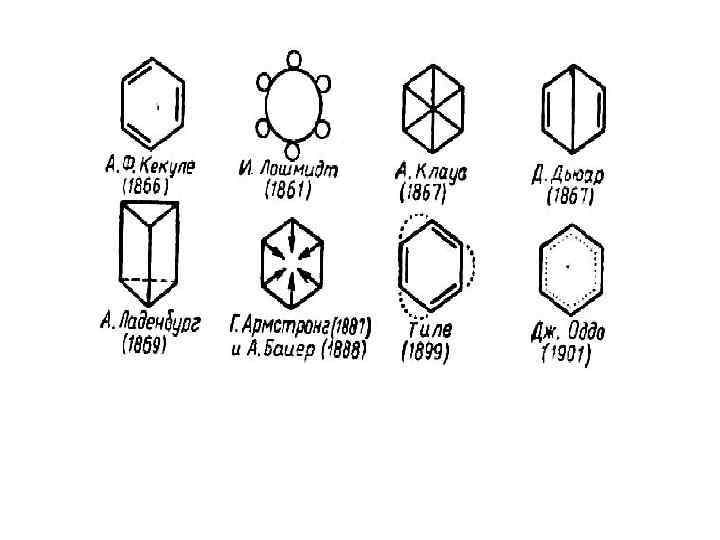
 Замкнутые , -, и р, - сопряженные системы Наибольший интерес представляют ароматические углеводороды (арены и их производные) и гетероциклические соединения с , - или p, сопряженными системами. Простейшим представителем этой группы веществ является бензол. В 1866 г. А. Кекуле предложил знаменитую формулу бензола:
Замкнутые , -, и р, - сопряженные системы Наибольший интерес представляют ароматические углеводороды (арены и их производные) и гетероциклические соединения с , - или p, сопряженными системами. Простейшим представителем этой группы веществ является бензол. В 1866 г. А. Кекуле предложил знаменитую формулу бензола:
 Кекуле (Kekule) Фридрих Август (1829 -96), немецкий химик-органик, иностранный член-корреспондент Петербургской АН (1887). Труды по теории строения органических соединений. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола.
Кекуле (Kekule) Фридрих Август (1829 -96), немецкий химик-органик, иностранный член-корреспондент Петербургской АН (1887). Труды по теории строения органических соединений. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола.
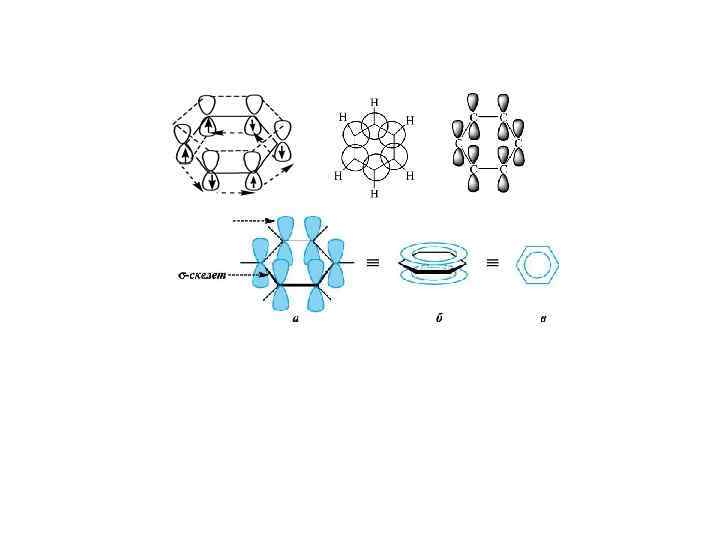
 Критерии ароматичности были установлены Хюккелем в 1931 году и получили название правило Хюккеля. Система ароматична, если она обладает совокупностью следующих признаков: 1. все атомы в цикле находятся в sр2 -гибридизации (следовательно -скелет плоскостной); 2. молекула имеет циклическую систему сопряжения; в котром участвует (4 n+2) р-электрона, где n — целое число (n = 0, 1, 2, 3, 4. . . ). 3. Характерны реакции электрофильного замещения, а не присоединения. Бензол отвечает правилу Хюккеля при n = 1, т. е. в сопряжении участвует 6 р-электронов.
Критерии ароматичности были установлены Хюккелем в 1931 году и получили название правило Хюккеля. Система ароматична, если она обладает совокупностью следующих признаков: 1. все атомы в цикле находятся в sр2 -гибридизации (следовательно -скелет плоскостной); 2. молекула имеет циклическую систему сопряжения; в котром участвует (4 n+2) р-электрона, где n — целое число (n = 0, 1, 2, 3, 4. . . ). 3. Характерны реакции электрофильного замещения, а не присоединения. Бензол отвечает правилу Хюккеля при n = 1, т. е. в сопряжении участвует 6 р-электронов.
 Эрих Арманд Артур Йозеф Хюккель (1896— 1980) Немецкий физик и химик-теоретик. Ученик П. Й. В. Дебая. Основное научное направление — разработка квантово-химических методов изучения строения молекул. Объяснил (1929— 1930) природу связи в ненасыщенных и ароматических соединениях. Выдвинул (1930) объяснение устойчивости ароматического секстета на основе метода молекулярных орбиталей (правило Хюккеля).
Эрих Арманд Артур Йозеф Хюккель (1896— 1980) Немецкий физик и химик-теоретик. Ученик П. Й. В. Дебая. Основное научное направление — разработка квантово-химических методов изучения строения молекул. Объяснил (1929— 1930) природу связи в ненасыщенных и ароматических соединениях. Выдвинул (1930) объяснение устойчивости ароматического секстета на основе метода молекулярных орбиталей (правило Хюккеля).
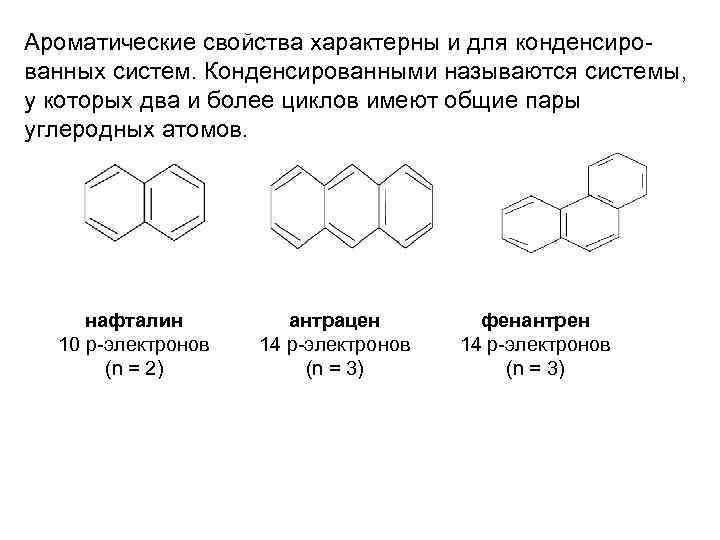 Ароматические свойства характерны и для конденсированных систем. Конденсированными называются системы, у которых два и более циклов имеют общие пары углеродных атомов. нафталин 10 р-электронов (n = 2) антрацен 14 р-электронов (n = 3) фенантрен 14 р-электронов (n = 3)
Ароматические свойства характерны и для конденсированных систем. Конденсированными называются системы, у которых два и более циклов имеют общие пары углеродных атомов. нафталин 10 р-электронов (n = 2) антрацен 14 р-электронов (n = 3) фенантрен 14 р-электронов (n = 3)
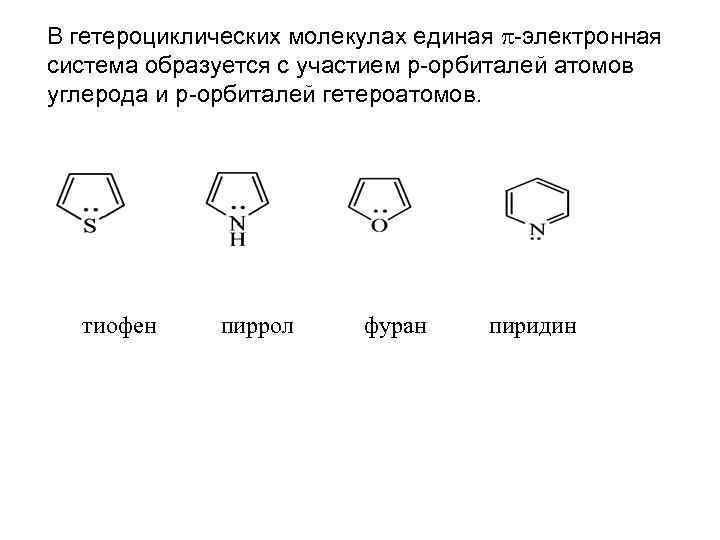 В гетероциклических молекулах единая -электронная система образуется с участием р-орбиталей атомов углерода и р-орбиталей гетероатомов. тиофен пиррол фуран пиридин
В гетероциклических молекулах единая -электронная система образуется с участием р-орбиталей атомов углерода и р-орбиталей гетероатомов. тиофен пиррол фуран пиридин

 Ароматические свойства пиридина ь все атомы цикла sp 2–гибридизованы ь цикл плоский ь замкнутая сопряженная система π-π типа ь количество ē удовлетворяет правилу Хюккеля 4 n+2, где n-целое число 4 n+2=6; 4 n=6 -2=4; n=1
Ароматические свойства пиридина ь все атомы цикла sp 2–гибридизованы ь цикл плоский ь замкнутая сопряженная система π-π типа ь количество ē удовлетворяет правилу Хюккеля 4 n+2, где n-целое число 4 n+2=6; 4 n=6 -2=4; n=1
 ∙ ∙ ∙ бензол ∙ ∙ N ∙ ∙ ∙ пиридин ∙ ∙∙ ∙∙ N Н пиррол ∙ ∙∙ N Н Эта электронная пара не участвует в сопряжении
∙ ∙ ∙ бензол ∙ ∙ N ∙ ∙ ∙ пиридин ∙ ∙∙ ∙∙ N Н пиррол ∙ ∙∙ N Н Эта электронная пара не участвует в сопряжении
 Электронные эффекты в органических молекулах Электронные эффекты – смещение, перераспределение электронной плотности в молекуле. Электронные эффекты характеризуют способность заместителей передавать свое влияние по цепи ковалентно связанных атомов, что приводит к поляризации связей и перераспределению электронной плотности. В зависимости от строения молекулы, проявляется два вида электронных эффектов: 1. ИНДУКТИВНЫЙ ( +, -J) 2. МЕЗОМЕРНЫЙ (+, -M)
Электронные эффекты в органических молекулах Электронные эффекты – смещение, перераспределение электронной плотности в молекуле. Электронные эффекты характеризуют способность заместителей передавать свое влияние по цепи ковалентно связанных атомов, что приводит к поляризации связей и перераспределению электронной плотности. В зависимости от строения молекулы, проявляется два вида электронных эффектов: 1. ИНДУКТИВНЫЙ ( +, -J) 2. МЕЗОМЕРНЫЙ (+, -M)
 Индуктивным (индукционным) эффектом называется смещение электронной плотности в молекуле вдоль σ-связи под влиянием заместителя. (Индуктивный эффект –передача электронного влияния заместителя по цепи σ-связей. ) В основе проявления индуктивного эффекта лежит разная электроотрицательность атомов (шкала Полинга), участвующих в образования химической связи: F > О > N, Cl 4, 0 3, 5 3, 0 > Br > Csp 2 > Csp 3 S > H 2, 8 2, 78 2, 69 2, 5 2, 2 Индуктивный эффект (I) показывается в формулах прямой стрелкой, указывающей направление смещения электронов.
Индуктивным (индукционным) эффектом называется смещение электронной плотности в молекуле вдоль σ-связи под влиянием заместителя. (Индуктивный эффект –передача электронного влияния заместителя по цепи σ-связей. ) В основе проявления индуктивного эффекта лежит разная электроотрицательность атомов (шкала Полинга), участвующих в образования химической связи: F > О > N, Cl 4, 0 3, 5 3, 0 > Br > Csp 2 > Csp 3 S > H 2, 8 2, 78 2, 69 2, 5 2, 2 Индуктивный эффект (I) показывается в формулах прямой стрелкой, указывающей направление смещения электронов.
 В молекуле СН 3 ОН метанола группа –ОН, содержащая атом кислорода и обладающая высокой электроотрицательностью, проявляет отрицательный индуктивный эффект и является электроноакцепторным заместителем: δ+ δ- Н 3 С → OH метанол -Ј-ОН (ЭА)
В молекуле СН 3 ОН метанола группа –ОН, содержащая атом кислорода и обладающая высокой электроотрицательностью, проявляет отрицательный индуктивный эффект и является электроноакцепторным заместителем: δ+ δ- Н 3 С → OH метанол -Ј-ОН (ЭА)
 Индуктивный эффект заместителя распространяется на несколько близлежащих атомов углеродной цепи. По цепи σ-связей индуктивный эффект передается с затуханием (быстро гаснет). Наиболее сильно действие эффекта проявляется на α-углеродном (ближайшем) атоме цепи по отношению к заместителю. Затем, из-за слабой поляризуемости σ-связи, эффект затухает и к четвертому углеродному атому его действие прекращается. +δ 3 +δ 2 +δ 1 +δCH 3–CH 2 → CH 2→ Cl α 1–хлорпентан δ 1+> δ 2+>δ 3+
Индуктивный эффект заместителя распространяется на несколько близлежащих атомов углеродной цепи. По цепи σ-связей индуктивный эффект передается с затуханием (быстро гаснет). Наиболее сильно действие эффекта проявляется на α-углеродном (ближайшем) атоме цепи по отношению к заместителю. Затем, из-за слабой поляризуемости σ-связи, эффект затухает и к четвертому углеродному атому его действие прекращается. +δ 3 +δ 2 +δ 1 +δCH 3–CH 2 → CH 2→ Cl α 1–хлорпентан δ 1+> δ 2+>δ 3+
 Заместители, смещающие электронную плотность от себя, проявляют положительный индуктивный эффект (+I) Все алкильные радикалы обладают положительным индуктивным эффектом. В результате индуктивного эффекта может поляризоваться и -связь. э. о sp 3 C < э. о sp 2 C , +ICH 3 , Метильный радикал- электронодонорный заместитель Поляризация -связи обозначается изогнутой стрелкой
Заместители, смещающие электронную плотность от себя, проявляют положительный индуктивный эффект (+I) Все алкильные радикалы обладают положительным индуктивным эффектом. В результате индуктивного эффекта может поляризоваться и -связь. э. о sp 3 C < э. о sp 2 C , +ICH 3 , Метильный радикал- электронодонорный заместитель Поляризация -связи обозначается изогнутой стрелкой
 Мезомерный эффект- это перераспределение электронной плотности в молекуле с участием π-связей (Мезомерный эффект–передача электронного влияния заместителей в сопряженной (делокализованной) системе. ) Мезомерный эффект обозначается +, -M и показывается в формулах изогнутой стрелкой, указывающей направление смещения электронов. Мезомерный эффект проявляют только те заместители, которые вступают в - - или р- -сопряжение с кратной связью молекулы.
Мезомерный эффект- это перераспределение электронной плотности в молекуле с участием π-связей (Мезомерный эффект–передача электронного влияния заместителей в сопряженной (делокализованной) системе. ) Мезомерный эффект обозначается +, -M и показывается в формулах изогнутой стрелкой, указывающей направление смещения электронов. Мезомерный эффект проявляют только те заместители, которые вступают в - - или р- -сопряжение с кратной связью молекулы.
 Если заместитель вступает в , -сопряжение, то электронная плотность сопряженной системы будет смещаться в сторону более электроотрицательного атома -связи заместителя, который при этом будет проявлять отрицательный мезомерный эффект.
Если заместитель вступает в , -сопряжение, то электронная плотность сопряженной системы будет смещаться в сторону более электроотрицательного атома -связи заместителя, который при этом будет проявлять отрицательный мезомерный эффект.
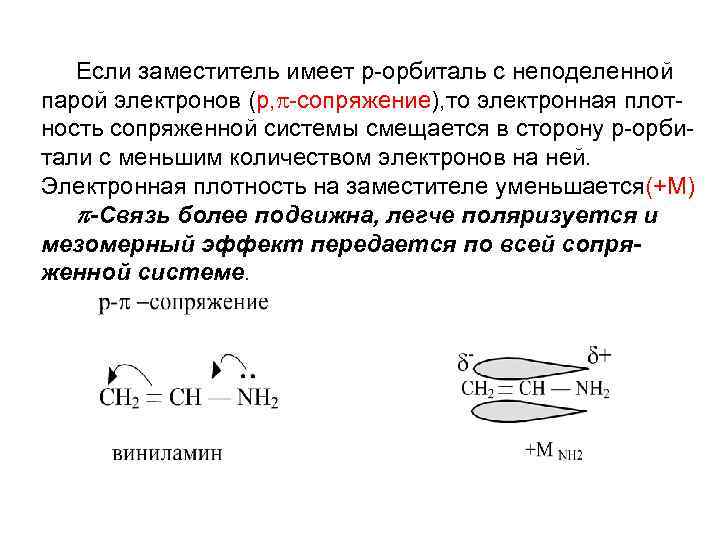 Если заместитель имеет р-орбиталь с неподеленной парой электронов (р, -сопряжение), то электронная плотность сопряженной системы смещается в сторону р-орбитали с меньшим количеством электронов на ней. Электронная плотность на заместителе уменьшается(+М) -Связь более подвижна, легче поляризуется и мезомерный эффект передается по всей сопряженной системе.
Если заместитель имеет р-орбиталь с неподеленной парой электронов (р, -сопряжение), то электронная плотность сопряженной системы смещается в сторону р-орбитали с меньшим количеством электронов на ней. Электронная плотность на заместителе уменьшается(+М) -Связь более подвижна, легче поляризуется и мезомерный эффект передается по всей сопряженной системе.
 Заместители, понижающие электронную плотность в сопряженной системе (смещающие ее на себя), проявляют отрицательный мезомерный эффект (-М). К ним относятся заместители, содержащие кратные связи с кислородом - CH=O, -COOH, -NO 2… Заместители, повышающие электронную плотность в сопряженной системе (смещающие от себя) проявляют положительный мезомерный эффект (+М). К ним относятся, в первую очередь, гетероатомы (галогены) или группы атомов, такие как аминогруппа, гидроксильная группа и др. В молекулах органических соединений электронные эффекты заместителей могут действовать либо согласо ванно, либо в противоположных направлениях. При оценке влияния заместителя на распределение электронной плотности в молекуле необходимо учитывать результирующее действие электронных эффектов.
Заместители, понижающие электронную плотность в сопряженной системе (смещающие ее на себя), проявляют отрицательный мезомерный эффект (-М). К ним относятся заместители, содержащие кратные связи с кислородом - CH=O, -COOH, -NO 2… Заместители, повышающие электронную плотность в сопряженной системе (смещающие от себя) проявляют положительный мезомерный эффект (+М). К ним относятся, в первую очередь, гетероатомы (галогены) или группы атомов, такие как аминогруппа, гидроксильная группа и др. В молекулах органических соединений электронные эффекты заместителей могут действовать либо согласо ванно, либо в противоположных направлениях. При оценке влияния заместителя на распределение электронной плотности в молекуле необходимо учитывать результирующее действие электронных эффектов.
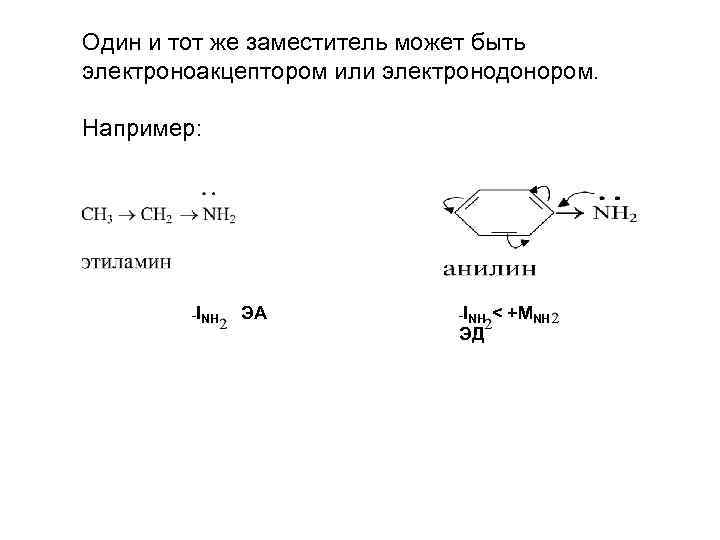 Один и тот же заместитель может быть электроноакцептором или электронодонором. Например: -INH ЭА -INH ЭД < +МNH
Один и тот же заместитель может быть электроноакцептором или электронодонором. Например: -INH ЭА -INH ЭД < +МNH
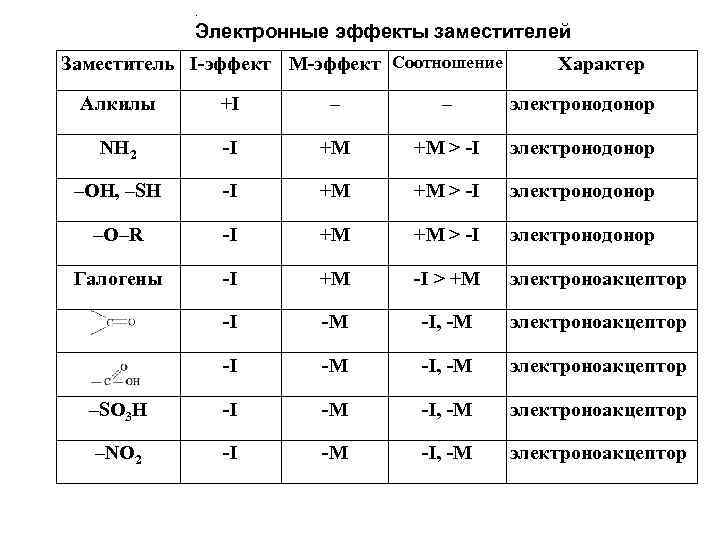 . Электронные эффекты заместителей Заместитель I-эффект M-эффект Соотношение Характер Алкилы +I – – электронодонор NH 2 -I +M +M > -I электронодонор –OH, –SH -I +M +M > -I электронодонор –O–R -I +M +M > -I электронодонор Галогены -I +M -I > +M электроноакцептор -I -M -I, -M электроноакцептор –SО 3 Н -I -M -I, -M электроноакцептор –NО 2 -I -M -I, -M электроноакцептор
. Электронные эффекты заместителей Заместитель I-эффект M-эффект Соотношение Характер Алкилы +I – – электронодонор NH 2 -I +M +M > -I электронодонор –OH, –SH -I +M +M > -I электронодонор –O–R -I +M +M > -I электронодонор Галогены -I +M -I > +M электроноакцептор -I -M -I, -M электроноакцептор –SО 3 Н -I -M -I, -M электроноакцептор –NО 2 -I -M -I, -M электроноакцептор
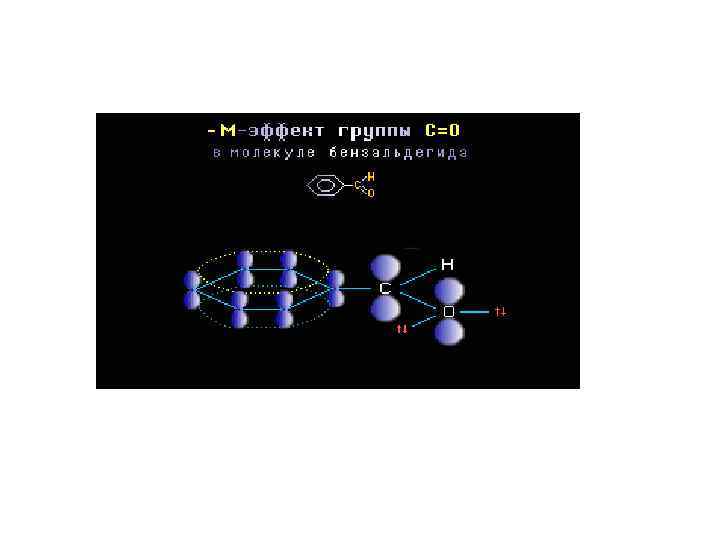

 Сравнение –МСОН и +МОН эффектов фенол бензальдегид
Сравнение –МСОН и +МОН эффектов фенол бензальдегид
 Медик без довольного познания химии совершенен быть не может М. В. Ломоносов
Медик без довольного познания химии совершенен быть не может М. В. Ломоносов


