Методы объемного анализа.ppt
- Количество слайдов: 27

Кафедра химии Тема лекции: Методы объемного анализа

Титриметрия (титрование) – процесс последовательного прибавления небольших порций раствора с известной концентрацией к измеренному объему раствора с неизвестной концентрацией. Цель: определение концентрации исследуемого раствора
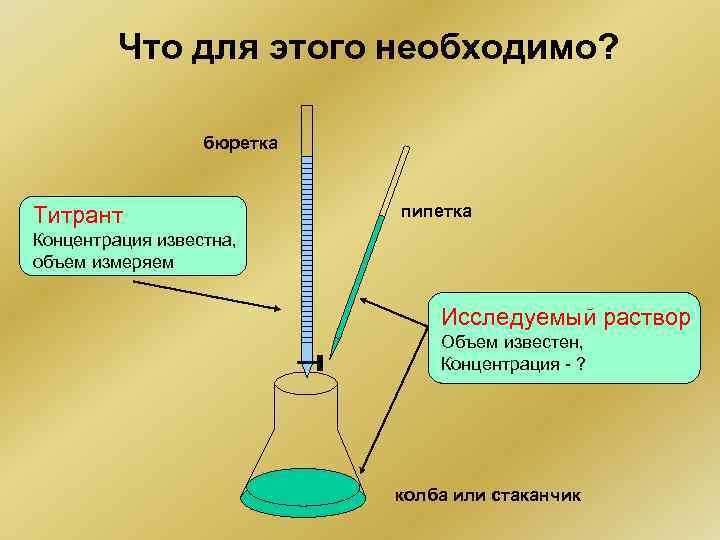
Что для этого необходимо? бюретка Титрант пипетка Концентрация известна, объем измеряем Исследуемый раствор Объем известен, Концентрация - ? колба или стаканчик

• Точка эквивалентности – момент, когда вещества прореагируют в эквивалентных количествах. • Объем титранта, затраченный для достижения точки эквив. называют эквивалентным объемом и используют в расчетах. • Индикатор – вещество, меняющее свою окраску вблизи точки эквивалентности.

Пример: Реакция нейтрализации Кривая титрования – график зависимости р. Н от объема добавленного титранта Скачок титрования – резкое изменение р. Н вблизи точки эквивалентности
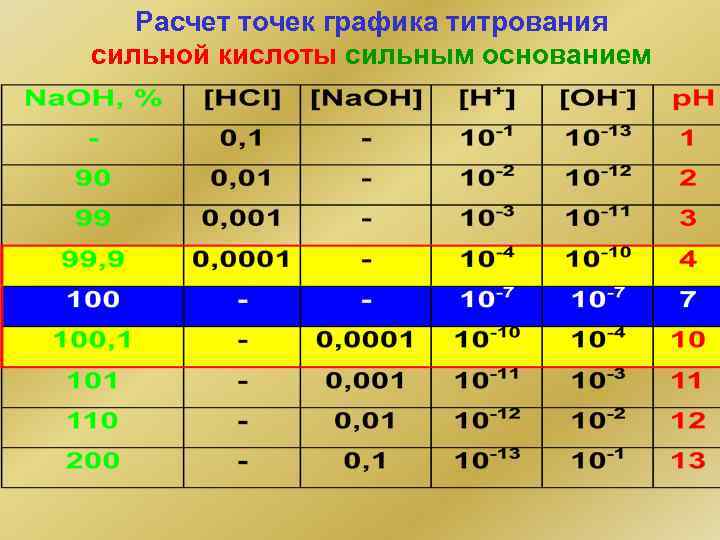
Расчет точек графика титрования сильной кислоты сильным основанием
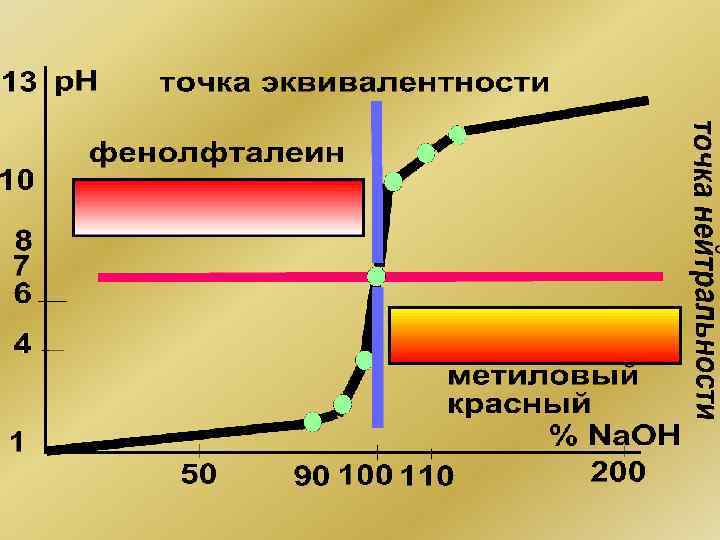

Общие закономерности • Эквивалентная и нейтральная точки не всегда совпадают. • Эквивалентная точка и зона скачка титрования могут лежать как в щелочной, так и в кислотной области. • Для обнаружения эквивалентной точки пригоден лишь тот индикатор, чей диапазон изменения окраски находится в зоне скачка титрования.
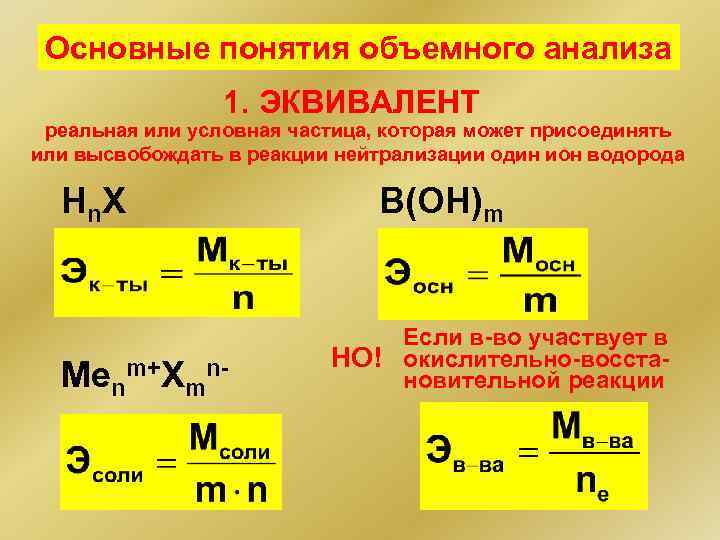
Основные понятия объемного анализа 1. ЭКВИВАЛЕНТ реальная или условная частица, которая может присоединять или высвобождать в реакции нейтрализации один ион водорода Hn X Menm+Xmn- B(OH)m Если в-во участвует в НО! окислительно-восстановительной реакции

Основные понятия объемного анализа Фактор эквивалентности – feq Показывает, какая доля реальной частицы вещества эквивалентна одному иону водорода (одному электрону) в данной конкретной реакции. Обратен эквивалентному числу z вещества. Hn X Пример: B(OH)m Z=n Z=m H 2 SO 4 + 2 Na. OH Na 2 SO 4 + 2 H 2 O Но: H 2 SO 4 + Na. OH Na. HSO 4 + H 2 O feq(H 2 SO 4) = ½ feq(H 2 SO 4) = 1

Основные понятия объемного анализа 2. ЭКВИВАЛЕНТНАЯ МАССА Молярная масса эквивалента (M 1/z) – масса одного моля эквивалента вещества (г), г/моль Пример: H 2 SO 4 + 2 Na. OH Na 2 SO 4 + 2 H 2 O feq(H 2 SO 4) = ½ M 1/z (H 2 SO 4) = M feq = 98 ½ = 49 г/моль Но: H 2 SO 4 + Na. OH Na. HSO 4 + H 2 O feq(H 2 SO 4) = 1 M 1/z (H 2 SO 4) = M feq = 98 1 = 98 г/моль

Основные понятия объемного анализа 3. НОРМАЛЬНАЯ КОНЦЕНТРАЦИЯ (нормальность, молярная концентрация эквивалента) Обозначения: Сн , N, С 1/z Показывает количество моль эквивалентов вещества в одном литре раствора Поскольку M 1/z М , то N См N = См , если M 1/z = М

Основные понятия объемного анализа 4. ТИТР Тр-ра = Nр-ра. M 1/z Размерность: г/л, мг/мл. Показывает, сколько миллиграммов вещества содержится в одном миллилитре раствора ТИТР по определяемому веществу ТА/В = Nр-ра(А). M 1/z(В) Размерность: г/л, мг/мл. Показывает, сколько миллиграммов вещества В реагирует с одним миллилитром раствора А

ЗАКОН ЭКВИВАЛЕНТОВ При титровании в точке эквивалентности количество эквивалентов одного вещества равно количеству эквивалентов другого : 1/z(A) = 1/z(B) или С 1/z(A) V(A) = C 1/z(B) V(B) Или, как писали ранее: Отсюда: С 1/z(A) = C 1/z(B) V(A) N 1. V 1 = N 2. V 2 N 1 = N 2 V 2 V 1 Расчет массы вещества в растворе: mв-ва = Nр-ра. M 1/z. Vр-ра
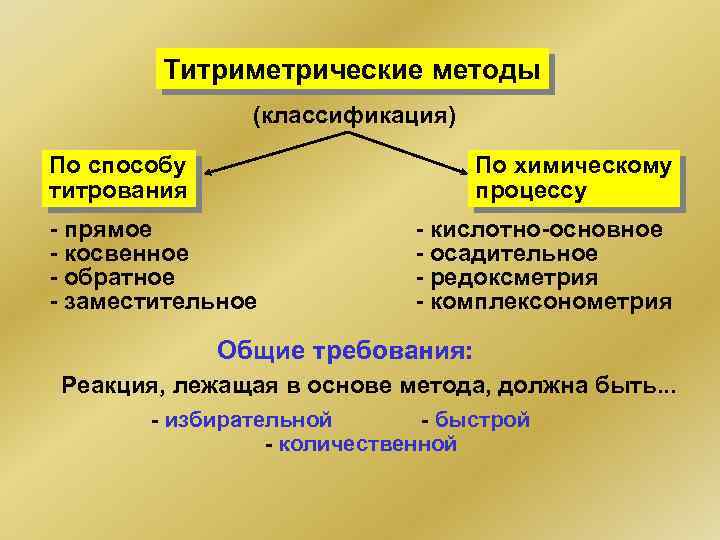
Титриметрические методы (классификация) По способу титрования По химическому процессу - прямое - косвенное - обратное - заместительное - кислотно-основное - осадительное - редоксметрия - комплексонометрия Общие требования: Реакция, лежащая в основе метода, должна быть. . . - избирательной - быстрой - количественной
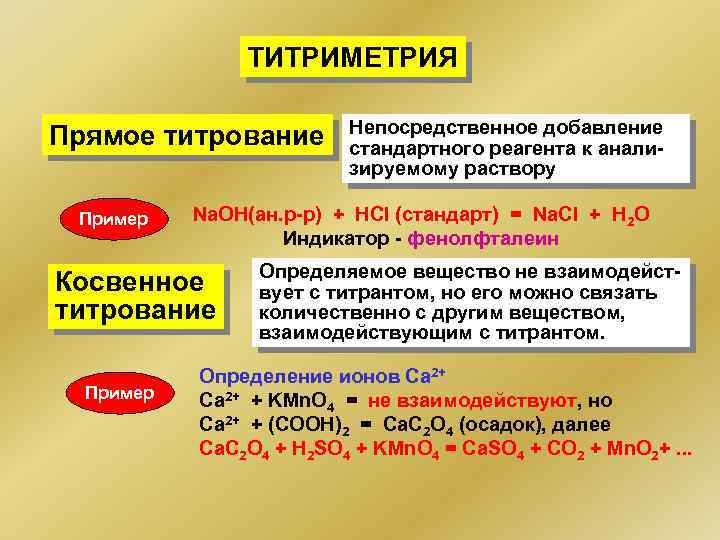
ТИТРИМЕТРИЯ Прямое титрование Пример Na. OH(ан. р-р) + HCl (стандарт) = Na. Cl + H 2 O Индикатор - фенолфталеин Косвенное титрование Пример Непосредственное добавление стандартного реагента к анализируемому раствору Определяемое вещество не взаимодействует с титрантом, но его можно связать количественно с другим веществом, взаимодействующим с титрантом. Определение ионов Са 2+ Ca 2+ + KMn. O 4 = не взаимодействуют, но Сa 2+ + (COOH)2 = Ca. C 2 O 4 (осадок), далее Ca. C 2 O 4 + H 2 SO 4 + KMn. О 4 = Ca. SO 4 + CO 2 + Mn. O 2+. . .
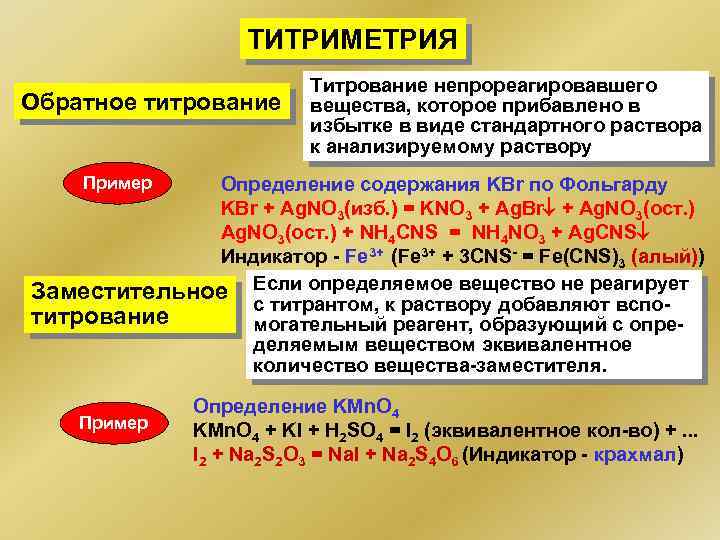
ТИТРИМЕТРИЯ Обратное титрование Титрование непрореагировавшего вещества, которое прибавлено в избытке в виде стандартного раствора к анализируемому раствору Пример Определение содержания KBr по Фольгарду KBr + Ag. NO 3(изб. ) = KNO 3 + Ag. Br + Ag. NO 3(ост. ) + NH 4 CNS = NH 4 NO 3 + Ag. CNS Индикатор - Fe 3+ (Fe 3+ + 3 CNS- = Fe(CNS)3 (алый)) Заместительное Если определяемое вещество не реагирует с титрантом, к раствору добавляют вспотитрование могательный реагент, образующий с определяемым веществом эквивалентное количество вещества-заместителя. Пример Определение KMn. O 4 + KI + H 2 SO 4 = I 2 (эквивалентное кол-во) +. . . I 2 + Na 2 S 2 O 3 = Na. I + Na 2 S 4 O 6 (Индикатор - крахмал)

Кислотно-основное титрование Основано на реакции переноса протонов или электронных пар Na. OH(ан. р-р) + HCl (стандарт) Na. Cl + H 2 O Титрант – сильная кислота (ацидиметрия) или щелочь (алкалиметрия) Исследуемые вещества – сильные и слабые кислоты и основания, многие гидролизующиеся соли Индикаторы – кислотно-основные, меняющие цвет в зависимости от р. Н (фенолфталеин, метиловый красный и др. ) Применение в медицине: üкислотность желудочного содержимого üщелочность промывных вод при мытье посуды üкислотность пищевых продуктов (хлеба, муки, творога и др. ) ü годность лекарственных препаратов (анальгина, аспирина и др. )

Осадительное титрование Исследуемое вещество с титрантом образует осадок Титрант – Ag. NO 3 (аргентометрия), Hg. NO 3 (меркурометрия), иногда Ba. Cl 2 Исследуемые вещества – Cl– Cd 2+ Br – Ba 2+ I– Hg+ CN– As 3+ SO 42– барбитал, димедрол и др. Индикаторы – в зависимости от методики

Аргентометрия, метод Мора Прямое титрование Cl– + Ag. NO 3 Ag. Cl + NO 3 – Индикатор: K 2 Cr. O 4 – ярко-желтый Ag 2 Cr. O 4 – кирпично-красный, выпадает после полного осаждения хлорид-иона 2 Ag+(изб. ) + Cr. O 42 Ag 2 Cr. O 4 Ограничения: р. Н 6 -8

Аргентометрия, метод Фольгарда Обратное титрование Cl– + Ag. NO 3(избыток!) Ag. Cl + NO 3 – {+ Ag. NO 3(изб. )} Ag. NO 3(изб. ) + NH 4 SCN Ag. SCN + NH 4 NO 3 Индикатор: соль Мора NH 4 Fe(SO 4)2 12 H 2 O Fe 3++ SCN (изб. ) + 3 H 2 O [Fe(H 2 O)3(SCN)3] Ярко-красный комплекс

Комплексонометрия Титрование раствором вещества, образующего с определяемым растворимый комплекс. Титрант – трилон Б (двунатриевая соль этилендиаминтетрауксусной кислоты, ЭДТА-Na) и другие комплексоны Индикаторы – металлохромные (тоже комплексоны), например, эриохром черный, мурексид и др. Исследуемые вещества – ионы металлов (Ca 2+, Mg 2+, Ba 2+, Cu 2+, Bi 2+, Cd 2+ и др. ), сульфат-ион.
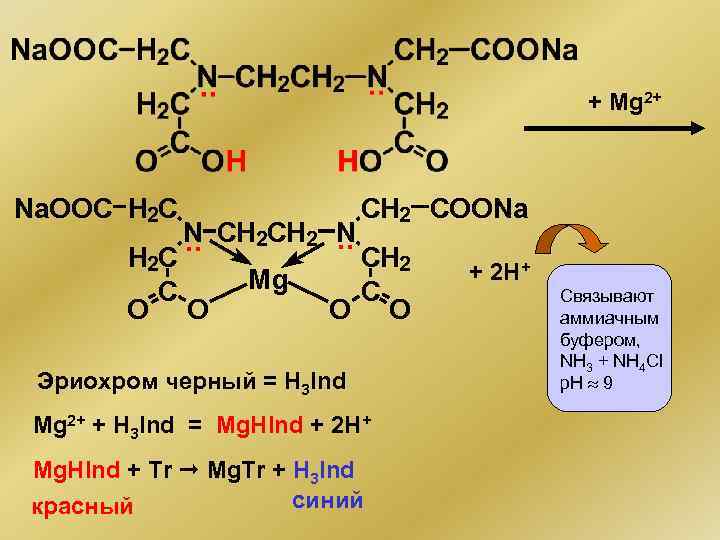
+ Mg 2+ Na. OOC H 2 C CH 2 COONa N CH 2 N. . H 2 C CH 2 Mg C C O O Эриохром черный = H 3 Ind Mg 2+ + H 3 Ind = Mg. HInd + 2 H+ Mg. HInd + Tr Mg. Tr + H 3 Ind синий красный + 2 H+ Связывают аммиачным буфером, NH 3 + NH 4 Cl p. H 9
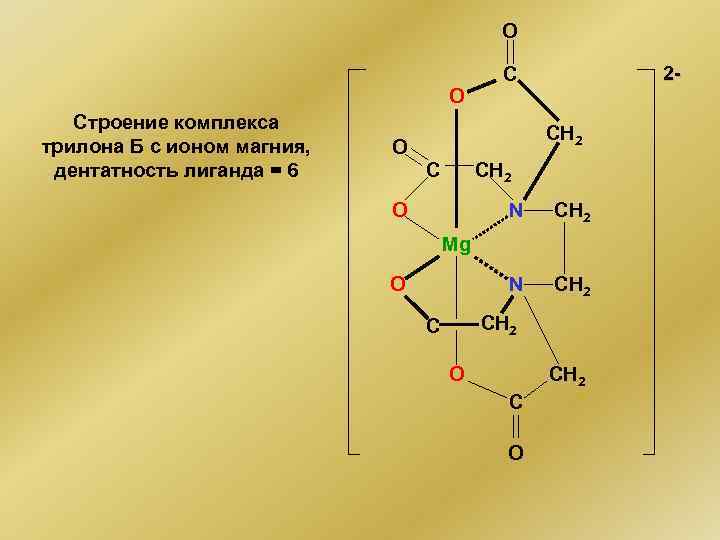
O O Строение комплекса трилона Б с ионом магния, дентатность лиганда = 6 2 - C CH 2 O N CH 2 Mg O CH 2 C O
Редоксметрия Основана на окислительно-восстановительной реакции между титруемым веществом и стандартом. Титранты – KMn. O 4 (перманганатометрия) K 2 Cr 2 O 7 (бихроматометрия) I 2, Na 2 S 2 O 3 (иодометрия) Исследуемые вещества – различные окислители и восстановители Индикаторы – в зависимости от метода

Иодометрия Рабочие растворы – Na 2 S 2 O 3, KI или I 2 Исследуемые вещества – различные окислители и восстановители Индикатор – крахмал Практическое определение содержания активного хлора в хлорной извести: Ca. OCl 2 + 2 HCl Cl 2 + Ca. Cl 2 + H 2 O Cl 2 + 2 KI I 2 + 2 KCl I 2 + Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 тиосульфат натрия Заместительное титрование

Перманганатометрия Рабочие растворы – KMn. O 4, H 2 C 2 O 4 или Na 2 C 2 O 4 Индикатора нет, среда кислая Mn. O 4 - + 8 Н+ + 5 е- Исследуемые вещества – различные восстановители (Fe 2+, H 2 O 2, окисляемость воды и др. ) Mn+2 + 4 Н 2 О Избыток KMn. O 4: 2 Mn. O 4 + 5 C 2 O 4 2 + 16 Н+ 2 Mn+2 + 10 CO 2 + 8 Н 2 О
Методы объемного анализа.ppt