Кафедра химии Тема лекции: Физико-химические свойства растворов Растворы



















9192-fiz-khim_sv_rastvorov.ppt
- Количество слайдов: 34
 Кафедра химии Тема лекции: Физико-химические свойства растворов
Кафедра химии Тема лекции: Физико-химические свойства растворов

 Растворы Истинные растворы – гомогенные системы, в которых структурной единицей растворенного вещества являются ионы или молекулы. Водные растворы. Содержание воды в организме от массы человека: Эмбрион (97%), Новорожденный (77%), Взрослый (18-55 лет): 54% - Ж, 61% - М
Растворы Истинные растворы – гомогенные системы, в которых структурной единицей растворенного вещества являются ионы или молекулы. Водные растворы. Содержание воды в организме от массы человека: Эмбрион (97%), Новорожденный (77%), Взрослый (18-55 лет): 54% - Ж, 61% - М
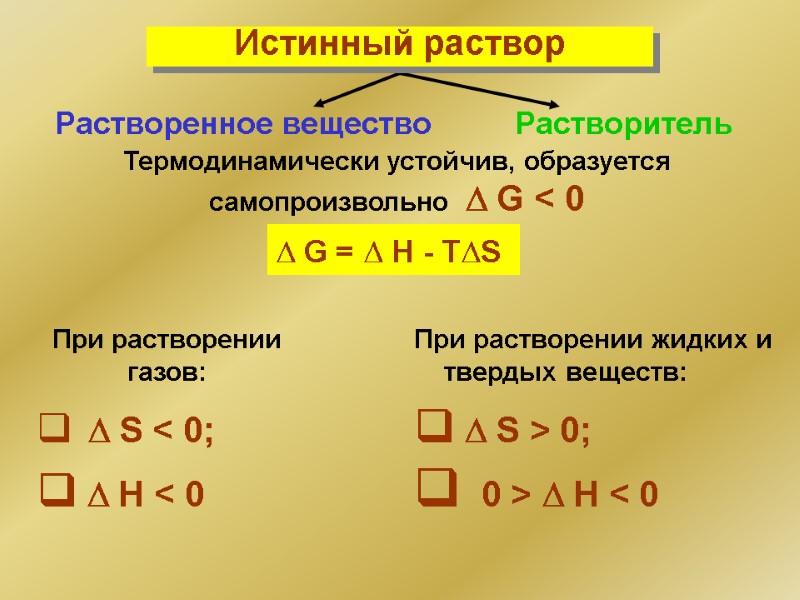
 Термодинамически устойчив, образуется самопроизвольно G < 0 G = H - TS При растворении газов: S < 0; H < 0 При растворении жидких и твердых веществ: S > 0; 0 > H < 0 Растворенное вещество Растворитель Истинный раствор
Термодинамически устойчив, образуется самопроизвольно G < 0 G = H - TS При растворении газов: S < 0; H < 0 При растворении жидких и твердых веществ: S > 0; 0 > H < 0 Растворенное вещество Растворитель Истинный раствор
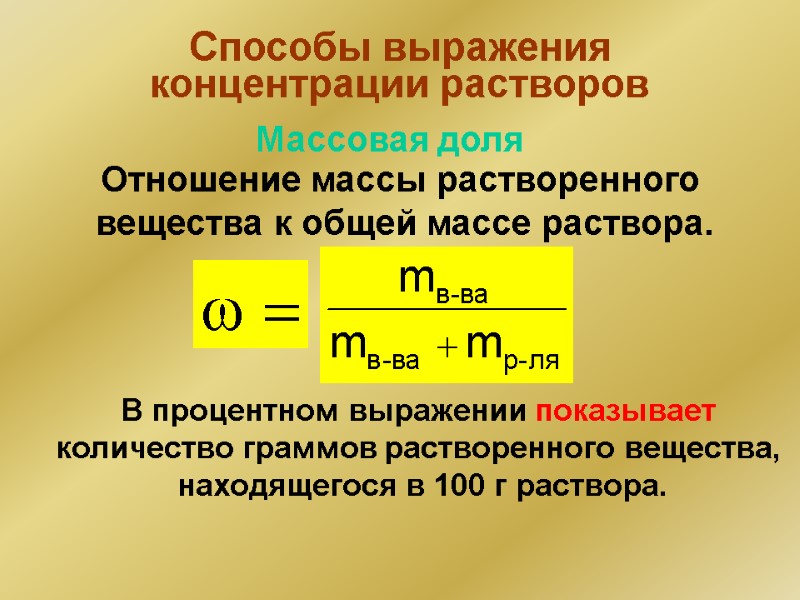
 Способы выражения концентрации растворов Отношение массы растворенного вещества к общей массе раствора. В процентном выражении показывает количество граммов растворенного вещества, находящегося в 100 г раствора. w = Массовая доля
Способы выражения концентрации растворов Отношение массы растворенного вещества к общей массе раствора. В процентном выражении показывает количество граммов растворенного вещества, находящегося в 100 г раствора. w = Массовая доля
 Способы выражения концентрации растворов Количество молей растворенного вещества, находящееся в 1 литре раствора. СM = Молярность
Способы выражения концентрации растворов Количество молей растворенного вещества, находящееся в 1 литре раствора. СM = Молярность
 Способы выражения концентрации растворов Количество молей растворенного вещества, находящееся в 1 килограмме растворителя. Сm = Моляльность
Способы выражения концентрации растворов Количество молей растворенного вещества, находящееся в 1 килограмме растворителя. Сm = Моляльность
 Способы выражения концентрации растворов Отношение числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя. Мольная доля
Способы выражения концентрации растворов Отношение числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя. Мольная доля
 Пересчет различных видов концентраций (пример) Условие: 1% раствор NaOH (плотность 1.1 г/мл) Определить: СМ = ? РЕШЕНИЕ: Исходя из определения массовой доли: В 100 г раствора находится 1 г вещества p В 90.9 мл раствора находится 0.025 моль вещества В 1000 мл раствора содержится X моль вещества Ответ: СМ = 0.275 моль/л
Пересчет различных видов концентраций (пример) Условие: 1% раствор NaOH (плотность 1.1 г/мл) Определить: СМ = ? РЕШЕНИЕ: Исходя из определения массовой доли: В 100 г раствора находится 1 г вещества p В 90.9 мл раствора находится 0.025 моль вещества В 1000 мл раствора содержится X моль вещества Ответ: СМ = 0.275 моль/л
 Добрые советы: При пересчетах концентраций растворов из одного вида в другую ИЗБЕГАЙТЕ ГОТОВЫХ ФОРМУЛ! Решайте задачи методом составления пропорций. Получив числовой ответ, не забудьте о его размерности. Без нее он не имеет никакого смысла.
Добрые советы: При пересчетах концентраций растворов из одного вида в другую ИЗБЕГАЙТЕ ГОТОВЫХ ФОРМУЛ! Решайте задачи методом составления пропорций. Получив числовой ответ, не забудьте о его размерности. Без нее он не имеет никакого смысла.
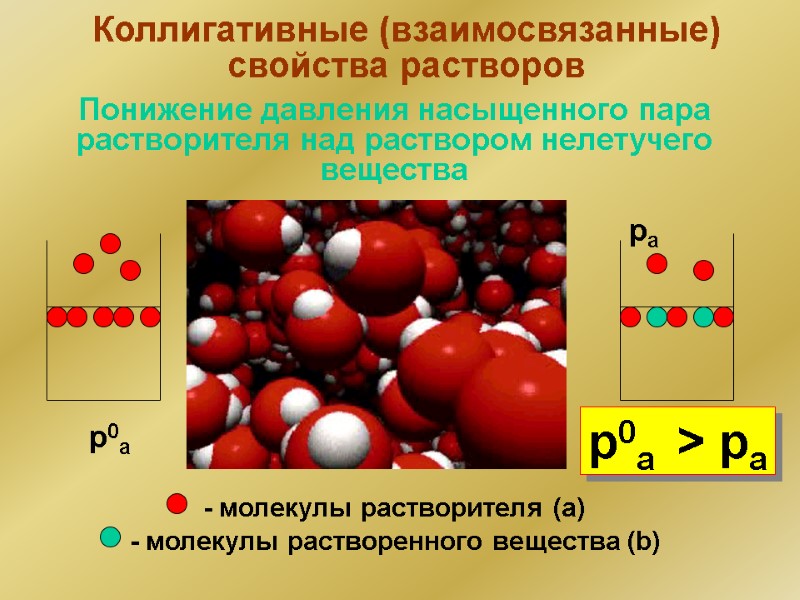
 Коллигативные (взаимосвязанные) свойства растворов Понижение давления насыщенного пара растворителя над раствором нелетучего вещества - молекулы растворителя (a) - молекулы растворенного вещества (b) p0a pa p0a > pa
Коллигативные (взаимосвязанные) свойства растворов Понижение давления насыщенного пара растворителя над раствором нелетучего вещества - молекулы растворителя (a) - молекулы растворенного вещества (b) p0a pa p0a > pa
 pa= p0aNa Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества Для разбавленных водных растворов: Возьмем 1000 г Н2О (вещество а) и n молей вещества b.
pa= p0aNa Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества Для разбавленных водных растворов: Возьмем 1000 г Н2О (вещество а) и n молей вещества b.
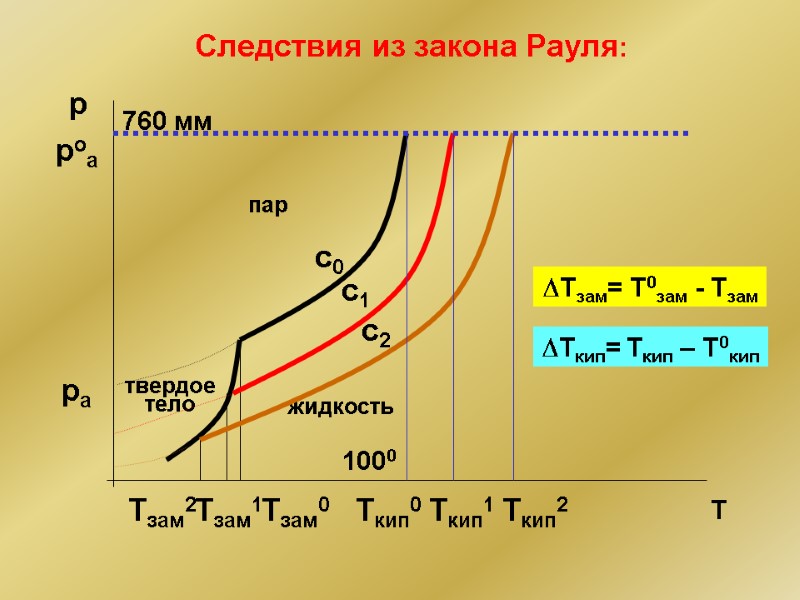
 Cледствия из закона Рауля: с0 pa твердое тело жидкость пар Тзам0 с1 Тзам1 с2 Тзам2 DТзам= Т0зам - Тзам poa 760 мм Ткип0 1000 Ткип1 Ткип2 DТкип= Ткип – Т0кип
Cледствия из закона Рауля: с0 pa твердое тело жидкость пар Тзам0 с1 Тзам1 с2 Тзам2 DТзам= Т0зам - Тзам poa 760 мм Ткип0 1000 Ткип1 Ткип2 DТкип= Ткип – Т0кип
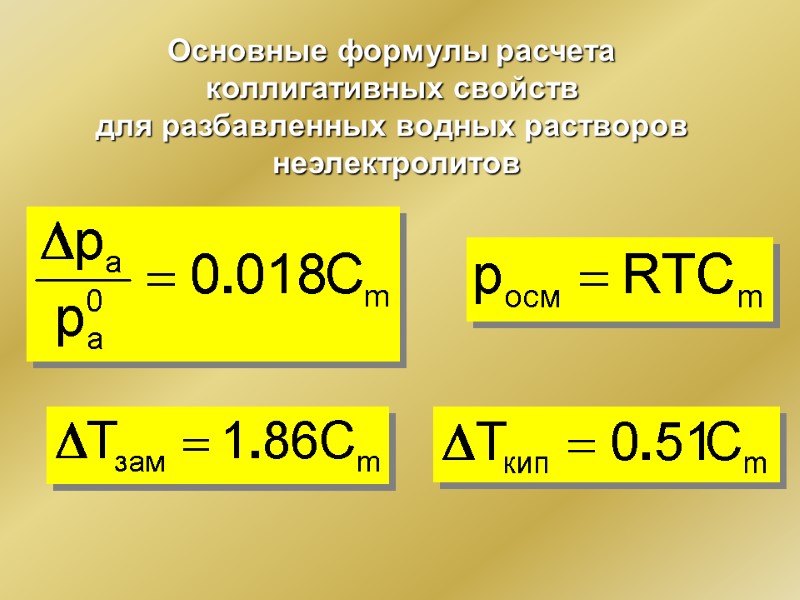
 Численное выражение следствий из закона Рауля DTзам = KCm Депрессия температуры замерзания раствора неэлектролита пропорциональна его моляльной концентрации DTкип = ЕCm Повышение температуры кипения раствора неэлектролита пропорционально его моляльной концентрации
Численное выражение следствий из закона Рауля DTзам = KCm Депрессия температуры замерзания раствора неэлектролита пропорциональна его моляльной концентрации DTкип = ЕCm Повышение температуры кипения раствора неэлектролита пропорционально его моляльной концентрации
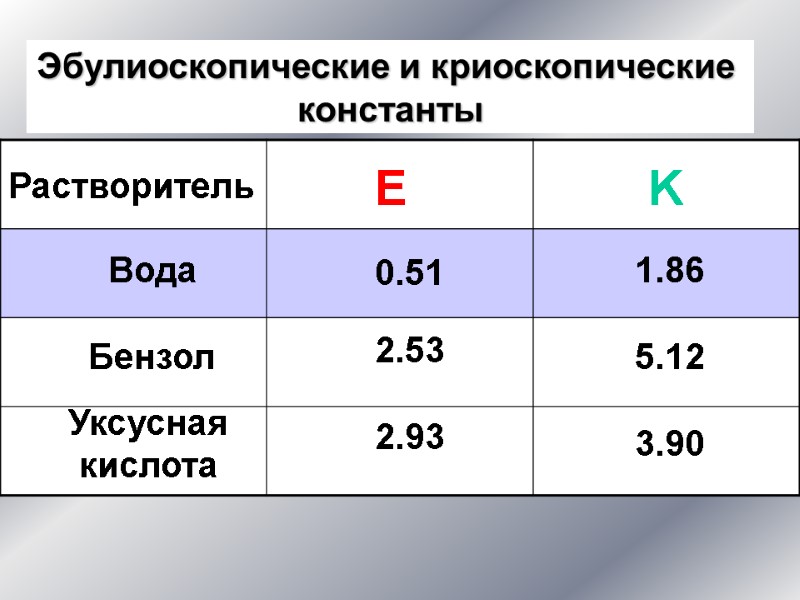
 Растворитель Вода Бензол Уксусная кислота E K 0.51 2.53 2.93 1.86 5.12 3.90 Эбулиоскопические и криоскопические константы
Растворитель Вода Бензол Уксусная кислота E K 0.51 2.53 2.93 1.86 5.12 3.90 Эбулиоскопические и криоскопические константы
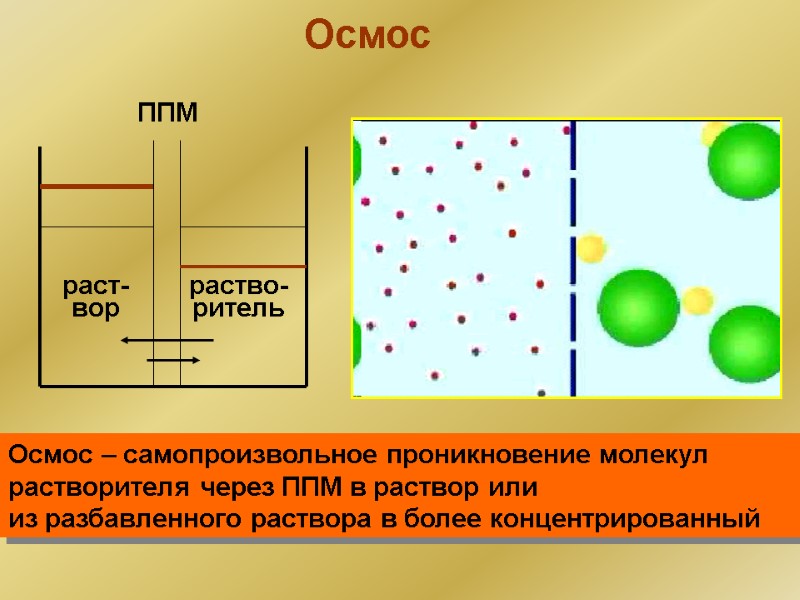
 Осмос ППМ раст- вор раство- ритель Осмос – самопроизвольное проникновение молекул растворителя через ППМ в раствор или из разбавленного раствора в более концентрированный
Осмос ППМ раст- вор раство- ритель Осмос – самопроизвольное проникновение молекул растворителя через ППМ в раствор или из разбавленного раствора в более концентрированный
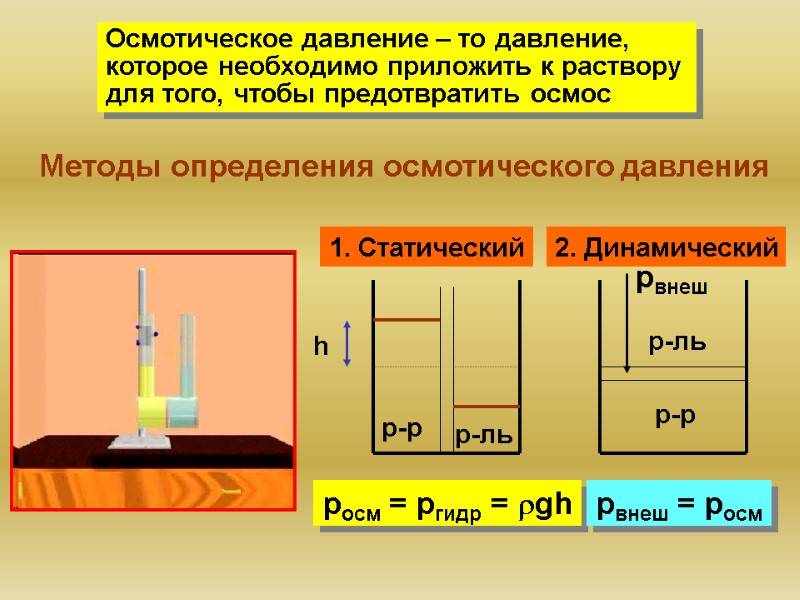
 Осмотическое давление – то давление, которое необходимо приложить к раствору для того, чтобы предотвратить осмос Методы определения осмотического давления 1. Статический pосм = ргидр = rgh 2. Динамический рвнеш h рвнеш = росм
Осмотическое давление – то давление, которое необходимо приложить к раствору для того, чтобы предотвратить осмос Методы определения осмотического давления 1. Статический pосм = ргидр = rgh 2. Динамический рвнеш h рвнеш = росм
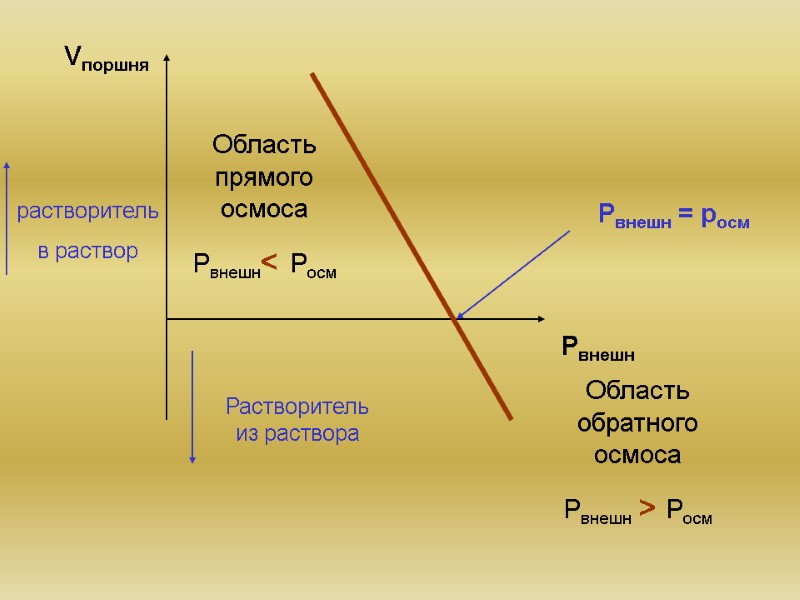
 Рвнешн = росм Область прямого осмоса Рвнешн< Росм Область обратного осмоса Рвнешн > Росм
Рвнешн = росм Область прямого осмоса Рвнешн< Росм Область обратного осмоса Рвнешн > Росм
 Осмотическая работа Аосм = RT2.3lgС2 / C1 Обратный осмос Рвнешнее > Pосм Пример: За сутки выделяется 0,5 моль мочевины. Концентрация её в плазме 0,05 моль/л, а в моче – 0,33 моль/л. Вычислить затрачиваемую почками работу. Аосм = 0,58,33102,3lg0,33/0,05 = 2442 Дж
Осмотическая работа Аосм = RT2.3lgС2 / C1 Обратный осмос Рвнешнее > Pосм Пример: За сутки выделяется 0,5 моль мочевины. Концентрация её в плазме 0,05 моль/л, а в моче – 0,33 моль/л. Вычислить затрачиваемую почками работу. Аосм = 0,58,33102,3lg0,33/0,05 = 2442 Дж
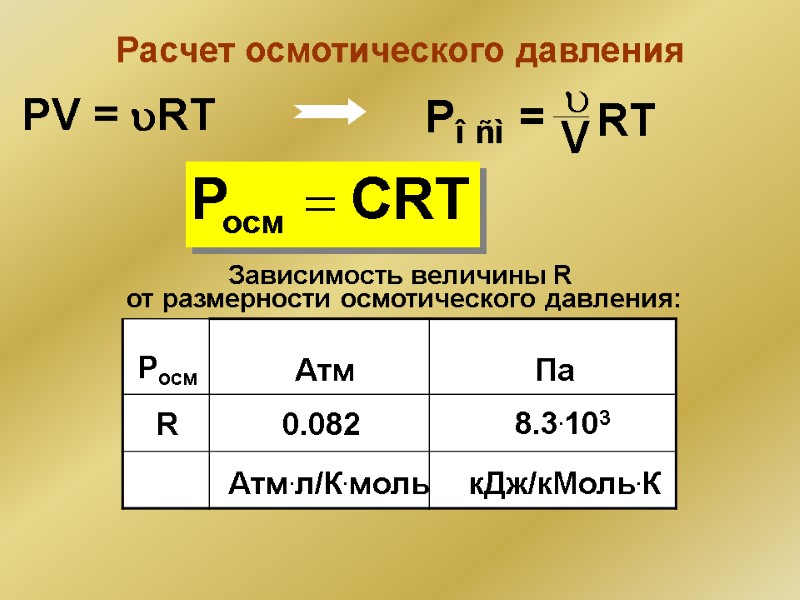
 Расчет осмотического давления Зависимость величины R от размерности осмотического давления: R Pосм Атм Па 0.082 8.3.103 Атм.л/К.моль кДж/кМоль.К
Расчет осмотического давления Зависимость величины R от размерности осмотического давления: R Pосм Атм Па 0.082 8.3.103 Атм.л/К.моль кДж/кМоль.К
 Осмос в биологии Росм листьев > Росм корней > Росм почвы Условие питания листьев водой: Условие прорастания семян: Росм клеточное > Росм внеклеточное
Осмос в биологии Росм листьев > Росм корней > Росм почвы Условие питания листьев водой: Условие прорастания семян: Росм клеточное > Росм внеклеточное
 Осмос в медицине Условие существования человека и высших животных : Росм внутриклет. = Росм внеклет. = Росм межклет. Онкотическое давление – осмотическое давление, обусловленное белками крови Ронк = 0.03 – 0.04 атм ИЗООСМИЯ Росм жидкостей человека = 7,62 атм
Осмос в медицине Условие существования человека и высших животных : Росм внутриклет. = Росм внеклет. = Росм межклет. Онкотическое давление – осмотическое давление, обусловленное белками крови Ронк = 0.03 – 0.04 атм ИЗООСМИЯ Росм жидкостей человека = 7,62 атм
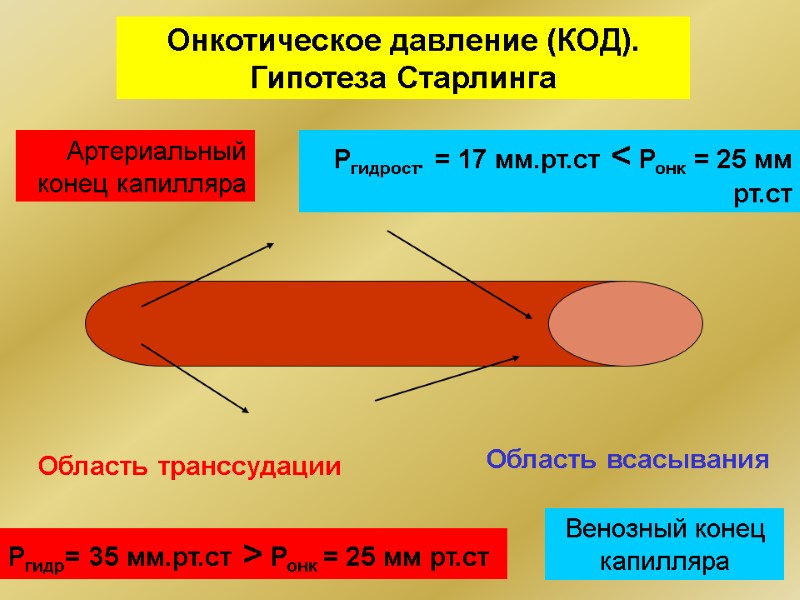
 Онкотическое давление (КОД). Гипотеза Старлинга Артериальный конец капилляра Венозный конец капилляра Ргидр= 35 мм.рт.ст > Ронк = 25 мм рт.ст Область транссудации Ргидрост. = 17 мм.рт.ст < Ронк = 25 мм рт.ст Область всасывания
Онкотическое давление (КОД). Гипотеза Старлинга Артериальный конец капилляра Венозный конец капилляра Ргидр= 35 мм.рт.ст > Ронк = 25 мм рт.ст Область транссудации Ргидрост. = 17 мм.рт.ст < Ронк = 25 мм рт.ст Область всасывания
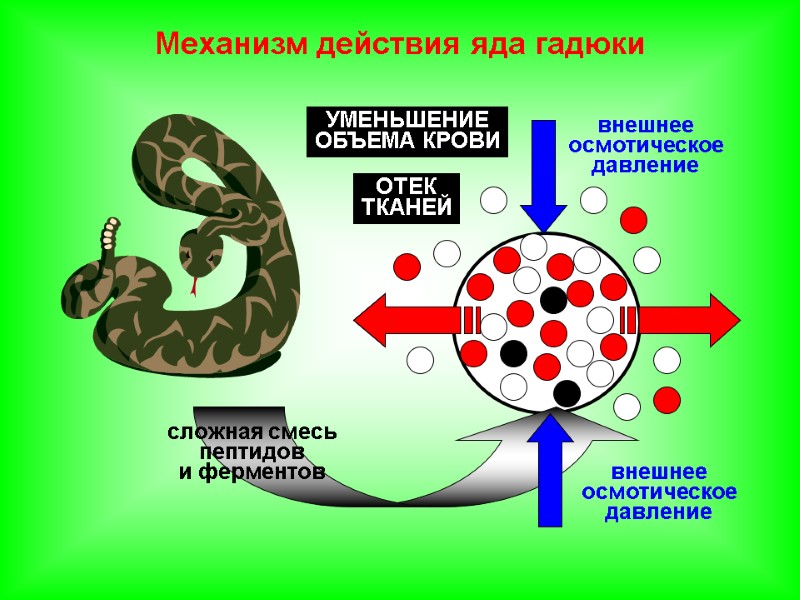
 сложная смесь пептидов и ферментов Механизм действия яда гадюки внешнее осмотическое давление внешнее осмотическое давление ОТЕК ТКАНЕЙ УМЕНЬШЕНИЕ ОБЪЕМА КРОВИ
сложная смесь пептидов и ферментов Механизм действия яда гадюки внешнее осмотическое давление внешнее осмотическое давление ОТЕК ТКАНЕЙ УМЕНЬШЕНИЕ ОБЪЕМА КРОВИ
 Типы растворов, используемых в медицине - гипертонические (росм > pосм крови) - гипотонические (росм < pосм крови) - изотонические (pосм = pосм крови = 7.62 атм) При контакте с кровью наблюдается плазмолиз – сжатие эритроцитов При контакте с кровью наблюдается гемолиз – разрыв эритроцитов (если Росм < 3.6- 4.0 атм) Используются в тех случаях, когда необходимо обеспечить отток жидкости из тканей Используются в тех случаях, когда необходимо обеспечить приток жидкости к тканям Используются для внутривенных вливаний
Типы растворов, используемых в медицине - гипертонические (росм > pосм крови) - гипотонические (росм < pосм крови) - изотонические (pосм = pосм крови = 7.62 атм) При контакте с кровью наблюдается плазмолиз – сжатие эритроцитов При контакте с кровью наблюдается гемолиз – разрыв эритроцитов (если Росм < 3.6- 4.0 атм) Используются в тех случаях, когда необходимо обеспечить отток жидкости из тканей Используются в тех случаях, когда необходимо обеспечить приток жидкости к тканям Используются для внутривенных вливаний
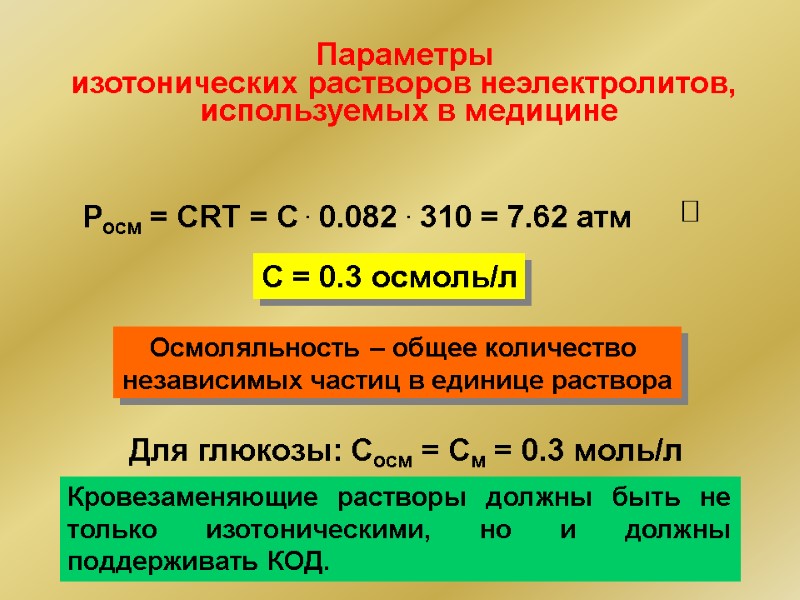
 Параметры изотонических растворов неэлектролитов, используемых в медицине Росм = СRT = С . 0.082 . 310 = 7.62 атм Ю С = 0.3 осмоль/л Осмоляльность – общее количество независимых частиц в единице раствора Для глюкозы: Сосм = См = 0.3 моль/л Кровезаменяющие растворы должны быть не только изотоническими, но и должны поддерживать КОД.
Параметры изотонических растворов неэлектролитов, используемых в медицине Росм = СRT = С . 0.082 . 310 = 7.62 атм Ю С = 0.3 осмоль/л Осмоляльность – общее количество независимых частиц в единице раствора Для глюкозы: Сосм = См = 0.3 моль/л Кровезаменяющие растворы должны быть не только изотоническими, но и должны поддерживать КОД.
 Основные формулы расчета коллигативных свойств для разбавленных водных растворов неэлектролитов
Основные формулы расчета коллигативных свойств для разбавленных водных растворов неэлектролитов
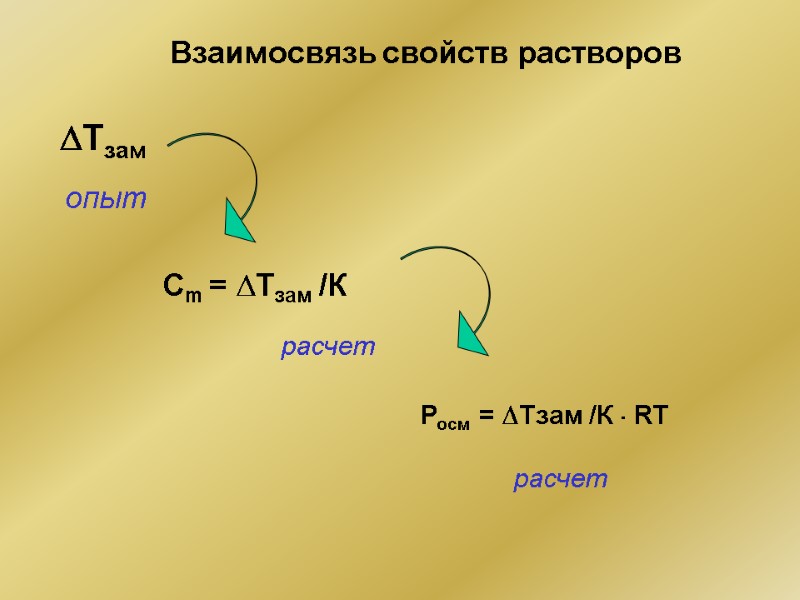
 Взаимосвязь свойств растворов Tзам опыт Cm = Tзам /К расчет Росм = Tзам /К RT расчет
Взаимосвязь свойств растворов Tзам опыт Cm = Tзам /К расчет Росм = Tзам /К RT расчет
 Сильные и слабые электролиты HA D H+ + A- BOH D B+ + OH- Характеристикой силы диссоциации может быть степень диссоциации (a) C0 – начальная концентрация электролита Cдисс – концентрация электролита после заверше-ния процесса диссоциации (равновесная концен-трация)
Сильные и слабые электролиты HA D H+ + A- BOH D B+ + OH- Характеристикой силы диссоциации может быть степень диссоциации (a) C0 – начальная концентрация электролита Cдисс – концентрация электролита после заверше-ния процесса диссоциации (равновесная концен-трация)
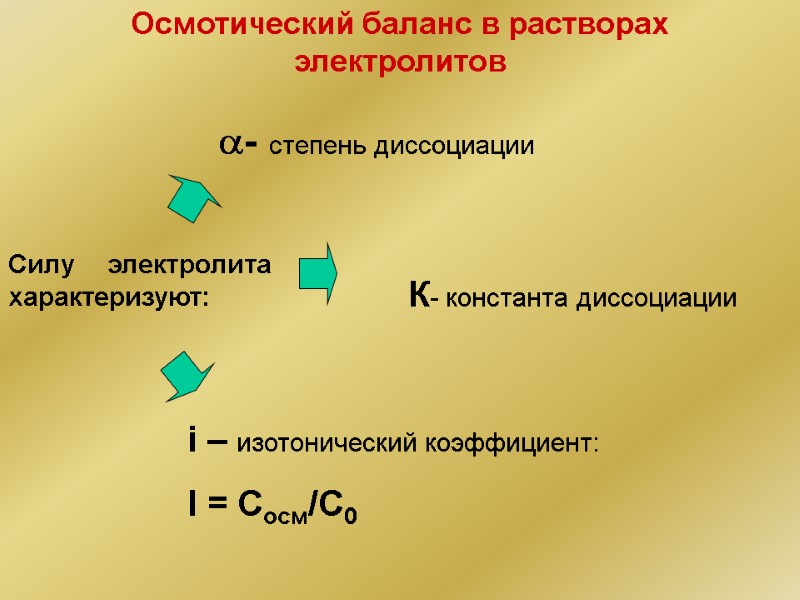
 Осмотический баланс в растворах электролитов Силу электролита характеризуют: - степень диссоциации К- константа диссоциации i – изотонический коэффициент: I = Сосм/C0
Осмотический баланс в растворах электролитов Силу электролита характеризуют: - степень диссоциации К- константа диссоциации i – изотонический коэффициент: I = Сосм/C0
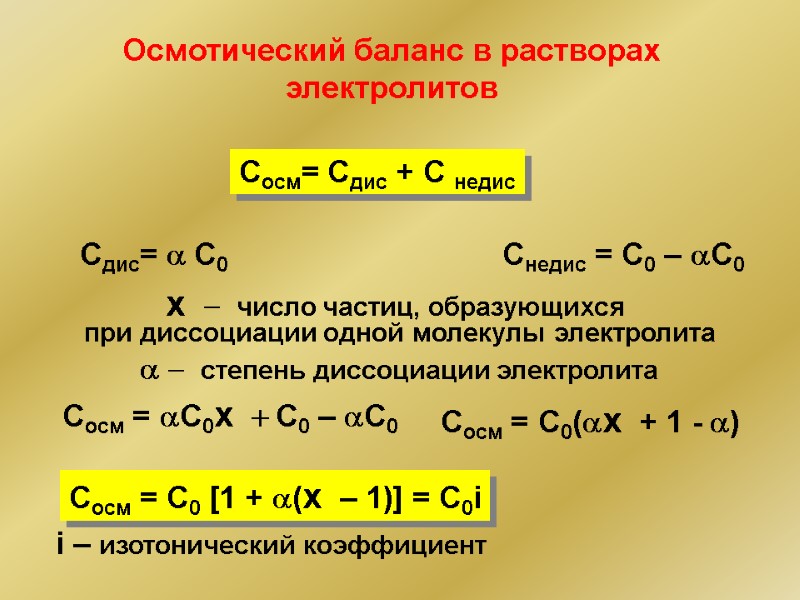
 Осмотический баланс в растворах электролитов Сосм= Сдис + С недис Сдис= a C0 Снедис = С0 – aС0 Сосм = aC0x + C0 – aC0 Cосм = С0(ax + 1 - a) Cocм = C0 [1 + a(x – 1)] = С0i x - число частиц, образующихся при диссоциации одной молекулы электролита a - степень диссоциации электролита i – изотонический коэффициент
Осмотический баланс в растворах электролитов Сосм= Сдис + С недис Сдис= a C0 Снедис = С0 – aС0 Сосм = aC0x + C0 – aC0 Cосм = С0(ax + 1 - a) Cocм = C0 [1 + a(x – 1)] = С0i x - число частиц, образующихся при диссоциации одной молекулы электролита a - степень диссоциации электролита i – изотонический коэффициент
 Расчет изотонического коэффициента для растворов различных типов Неэлек- тролит Слабый эл-т Сильный эл-т, конц. р-р Сильный эл-т, разб. р-р i = 1 x = 1 i = 1 + a(x– 1) a = 1 i =x a = aкаж < 1 i = 1+aкаж(x–1) i = 1 + a(x– 1) В тех случаях, когда имеют место межионные взаимодействия, вместо расчетных концентраций следует использовать активные Сосм = С0i
Расчет изотонического коэффициента для растворов различных типов Неэлек- тролит Слабый эл-т Сильный эл-т, конц. р-р Сильный эл-т, разб. р-р i = 1 x = 1 i = 1 + a(x– 1) a = 1 i =x a = aкаж < 1 i = 1+aкаж(x–1) i = 1 + a(x– 1) В тех случаях, когда имеют место межионные взаимодействия, вместо расчетных концентраций следует использовать активные Сосм = С0i
 Активные концентрации (активности) a = C0g g - коэффициент активности g- - коэффициент активности аниона g+ - коэффициент активности катиона I – ионная сила раствора
Активные концентрации (активности) a = C0g g - коэффициент активности g- - коэффициент активности аниона g+ - коэффициент активности катиона I – ионная сила раствора
 Принципы гомеостаза человеческого организма DТзам = 0.56 0 Росм = 7.6- 8.1 (7.62) атм Ронк = 0.03 – 0.04 атм Iплазмы = 0.15 Iвнутрикл. = 0.25 Сосм = 0.3 моль/л
Принципы гомеостаза человеческого организма DТзам = 0.56 0 Росм = 7.6- 8.1 (7.62) атм Ронк = 0.03 – 0.04 атм Iплазмы = 0.15 Iвнутрикл. = 0.25 Сосм = 0.3 моль/л

