c71177ad4f31b926a7e28eb5da72186a.ppt
- Количество слайдов: 49
 Кафедра управления качеством НАДЛЕЖАЩИЕ ПРАКТИКИ В ФАРМАЦИИ Введение в курс "Надлежащие практики в фармации". Эволюция подходов к обеспечению качества ЛС. Концепция надлежащих фармацевтических практик (GXP) Лектор: к. фарм. н. , доц. кафедры управления качеством Ткаченко Е. В. 1
Кафедра управления качеством НАДЛЕЖАЩИЕ ПРАКТИКИ В ФАРМАЦИИ Введение в курс "Надлежащие практики в фармации". Эволюция подходов к обеспечению качества ЛС. Концепция надлежащих фармацевтических практик (GXP) Лектор: к. фарм. н. , доц. кафедры управления качеством Ткаченко Е. В. 1
 Структура курса Лекции 5 Практических занятий 18 Семинарские занятия 12 Самостоятельная работа 25 Тема 1. Введение в курс "Надлежащие практики в фармации". Хронология мирового развития науки о обеспечения и управления качеством. Эволюция подходов к обеспечению качества лекарственных средств. Тема 2. Концепция надлежащих фармацевтических практик (GXP) и их роль в обеспечении качества на всех этапах жизненного цикла лекарственных средств. Тема 3. Деятельность регуляторных органов в сфере обращения ЛС – их функции и направления работы. Тема 4. Понятие системы управления качеством предприятий – субъектов фармацевтического рынка (фармацевтических систем качества). Обзор требований универсального стандарта ISO 9001 и отраслевого руководства ICH Q 10 Фармацевтическая система качества. Этапы построения ФСК. Тема 5. Регламентация и документирование процессов ФСК. Разработка руководства по качеству, документированных процедур выполнения процессов ФСЯ и стандартных операционных процедур (СОП). Тема 6. Анализ и оценка рисков для качества при фармацевтической разработке, производстве и дистрибуции лекарственных средств. Методы определения, анализа и оценки рисков для качества лекарственных средств. Тема 7. Организация деятельности по валидации производственных процессов и квалификации оборудования и вспомогательных систем на предприятиях–субъектах фармацевтического рынка. Тема 8. Внутренние аудиты (самоинспекции) фармацевтических систем качества: организация, документальное сопровождение, методы аудита, психологические и этические аспекты. 2
Структура курса Лекции 5 Практических занятий 18 Семинарские занятия 12 Самостоятельная работа 25 Тема 1. Введение в курс "Надлежащие практики в фармации". Хронология мирового развития науки о обеспечения и управления качеством. Эволюция подходов к обеспечению качества лекарственных средств. Тема 2. Концепция надлежащих фармацевтических практик (GXP) и их роль в обеспечении качества на всех этапах жизненного цикла лекарственных средств. Тема 3. Деятельность регуляторных органов в сфере обращения ЛС – их функции и направления работы. Тема 4. Понятие системы управления качеством предприятий – субъектов фармацевтического рынка (фармацевтических систем качества). Обзор требований универсального стандарта ISO 9001 и отраслевого руководства ICH Q 10 Фармацевтическая система качества. Этапы построения ФСК. Тема 5. Регламентация и документирование процессов ФСК. Разработка руководства по качеству, документированных процедур выполнения процессов ФСЯ и стандартных операционных процедур (СОП). Тема 6. Анализ и оценка рисков для качества при фармацевтической разработке, производстве и дистрибуции лекарственных средств. Методы определения, анализа и оценки рисков для качества лекарственных средств. Тема 7. Организация деятельности по валидации производственных процессов и квалификации оборудования и вспомогательных систем на предприятиях–субъектах фармацевтического рынка. Тема 8. Внутренние аудиты (самоинспекции) фармацевтических систем качества: организация, документальное сопровождение, методы аудита, психологические и этические аспекты. 2
 План лекции 1. Введение в курс «Надлежащие практики в фармации» . Эволюция подходов к обеспечению качества лекарственных средств. 2. Концепция надлежащих фармацевтических практик (GXP) и их роль в обеспечении качества на всех этапах жизненного цикла лекарственных средств. 3
План лекции 1. Введение в курс «Надлежащие практики в фармации» . Эволюция подходов к обеспечению качества лекарственных средств. 2. Концепция надлежащих фармацевтических практик (GXP) и их роль в обеспечении качества на всех этапах жизненного цикла лекарственных средств. 3
 Основные термины Лекарственное средство (ЛС) — любой активный фармацевтический ингредиент (АФИ) или комбинация АФИ, лекарственные формы (ЛФ), имеющие лечебные либо профилактические свойства, использующиеся для восстановления коррекции или изменения физиологических функций у человека, для установления медицинского диагноза, для выявления возбудителей болезней, а также борьбы с возбудителями болезней или паразитами. Качество ЛС — совокупность свойств, которые предоставляют ЛС способность удовлетворять потребителей в соответствии со своим назначением и соответствуют требованиям, установленным действующим законодательством. 4
Основные термины Лекарственное средство (ЛС) — любой активный фармацевтический ингредиент (АФИ) или комбинация АФИ, лекарственные формы (ЛФ), имеющие лечебные либо профилактические свойства, использующиеся для восстановления коррекции или изменения физиологических функций у человека, для установления медицинского диагноза, для выявления возбудителей болезней, а также борьбы с возбудителями болезней или паразитами. Качество ЛС — совокупность свойств, которые предоставляют ЛС способность удовлетворять потребителей в соответствии со своим назначением и соответствуют требованиям, установленным действующим законодательством. 4
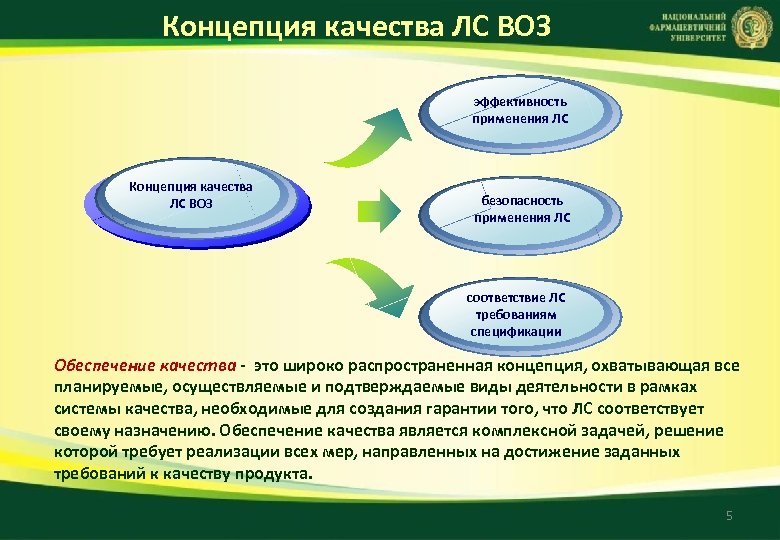 Концепция качества ЛС ВОЗ эффективность применения ЛС Концепция качества ЛС ВОЗ безопасность применения ЛС соответствие ЛС требованиям спецификации Обеспечение качества - это широко распространенная концепция, охватывающая все планируемые, осуществляемые и подтверждаемые виды деятельности в рамках системы качества, необходимые для создания гарантии того, что ЛС соответствует своему назначению. Обеспечение качества является комплексной задачей, решение которой требует реализации всех мер, направленных на достижение заданных требований к качеству продукта. 5
Концепция качества ЛС ВОЗ эффективность применения ЛС Концепция качества ЛС ВОЗ безопасность применения ЛС соответствие ЛС требованиям спецификации Обеспечение качества - это широко распространенная концепция, охватывающая все планируемые, осуществляемые и подтверждаемые виды деятельности в рамках системы качества, необходимые для создания гарантии того, что ЛС соответствует своему назначению. Обеспечение качества является комплексной задачей, решение которой требует реализации всех мер, направленных на достижение заданных требований к качеству продукта. 5
 Эволюция подходов к обеспечению качества ЛС 1902 г. В США погибли 12 детей от дифтерийного антитоксина. Конгрессом США принят Закон «О Биопрепаратах» , предписывающий в обязательном порядке тестировать препараты на предмет чистоты и эффективности, а также инспектировать деятельность их производителей и продавцов. 1905 г. Самюэль Гопкинс Адамс написал серию статей под общим названием «Большая американская афера» (The Great American Fraud) для журнала «Collier's» . Эта серия из одиннадцати статей, в которых он разоблачил опасные для здоровья потребителей махинации фармацевтических компаний, вызвала огромный скандал. 1906 г. Конгрессом США принят Закон «О доброкачественных пищевых продуктах и медицинских препаратах» , согласно которому незаконным считается сбыт фальсифицированной продукции. Впервые выдвинуты требования к маркировке продукции: информация должна быть достоверной. 1906 г. Создание Управления продовольствия и медикаментов США (Food and Drug Administration — FDA), агентства Министерства здравоохранения и социальной защиты США, которое занимается контролем качества пищевых продуктов, ЛC, косметических средств, табачных изделий и некоторых других категорий товаров, а также осуществляет контроль за соблюдением законодательства и стандартов в этой области. 6
Эволюция подходов к обеспечению качества ЛС 1902 г. В США погибли 12 детей от дифтерийного антитоксина. Конгрессом США принят Закон «О Биопрепаратах» , предписывающий в обязательном порядке тестировать препараты на предмет чистоты и эффективности, а также инспектировать деятельность их производителей и продавцов. 1905 г. Самюэль Гопкинс Адамс написал серию статей под общим названием «Большая американская афера» (The Great American Fraud) для журнала «Collier's» . Эта серия из одиннадцати статей, в которых он разоблачил опасные для здоровья потребителей махинации фармацевтических компаний, вызвала огромный скандал. 1906 г. Конгрессом США принят Закон «О доброкачественных пищевых продуктах и медицинских препаратах» , согласно которому незаконным считается сбыт фальсифицированной продукции. Впервые выдвинуты требования к маркировке продукции: информация должна быть достоверной. 1906 г. Создание Управления продовольствия и медикаментов США (Food and Drug Administration — FDA), агентства Министерства здравоохранения и социальной защиты США, которое занимается контролем качества пищевых продуктов, ЛC, косметических средств, табачных изделий и некоторых других категорий товаров, а также осуществляет контроль за соблюдением законодательства и стандартов в этой области. 6
 Эволюция подходов к обеспечению качества ЛС 1937 г. В США 107 человек погибли, принимая «эликсир сульфаниламида» , в котором использовался токсичный диэтиленгликоль. 1938 г. Принятие в США Федерального закона «О пищевых продуктах, лекарственных средств и косметических изделиях» . Начало обязательной проверки на токсичность. Закон расширил полномочия FDA по надзору за качеством продукции, а также проведению детальных инспекций предприятий, усилил стандарты качества продукции и позволил в случае нарушения осуществлять принудительную остановку производства как еще одну превентивную меру в дополнение к уже легализованной полной конфискации продукции и уголовной ответственности. 1941 г. Около 300 человек погибли от использования таблеток сульфатиазол, в которые были добавлены как успокаивающее средство фенобарбитал. Этот инцидент заставил FDA в корне пересмотреть требования к производству и контролю качества ЛС. 1944 г. В США вышел новый Закон «О здравоохранении» . Введена обязательная сертификация отдельных видов препаратов, таких как инсулины и антибиотики. Система сертификации обязывала производителей предоставлять в FDA пробы из каждой выпускаемой серии продукции и только после проведения анализа FDA выдавала разрешение на реализацию. Обязательная сертификация была отменена в 1983 г. 7
Эволюция подходов к обеспечению качества ЛС 1937 г. В США 107 человек погибли, принимая «эликсир сульфаниламида» , в котором использовался токсичный диэтиленгликоль. 1938 г. Принятие в США Федерального закона «О пищевых продуктах, лекарственных средств и косметических изделиях» . Начало обязательной проверки на токсичность. Закон расширил полномочия FDA по надзору за качеством продукции, а также проведению детальных инспекций предприятий, усилил стандарты качества продукции и позволил в случае нарушения осуществлять принудительную остановку производства как еще одну превентивную меру в дополнение к уже легализованной полной конфискации продукции и уголовной ответственности. 1941 г. Около 300 человек погибли от использования таблеток сульфатиазол, в которые были добавлены как успокаивающее средство фенобарбитал. Этот инцидент заставил FDA в корне пересмотреть требования к производству и контролю качества ЛС. 1944 г. В США вышел новый Закон «О здравоохранении» . Введена обязательная сертификация отдельных видов препаратов, таких как инсулины и антибиотики. Система сертификации обязывала производителей предоставлять в FDA пробы из каждой выпускаемой серии продукции и только после проведения анализа FDA выдавала разрешение на реализацию. Обязательная сертификация была отменена в 1983 г. 7
 Эволюция подходов к обеспечению качества ЛС 1947 г. Принятие Нюрнбергского кодекса как основы этических стандартов клинических испытаний в ответ на военные уголовные испытания нацистских врачей 1948 г. Создание Всемирной организации здравоохранения (World Health Organization — WHO) 1950 е гг. Правительство Японии устанавливает на уровне законодательства обязательную регистрацию ЛС до момента их поступления на прилавки аптек. Дефект стопы, вызванный фоколемией 1959 1962 гг. «Талидомидовая» трагедия. В европейских странах, Австралии более 10000 детей с очень редкой врожденной аномалии развития фокомелия, при которой отмечаются дефекты трубчатых костей конечностей и формируются аномальные или рудиментарные кисти и стопы, родившихся от матерей, принимавших снотворное Талидомид. Реакцией фармацевтической мировой общественности на «талидомидовую» трагедию стало введение поправки Кефовера Харриса в США и создание ВОЗ глобальной системы фармаконадзора. 8
Эволюция подходов к обеспечению качества ЛС 1947 г. Принятие Нюрнбергского кодекса как основы этических стандартов клинических испытаний в ответ на военные уголовные испытания нацистских врачей 1948 г. Создание Всемирной организации здравоохранения (World Health Organization — WHO) 1950 е гг. Правительство Японии устанавливает на уровне законодательства обязательную регистрацию ЛС до момента их поступления на прилавки аптек. Дефект стопы, вызванный фоколемией 1959 1962 гг. «Талидомидовая» трагедия. В европейских странах, Австралии более 10000 детей с очень редкой врожденной аномалии развития фокомелия, при которой отмечаются дефекты трубчатых костей конечностей и формируются аномальные или рудиментарные кисти и стопы, родившихся от матерей, принимавших снотворное Талидомид. Реакцией фармацевтической мировой общественности на «талидомидовую» трагедию стало введение поправки Кефовера Харриса в США и создание ВОЗ глобальной системы фармаконадзора. 8
 Эволюция подходов к обеспечению качества ЛС 1962 г. В США вышли первые правила GСP. 1962 г. В США введена поправка Кефовера Харриса в закон «О пищевых продуктах, лекарствах и косметических средствах» , которая вводила обязательность доказательств эффективности и безопасности препаратов и обязательное получение информированного согласия пациента на участие в клиническом исследовании. Данная поправка обязала компании проводить доклинические испытания на животных, прежде чем испытывать новые ЛС на людях. Ответственность подтверждение эффективности препаратов, проходивших испытания, ложилась на исследователей. Также производители обязаны сообщать о случаях выявления негативного побочного эффекта. Кроме того, с этого момента FDA получило полномочия регулировать рекламу рецептурных препаратов. Кроме того, поскольку до вступления закона в силу было принято несколько тысяч препаратов только на основании доказательств безопасности, FDA инициировала ретроспективную оценку эффективности принятых ранее препаратов (Drug Efficacy Study Implementation DESI). К 1984 г. FDA оценила 3443 препаратов, из них 2225 были признаны эффективными, 1051 неэффективными, по 167 принятие решения было отложено. 9
Эволюция подходов к обеспечению качества ЛС 1962 г. В США вышли первые правила GСP. 1962 г. В США введена поправка Кефовера Харриса в закон «О пищевых продуктах, лекарствах и косметических средствах» , которая вводила обязательность доказательств эффективности и безопасности препаратов и обязательное получение информированного согласия пациента на участие в клиническом исследовании. Данная поправка обязала компании проводить доклинические испытания на животных, прежде чем испытывать новые ЛС на людях. Ответственность подтверждение эффективности препаратов, проходивших испытания, ложилась на исследователей. Также производители обязаны сообщать о случаях выявления негативного побочного эффекта. Кроме того, с этого момента FDA получило полномочия регулировать рекламу рецептурных препаратов. Кроме того, поскольку до вступления закона в силу было принято несколько тысяч препаратов только на основании доказательств безопасности, FDA инициировала ретроспективную оценку эффективности принятых ранее препаратов (Drug Efficacy Study Implementation DESI). К 1984 г. FDA оценила 3443 препаратов, из них 2225 были признаны эффективными, 1051 неэффективными, по 167 принятие решения было отложено. 9
 Эволюция подходов к обеспечению качества ЛС 1963 г. Первые правила GMP разработаны FDA США 1964 г. Создание Европейского директората по контролю качества лекарственных средств и здравоохранения (European Directorate for the Quality of Medicines & Health. Care — EDQM), организация (институт) Совета Европы, которая разрабатывает Европейскую Фармакопею. В подчинении у EDQM находится Сеть официальных лабораторий по контролю за лекарственными средствами (Network of official medicines control laboratories OMCLs). OMCLs оказывает поддержку регуляторным органам в сфере контроля качества ЛС на европейском рынке. 1968 г. Комитетом экспертов по спецификациям для фармацевтических препаратов ВОЗ разработаны правила GMP ВОЗ. Правила GMP вводят как обязательные для производителей ЛС в Италии и Канаде. 1969 p. Ассамблея ВОЗ рекомендовала первую версию Системы подтверждения качества фармацевтических препаратов для международной торговли. Правила GMP вводят как обязательные в Сингапуре и Швеции 1976 г. Первые правила GLP были опубликованы в США 10
Эволюция подходов к обеспечению качества ЛС 1963 г. Первые правила GMP разработаны FDA США 1964 г. Создание Европейского директората по контролю качества лекарственных средств и здравоохранения (European Directorate for the Quality of Medicines & Health. Care — EDQM), организация (институт) Совета Европы, которая разрабатывает Европейскую Фармакопею. В подчинении у EDQM находится Сеть официальных лабораторий по контролю за лекарственными средствами (Network of official medicines control laboratories OMCLs). OMCLs оказывает поддержку регуляторным органам в сфере контроля качества ЛС на европейском рынке. 1968 г. Комитетом экспертов по спецификациям для фармацевтических препаратов ВОЗ разработаны правила GMP ВОЗ. Правила GMP вводят как обязательные для производителей ЛС в Италии и Канаде. 1969 p. Ассамблея ВОЗ рекомендовала первую версию Системы подтверждения качества фармацевтических препаратов для международной торговли. Правила GMP вводят как обязательные в Сингапуре и Швеции 1976 г. Первые правила GLP были опубликованы в США 10
 Эволюция подходов к обеспечению качества ЛС 1970 г. Создание Конвенции по фармацевтических инспекций (Pharmaceutical Inspection Convention — PIC), наиболее авторитетной организации по стандартизации правил GMP и GDP и проведению GMP и GDP инпекторатов, объединившей уполномоченные органы системы здравоохранения стран всего мира. 1978 г. Создание Европейской федерации фармацевтических производителей и ассоциаций (The European Federation of Pharmaceutical Industries and Associations — EFPIA). Сегодня членами EFPIA являются 33 национальных фармацевтических ассоциаций и 40 ведущих фармацевтических компаний ЕС, занимающихся исследованиями, разработкой и производством новых ЛС. 1990 г. Создание Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для человека (International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use — ICH). С 2015 г. —Международный совет по гармонизации (The International Council for Harmonisation — ICH). 11
Эволюция подходов к обеспечению качества ЛС 1970 г. Создание Конвенции по фармацевтических инспекций (Pharmaceutical Inspection Convention — PIC), наиболее авторитетной организации по стандартизации правил GMP и GDP и проведению GMP и GDP инпекторатов, объединившей уполномоченные органы системы здравоохранения стран всего мира. 1978 г. Создание Европейской федерации фармацевтических производителей и ассоциаций (The European Federation of Pharmaceutical Industries and Associations — EFPIA). Сегодня членами EFPIA являются 33 национальных фармацевтических ассоциаций и 40 ведущих фармацевтических компаний ЕС, занимающихся исследованиями, разработкой и производством новых ЛС. 1990 г. Создание Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для человека (International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use — ICH). С 2015 г. —Международный совет по гармонизации (The International Council for Harmonisation — ICH). 11
 Эволюция подходов к обеспечению качества ЛС 1993 г. Первое руководство по GPP разработано FIP. 1994 г. Первые правила GDP опубликованы в ЕС. 1995 г. Создание Европейского агентства по лекарственным средствам (European Medicines Agency — EMA), регуляторного органа ЕС, в компетенцию которого входит допуск на рынок ЛС по централизованной процедуре, экспертная оценка эффективности и безопасности ЛС, разработка стандартов, проведение фармаконадзора в ЕС. 2003 г. Первое руководство по GSP разработано ВОЗ. 12
Эволюция подходов к обеспечению качества ЛС 1993 г. Первое руководство по GPP разработано FIP. 1994 г. Первые правила GDP опубликованы в ЕС. 1995 г. Создание Европейского агентства по лекарственным средствам (European Medicines Agency — EMA), регуляторного органа ЕС, в компетенцию которого входит допуск на рынок ЛС по централизованной процедуре, экспертная оценка эффективности и безопасности ЛС, разработка стандартов, проведение фармаконадзора в ЕС. 2003 г. Первое руководство по GSP разработано ВОЗ. 12
 Концепция надлежащих практик в фармации GPP Розничная торговля Разработка ЛС GLP Доклинические исследования GDP Оптовая торговля КОНЦЕПЦИЯ GХP GSP хранение GMP Производство GCP Клинические испытания Регистрация (лицензирование) ЛС 13
Концепция надлежащих практик в фармации GPP Розничная торговля Разработка ЛС GLP Доклинические исследования GDP Оптовая торговля КОНЦЕПЦИЯ GХP GSP хранение GMP Производство GCP Клинические испытания Регистрация (лицензирование) ЛС 13
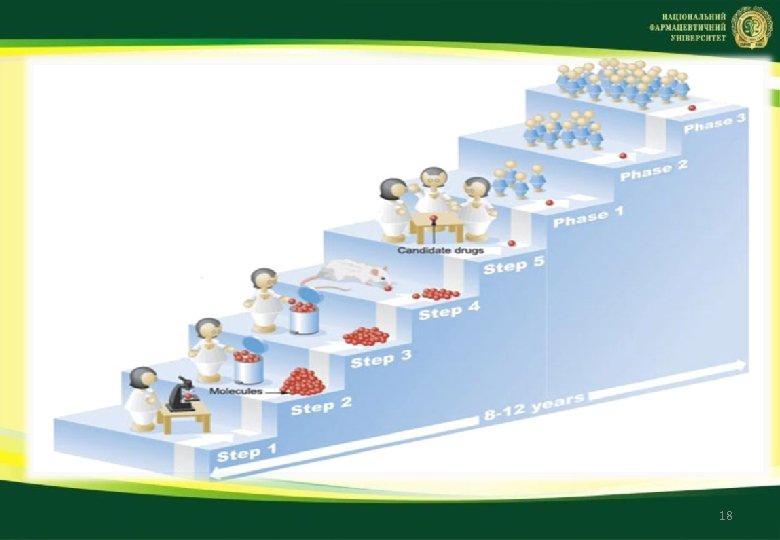
 Разработка и исследования новых ЛС (Research & Development – R&D) Цель фармацевтической разработки – создать препарат соответствующего качества и обосновать процесс его производства, чтобы постоянно выпускать продукцию с заданными функциональными характеристиками. Руководство ICH Q 8 Фармацевтическая разработка (2009) В соответствии с руководством ICH Q 8 качество не может быть полностью проверено в препаратах; качество необходимо заложить при разработке и обеспечить при производстве. Медико биологические факторы • изменение иммунной системы человека, • появление новых заболеваний, • резистентность возбудителей заболеваний, • экологическая обстановка Социально экономические факторы • финансовые потери фармацевтических компаний в связи с окончанием срока действий патентов на препараты • необходимость обеспечения населения современными эффективными ЛС 14
Разработка и исследования новых ЛС (Research & Development – R&D) Цель фармацевтической разработки – создать препарат соответствующего качества и обосновать процесс его производства, чтобы постоянно выпускать продукцию с заданными функциональными характеристиками. Руководство ICH Q 8 Фармацевтическая разработка (2009) В соответствии с руководством ICH Q 8 качество не может быть полностью проверено в препаратах; качество необходимо заложить при разработке и обеспечить при производстве. Медико биологические факторы • изменение иммунной системы человека, • появление новых заболеваний, • резистентность возбудителей заболеваний, • экологическая обстановка Социально экономические факторы • финансовые потери фармацевтических компаний в связи с окончанием срока действий патентов на препараты • необходимость обеспечения населения современными эффективными ЛС 14
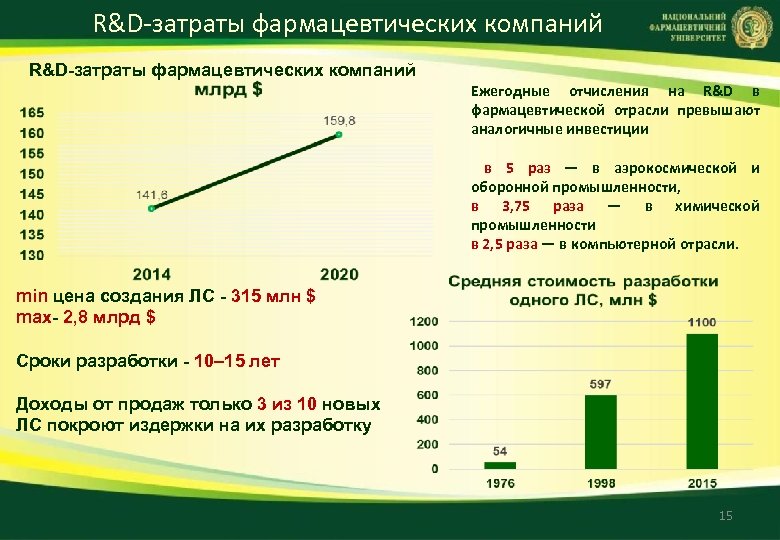 R&D-затраты фармацевтических компаний Ежегодные отчисления на R&D в фармацевтической отрасли превышают аналогичные инвестиции в 5 раз — в аэрокосмической и оборонной промышленности, в 3, 75 раза — в химической промышленности в 2, 5 раза — в компьютерной отрасли. min цена создания ЛС - 315 млн $ max- 2, 8 млрд $ Сроки разработки - 10– 15 лет Доходы от продаж только 3 из 10 новых ЛС покроют издержки на их разработку 15
R&D-затраты фармацевтических компаний Ежегодные отчисления на R&D в фармацевтической отрасли превышают аналогичные инвестиции в 5 раз — в аэрокосмической и оборонной промышленности, в 3, 75 раза — в химической промышленности в 2, 5 раза — в компьютерной отрасли. min цена создания ЛС - 315 млн $ max- 2, 8 млрд $ Сроки разработки - 10– 15 лет Доходы от продаж только 3 из 10 новых ЛС покроют издержки на их разработку 15
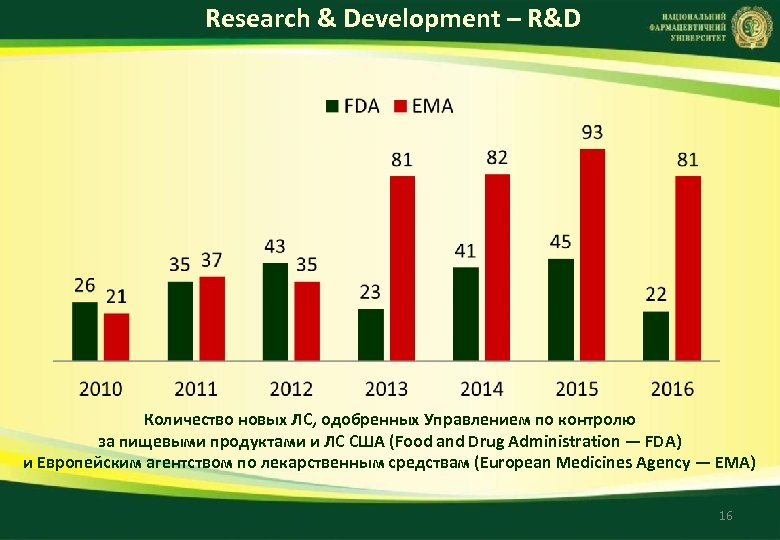 Research & Development – R&D Количество новых ЛC, одобренных Управлением по контролю за пищевыми продуктами и ЛС США (Food and Drug Administration — FDA) и Европейским агентством по лекарственным средствам (European Medicines Agency — EMA) 16
Research & Development – R&D Количество новых ЛC, одобренных Управлением по контролю за пищевыми продуктами и ЛС США (Food and Drug Administration — FDA) и Европейским агентством по лекарственным средствам (European Medicines Agency — EMA) 16
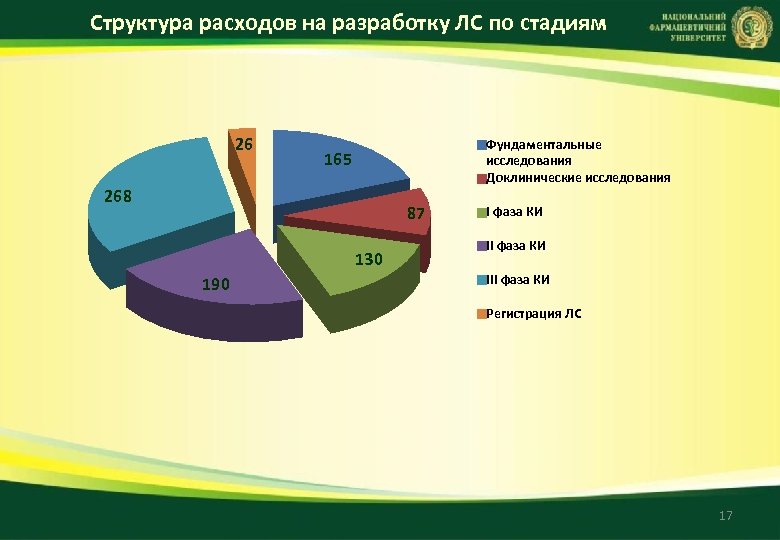 Структура расходов на разработку ЛС по стадиям 26 Фундаментальные исследования Доклинические исследования 165 268 87 130 190 I фаза КИ ІІІ фаза КИ Регистрация ЛС 17
Структура расходов на разработку ЛС по стадиям 26 Фундаментальные исследования Доклинические исследования 165 268 87 130 190 I фаза КИ ІІІ фаза КИ Регистрация ЛС 17
 18
18
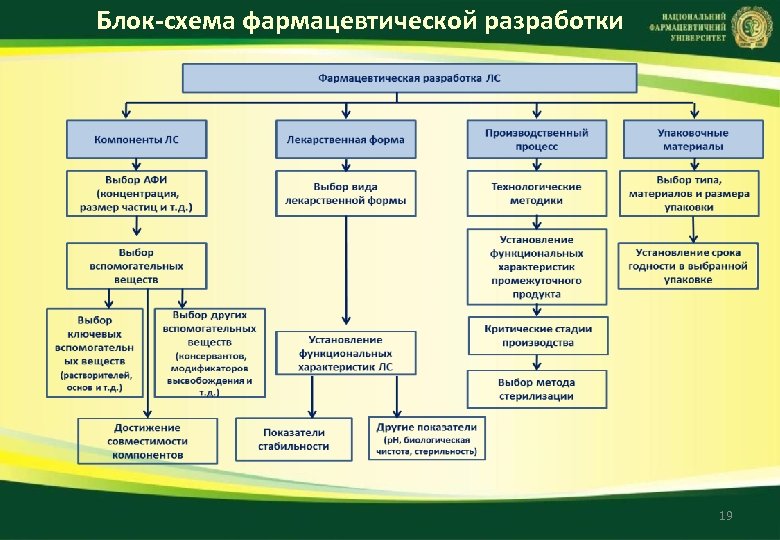 Блок схема фармацевтической разработки 19
Блок схема фармацевтической разработки 19
 ICH «Качество путем разработки» (Quality by Design Qb. D) ICH Q 8 «Фармацевтическая разработка» ICH Q 9 «Управление рисками для качества» ICH Q 10 «Фармацевтическая система качества» ICH Q 11 «Разработка и производство лекарственных субстанций» В Украине документы ICH приняты в виде гармонизированных руководств «Лекарственные средства. Управление рисками для качества (ICH Q 9). СТ-Н МЗУ 42 -4. 2: 2011» , «Лекарственные средства. Фармацевтическая система качества (ICH Q 10). СТ-Н МЗУ 42 -4. 3: 2011» ; «Лекарственные средства. Фармацевтическая разработка (ICH Q 8). СТ-Н МЗУ 423. 0: 2011» . 20
ICH «Качество путем разработки» (Quality by Design Qb. D) ICH Q 8 «Фармацевтическая разработка» ICH Q 9 «Управление рисками для качества» ICH Q 10 «Фармацевтическая система качества» ICH Q 11 «Разработка и производство лекарственных субстанций» В Украине документы ICH приняты в виде гармонизированных руководств «Лекарственные средства. Управление рисками для качества (ICH Q 9). СТ-Н МЗУ 42 -4. 2: 2011» , «Лекарственные средства. Фармацевтическая система качества (ICH Q 10). СТ-Н МЗУ 42 -4. 3: 2011» ; «Лекарственные средства. Фармацевтическая разработка (ICH Q 8). СТ-Н МЗУ 423. 0: 2011» . 20
 Доклинические исследования. Надлежащая лабораторная практика (GLP) Надлежащая лабораторная практика (Good Laboratory Practice — GLP) – это система качества, охватывающая организационный процесс и условия, при которых выполняются ДИ, связанные со здоровьем и экологической безопасностью: планируются, проводятся, проверяются, регистрируются, архивируются и оформляются в виде отчета Действие правил GLP распространяется на работу фармакологических, токсикологических и других лабораторий биологического профиля, а также на исследования в сфере промышленной токсикологии. 21
Доклинические исследования. Надлежащая лабораторная практика (GLP) Надлежащая лабораторная практика (Good Laboratory Practice — GLP) – это система качества, охватывающая организационный процесс и условия, при которых выполняются ДИ, связанные со здоровьем и экологической безопасностью: планируются, проводятся, проверяются, регистрируются, архивируются и оформляются в виде отчета Действие правил GLP распространяется на работу фармакологических, токсикологических и других лабораторий биологического профиля, а также на исследования в сфере промышленной токсикологии. 21
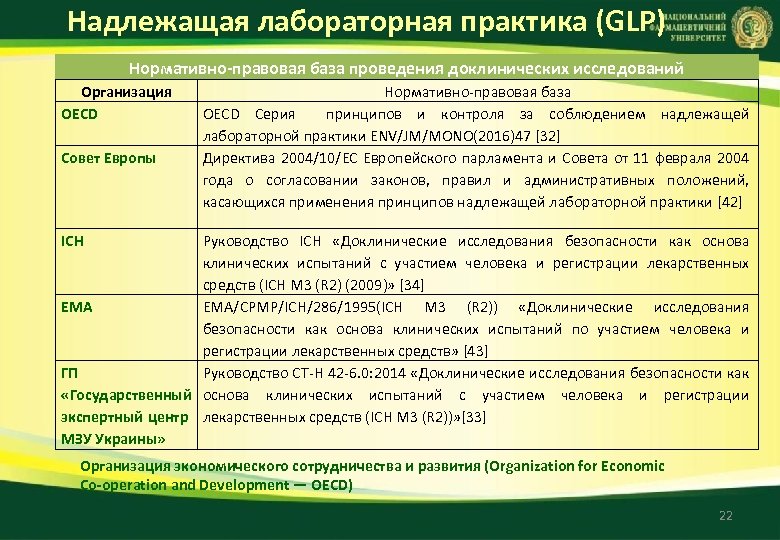 Надлежащая лабораторная практика (GLP) Нормативно правовая база проведения доклинических исследований Организация OECD Совет Европы Нормативно-правовая база OECD Серия принципов и контроля за соблюдением надлежащей лабораторной практики ENV/JM/MONO(2016)47 [32] Директива 2004/10/ЕС Европейского парламента и Совета от 11 февраля 2004 года о согласовании законов, правил и административных положений, касающихся применения принципов надлежащей лабораторной практики [42] ICH Руководство ICH «Доклинические исследования безопасности как основа клинических испытаний с участием человека и регистрации лекарственных средств (ICH M 3 (R 2) (2009)» [34] EMA/CPMP/ICH/286/1995(ICH M 3 (R 2)) «Доклинические исследования безопасности как основа клинических испытаний по участием человека и регистрации лекарственных средств» [43] ГП Руководство CT-Н 42 -6. 0: 2014 «Доклинические исследования безопасности как «Государственный основа клинических испытаний с участием человека и регистрации экспертный центр лекарственных средств (ICH M 3 (R 2))» [33] МЗУ Украины» Организация экономического сотрудничества и развития (Organization for Economic Co operation and Development — OECD) 22
Надлежащая лабораторная практика (GLP) Нормативно правовая база проведения доклинических исследований Организация OECD Совет Европы Нормативно-правовая база OECD Серия принципов и контроля за соблюдением надлежащей лабораторной практики ENV/JM/MONO(2016)47 [32] Директива 2004/10/ЕС Европейского парламента и Совета от 11 февраля 2004 года о согласовании законов, правил и административных положений, касающихся применения принципов надлежащей лабораторной практики [42] ICH Руководство ICH «Доклинические исследования безопасности как основа клинических испытаний с участием человека и регистрации лекарственных средств (ICH M 3 (R 2) (2009)» [34] EMA/CPMP/ICH/286/1995(ICH M 3 (R 2)) «Доклинические исследования безопасности как основа клинических испытаний по участием человека и регистрации лекарственных средств» [43] ГП Руководство CT-Н 42 -6. 0: 2014 «Доклинические исследования безопасности как «Государственный основа клинических испытаний с участием человека и регистрации экспертный центр лекарственных средств (ICH M 3 (R 2))» [33] МЗУ Украины» Организация экономического сотрудничества и развития (Organization for Economic Co operation and Development — OECD) 22
 Надлежащая лабораторная практика (GLP) Требования GLP при проведении доклинических исследованиях: 1. Организация исследовательского учреждения (ИУ) и персонала. 2. Программа обеспечения качества. 3. Помещения. 4. Оборудование, материалы и реактивы. 5. Тест системы. 6. Исследуемые и стандартные образцы. 7. Стандартные операционные процедуры. 8. Проведение исследований. 9. Отчеты о результатах исследования. 10. Хранение и архивирование отчетов и материалов 23
Надлежащая лабораторная практика (GLP) Требования GLP при проведении доклинических исследованиях: 1. Организация исследовательского учреждения (ИУ) и персонала. 2. Программа обеспечения качества. 3. Помещения. 4. Оборудование, материалы и реактивы. 5. Тест системы. 6. Исследуемые и стандартные образцы. 7. Стандартные операционные процедуры. 8. Проведение исследований. 9. Отчеты о результатах исследования. 10. Хранение и архивирование отчетов и материалов 23
 Надлежащая лабораторная практика (GLP) Тест-системы это любое животное, растение, микроорганизм, а также клеточная, субклеточная, химическая и физическая система или их комбинация, которые используются в исследованиях: физико химические (аппаратура, которая используется для получения физико химических данных) биологические (тест системы животного или растительного происхождения) 24
Надлежащая лабораторная практика (GLP) Тест-системы это любое животное, растение, микроорганизм, а также клеточная, субклеточная, химическая и физическая система или их комбинация, которые используются в исследованиях: физико химические (аппаратура, которая используется для получения физико химических данных) биологические (тест системы животного или растительного происхождения) 24
 Этапы и виды доклинических исследований Обязательно ДИ на животных проводятся для: • новых (оригинальных) действующих веществ и лекарственных форм, в которые входят эти вещества; • новых вспомогательных веществ, которые ранее не использовались в составах ЛП или данных лекарственных формах; • фиксированной комбинации, которая содержит хотя бы два действующих вещества с известным профилем безопасности и эффективности каждой из них, но которые ранее не применялись в данном соотношении с терапевтической целью; • растительных лекарственных препаратов. 25
Этапы и виды доклинических исследований Обязательно ДИ на животных проводятся для: • новых (оригинальных) действующих веществ и лекарственных форм, в которые входят эти вещества; • новых вспомогательных веществ, которые ранее не использовались в составах ЛП или данных лекарственных формах; • фиксированной комбинации, которая содержит хотя бы два действующих вещества с известным профилем безопасности и эффективности каждой из них, но которые ранее не применялись в данном соотношении с терапевтической целью; • растительных лекарственных препаратов. 25
 Этапы и виды доклинических исследований токсикологические: острая токсичность, токсичность при повтор ных введениях (подострая, субхроническая, хроническая), кумулятивное дейст вие, местнораздражающее действие, аллергенность, иммунотоксичность, терато ген ность, мутагенность, гонадотоксичность, канцерогенность, пирогенность; общефармакологические; специфические фармакологические (с указанием клинико фармакологической группы); фармакодинамические; фармакокинетические; химические, физические, биологические, микробиологические… 26
Этапы и виды доклинических исследований токсикологические: острая токсичность, токсичность при повтор ных введениях (подострая, субхроническая, хроническая), кумулятивное дейст вие, местнораздражающее действие, аллергенность, иммунотоксичность, терато ген ность, мутагенность, гонадотоксичность, канцерогенность, пирогенность; общефармакологические; специфические фармакологические (с указанием клинико фармакологической группы); фармакодинамические; фармакокинетические; химические, физические, биологические, микробиологические… 26
 Биоэтические нормы проведения доклинических исследований Концепция « 3 R» «Reduction» уменьшение количества животных в эксперименте «Refinement» улучшение условий содержания и использования «Replacement» предпочтение животным, которые находятся на низшей ступени эволюционного развития или альтернативным объектам и методам 27
Биоэтические нормы проведения доклинических исследований Концепция « 3 R» «Reduction» уменьшение количества животных в эксперименте «Refinement» улучшение условий содержания и использования «Replacement» предпочтение животным, которые находятся на низшей ступени эволюционного развития или альтернативным объектам и методам 27
 Клинические исследования. Надлежащая клиническая практика (GСP) GCP международный этический и научный стандарт качества планирования и проведения КИ ЛС с участием людей, а также документального оформления и представления их результатов. Мировой рынок КИ 50– 80 млрд $ в год. В Украине в 2016 г. было зарегистрировано 139 клинических испытаний, из них 100 являются международными многоцентровыми исследованиями и 39 – предрегистрационными. 28
Клинические исследования. Надлежащая клиническая практика (GСP) GCP международный этический и научный стандарт качества планирования и проведения КИ ЛС с участием людей, а также документального оформления и представления их результатов. Мировой рынок КИ 50– 80 млрд $ в год. В Украине в 2016 г. было зарегистрировано 139 клинических испытаний, из них 100 являются международными многоцентровыми исследованиями и 39 – предрегистрационными. 28
 Документы, регламентирующие клинические испытания ЛС • Хельсинская декларация Всемирной медицинской ассоциации • Руководство GCP ВОЗ • Руководство GCP ICH • Директива Европейской Комиссии 2005/28/ЕС о принципах и подробных рекомендациях в сфере исследуемых ЛС для применения у человека, а также требованиях к получению разрешения на их импортирование • Регламент Европейского Парламента и Совета № 536/2014 о проведении КИ ЛС для применения у человека • Руководства Совета научных медицинских обществ (The Council for International Organizations of Medical Sciences — CIOMS) • Национальные правила GCP. 29
Документы, регламентирующие клинические испытания ЛС • Хельсинская декларация Всемирной медицинской ассоциации • Руководство GCP ВОЗ • Руководство GCP ICH • Директива Европейской Комиссии 2005/28/ЕС о принципах и подробных рекомендациях в сфере исследуемых ЛС для применения у человека, а также требованиях к получению разрешения на их импортирование • Регламент Европейского Парламента и Совета № 536/2014 о проведении КИ ЛС для применения у человека • Руководства Совета научных медицинских обществ (The Council for International Organizations of Medical Sciences — CIOMS) • Национальные правила GCP. 29
 Общие принципы GCP 1. КИ следует проводить в соответствии с этическими принципами Хельсинкской декларации, правилами GCP и соответствующими регуляторными требованиями 2. До начала КИ должна быть проведена оценка соотношения предвидимого риска с ожидаемой пользой для субъекта исследования и общества. КИ может быть начато и продолжено только в том случае, если ожидаемая польза оправдывает риск. 3. Права, безопасность и благополучие субъектов испытания важнее интересов науки и общества. 4. Имеющиеся данные доклинического изучения исследуемого препарата должны быть достаточными для обоснования планируемого КИ. 5. КИ должно быть научно обосновано, подробно и четко описано в протоколе. 6. Испытание следует проводить в соответствии с протоколом, в отношении которого заранее получено одобрение/положительное решение этической комиссии. 30
Общие принципы GCP 1. КИ следует проводить в соответствии с этическими принципами Хельсинкской декларации, правилами GCP и соответствующими регуляторными требованиями 2. До начала КИ должна быть проведена оценка соотношения предвидимого риска с ожидаемой пользой для субъекта исследования и общества. КИ может быть начато и продолжено только в том случае, если ожидаемая польза оправдывает риск. 3. Права, безопасность и благополучие субъектов испытания важнее интересов науки и общества. 4. Имеющиеся данные доклинического изучения исследуемого препарата должны быть достаточными для обоснования планируемого КИ. 5. КИ должно быть научно обосновано, подробно и четко описано в протоколе. 6. Испытание следует проводить в соответствии с протоколом, в отношении которого заранее получено одобрение/положительное решение этической комиссии. 30
 Общие принципы GCP 7. Ответственность за оказание субъектам испытания медицинской помощи и принятие решений медицинского характера может взять на себя только квалифицированный врач. 8. Все лица, участвующие в проведении КИ, должны иметь образование, профессиональную подготовку и опыт, соответствующие выполняемым функциям 9. До включения субъекта в КИ необходимо получить его добровольное информированное согласие. 10. Регистрировать, обрабатывать и хранить всю получаемую в ходе КИ информацию следует таким образом, чтобы обеспечить корректное представление, интерпретацию и верификацию данных. 11. Необходимо обеспечить конфиденциальность документов, позволяющих установить личность субъекта, при соблюдении прав на неприкосновенность частной жизни и конфиденциальность согласно существующим регуляторным требованиям. 12. Производство и хранение исследуемых препаратов, а также обращение с ними должны осуществляться в соответствии с принципами GMP. Препараты необходимо применять в соответствии с утвержденным протоколом. 31
Общие принципы GCP 7. Ответственность за оказание субъектам испытания медицинской помощи и принятие решений медицинского характера может взять на себя только квалифицированный врач. 8. Все лица, участвующие в проведении КИ, должны иметь образование, профессиональную подготовку и опыт, соответствующие выполняемым функциям 9. До включения субъекта в КИ необходимо получить его добровольное информированное согласие. 10. Регистрировать, обрабатывать и хранить всю получаемую в ходе КИ информацию следует таким образом, чтобы обеспечить корректное представление, интерпретацию и верификацию данных. 11. Необходимо обеспечить конфиденциальность документов, позволяющих установить личность субъекта, при соблюдении прав на неприкосновенность частной жизни и конфиденциальность согласно существующим регуляторным требованиям. 12. Производство и хранение исследуемых препаратов, а также обращение с ними должны осуществляться в соответствии с принципами GMP. Препараты необходимо применять в соответствии с утвержденным протоколом. 31
 Фазы и виды клинических исследований Фазы I II IV Описание Цель Участвуют в КИ здоровые добровольцы (если установить переносимость, препарат высокотоксичный (например, для лечения фармакокинетические и онкологических заболеваний и СПИДа, то фармакодинамические параметры, дать исследования проводятся с участием пациентов, предварительную оценку безопасности страдающих соответствующим заболеванием). КИ на группах пациентов с профильным Установить эффективность препарата на заболеванием. пациентах с исследуемым заболеванием. Обязательно наличие контрольной группы Оценить безопасность ЛС. Определить уровень терапевтической дозы Многоцентровые КИ с участием больших и различных групп пациентов с сопутствующей патологией. Данные, полученные в КИ III фазы, являются основой для создания инструкции по применению препарата и важным фактором для принятия регуляторными органами решения о регист рации ЛС и возможности его медицинского использования. КИ после регистрации ЛС, постмаркетинговые Количество испытуемых 20 100 500 Изучить характер наиболее частых 1000 3000 не же ла тельных реакций, клинически значимые лекарственные взаимодействия, влия ние возраста, сопутствующих состояний и т. д. Выявление отличий нового ЛС от других >10000 препаратов его класса, выявление побочных эффектов. Сравнение эффективности по отношению к аналогичным препаратам и методам лечения. Демонстрация его пользы с точки зрения экономики здравоохранения в условиях фармацевтического рынка 32
Фазы и виды клинических исследований Фазы I II IV Описание Цель Участвуют в КИ здоровые добровольцы (если установить переносимость, препарат высокотоксичный (например, для лечения фармакокинетические и онкологических заболеваний и СПИДа, то фармакодинамические параметры, дать исследования проводятся с участием пациентов, предварительную оценку безопасности страдающих соответствующим заболеванием). КИ на группах пациентов с профильным Установить эффективность препарата на заболеванием. пациентах с исследуемым заболеванием. Обязательно наличие контрольной группы Оценить безопасность ЛС. Определить уровень терапевтической дозы Многоцентровые КИ с участием больших и различных групп пациентов с сопутствующей патологией. Данные, полученные в КИ III фазы, являются основой для создания инструкции по применению препарата и важным фактором для принятия регуляторными органами решения о регист рации ЛС и возможности его медицинского использования. КИ после регистрации ЛС, постмаркетинговые Количество испытуемых 20 100 500 Изучить характер наиболее частых 1000 3000 не же ла тельных реакций, клинически значимые лекарственные взаимодействия, влия ние возраста, сопутствующих состояний и т. д. Выявление отличий нового ЛС от других >10000 препаратов его класса, выявление побочных эффектов. Сравнение эффективности по отношению к аналогичным препаратам и методам лечения. Демонстрация его пользы с точки зрения экономики здравоохранения в условиях фармацевтического рынка 32
 v 33
v 33
 Разработка генерических лекарственных средств Генерический лекарственный препарат (генерик, взаимозаменяемый) — лекарственный препарат, который имеет такой же качественный и количественный состав действующих веществ и лекарственную форму, как и референтный препарат, и чья взаимозаменяемость с референтным препаратом доказана соответствующими исследованиями. Различные соли, простые и сложные эфиры, изомеры, смеси изомеров, комплексы или производные действующего вещества считаются одним и тем же действующим веществом при условии, что они существенно не отличаются с точки зрения безопасности и эффективности. Различные лекарственные формы перорального применения с немедленным высвобождением считаются одной и той же лекарственной формой. Генерические ЛС могут выходить на рынок как фирменные, с собственной зарегистрированной торговой маркой, так и немарочные, которые в названии употребляют упрощенное название действующего вещества и имеют ту же лекарственную форму. 34
Разработка генерических лекарственных средств Генерический лекарственный препарат (генерик, взаимозаменяемый) — лекарственный препарат, который имеет такой же качественный и количественный состав действующих веществ и лекарственную форму, как и референтный препарат, и чья взаимозаменяемость с референтным препаратом доказана соответствующими исследованиями. Различные соли, простые и сложные эфиры, изомеры, смеси изомеров, комплексы или производные действующего вещества считаются одним и тем же действующим веществом при условии, что они существенно не отличаются с точки зрения безопасности и эффективности. Различные лекарственные формы перорального применения с немедленным высвобождением считаются одной и той же лекарственной формой. Генерические ЛС могут выходить на рынок как фирменные, с собственной зарегистрированной торговой маркой, так и немарочные, которые в названии употребляют упрощенное название действующего вещества и имеют ту же лекарственную форму. 34
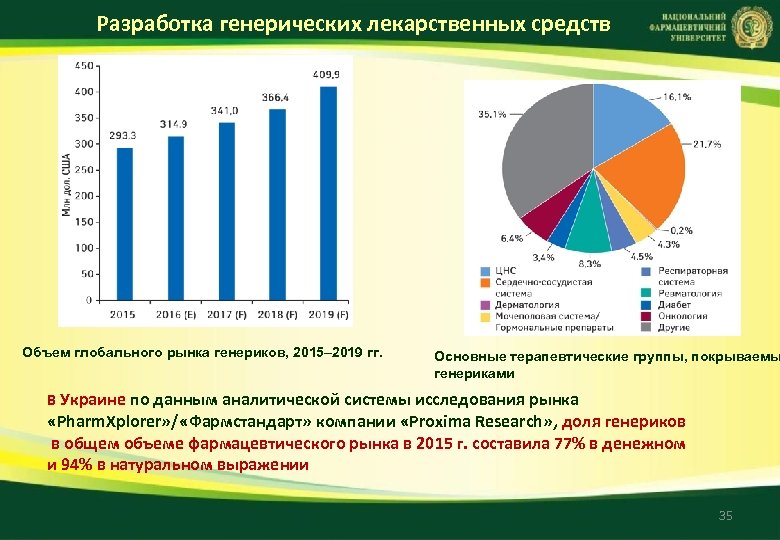 Разработка генерических лекарственных средств Объем глобального рынка генериков, 2015– 2019 гг. Основные терапевтические группы, покрываемы генериками В Украине по данным аналитической системы исследования рынка «Pharm. Xplorer» / «Фармстандарт» компании «Proxima Research» , доля генериков в общем объеме фармацевтического рынка в 2015 г. составила 77% в денежном и 94% в натуральном выражении 35
Разработка генерических лекарственных средств Объем глобального рынка генериков, 2015– 2019 гг. Основные терапевтические группы, покрываемы генериками В Украине по данным аналитической системы исследования рынка «Pharm. Xplorer» / «Фармстандарт» компании «Proxima Research» , доля генериков в общем объеме фармацевтического рынка в 2015 г. составила 77% в денежном и 94% в натуральном выражении 35
 Разработка генерических лекарственных средств Биоэквивалентность — соответствие фармацевтических и терапевтических показателей у оригинального и воспроизведенного ЛС. Впервые указанный термин в значении «отсутствие существенных отличий в способности АФИ достигать места действия ЛС» (США, 1984 г. ). Фармацевтическая (химическая) эквивалентность не тождественна биоэквивалентности. ЛС являются фармацевтически эквивалентными, если они содержат один и тот же АФИ в одинаковых концентрациях (дозах) и вводятся в организм одним и тем же путем. При этом не обязательна идентичность состава вспомогательных веществ, цвета, вкуса. Биоэквивалентными ЛС могут быть признаны тогда, когда они: а) фармацевтически эквивалентны или альтернативны (содержат один и тот же АФИ, но в виде разных солей) и соответствуют принятым фармакопейным стандартам (содержание АФИ, состав сопутствующих примесей и остаточных растворителей, скорость высвобождения из лекарственной формы, растворимость АФИ и др. ); б) их фармакокинетические показатели, главным образом биодоступность (AUC 0–t, Сmax, tmax), различаются не более чем на 20 %; в) они произведены с соблюдением требований GMP. 36
Разработка генерических лекарственных средств Биоэквивалентность — соответствие фармацевтических и терапевтических показателей у оригинального и воспроизведенного ЛС. Впервые указанный термин в значении «отсутствие существенных отличий в способности АФИ достигать места действия ЛС» (США, 1984 г. ). Фармацевтическая (химическая) эквивалентность не тождественна биоэквивалентности. ЛС являются фармацевтически эквивалентными, если они содержат один и тот же АФИ в одинаковых концентрациях (дозах) и вводятся в организм одним и тем же путем. При этом не обязательна идентичность состава вспомогательных веществ, цвета, вкуса. Биоэквивалентными ЛС могут быть признаны тогда, когда они: а) фармацевтически эквивалентны или альтернативны (содержат один и тот же АФИ, но в виде разных солей) и соответствуют принятым фармакопейным стандартам (содержание АФИ, состав сопутствующих примесей и остаточных растворителей, скорость высвобождения из лекарственной формы, растворимость АФИ и др. ); б) их фармакокинетические показатели, главным образом биодоступность (AUC 0–t, Сmax, tmax), различаются не более чем на 20 %; в) они произведены с соблюдением требований GMP. 36
 Разработка генерических лекарственных средств Для оценки терапевтической эквивалентности ЛС приняты следующие виды исследований: • сравнительные исследования биодоступности in vivo на людях. При этом допускается проведение тестов in vitro при условии их доказанного соответствия показателям обоснованности и валидации, определенным in vivo на людях; • сравнительные фармакодинамические исследования на людях; • тесты на растворение in vitro. • сравнительные КИ, проводимые в случае, когда невозможно определить фармакокинетический профиль или найти приемлемые фармакодинамические конечные точки. 37
Разработка генерических лекарственных средств Для оценки терапевтической эквивалентности ЛС приняты следующие виды исследований: • сравнительные исследования биодоступности in vivo на людях. При этом допускается проведение тестов in vitro при условии их доказанного соответствия показателям обоснованности и валидации, определенным in vivo на людях; • сравнительные фармакодинамические исследования на людях; • тесты на растворение in vitro. • сравнительные КИ, проводимые в случае, когда невозможно определить фармакокинетический профиль или найти приемлемые фармакодинамические конечные точки. 37
 Надлежащая производственная практика (GМP) Производство лекарственных средств деятельность, связанная с серийным выпуском ЛС, которая включает все или хотя бы одну из операций по технологическому процессу, контролю качества, выдаче разрешения на выпуск (сертификации) серии, а также закупку материалов и продукции, хранение, оптовую торговлю (дистрибуцию) ЛС собственного производства. Надлежащая производственная практика (Good Manufacturing Practice, GMP) часть обеспечения качества, которая гарантирует, что ЛС пос то ян но производятся и контролируются в соответствии со стандартами качес тва, которые соответствуют их назначению, а также в соответствии с требова ния ми регистрационного досье, досье исследуемого ЛС для КИ или специфи ка ции на эту продукцию. Правила GMP предназначены в первую очередь для сни же ния риска, присущего любой фармацевтической продукции, которого нельзя полностью предотвратить путем проведения испытаний готовой продукции. 38
Надлежащая производственная практика (GМP) Производство лекарственных средств деятельность, связанная с серийным выпуском ЛС, которая включает все или хотя бы одну из операций по технологическому процессу, контролю качества, выдаче разрешения на выпуск (сертификации) серии, а также закупку материалов и продукции, хранение, оптовую торговлю (дистрибуцию) ЛС собственного производства. Надлежащая производственная практика (Good Manufacturing Practice, GMP) часть обеспечения качества, которая гарантирует, что ЛС пос то ян но производятся и контролируются в соответствии со стандартами качес тва, которые соответствуют их назначению, а также в соответствии с требова ния ми регистрационного досье, досье исследуемого ЛС для КИ или специфи ка ции на эту продукцию. Правила GMP предназначены в первую очередь для сни же ния риска, присущего любой фармацевтической продукции, которого нельзя полностью предотвратить путем проведения испытаний готовой продукции. 38
 Надлежащая производственная практика (GМP) ВОЗ PIC/S ICH Основные руководства по GMP Международные организации WHO Надлежащая производственная практика для медицинских продуктов: основные принципы/ Серия технических докладов 2011. № 961. PIC/S Руководство по Надлежащей производственной практике для медицинских продуктов (PE 009 12) ICH Q 7 A «Руководство по Надлежащей производственной практике для активных фармацевтических ингредиентов» [82] ICH Q 9 Управление рисками для качества ICH Q 10 Фармацевтическая система качества Региональные организации ЕС Директива 2001/83/EC Директива 2003/94/EC Правила, регулирующие ЛС в Европейском Союзе. Том 4. Правила ЕС по надлежащей производственной практике ЛС для человека и применения в ветеринарии Национальные организации Украина Руководство СТ Н МЗУ 42 4. 0: 2016 «Лекарственные средства. Надлежащая производственная практика» Руководство 42 4. 1: 2011 «Лекарственные средства. Досье производственного участка» СТ Н МЗУ 42 4. 7: 2016 «Лекарственные средства. Установление границ влияния на здоровье для использования при идентификации риска в случае производства различных лекарственных препаратов с помощью технических средств общего пользования» СТ Н МЗУ 42 4. 8: 2016 «Лекарственные средства. Формализованное общее оценки рисков с целью установления соответствующей надлежащей производственной практики для вспомогательных веществ, используемых в лекарственных препаратах для человека » СТ Н МЗУ 42 3. 5: 2016 «Лекарственные средства. Валидация процессов » Руководство СТ Н МЗУ 42 3. 0: 2011 «Лекарственные средства. Фармацевтическая разработка (ICH Q 8)» Руководство СТ Н МЗУ 42 4. 2: 2011 «Лекарственные средства. Управление рисками для качества (ICH Q 9)» Руководство СТ Н МЗУ 42 4. 3: 2011 «Лекарственные средства. Фармацевтическая система качества (ICH Q 10)» 39
Надлежащая производственная практика (GМP) ВОЗ PIC/S ICH Основные руководства по GMP Международные организации WHO Надлежащая производственная практика для медицинских продуктов: основные принципы/ Серия технических докладов 2011. № 961. PIC/S Руководство по Надлежащей производственной практике для медицинских продуктов (PE 009 12) ICH Q 7 A «Руководство по Надлежащей производственной практике для активных фармацевтических ингредиентов» [82] ICH Q 9 Управление рисками для качества ICH Q 10 Фармацевтическая система качества Региональные организации ЕС Директива 2001/83/EC Директива 2003/94/EC Правила, регулирующие ЛС в Европейском Союзе. Том 4. Правила ЕС по надлежащей производственной практике ЛС для человека и применения в ветеринарии Национальные организации Украина Руководство СТ Н МЗУ 42 4. 0: 2016 «Лекарственные средства. Надлежащая производственная практика» Руководство 42 4. 1: 2011 «Лекарственные средства. Досье производственного участка» СТ Н МЗУ 42 4. 7: 2016 «Лекарственные средства. Установление границ влияния на здоровье для использования при идентификации риска в случае производства различных лекарственных препаратов с помощью технических средств общего пользования» СТ Н МЗУ 42 4. 8: 2016 «Лекарственные средства. Формализованное общее оценки рисков с целью установления соответствующей надлежащей производственной практики для вспомогательных веществ, используемых в лекарственных препаратах для человека » СТ Н МЗУ 42 3. 5: 2016 «Лекарственные средства. Валидация процессов » Руководство СТ Н МЗУ 42 3. 0: 2011 «Лекарственные средства. Фармацевтическая разработка (ICH Q 8)» Руководство СТ Н МЗУ 42 4. 2: 2011 «Лекарственные средства. Управление рисками для качества (ICH Q 9)» Руководство СТ Н МЗУ 42 4. 3: 2011 «Лекарственные средства. Фармацевтическая система качества (ICH Q 10)» 39
 Надлежащая производственная практика (GМP) Принципы GMP 1. постоянное совершенствование системы качества 2. гигиена, вовлечение персонала и понимание ключевых компетенций 3. надлежащие помещения, оборудование и инженерные системы 4. системность и простота документации 5. управляемые производственные процессы 6. надежность и достоверность контроля качества 7. взаимодействие с партнерами (управление аутсорсинговыми работами) 8. реакция на жалобы и эффективный отзыв продукции 9. постоянная самооценка деятельности 10. валидация процессов 11. роль Уполномоченного Лица 12. принятие решений на основе фактов с учетом потенциальных рисков по качеству. 40
Надлежащая производственная практика (GМP) Принципы GMP 1. постоянное совершенствование системы качества 2. гигиена, вовлечение персонала и понимание ключевых компетенций 3. надлежащие помещения, оборудование и инженерные системы 4. системность и простота документации 5. управляемые производственные процессы 6. надежность и достоверность контроля качества 7. взаимодействие с партнерами (управление аутсорсинговыми работами) 8. реакция на жалобы и эффективный отзыв продукции 9. постоянная самооценка деятельности 10. валидация процессов 11. роль Уполномоченного Лица 12. принятие решений на основе фактов с учетом потенциальных рисков по качеству. 40
 Надлежащая практика хранения (GSP) Хранение и транспортировка ЛС и фармацевтической продукции имеют место на всех этапах обращения ЛС, от производства до пациента, и должны осуществляться в соответствии со стандартом Надлежащей практики хранения (Good Storage Practise — GSP). Руководство GSP предназначено для всех сотрудников, деятельность которых относится к хранению, транспортировке и дистрибьюции фармацевтической продукции, и применимо к производителям, импортерам и различным поставщикам, дистрибьюторами, оптовым фирмам, аптекам и другим учреждениям здравоохранения. 41
Надлежащая практика хранения (GSP) Хранение и транспортировка ЛС и фармацевтической продукции имеют место на всех этапах обращения ЛС, от производства до пациента, и должны осуществляться в соответствии со стандартом Надлежащей практики хранения (Good Storage Practise — GSP). Руководство GSP предназначено для всех сотрудников, деятельность которых относится к хранению, транспортировке и дистрибьюции фармацевтической продукции, и применимо к производителям, импортерам и различным поставщикам, дистрибьюторами, оптовым фирмам, аптекам и другим учреждениям здравоохранения. 41
 Надлежащая практика хранения (GSP) Основные требования GSP Персонал Помещения и оборудование • Помещения для хранения продукции • Условия хранения • Контроль условий хранения Требования к хранению продукции • Документация: письменные инструкции и отчеты • Маркировка и контейнеры • Получение материалов и фармацевтической продукции • Обновление запасов и контроль • Проверка на наличие просроченных и вышедших из употребления материалов и продукции Возврат товара Отправка и транспортировка Отзыв продукции 42
Надлежащая практика хранения (GSP) Основные требования GSP Персонал Помещения и оборудование • Помещения для хранения продукции • Условия хранения • Контроль условий хранения Требования к хранению продукции • Документация: письменные инструкции и отчеты • Маркировка и контейнеры • Получение материалов и фармацевтической продукции • Обновление запасов и контроль • Проверка на наличие просроченных и вышедших из употребления материалов и продукции Возврат товара Отправка и транспортировка Отзыв продукции 42
 Надлежащая практика дистрибуции (GDP) Оптовая торговля ЛС — это деятельность по приобретению ЛС у производителей ЛС либо других субъектов хозяйствования, хранению и продаже ЛС из аптечных (фармацевтических) складов другим субъектам оптовой и розничной торговли ЛС, которые получили на это соответствующие лицензии, и непосредственно лечебно профилактическим учреждениям и производителям ЛС. Дистрибутор субъект хозяйствования, имеющий лицензию на оптовую торговлю ЛС и осуществляющий соответствующую деятельность относительно их дистрибьюции (оптовой торговли). Надлежащая практика дистрибуции (Good Distribution Practice — GDP) — это одна из систем контроля качества, обеспечивающая качество фармацевтической продукции, которое гарантируется соответствующим контролем действий, совершаемых в ходе дистрибуции, а также инструмент, обеспечивающий защиту организации от фальсифицированных, недоброкачественных и контрафактных ЛС. 43
Надлежащая практика дистрибуции (GDP) Оптовая торговля ЛС — это деятельность по приобретению ЛС у производителей ЛС либо других субъектов хозяйствования, хранению и продаже ЛС из аптечных (фармацевтических) складов другим субъектам оптовой и розничной торговли ЛС, которые получили на это соответствующие лицензии, и непосредственно лечебно профилактическим учреждениям и производителям ЛС. Дистрибутор субъект хозяйствования, имеющий лицензию на оптовую торговлю ЛС и осуществляющий соответствующую деятельность относительно их дистрибьюции (оптовой торговли). Надлежащая практика дистрибуции (Good Distribution Practice — GDP) — это одна из систем контроля качества, обеспечивающая качество фармацевтической продукции, которое гарантируется соответствующим контролем действий, совершаемых в ходе дистрибуции, а также инструмент, обеспечивающий защиту организации от фальсифицированных, недоброкачественных и контрафактных ЛС. 43
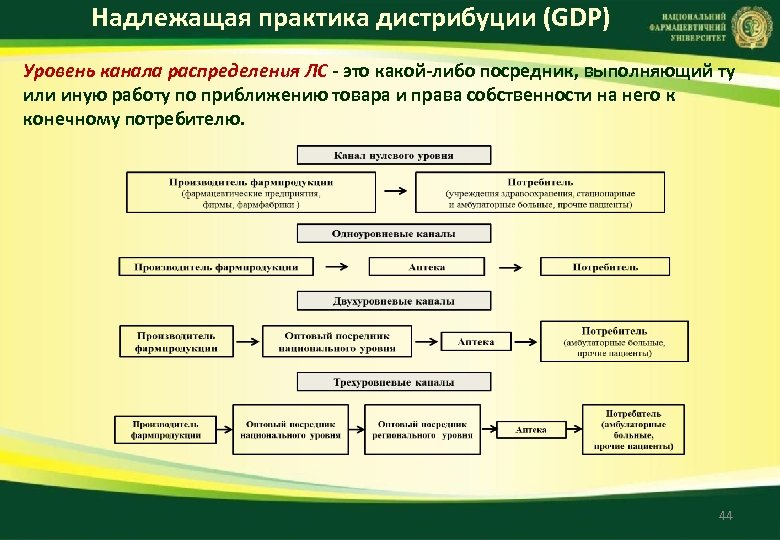 Надлежащая практика дистрибуции (GDP) Уровень канала распределения ЛС это какой либо посредник, выполняющий ту или иную работу по приближению товара и права собственности на него к конечному потребителю. 44
Надлежащая практика дистрибуции (GDP) Уровень канала распределения ЛС это какой либо посредник, выполняющий ту или иную работу по приближению товара и права собственности на него к конечному потребителю. 44
 Надлежащая аптечная практика (GPP) Фармацевтическое обеспечение является интегрированной системой, объединяющей реализацию фармацевтической помощи, фармацевтической услуги и обеспечение лекарствами. Фармацевтическая помощь комплекс организационно правовых, социально экономических и медико фармацевтических мероприятий, направленных на сохранение здоровья и жизни человека, профилактику и лечение. Составляющими фармацевтической помощи являются обеспечение ЛС, фармацевтическая этика и деонтология, фармацевтическая диагностика, фармацевтическая опека и фармацевтическая профилактика. Фармацевтическая услуга это предоставленная населению фармацевтическая помощь как результат профессиональной деятельности фармацевтических работников, имеющий стоимостную оценку. Надлежащая аптечная практика (GPP) совокупность правил розничной реализации ЛС, их хранения, контроля качества, изготовление в условиях аптеки, отпуска, рационального использования по принципу клинической целесообразности и экономической доступности в интересах пациента, соблюдение которых обеспечивает качество ЛС на всех этапах их закупки, изготовление, хранение и розничной реализации, а также предусматривает реализацию ответственного самолечения. 45
Надлежащая аптечная практика (GPP) Фармацевтическое обеспечение является интегрированной системой, объединяющей реализацию фармацевтической помощи, фармацевтической услуги и обеспечение лекарствами. Фармацевтическая помощь комплекс организационно правовых, социально экономических и медико фармацевтических мероприятий, направленных на сохранение здоровья и жизни человека, профилактику и лечение. Составляющими фармацевтической помощи являются обеспечение ЛС, фармацевтическая этика и деонтология, фармацевтическая диагностика, фармацевтическая опека и фармацевтическая профилактика. Фармацевтическая услуга это предоставленная населению фармацевтическая помощь как результат профессиональной деятельности фармацевтических работников, имеющий стоимостную оценку. Надлежащая аптечная практика (GPP) совокупность правил розничной реализации ЛС, их хранения, контроля качества, изготовление в условиях аптеки, отпуска, рационального использования по принципу клинической целесообразности и экономической доступности в интересах пациента, соблюдение которых обеспечивает качество ЛС на всех этапах их закупки, изготовление, хранение и розничной реализации, а также предусматривает реализацию ответственного самолечения. 45
 Надлежащая аптечная практика (GPP) Роль фармацевта Функции фармацевта Прием, хранение, безопасность, Приготовление екстемпоральних ЛС администрирование и отпуск ЛС и Получение, надлежащее хранение ЛС и ИМН по соблюдению ИМН национальных стандартов на эти виды деятельности Распределение ЛС и ИМН в пределах национальных стандартов Назначение медикаментов, вакцин да и других инъекционных ЛС Дозирование лекарственных препаратов Утилизация ЛС и ИМН Обеспечение эффективного управления лекарственной терапией Образование и улучшение профессиональной деятельности Внесение улучшений в эффективность системы здравоохранения и здоровья населения Оценка состояния здоровья пациента Управление терапией пациента Мониторинг прогресса пациента и результатов лечения Предоставление информации о ЛС и связанные со здоровьем проблемы Планирование и осуществление непрерывного профессионального развития. стратегии улучшения Распространение информации о ЛС и различных аспектах самолечения Участие в деятельности профилактики Соблюдение национальных профессиональных обязанностей, руководящих принципов и законодательства Защита и поддержка национальной политики, способствующей улучшению результатов лечения 46
Надлежащая аптечная практика (GPP) Роль фармацевта Функции фармацевта Прием, хранение, безопасность, Приготовление екстемпоральних ЛС администрирование и отпуск ЛС и Получение, надлежащее хранение ЛС и ИМН по соблюдению ИМН национальных стандартов на эти виды деятельности Распределение ЛС и ИМН в пределах национальных стандартов Назначение медикаментов, вакцин да и других инъекционных ЛС Дозирование лекарственных препаратов Утилизация ЛС и ИМН Обеспечение эффективного управления лекарственной терапией Образование и улучшение профессиональной деятельности Внесение улучшений в эффективность системы здравоохранения и здоровья населения Оценка состояния здоровья пациента Управление терапией пациента Мониторинг прогресса пациента и результатов лечения Предоставление информации о ЛС и связанные со здоровьем проблемы Планирование и осуществление непрерывного профессионального развития. стратегии улучшения Распространение информации о ЛС и различных аспектах самолечения Участие в деятельности профилактики Соблюдение национальных профессиональных обязанностей, руководящих принципов и законодательства Защита и поддержка национальной политики, способствующей улучшению результатов лечения 46
 Надлежащая аптечная практика (GPP) Основные принципы GPP • Фармацевты и, соответственно, фармацевтическая помощь должны быть доступны для пациента; • фармацевт принимает участие в выявлении и менеджменте (управлении) проблем пациентов со здоровьем; • фармацевт принимает участие в пропаганде здорового образа жизни и здоровья как ценности; • фармацевт принимает участие в обеспечении качества лекарственных средств; • фармацевт должен предотвратить вред здоровью, который могут нанести лекарственные средства; • фармацевт способствует оптимальному использованию ограниченных ресурсов здравоохранения . 47
Надлежащая аптечная практика (GPP) Основные принципы GPP • Фармацевты и, соответственно, фармацевтическая помощь должны быть доступны для пациента; • фармацевт принимает участие в выявлении и менеджменте (управлении) проблем пациентов со здоровьем; • фармацевт принимает участие в пропаганде здорового образа жизни и здоровья как ценности; • фармацевт принимает участие в обеспечении качества лекарственных средств; • фармацевт должен предотвратить вред здоровью, который могут нанести лекарственные средства; • фармацевт способствует оптимальному использованию ограниченных ресурсов здравоохранения . 47
 Информационные ресурсы Сайт кафедры управления качеством http: //quality. nuph. edu. ua/ 1. Хрестоматия фармацевтического качества [Текст] / Ю. В. Подпружников [и др. ] ; под ред. А. Ишмухаметова. Москва : Группа Ремедиум, 2015. 430 с. : ил. , табл. ; 25 см 2. Сметаніна К. І. Основи стандартизації та сертифікації лікарських засобів. – Вінниця: Нова книга, 2010. – 376 с. 3. Всемирная организация здравоохранения http: //www. who. int/en/ 4. Международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для человека (ICH) 5. Международная система сотрудничества фармацевтических инспекций (PIC / S) http: //www. picscheme. org/ 6. Европейский директорат по качеству лекарственных средств и здравоохранения Совета Европы (EDQM) http: //www. edqrn. eu/ 7. Европейское агентство по лекарственным средствам (EMA) http: //www. ema. europa. eu/ema/ 8. Международная организация по стандартизации (ISO) http: //www. iso. org/ 9. Международная фармацевтическая федерация (FIP) http: //www. fip. org/ 10. Европейская федерация фармацевтических производителей и ассоциаций (EFPIA) http: //www. efpia. eu/ 11. Минздрав Украины www. moz. gov. ua 48
Информационные ресурсы Сайт кафедры управления качеством http: //quality. nuph. edu. ua/ 1. Хрестоматия фармацевтического качества [Текст] / Ю. В. Подпружников [и др. ] ; под ред. А. Ишмухаметова. Москва : Группа Ремедиум, 2015. 430 с. : ил. , табл. ; 25 см 2. Сметаніна К. І. Основи стандартизації та сертифікації лікарських засобів. – Вінниця: Нова книга, 2010. – 376 с. 3. Всемирная организация здравоохранения http: //www. who. int/en/ 4. Международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для человека (ICH) 5. Международная система сотрудничества фармацевтических инспекций (PIC / S) http: //www. picscheme. org/ 6. Европейский директорат по качеству лекарственных средств и здравоохранения Совета Европы (EDQM) http: //www. edqrn. eu/ 7. Европейское агентство по лекарственным средствам (EMA) http: //www. ema. europa. eu/ema/ 8. Международная организация по стандартизации (ISO) http: //www. iso. org/ 9. Международная фармацевтическая федерация (FIP) http: //www. fip. org/ 10. Европейская федерация фармацевтических производителей и ассоциаций (EFPIA) http: //www. efpia. eu/ 11. Минздрав Украины www. moz. gov. ua 48
 Спасибо за внимание! 49
Спасибо за внимание! 49


