3_MLS_ONDPE.ppt
- Количество слайдов: 20

Кафедра Промышленной фармации Исследования при разработке мягких лекарственых средств Workshop on 1

Пример • В качестве примера – разработка мягкой лекарственной формы • • Линименты Мази Пасты Гели Кремы Пластыри Медицинские карандаши (на жировой основе) 2

Выбор лекарственной формы • Факторы: • • • Место нанесения Назначение Тип воздействия Действующие вещества Вспомогательные вещества Влияние внешних факторов 3

Факторы • Место нанесения • • • Кожные покровы Слизистая Волосистая часть головы Глаза Ногтевая пластина 4

Факторы • Назначение (тип воздействия) • Эпидермально (местное действие) • Трансдермально (общее или резорбтивное действие) 5

Факторы • Действующие вещества • Совместимость • Растворимость и другие физико-химические свойства • Синергизм (потенцирование эффекта терапевтического действия) 6

Факторы • Вспомогательные вещества • Совместимость с действующими веществами • Потенцирующее влияние на различные составляющие лекарственной формы • Не мешать при проведении анализа 7

Факторы • Внешние факторы • • • Условия нанесения Стабильность при хранении Выбор упаковки Условия транспортировки и хранения Специальные факторы (стерильность, возможность стерилизации и т. д. ) 8
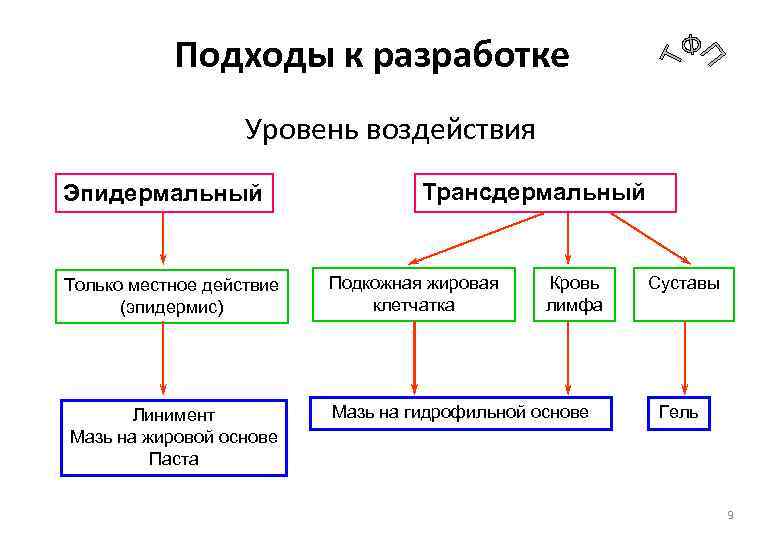
Подходы к разработке Уровень воздействия Эпидермальный Только местное действие (эпидермис) Линимент Мазь на жировой основе Паста Трансдермальный Подкожная жировая клетчатка Кровь лимфа Мазь на гидрофильной основе Суставы Гель 9
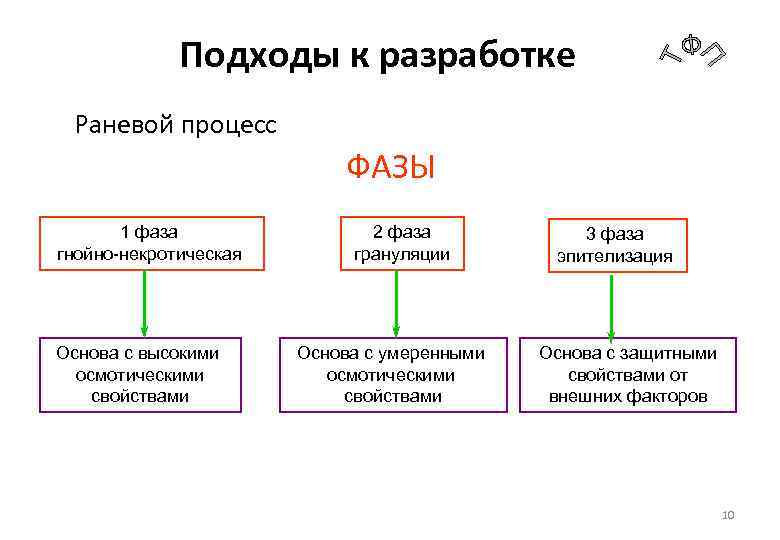
Подходы к разработке Раневой процесс ФАЗЫ 1 фаза гнойно-некротическая Основа с высокими осмотическими свойствами 2 фаза грануляции Основа с умеренными осмотическими свойствами 3 фаза эпителизация Основа с защитными свойствами от внешних факторов 10

Этапы разработки МЛС • Поиск информации • Изучение физико-химических свойств субстанции • Разработка основы и технология производства • Разработка методов контроля качества МЛФ • Наработка трех серий • Апробация ЛП в производственных условиях • Подача регистрационного досье на препарат • Первый промышленный выпуск ЛС • Акт и отчет о ППВ 11

Поиск информации 1. Выбор референтного препарата (согласно маркетинговым исследованиям, результативности применения в терапии); 2. Анализ нескольких составов на разрабатываемый препарат; 3. Теоретический анализ действующего вещества 4. Изучение показателей качества (согласно сертификату качества референтного препарата); 5. Бенчмаркетинг - это процесс определения, понимания и адаптации имеющихся примеров эффективного производства ЛП конкурирующих компаний с целью улучшения собственной работы. Цель: сократить время разработки ЛП, превосходство разработанного препарата над референтным. 12

Изучение физико-химических свойств субстанции При разработке МЛФ субстанции могут быть жидкие и твердые. Твердые 1. Кристаллическая форма (для суспензии) 2. Фракционный состав 3. Растворимость Жидкие 1. Вязкость 2. Плотность 3. Растворимость 4. р. Н 4. Термолабильность 5. р. Н 13

Разработка мазевой основы и технология производства Выбор мазевых основ: 1. Гидрофобные Требования, предъявляемые к мазевым основам: 2. Абсорбционные 1. Обладать мажущей способностью 3. Водосмываемые 2. 4. Водорастворимые Обладать абсорбционной способностью 5. Эмульсионные 3. Обладать химической стойкостью 4. Быть индифферентной в фармакологическом отношении 14

Разработка методов контроля качества лекарственных средств Качество выпускаемых мазей определяется различными показателями: 1. Качественный и количественный состав 2. Структурно-механические свойства (консистенция, степень высвобождения ЛВ и стабильность) 3. Если суспензионная мазь – определяют дисперсность частиц, размер частиц 4. Эмульсионная мазь - определяют дисперсность и размер дисперсионной фазы 5. Микробиологический контроль 6. Биологический контроль 15

Апробация ЛП в производственных условиях Масштабирование – перевод препарата из лаборатории на промышленные объемы с помощью технологических методов 16

Наработка трех серий В производственных условиях проводится наработка 3 -х серий разрабатываемого препарата. Объем серии согласовывается с аналитиками и разработчиками генерика. Цель данной стадии разработки препарата в том, что из каждой серии препарата аналитики отбирают необходимое количество образцов для проведения контроля на стабильность (ускоренное хранение). Результат этого анализа дает высокую степень уверенности в том, что препарат стабилен на протяжении предусмотренного срока годности. 17

Подача заявления на регистрацию препарата 1. Состав (аналитические листы на все компоненты состава, сертификаты качества субстанции) 2. Данные о первичной упаковке 3. Краткая технология производства 4. Метод изготовления 5. Отчет о фармацевтической разработке 6. Сертификации качества на образцы отправляемые в государственный фармакологический центр для окончательной регистрации 18

Первый промышленный выпуск ЛС 1. Производится регламентированная серия продукции в присутствии разработчика препарата и инженера-технолога. Цель – доказательство об успешности проведения технологического процесса. 2. Готовый продукт должен пройти все методы контроля качества в ОКК, что дает высокую степень уверенности качества производства ЛП. 3. Выявление отклонений в производстве и их корректирование. 19

Акт и отчет о ППВ Акт о ППВ содержит следующие данные: 1. Наименование препарата (форма выпуска, дозировка, первичная упаковка) 2. Номер приказа ППВ 3. Номер утверждённого МКК ЛС, согласно которого был проведен контроль качества ЛП Отчет о ППВ содержит следующие данные: 4. Ф. И. О. утверждающих лиц 6. Титульный лист (ФИО разработчика, название препарата, форма выпуска, дозировка, первичная упаковка) 2. Блок-схема производства 3. Описание технологического процесса 4. Контрольные точки Выход серии 5. 1. Место для замечаний 20
3_MLS_ONDPE.ppt