Аутоиммунитет. Л.П Чурилов.ppt
- Количество слайдов: 91

Кафедра патологии медицинского факультета Санкт-Петербургского государственного университета Курс общей иммунологии Л. П. Чурилов Введение в иммунопатологию. Физиологический аутоиммунитет и аутоаллергия См. главу 16 I тома нашего учебника, предпочтительно 4 -е издание

Иммунопатологические процессы n n Штатный иммунный ответ клинически неощутим, представляет собой видоизменение иммунной системы в ответ на антиген, ведет к нормэргическому воспалению или к регуляции роста и функций клеток и не порождает сам по себе дополнительных проблем для здоровья Иммунопатологические процессы характеризуются либо слишком сильным, либо слишком слабым, либо неадекватно нацеленным и плохо отрегулированным иммунным ответом Коррелятами иммунопатологических процессов являются иммунопатологические заболевания

Иммунопатологические заболевания n n n Аллергические заболевания Аутоаллергические заболевания Иммунодефицитные и иммунодепрессивные состояния Более 30% населения страдает каким-то иммунопатологическим рассстройством К данной группе относятся такие разные болезни как инсулинзависимый сахарный диабет, брохиальная астма, диффузный гломерулонефрит, хронический аутоиммунный тироидит, системная красная волчанка, ВИЧ-инфекция и мн. др.

Аутоиммунитет и аутоаллергические заболевания. МОЖНО ЛИ СТАВИТЬ = ЕСЛИ ЕСТЬ НЕНОРМАЛЬНАЯ АУТОРЕАКТИВНОСТЬ (АУТОАЛЛЕРГИЯ) ЗНАЧИТ, ЕСТЬ (БЫЛА ДО БОЛЕЗНИ) НОРМАЛЬНАЯ АУТОРЕАКТИВНОСТЬ! ИДЕЯ ФИЗИОЛОГИЧЕСКОГО АУТОИММУНИТЕТА

Илья Ильич Мечников (1845 -1916) n n n n n Первый русский патофизиолог, пользовавшийся мировой известностью. В 1868 г. был избран приват-доцентом Санкт-Петербургского университета, и именно отсюда в 1882 отправился в командировку в Мессину, чтобы продолжить исследования беспозвоночных животных. Первооткрыватель фагоцитоза (1883) и исследователь его роли при патологических процессах, создал фагоцитарную теорию воспаления Заложил основы клеточной иммунологии и общей патофизиолгии инфекционого процесса Ввел представление о физиологическом аутоиммунитете (1914) Создал концепцию ортобиоза и предвосхитил появление ортомолекулярной медицины и представлений об эубактериозе Сформулировал оригинальную теорию старения как результата аутоинтоксикации и избыточных аутоиммунных процессов ( «Чем длиннее толстые кишки – тем жизнь короче» ) «Нет в мире Основатель филогенетического подхода в сравнительной патологии, непонятного, многое создал оригинальную теорию происхождения многоклеточных. не понято» Вместе с В. В. Подвысоцким первым высказал вирусную гипотезу этиологии рака Учитель А. А. Богомольца, Е. С. Лондона, В. К. Линдемана , соратник Л. Пастера, возглавивший после него Институт Пастера Выдающийся философский труд Мечникова «Этюды о природе человека» (1903) содержит глубочайшую идею о принципиальной, изначальной биологической дисгармонии человеческой природы, связанной с филогенетическим происхождением человека. Мечников показывает, что механизмы реактивности человека внутренне противоречивы, а последствия их использования амбивалентны, что накладывает свой отпечаток на медицину и на все биосоциальное развитие цивилизации.

n n n n Сын производителя красок, увлеченный идеей окрашивания клеток, заложил основы гистохимии, что позволило ему открыть тучные клетки, различать миелоидные и лимфоидные лейкоциты, создать представления о функциях костного мозга и патогенезе апластических анемий, дифференцировать основные виды лейкозов. Он придумал способ окрашивания туберкулезных микробов. Эрлих – основатель представлений об антителах и их комплементарном взаимодействии с антигенами, создатель серологических методов. Глубочайшее предвидение Эрлиха об антителах как «оторвавшихся от клетки рецепторах или боковых цепях протоплазмы» лежит в основе современных идей клеточной информатики. « Тела не действуют, если не распознают» - говорил Эрлих Создал научную химиотерапию (в частности, малярии, трипаносомоза, сифилиса), выдвинул идею иммунотоксинов. Считал, что лекарства должны, подобно антителам, комплементарно «Клеточные рецепторы различного сродства играют распознавать свои мишени как «волшебные пули» . большую роль в патологии. Питательные вещества Предложил метод перевивки асцитной присоединяются к ним и проникают в клетку через их карциномы и заложил основы учения о посредство. Среди этих рецепторов те, которые имеют противоопухолевом иммунитете Уподобляя антитела избирательным ядам, развил сродство к ядам, вводят их в клетку, становящуюся от представления об аутотолерантности (принцип этого больной и даже погибающей. Если клетка выживает, она вырабатывает новые рецепторы, . . . и “horror autotoxicus”) Открыл явление приобретенной лекарственной вследствие определенной реакции производит не только утраченные, но и новые рецепторы в еще большем устойчивости микробов Пауль Эрлих (1854 -1915) количестве. Будучи в изобилии, эти рецепторы переходят в жидкости, готовые вступить в реакцию с веществом, к которому имеют сродство (с ядом). Антитоксическая сыворотка есть, следовательно сыворотка, содержащая избыточные рецепторы, оторвавшиеся от клеток, поглотивших токсин, отсюда ее специфичность»

In 1901 E. I. Mechnikov suggested that autoimmunity may be physiological and involved in senescence and ontogeny In 1901 Y. S. London revealed in healthy humans natural “autospermotoxins” and “anti-autospermotoxins” suggested their regulatory role for gonads In 1904 P. Ehrlich interpreted antibodies as receptors, separated from cell surface In 1909 A. A. Bogomoletz discovered accumulation of lipid material in adrenal cortex after injection of specific antiadrenocortical antiserum In early 50 -ies L. R. Perelman proposed to immunize with subcellular fractions in order to refine the specificity of antisera

Петр Николаевич Грабар (1898 – 1986) – выдающийся русский иммунохимик (работал во Франции) − одним из первых пришел к идее необходимости аутоантител при осуществлении нормального метаболизма и онтогенеза. Основоположники учения об аутоиммунной регуляции функций и онтогенеза организма: слева направо: И. И. Мечников и А. А. Безредка, на врезке портрет Е. С. Лондона, правее сидит А. А. Богомолец, стоит Л. Р. Перельман.

n n n Ефим Семенович Лондон (1869 - 1939) Ученик И. И. Мечникова, создатель первой в нашей стране университетской кафедры биохимии в СПб. ГУ и ее первый заведующий (1928 -1939) одним из первых приступил к изучению аутоаллергии и первым доказал существование физиологических аутоантител у человека. Пионер радиобиологии, включая исследования лучевой болезни, впервые в мире разработал методику авторадиографии. Можно только поражаться глубине научных предвидений Лондона. Сохранилось его письмо Николаю II, которым он убедил монарха в необходимости выделения средств для развития ядерной медицины в России: « В ХХ веке сила и могущество наций будут зависеть от того, в какой мере они овладеют технологией радия» . Ввел признанный во всем мире оригинальный метод изучения патофизиологии обмена веществ путем органостомии и ангиостомии. Использование биохимического анализа крови, взятой на входе и на выходе из соответствующего органа, соответствовало сформулированному кибернетикой много позже принципу "черного ящика". Внес существенный вклад в изучение патофизиологии печени и пищеварения, предложил (вместе с американским коллегой Левиным) первую в истории молекулярной биологии модель строения ДНК. Создал первую модель дуоденальной недостаточности и продемонстрировали, что двенадцатиперстная кишка является жизненно важным органом. Была выяснена гормональная природа специфического динамического действия пищи, а затем, развивая эти работы, А. М. Уголев сформулировал представления об энтериновой гормональной системе. Заложил основы учения о голодании как эндогенном питании организма

Аутоантитела присутствуют в норме

Аутоиммунитет и аутоаллергия n n n n УМЕРЕННЫЙ АУТОИММУННЫЙ ОТВЕТ – ФИЗИОЛОГИЧЕСКОЕ ЯВЛЕНИЕ, НЕОБХОДИМОЕ ДЛЯ САМОРЕГУЛЯЦИИ ИММУННОЙ СИСТЕМЫ И РЕГУЛЯЦИИ РОСТА И ФУНКЦИЙ СОМАТИЧЕСКИХ КЛЕТОК ЭКСЦЕСС АУТОИММУНИТЕТА _ АУТОАЛЛЕРГИЯ К аутоиммунным болезням, по модифицированным критериям Э. Витебского (1957), относят те формы патологии, при которых аутореактивные иммуноглобулины и/или клетки оказывают патогенетическое (деструктивное или дисрегуляторное) действие на организм. При такой болезни должны выполняться следующие критерии: расстройство воспроизводится у реципиента сывороткой или Т-клетками больного донора аутореактивные элементы иммунной системы выделяются или присутствуют в большинстве случаев болезни выделен и охарактеризован аутоантиген-мишень. В клинике дополнительным важным признаком аутоиммунной природы болезни считается эффективность лечебных воздействий, ослабляющих аутоиммунитет, а в экспериментальной медицине - наличие модели болезни на животных, воспроизводимой при спонтанном нарушении аутотолерантности или же путём иммунизации.

Двойная селекция в тимусе n При негативной селекции утрачивается способность экспрессировать один из ко-рецепторов, и Тлимфоцит теперь принадлежит к одной из субпопуляций, либо СD 4+, либо CD 8+ Стоит отметить, что клетки, слабо взаимодействующие с аутоантигенными секвенсами, элиминации не клонально рестриктированными белками подвергаются. Затем происходит изменение ГКГС Далее на кортико). медуллярной границе следует репертуара адресинов, негативная селекция. позволяющее покинуть вилочковую железу и расселиться. n Этот процесс происходит на стадии, когда Т-клетка еще имеет оба корецептора, в коре тимуса, путем взаимодействия с кортикальными эпителиоцитами вилочковой железы. Так как в результате Тклетки, способные распознавать свои белки ГКГС, подвергаются стимуляции и выживают, он называется позитивной селекцией. При позитивной селекции в выживших клонах прекращается активность генов рекомбиназ RAG 1 -2, и все полученные клоны отныне будут реагировать на секвенс-эпитопы только в контексте своих белков ГКГС (то есть оказываются

Аутотолерантность: устранение аутореактивных Т клонов до созревания

Делеция, анергия и молчание клонов

РАЗЛИЧНЫЕ МЕХАНИЗМЫ ИНДУКЦИИ ТОЛЕРАНТНОСТИ ПО КУМАРУ и соавт, 2005

Иммуносинапс – роль костимуляторных молекул n n В создании ключевой межклеточной структуры иммунной системы – иммунологического синапса участвуют взаимно распознающие молекулы – Тклеточный рецептор и ГКГС-белок с несомым на нём процессированным пептидом из состава антигена, белки семейства В 7 их лиганды и лимфоцитарные маркеры CD 28 и CD 152 ; лиганд АПК CD 40 и комплементарные ему лимфоцитарные молекулы CD 154 , а также молекулы клеточной адгезии -1 и ICAM LFA -3 на АПК и их лимфоцитарные лиганды, соответственно, LFA -1 и CD 2. Синаптоподобная структура существует до 8 часов и позволяет клеткам обмениваться активирующими контактными и цитокиновыми сигналами Молекулы, укрепляющие иммуносинапс, дрейфуют по плазматической мембране в сторону контакта иммунокомпетентных клеток и вытесняют молекулы, не участвующие в контактообразовании

n Анергия Т-клонов и гипотезабольшое значение для сдерживания ответа лимфоцитов на свои антигены опасности имеет тот факт, что при n внедрении чужеродного патогена неспецифические механизмы воспаления и преиммунного ответа индуцируют в АПК экспрессию ко-стимуляторных молекул, которые резко активируют Тклетки. При контакте с заурядно присутствующим в организме интактным антигеном такого неспецифического сигнала опасности нет, как нет и активной реакции аутореактивных клонов ( «гипотеза опасности » ). Разделение на специфический и неспецифический имм-т искусственно, физиологический аутоимм-т существует

Полли Матцингер
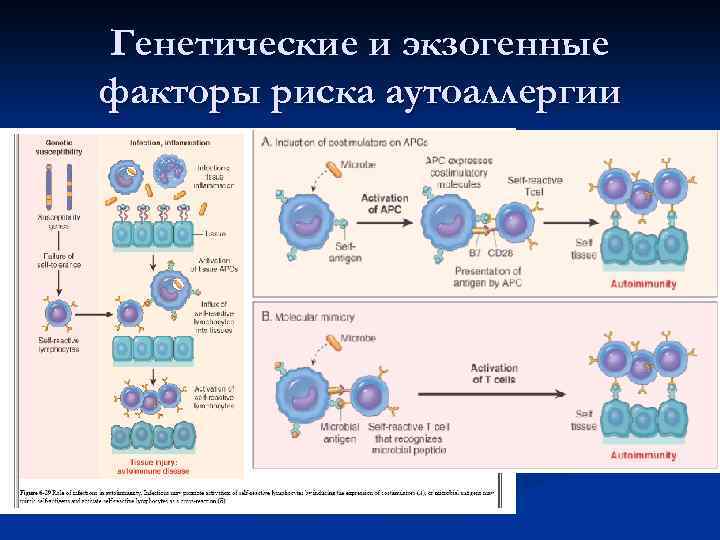
Генетические и экзогенные факторы риска аутоаллергии

Аутотолерантность от молчания Тхелперов

n n n Аутотолерантность зрелых клонов супрессия Т-хелперы 1 -го и второго типов рассматриваются в настоящее время, как важнейшие альтернативные регуляторы, переключающие ход иммунного ответа, соответственно, на рельсы ГЗТ (Тн 1) или анафилаксии (Тн 2). Наряду с Тн 1 и Тн 2, выделяют функционально гетрогенную субпопуляцию Тн 3. Т-хелперы 3 -го типаблизкие к ним, но и отличимые по поверхностным маркерам Тr 1 или Т-регуляторы 1 -го типа. обладают исключительными способностями к производству иммуносупрессорных цитокинов и с их помощью опосредуют некоторые формы супрессии индукции приобретенной толерантности. В отличие от иных. лимфоидных клеток, способных к супрессии иммунного ответа, данные лимфоциты не экспрессируют маркер CD 25, то есть α-цепь ИЛ-2

Супрессорные функции субпопуляций Т-клеток

Виды специфической супрессии: антигенопосредованная (сверху) и идиотипопосредованная (в

Serological identity between adrenocortical DNP antigen (DNP) and normal rat serum globulin antigen (NS): possible role of anti-idiotypic image of antigen. Autoantibodies similar to experimentally obtained Ig. G present in intact animal sera

А может быть, специализированные Тсупрессоры и существуют?

Существуют 2 основных механизма нарушения аутотолерантности каждый из них представлен при патологии несколькими разновидностями и многими примерами : n Аутоаллергия может развиться вследствие растормаживания активности аутореактивных Тхелперов или срыва их делеции и кооперативного усиления ими активности аутореактивных клонов эффекторов. n Аутоаллергия может развиться в обход заторможенного или элиминированного аутореактивного Т-хелпера, при стимуляции аутореактивных эффекторов иными прямыми и непрямыми путями.

Первый механизм срабатывает в следующих ситуациях: n дефицит супрессорных влияний n - аномальная экспрессия антигенов ГКГС 2 класса на клетках, где ее не происходит в норме n спонтанная активация аутореактивных Т-хелперов

Патогенез аутоаллергии n n n Существуют 2 основных механизма нарушения аутотолерантности; каждый из них представлен при патологии несколькими разновидностями и многими примерами : Аутоаллергия может развиться вследствие растормаживания активности аутореактивных Тхелперов или срыва их делеции и кооперативного усиления ими активности аутореактивных клонов эффекторов. Аутоаллергия может развиться в обход заторможенного или элиминированного аутореактивного Т -хелпера, при стимуляции аутореактивных эффекторов иными прямыми и непрямыми путями

Растормаживание аутореактивных Т-хелперов Первый механизм срабатывает в следующих ситуациях: n n n дефицит супрессорных влияний - аномальная экспрессия антигенов ГКГС 2 класса на клетках, где ее не происходит в норме спонтанная активация аутореактивных Тхелперов, нарастание в них уровня ц-АМФ и экспрессии рецепторов ИЛ-2

n n n Аутоаллергия как супрессорный иммунодефицит Аутоиммунные симптомы сопровождают парадоксальным образом многие иммунодефициты, включая ВИЧ и наследственные формы. Тимэктомия, тимомы и облучение тимуса могут давать аутоаллергические последствия Селективные дефекты аутопрезентации D-клетками тимуса дают тяжелые врожденные и ранние формы аутоаллергии (СКВ и АИТ) Более высокую частоту аутоиммунопатий у женщин объясняют иммуносупрессорной активностью андрогенов и антисупрессорным эффектом эстрогенов Мыши NZB/NZW спонтанно развивающие СКВ и иные аутоиммунопатии имеют наследственный дефицит супрессорной функции лимфоцитов

врожденные аутоиммунные лимфопролиферативные синдромы (ALPS). n При них имеется дефект Fas-белка (CD 95). Нарушается тимическая негативная селекция, сохраняется множество аутореактивных Тклонов, возникает избыток лимфоцитов, особенно CD 4 CD 8 -отрицательных клонов. Болезнь протекает на фоне полиорганного аутоаллергического поражения по типу ранней СКВ, резко увеличена частота лимфоидных неоплазий. Имеются линейные мыши lpr – модели данного заболевания, а также линии gld – генокопия ALPS с дефектом Fas-лиганда.

Аутопрезентация соматических клеток из-за аномальной экспрессии на них антигенов ГКГС II класса – основа аутоаллергии n n n Т-хелпер может распознать секвенциальную антигенную детерминанту только в комплексе с антигеном ГКГС II класса. Поэтому, аутоиммунный ответ может начаться лишь при условии экспрессии такого комплекса на какойлибо клеточной поверхности. Следовательно, молчание аутореактивных Т-хелперов зависит, в какой-то степени, от отсутствия в норме экспрессии ГКГС-II белков на соматических клетках, за исключением некоторых из них, прямо вовлеченных в иммунные ответы Но, имея гены ГКГС-II, все ядерные клетки, в принципе, способны к экспрессии этих белков. органоспецифические аутоиммунные процессы могут запускаться, если клетки органов-мишеней начинают экспрессировать белки ГКГС II класса и представлять аутореактивным Т-хелперам собственные антигены. Индукторами аномальной экспрессии служат ИФН- и ИФН- , а также ФНО, причем особенно мощным является их совместное действие. Продукция этих цитокинов может запускаться предрасполагающими к аутоаллергии вирусными инфекциями, так как эти регуляторы участвуют в противовирусном иммунитете. Ятрогенные воздействия (цитокинотерапия хронического вирусного гепатита и опухолей) могут индуцировать данный механизм. При тиропатиях аутоаллергия может зависеть от индукции экспрессии ГКГС II класса избытком йода.

спонтанная активация аутореактивных Т-хелперов n n n агенты, значительно увеличивающие концентрацию ц. АМФ в хелперных Т-лимфоцитах, могут напрямую активировать их, преодолевая клональную анергию. Примеры – метил-ДОФА, вызывающий аутоиммунную гемолитическую анемию Активаторы экспрессии рецепторов ИЛ-2 оказывают сходный эффект. Данный механизм может вносить вклад в аутоаллергические компоненты патогенеза ряда форм лекарственной аллергии и инфекций (коклюш)

Аутоаллергия в обход заторможенного аутореактивного Т-хелпера n Второй механизм присутствует при: n прямой активации В-клеток суперантигенами или поликлональными иммуностимуляторами, суперантигенами и облигатными патогенными комплексами различных формах перекрестной иммунореактивности, когда аутореактивный В-лимфоцит срабатывает от анти-чужого хелпера, идиотипспецифического хелпера или когда идиотип антиидиотипического антитела копирует аутоантиген n

Поликлональная иммуностимуляция и суперантигеннный эффект, как основа аутоа n n n Не специфические в отношении антигена активаторы В-клеток могут вызвать реакцию сразу множества В-лимфоцитов, включая и аутореактивные, помимо участия Т-хелперов. При этом различные клоны могут выработать значительные количества разных аутоантител. Так как это сопровождается нарастанием продукции цитокинов, вторично включается рассмотренный выше механизм аберрантной экспрессии белков II класса ГКГС и "аутопрезентация" антигенов. подобным действием обладают вирус Эпштейна-Барр (что обусловливает аутоиммунную природу некоторых симптомов инфекционного мононуклеоза), бактериальные липополисахариды, известные под условным названием эндотоксинов, растительные лектины, в частности, авенин, связанный с аутоиммунитетом против антигенов кишечника при дипептидазной недостаточности и нетропических формах спру. Суперантигены служат поликлональными активаторами Т-клеток и также провоцируют аутоиммунитет Поликлональными активаторами иммунной системы, способствующими аутоаллергии, являются гипометилированная бактериальная ДНК, микробные и иные облигатные патогенные комплексы, лиганды Tоll-подобных рецепторов

Суперантигенность – относительное свойство, зависящее от способности антигена сшивать некоторые ГКГС II белки с неантигенспецифическими участками Vβ-цепи TCR n n n Суперантигены активируют CD 4+ Т-клетки. Так как существует только 25 вариантов Vβ-цепи TCR, суперантиген может активировать сразу значительную часть CD 4+ Т-клеток индивида (до 10%). Поликлональная активация ведет в этом случае к мощнейшему цитокиновому ответу, с системным действием медиаторов и развитием этих ответа острой фазы, лихорадки, тошноты, рвоты, мальабсорбции, поноса, дегидратации, ацидоза, острых нарушений ионного баланса, и, как следствие – недостаточности кровообращения, шока и шокоподобных состояний В связи с инфекционным или пищевым происхождением суперантигенов, в клинике это расценивается как интоксикациятоксический и (токсико-септический) шок. У разных индивидов СА могут быть энтеротоксин стафилококка, токсин ЭПКП, компоненты плодов киви и других пищевых веществ Так как среди 10% клонов Т-лимфоцитов есть аутореактивные и перекрестно-реагирующие Т-хелперы, суперантигенные эффекты сопровождаются аутоаллергией. Суперантигенный патогенез имеют пищевые токсикоинфекции и токсическая диспепсия у грудных детей.

Перекрестная иммунореактивность – основа аутоаллергии в обход аутореактивных Т-хелперов n n В силу параллельной эволюции экзогенные патогены приобрели молекулярное сходство с эндогенными молекулами поражаемого макроорганизма иммунной системы свойственно имитировать антиидиотипами аутоантител структуру эпитопов антигенов. Ж. Линдеманн (1979) метко назвал это явление созданием иммунологических отображений антигенов. Данная форма мимикрии физиологический элемент иммунологической памяти, супрессии и регуляции. обе формы мимикрии могут приводить к аутоаллергии. Мимикрия патогенов вызывает аутоаллергию, если индивид, благодаря наследственным особенностям своих антигенов и рецепторов системы ГКГС плохо различает определенные свои и чужие секвенциальные детерминанты Мимикрия аутоантигена и антиидиотипов вызывает аутоаллергию при слишком сильном антиидиотипическом ответе против

Идиотип-специфический Т-хелпер может заместить аутореативный Т-хелпер и резко усилить слабый физиологический аутоиммунный ответ на такие антигены, как ДНК, после презентации идиотипа антитела из состава иммунного комплекса n n Идиотип-специфические хелперы нередко стимулируются антигенпредставляющими клетками, захватившими иммунный комплекс антител к микробу и антигена и процессировавшими пептид идиотипа этих антител. Для этого не нужно совпадения конформаций антигенов, так как Т-хелпер видит СЕКВЕНЦИАЛЬНЫЕ детерминанты, разнообразие которых куда менее велико и которые часто похожи у макроорганизма и микробов. именно так полисахарид К 30 Klebsiella провоцирует образование аутоантител к ДНК, а протеогликан Streptococcus pyogenes - ревматоидных факторов. Обращает на себя внимание полное несходство в этих случаях химической природы и конформационных антигенных детерминант антигенов-мишеней, что не мешает косвенной мимикрии и перекресту. Подобная ситуация - не редкость и при неинфекционой патологии. Предполагается, например, что низкоаффинные естественные регуляторные аутоантитела к ДНК могут образовывать с антигеном комплекс, который процессируется АПК, вследствие чего антиидиотипический Т-хелпер срабатывает от эпитопов антитела и стимулирует усиленный ответ Вклонов на аутоантигенную часть комплекса.

ВНИМАНИЕ! РЕВОЛЮЦИЯ!! Перекрестная хелперская помощь может быть связана с недавним революционным открытием того факта, что один Т-клон может отвечать на разные антигены ! n n n только цепи β, γ и δ в ходе выбора клонального Tc. R проходят, подобно цепям иммуноглобулинов, процедуру аллельного исключения, то есть выбора одной из двух гомологичных хромосом кодирования в данном клоне. Для α-цепи Tc. R этот процесс отсутствует. Следовательно, хотя каждый В-клон свято соблюдает клональноселекционную теорию и поставляет антитела лишь одной специфичности, часть Т-клеток (до 30% !) экспрессирует оба аллельных варианта α-цепей и, таким образом, может иметь Tc. R разной антигенной специфичности на одной клетке (Коико Р. и соавт. , 2003). Значение этого недавнего открытия неясно, но оно ПРОТИВОРЕЧИТ ОРТОДОКСАЛЬНОМУ ВАРИАНТУ ТЕОРИИ КЛОНАЛЬНОЙ СЕЛЕКЦИИ и , возможно, прольёт свет на некоторые факты перекрестных иммунных ответов по секвенциальным антигенам, имеющие большое значение для развития аутоиммунитета и аутоаллергии.

Антигенный перекрест по секвенциальным детерминантам – частое явление, по конформационным - исключительное n n Ранние представления об антигенном n перекресте, как причине аутоиммунитета, сводились к гипотезе, что трехмерная конформация некоторых чужеродных антигенов похожа на конформационные детерминанты собственных, что обусловливает, будто бы, аутореактивное действие антител к чужим антигенам. Однако, последующее развитие иммунопатофизиологии показало, что подобная ситуация - исключительная редкость. Полагают, что этот механизм обусловливает аутоиммунные осложнения африканского трипаносомоза (болезнь Чагаса), в частности, миокардиодистрофию, и некоторые последствия гельминтозов. Хрестоматийным является пример с полисахаридными антигенами гемолитического стрептококка и сердечных клапанов, перекрёст по которым способствует развитию ревматизма после инфекции определёными штаммами гемолитического стрептококка Гораздо чаще имеется перекрест по линейным, секвенциальным детерминантам аутоантигенов и чужеродных антигенов, так как эволюционное разнообразие этих детерминант, формируемых первичной структурой антигенов , гораздо меньше, чем конформационных. Между тем, именно секвенс -пептиды процессированного антигена контролируют поведение Т-хелперов. Именно сходство или общность коротких пептидов, притом конкретно тех, которые, благодаря индивидуальным особенностям гаплотипа ГКГС, процессируются у предрасположенных пациентов антигенпредставляющими клетками, имеется ввиду, когда говорят о перекрестной иммунореактивности между альбумином коровьего молока и собственным инсулином, при развитии аутоиммунного сахарного диабета, между антигенами Klebsiella и соединительной ткани при анкилозирующем спондилите или миелина - при демиелинизирующих нейропатиях, между антигенами Proteus mirabilis и синовии - при ревматоидном артрите, высококонсервативными пептидами белков теплового шока микобактерий и разнообразными аутоиммунными синдромами. Имеется также общность коротких пептидов в М -протеине стрептококка и М-протеине сарколеммы кардиомиоцитов при ревматизме.

В-1 лимфоциты – продуценты низкоаффинных естественных аутоантител и участники аутоаллергии при поликлональной иммуностимуляции и при перекрестной стимуляции аутореактивных ответов идиотипспецифическими Т-хелперами n n n В-1 клетки широко представлены в серозных полостях, но редко встречаются в селезенке и лимфоузлах. Они отличаются узким репертуаром рабочих V-генов и, в большинстве, несут маркер CD 5, отсутствующий у других В-клеток. Функционально, они предназначены для быстрого полиспецифичного ответа на Т-независимые бактериальные антигены, и синтезируют низкоаффинные полиспецифичные Ig. M, узнающие бактериальные полисахариды. Полагают, что большая часть естественных антител, имеющихся у неиммунизированных индивидов – продукты этой субпопуляции. В-1 лимфоциты могут синтезировать иммуноглобулины, обладающие перекрестной специфичностью к распространенным аутоантигенам и ответственны за некоторые проявления аутоиммунитета и аутоаллергии В-1 лимфоциты накапливаются при аутоиммунных заболеваниях с полисерозитами (СКВ, синдром Дресслера и др. – что сопряжено с наличием неорганоспецифических аутоантител к ядерным и митохондриальным аутоантигенам.

Новый механизм аутоаллергии n n Аутоантигены – почти исключительно белки, обладающие альтернативным процессингом Экзогенный фактор (например, йод) может менять процессинг первичного транскрипта такого белка (скажем, тироглобулина), что ведет к появлению молекул, к которым не было толеризации (Yang, 2006)

Роль нарушения клиренса иммунных комплексов при иммунопатологических болезнях

Проблема «забарьерных» антигенов и механизмы аутоалле n n n n n Согласно классическим представлениям, аутоаллергические эффекты могут проявляться лишь в слабой степени, если аутоантиген, в отношении которого произошел срыв аутотолерантности, в какой-то степени "забарьерен" (структурно "забарьерен" или функционально секвестрирован, отделен от иммунологического распознавания). Сложились представления о том, что "скрытыми" являются антигены хрусталика, семенника, ЦНС, коллоида щитовидной железы, надпочечников. концепция забарьерности, как механизма аутотолерантности у человека, оказалась для ряда органов, в значительной мере, надуманной. Не приходится отрицать, что в эксперименте нарушение гистогематических барьеров ускоряет развитие аутосенсибилизации и что имеются аналогичные клинические примеры - скажем, аутоиммунный травматический орхит (Н. Роуз, 1983). Но это замисит от неспецифического индуцирующего действия медиаторов воспаления на ко-стимуляторные молекулы иммуносинапсов, а вовсе не от мифической «принципиальной недоступности» части организма иммунному надзору. современные авторы полагают, что в норме нет аутоантигенов, принципиально недоступных иммунологическому надзору, Эффекторы иммунной системы проникают в клетки и через гистогематические барьеры За барьерами есть свои иммунокомпетентные клетки и местные мини-иммунные системы и, вклад нарушения барьеров при аутоиммунной патологии у человека считается минимальным. В последнее время концепция забарьерности эволюционировала под влиянием новейших исследований в области апоптоза. Оказалось, что многие клетки иммунологически привилегированных органов - глаза, гонад, головного мозга экспрессируют Fas. L и за счет этого вызывают апоптоз Тлимфоцитов, имеющих Fas-рецептор , когда последние проникают в Fas эти органы. Впрочем, этот механизм чреват аутоиндукцией апоптоза, что и происходит при рассеянном склерозе и тироидите Хасимото

О каких барьерах можно говорить, если IG G ЛЕГКО ПРОНИКАЮТ ВНУТРЬ КЛЕТОК И ДАЖЕ В КЛЕТОЧНЫЕ ЯДРА ЖИВЫХ КЛЕТОК МИШЕНЕЙ? Они в этом ничем не уступают ГОРМОНАМ

Zaichik et al. , Pathophysiology (Elsevier). -2008 (October). - v. 15. -N 3. - pp. 191 -207

Zaichik et al. , Pathophysiology (Elsevier). -2008 (October). - v. 15. -N 3. - pp. 191 -207

Zaichik et al. , Pathophysiology (Elsevier). -2008 (October). - v. 15. -N 3. - pp. 191 -207

ИММУННАЯ СИСТЕМА – НЕ ПОГРАНИЧНИК И НЕ ЖАНДАРМ ЭТО СЕНСОРНАЯ СИСТЕМА (ЧУВСТВО АНТИГЕННОСТИ) – как нервная. И даже есть общие молекулы – белок В 7 и в нейро синапсах и в иммуносинапсах Это регуляторная система. Антитело может изменять состояние клеточных рецепторов (и поверхностных и ядерных) и влиять на рост и на функции клеток – как ГОРМОН ИЛИ НЕЙРОТРАНСМИТТЕР – в норме и при патологии. Не верите – смотрите.

Zaichik et al. , Pathophysiology (Elsevier). -2008 (October). - v. 15. -N 3. - pp. 191 -207

Zaichik et al. , Pathophysiology (Elsevier). - 2008 (October). - v. 15. -N 3. - pp. 191 -207

Serological identity between adrenocortical DNP antigen (DNP) and normal rat serum globulin antigen (NS): possible role of anti-idiotypic image of antigen. Autoantibodies similar to experimentally obtained Ig. G present in intact animal sera


ИЗ КОНЦЕПЦИИ ФИЗИОЛОГИЧЕСКОГО АУТОИММУНИТЕТА СЛЕДУЕТ МНОГО ВАЖНЫХ ДЛЯ МЕДИЦИНЫ НОВЫХ ВЫВОДОВ И ПРЕДПОЛОЖЕНИЙ

Механизм гибели тироцитов при хроническом аутоиммунном тироидите Хасимото Параллельная экспрессия Fas и Fas. L

Общая схема патогенеза аутоаллергии

Среди аутоиммунных заболеваний можно легко найти примеры воплощения любой из форм аллергии по отдельности и в комбинациях Преобладающий тип гиперчувствительности Аутоаллергическое заболевание Цитототоксическая реакция Инсулинзависимый сахарный диабет Иммунокомплексная реакция Системная красная волчанка ГЗТ Аутоиммуный тироидит Хасимото Анафилаксия Периодическая крапивница, связанная с фазами менструального цикла Комбинация ГЗТ и ГНТ Хашитоксикоз

Спектр аутоаллергии – органоспецифические и неорганоспецифические поражения

Полиорганные аутоиммунопатии n n Полиорганные аутоиммунные поражения могут состоять из продукции нескольких видов органоспецифических аутоантител на общей наследственной основе или зависеть от присутствия близких аутоантигенов в разных органах. Важное клиническое значение имеют полиорганные аутоаллергические эндокринопатии (например, ( синдром Шмидта) – аутоиммунные сахарный диабет, АИТ и гипопаратироз, часто в сочетании с витилиго, аутоиммунным гастритом и вторичной анемией Аддисона. Бирмера

Органоспецифические аутоиммунопатии

Аутоантитела при аутоаллергических болезнях

Органоспецифические и неорганоспецифические аутоиммунные заболевания n n n При срыве толерантности по отношению ко всем аутоантигенам, например, при наследственном дефекте белка-индуктора апоптоза незрелых Т-клеток в ходе пренатальной элиминации, наблюдаются мультисистемные патологические аутоиммунные реакции, причем нередко - с множественными, неорганоспецифическими, перекрестно реагирующими и относительно низкоаффинными аутоантителами. Примерами могут служить СКВ, дискоидная красная волчанка, ревматоидный артрит и другие болезни, При утрате толерантности лишь к одному или нескольким аутоантигенам может возникать органо- или тканеспецифическая аутоиммунная патология (например, первичная микседема, болезнь Аддисона, апластическая анемия и. т. д. ). На этом, специфическом конце спектра аутоиммунопатий высокая аффинность аутоантител и одновременное присутствие иммуноглобулинов к разным эпитопам аутоантигена свидетельствуют о решающей роли иммунизации самим аутоантигеном, а не перекрестных аутоиммунных эффектов. В ряде случаев аффинность аутоантител при органоспецифическом ответе невелика, а поражают они единственный эпитоп, что свидетельствует о роли перекрёстной иммунореактивности в индукции аутоаллергии (например, при аутоиммунных демиелинизирующих нейропатиях).

Диагностически значимые аутоантитела при аутоиммунных болезнях

n n n n Существует отчетливая взаимосвязь аутоаллергии с мультифакториальной наследственной предрасположенностью одни и те же экзогенные провоцирующие факторы аутоиммунных заболеваний, например вирусные диабетогены, у одних индивидов неэффективны, а у других, семейно предрасположенных, запускают аутоаллергический процесс. наиболее яркие и практически изученные генетические параллели существуют между риском развития аутоиммунных заболеваний и экспрессией различных генов ГКГС среди больных анкилозирующим спондилитом и болезнью Рейтера почти в 90 раз повышена частота гена В 27. С данным геном ассоциированы многие аутоиммунные синдромы, для которых характерны нетканеспецифические аутоантитела (например, увеит). Гаплотип DR 3/B 8 типичен при органоспецифической и антирецепторной аутоаллергии. Особенно высокий относительный риск связан с геном DR 3, а В 8 находится с этим аллелем в неравновесном сцеплении. Носительство DR 3 ведет к семикратному возрастанию риска развития аутоиммунной болезни Аддисона, значительному учащению инсулинзависимого сахарного диабета, целиакии, тяжёлой миастении и аутоиммунных тиропатий. Аллель DR 4 ассоциирован как с повышенным риском органоспецифических поражений (инсулинозависимый сахарный диабет, тяжелая миастения, пемфигус, болезнь Бергера), так и неорганоспецифической аутоаллергии (ревматоидный артрит). Отмечена сильная взаимосвязь аутоиммунного тироидита, пернициозной анемии и аутоиммунной апластической анемии, а также синдрома Стилла с аллелем DR 5. При синдроме Гудпасчера и рассеянном склерозе выявлено повышение частоты экспрессии аллеля DR 2. Генетические основы аутоаллергии

ГКГС и болезни, по Кумару и соавт. , 2005

Модели аутоаллергических болезней на животных: генетическая основа и экзогенные воздействия n n n В экспериментальной практике получены линии крыс, мышей и цыплят, у которых по наследству передается способность развивать органоспецифические и неорганоспецифические аутоиммунопатии к определенному возрасту (например, цыплята OS, наклонные к спонтанному аутоиммунному тироидиту или упоминавшиеся выше "спонтанно-волчаночные" мыши NZB/NZW и MRL). Описаны аутоиммунные линии крыс, американских норок и собак-биглей. Чаще всего, у животных удаётся наблюдать спонтанное развитие аутоиммунных тиропатий, нефропатий, аллергического энцефаломиелита и волчаночноподобных синдромов с антинуклеарными аутоантителами Экзогенные воздействия химическими и вирусными диабетогенами воспроизводят инсулинзависимый диабет только у животных с сохранной функцией иммунной системы. Йодирование воды и пищи ускоряет развитие АИТ у крыс генетически предрасположенных к нему линий
Разнообразие аутоаллергии

НЕДЕСТРУКТИВНЫЕ (ЦИТОСТИМУЛИРУЮЩИЕ И ЦИТОБЛОКИРУЮЩИЕ РЕАКЦИИ III ТИПА Антирецепторные аутоантитела при цитотоксических реакциях могут эндоцитироваться вместе с рецептором и блокировать, либо имитировать действие соответствующего лиганда (гормона, нейротрансмиттера). Так как при этом достаточно невысокого титра антител, и в силу интериоризации комплекса рецептор-антитело, - активации деструктивных механизмов не происходит и реакция протекает без выраженного воспаления, а может ограничиваться только явлениями стимуляции или блокады клеточных функций и/ или роста. Цитостимулирующие и цитоблокирующие эффекты аутоантител к рецепторам лежат в основе многих эндокринных и нервных заболеваний (болезнь Грейвса- фон Базедова, синдром хронической усталости, генерализованная миастения, гипергонадотропный гипогонадизм, аутоиммунная гипогликемия и др. )

Как с этим бороться или патофизиологические основы терапии аутоаллергических болезней

Аутоиммуный тироидит Хасимото

Etiology of AIT n n n Cross-reacting infectious antigens (non-sporoformic anaerobic germs –Iersinia) Immunostimulation (Interferons, Interleukins) Excess of iodine from drugs (amyodarone) and diet Thyroid injury HLA DR 3, DR 5, B 8 KEY LINK OF PATHOGENESIS: Aberrant expression of HLA- class II antigens on thyrocytes and self-presentation

Динамика внешних симптомов гипотироза у пациентки с АИТ при успешном лечении (наблюдение Ю. И. Строева)

Системные аутоаллергические болезни с неорганиспецифическими аутоантителами n Большое семейство аутоаллергических болезней и синдромов возникает от действия аутоантител против антигенов клеточных ядер, рибосом или иных мишеней, универсально представленных во многих органах. Клиника таких болезней очень полиморфна. Так как в ней на первый план выходят поражения различных мезенхимальных тканей, в медицине они ранее традиционно (и патогенетически неверно) именовались «коллагенозы» .

СКВ и дискоидная КВ n СКВ – системное аутоаллергическое неорганоспецифическое заболевание с аутоантителами к двуспиральной ДНК и кардиолипинус вторичным и иммунокомплексным системным васкулитом. n Дискоидная КВ отличается присутствием аутоантител к нативным гистонам и изолированным поражением кожи и СОПР

Разнообразие иммунопатологических поражений при СКВ

СКВ – иммунопатологическое заболевание с поражением тканей цитотоксическими и дизрегуляторными . аутоантителами, а также иммунными комплексами n n n n n Пораженность 15 -50 на 100000 90% больных- женщины детородного возраста Выраженная полигенная предрасположенность Нулевой аллель гена С 4 АQ 0, дефицит ф-ров комплемента и нарушение клиренса ИК Определенные аллели ГКГС 2 () предрасполагают к синтезу аутоантител к : Двуспиральной ДНК HLADQB 1*0201, 0602, 0302, Липидам хроматина (кардиолипин) – HLADQB 1*0301 -0303 Малым ядерным РНК-протеидам Ro/SS-A & La SS-B, Sm (сцепленные с DR 3/DR 2) Аутоантитела к нативным гистонам, Р-протеину рибосом, всем видам клеток крови n n n Ряд экзогенных факторов способствует СКВ за счет растормаживания аутореактивных Т-хелперов, перекрестной реактивности или же поликлонального (суперантигенного) иммуностимуляторного эффекта. Это УФО, ряд лекарств (новокаинамид, гидралазин, изониазид, метилдофа, интерфероны), пищевая люцерна Ретровирусы Вирус везикулярного стоматита, имеющий аналог Sm-антигена Полисахарид клебсиеллы К 30 – перекрест по идиотипу антител с аутоантителами к ДНК Нарушение апоптоза аутореактивных лимфоцитов и лимфоцитов субпопуляции В 1, их накопление, перекрестное реагирование антикардиолипиновых антител с факторами коагуляции, а аутоантител к ДНК - с ламинином базальных мембран клубочков.

Депозиты ИК под эндотелием клубочков при СКВ, дерматит и эндокардит Либмана-Сакса (справа)
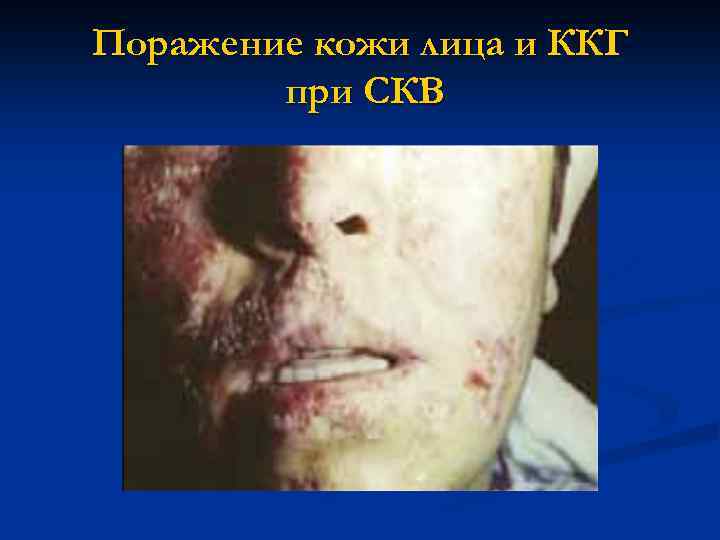
Поражение кожи лица и ККГ при СКВ

Дискоидная красная волчанка n n n n Дерматит с бляшками Артрит Утомляемость ЦНС и почки не страдают До 5% переходят в СКВ Аутоантитела к гистонам Провокация лекарствами
Ревматоидный артрит n РА – системное неорганоспецифическое аутоаллергическое заболевание, для которого наиболее характерны аутоантитела к нативному комплексу ядерных гистонов ревматоидные факторы и n – аутоантитела к нуклеогистонам, перекрестно связывающие Fc-фрагменты собственных иммуноглобулинов. Экзогенная провокация антигенами протея, клебсиеллы и (или) боррелий

Склеродермия (системный склероз) n n СКД – системное неорганоспецифическое аутоаллергическое заболевание с аутоантителами к центромерам хромосом и/или ДНК-топоизомеразе I (антиген Scl 70), а также против ядрышковых РНКполимераз I-III. Болезнь поражает кожу, сосуды и внутренние органы и вызывает их фиброз вследствие системного влияния гранзима А, эндотелинов и ФНО, а также аутоантител и аутореактивных Тлимфоцитов на сосуды. CREST-синдром: При этой разновидности СКД кроме телеангиэктазий также типичны аутоантитела к центромерам, кальциноз кожи и сосудов, феномен Рейно, нарушения эзофагальной моторики, дигитальный склероз.

Патогенез склеродермии

Идиопатический (первичный) дерматомиозит (ДМ) n n n ДМ – сравнительно редкая нозологическая форма, обусловленная системным поражением поперечнополосатой мускулатуры, включая мышцы глотки, гортани, грудной клетки, диафрагмы, с аутоантителами против амино-ацил-т. РНК. Болезнь приводит к полной обездвиженности больных, явлениям дисфагии, дизартрии, гиповентиляции легких с развитием аспирационной пневмонии ДМ выявляется преимущественно кожными симптомами. Чаще болеют женщины. Болезнь нередко сочетается с онкологической патологией половых органов и лимфомами. Возраст больных ДМ может быть от 2 -дневного ребенка до 80 лет. Вообще поражаемость детей ДМ выше, чем другими системными заболеваниями соединительной ткани.

Узелковый периартериит панартериит (УП) n аутоаллергический некротический васкулит, с нейтрофильнолимфоцитарной инфильтрацией сосудистых стенок, который поражает сосуды большого круга кровообращения, мышечного типа, обычно артерии среднего и малого калибра, артериолы, реже – более крупные сосуды с образованием сосудистых аневризм, которые можно прощупать под кожей в виде узелков (отсюда – название болезни). Это «мужская» болезнь. Для нее характерны аутоантитела к миелопероксидазе нейтрофилов.

Сухой синдром Шёгрена

Сиалоаденит при синдроме Шёгрена

Этиология Поражение слюнных желез вирусами (гепатита В, цитомегаловирус, Эпштейна-Барр) Патогенез Аутоаллергия вследствие аберрантной экспрессии белков ГКГС 2 класса на эпителии слюнных желез, аутопрезентация. Возможно- антигенный перекрест между РНП клеток и вирусов. аутоаллергический сиаладенит. В слюнных железах образуются лимфопролифераты. Затем обнаруживаются антитела (Ig G, Ig M), направленные против РНК-протеидных рибосомальных антигенов Ro (7095%)и La (60 -90%), в первом случае это коррелирует клинически с развитием гломерулонефрита. Ig вызывают против железистых клеток ГНТ (альтерация по цитотоксическому механизму). Параллельно следует ГЗТ и лимфоидная инфильтрация желез. Положительная реакция на указанные выше аутоантитела – патогномоничный признак данного синдрома, анализ на их наличие обязательно

Аутоиммунитет при синдроме Шёгрена n n n n Сцеплен c гаплотипами ГКГС D 3/ D 4 И B 8, DRw 52 большинство больных женщины 40 -60 лет Течение волнообразное, пожизненное Тест Ширмера на недостаточность слезоотделения (менее 10 мм промокашки намокает за 5 мин. при контакте с нижним веком) Окраска бенгальским розовым на точечный или нитевидный кератит Лечение – иммуносупрессия, замещение слезной и слюнной жидкостей В 40 раз увеличивается риск лимфом, возникающих в легких или по месту поражения. Диагностично присутствие лимфоидных скоплений с плотностью не менее 1 на 4 кв. мм Среза железы.

Височный (краниальный гигантоклеточный) артериит (болезнь Хортона) n аутоаллергический генерализованный или региональный васкулит, выражающийся в гранулематозном (гигантоклеточном) воспалении преимущественно сосудов системы сонной артерии, в частности – височной артерии. Поражает, в основном, европеоидов из скандинаво-балтийских этнических групп, сцеплено с носительством антигена ГКГС DR 4 и DR B 1*04. Интима пораженных артерий инфильтрирована лимфоцитами (преобладают Т-клетки) и макрофагами, имеется гиперцитокинемия, клетки в очегах воспаления вырабатывают усиливающие процесс ИЛ-6, ИЛ-1 и γ-интерферон. Вероятна инфекционная провокация болезни, но причинный агент не установлен.

Болезнь Кавасаки n n n аутоаллергический цитотоксический панваскулит с поражением средних и мелких артериальных сосудов мышц, кожи, СОПР и ККГ и, в 70% случаев - коронарного бассейна. При болезни Кавасаки наблюдается системный панваскулит, сопровождаемый комплемент-зависимым лизисом эндотелиальных клеток и лихорадкой. Установлено наличие при болезни Кавасаки аутоантител против Е-селектина, молекулы клеточной адгезии, экспрессируемой на эндотелиоцитах после их активации пирогенными цитокинами (ИЛ-1, ФНО и другими). Формированию аутоаллергии у лиц с определенными вариантами гаплотипа ГКГС способствует перекрестная иммунореактивность с неустановленными экзоантигенами. Сообщения о роли суперантигенного эффекта и стафилококкового токсина TSST-1 не подтвердились. Есть гипотеза, что болезнь может провоцироваться ретровирусами или хламидиями, в том числе – переданными при тесном контакте с домашними кошками. Есть сведения об эпидемиологической связи с применением шампуней для мытья ковров и мягкой мебели. Полагают, что при этом какие-то антигены сапрофитирующих в коврах микроскопических членистоногих освобождаются и могут перекрестно сенсибилизировать предрасположенных к аутоаллергии индивидов. Патогенез заболевания выражается в цитотоксической ГНТ, при которой аутоантитела к активированному эндотелию (возможно, к его Е-селектину) вызывают лизис эндотелиоцитов. Д. И. Люн и соавторы (1986) обнаружили, что у детей, больных этим заболеванием, имеются аутоантитела (иммуноглобулины класса М), вызывающие лизис эндотелиальных клеток, стимулированных ФНО, ИЛ-1 и интерфероном, но не действующие на покоящийся эндотелий. Установлено, что это два разных вида аутоантител против эндотелиальных селектинов, вероятно, включая Е-селектин. Картина дополняется ГЗТ-проявлениями, похожими на узелковый периартериит.

Гранулематоз Вегенера (ГВ) и другие нейтропенические синдромы n системный некротический гранулематозный артериит с преимущественным поражением дыхательных путей и почек. Он чаще встречается у европеоидов, как правило, молодого и среднего возраста, без различия пола. Характерны и диагностически значимы аутоантитела к нейтрофильной протеазе-3, что отличает болезнь от УП (см. выше). Ускорена гибель нейтрофилов. Бывают нейтропении.
Аутоиммунитет. Л.П Чурилов.ppt